La première transplantation utérine (TU) a été réalisée avec succès en Arabie saoudite en 2000 ; cependant, le greffon a dû être retiré à 3 mois à cause d’une nécrose. La deuxième, en Turquie (2011), a permis d’obtenir des grossesses chez la receveuse, qui se sont toutefois soldées par des fausses couches spontanées.
Si la faisabilité technique de la TU était démontrée, il a fallu attendre 2014 pour qu’elle fasse pleinement la preuve de son efficacité,
avec la première naissance d’un enfant en bonne santé en Suède (équipe du Pr Brännström). La patiente était une femme de 35 ans atteinte du syndrome de Mayer-Rokitansky-Küster- Hauser (MRKH), caractérisé par une agénésie utérine totale. Après 3 cycles de FIV et la congélation de 11 embryons, elle a reçu l’utérus d’une amie de la famille de 61 ans. Cette intervention a permis la naissance à 31 semaines d’aménorrhée et 5 jours d’un enfant de 1 775 g, par césarienne en raison d’une prééclampsie.
La TU est la seule possibilité pour les femmes atteintes d’infertilité d’origine utérine (IU) de devenir à la fois mères biologiques, porteuses et légales de leur enfant. Cette première naissance a représenté un espoir pour nombre d’entre elles. 2 L’infertilité utérine toucherait plusieurs milliers de femmes en France. Elle peut être due à une agénésie congénitale de l’utérus sans dysfonctionnement ovarien (syndrome MRKH), être secondaire à une hystérectomie pour pathologie bénigne (hémorragie du post-partum [HPP], utérus fibromateux…) ou maligne. 3 Enfin, l’utérus peut être présent mais non fonctionnel (postradique ; adénomyose étendue…). Rappelons que les alternatives possibles sont l’adoption et la gestation pour autrui, interdite en France par les lois de bioéthique de 2011.
Si la faisabilité technique de la TU était démontrée, il a fallu attendre 2014 pour qu’elle fasse pleinement la preuve de son efficacité,
avec la première naissance d’un enfant en bonne santé en Suède (équipe du Pr Brännström). La patiente était une femme de 35 ans atteinte du syndrome de Mayer-Rokitansky-Küster- Hauser (MRKH), caractérisé par une agénésie utérine totale. Après 3 cycles de FIV et la congélation de 11 embryons, elle a reçu l’utérus d’une amie de la famille de 61 ans. Cette intervention a permis la naissance à 31 semaines d’aménorrhée et 5 jours d’un enfant de 1 775 g, par césarienne en raison d’une prééclampsie.
La TU est la seule possibilité pour les femmes atteintes d’infertilité
Pour quelles patientes ?
À ce jour, la majorité des candidates étaient atteintes d’une agénésie utérine appartenant au syndrome MRKH, dont l’incidence est estimée à 1 naissance sur 5 000. Deux exceptions : une femme en Arabie saoudite ayant subi une hystérectomie pour HPP et une patiente de la série suédoise ayant eu cette intervention pour cancer du col.
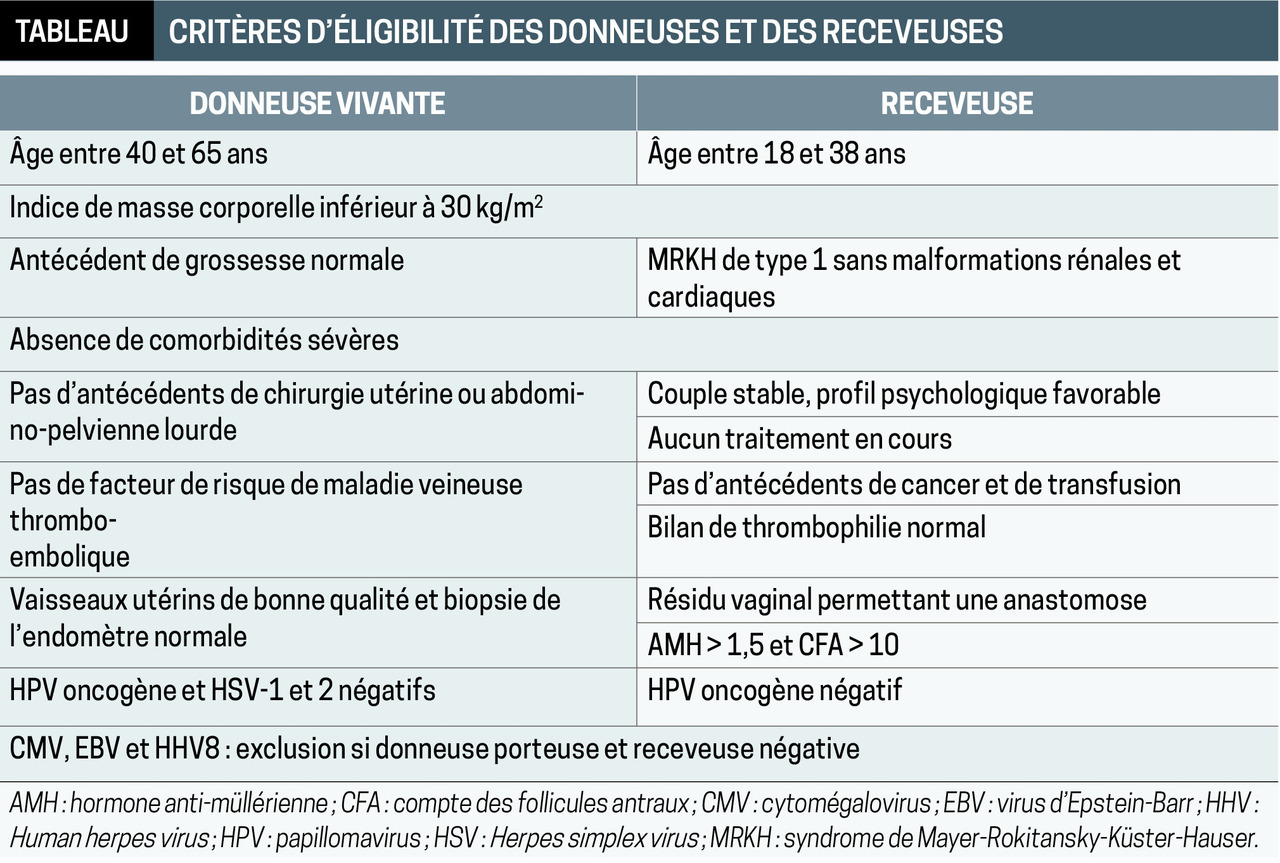
En effet, diverses craintes sont liées à l’étiologie de l’IU : risque de réactivation de cancer sous immunosuppresseurs (IS) en cas d’antécédent de néoplasie pelvienne, d’immunisation HLA après transfusion (si HPP), difficultés chirurgicales après irradiation pelvienne. À l’heure actuelle, les indications sont restreintes aux patientes atteintes du syndrome MRKH et n’ayant pas bénéficié de reconstruction vaginale (
).
En effet, diverses craintes sont liées à l’étiologie de l’IU : risque de réactivation de cancer sous immunosuppresseurs (IS) en cas d’antécédent de néoplasie pelvienne, d’immunisation HLA après transfusion (si HPP), difficultés chirurgicales après irradiation pelvienne. À l’heure actuelle, les indications sont restreintes aux patientes atteintes du syndrome MRKH et n’ayant pas bénéficié de reconstruction vaginale (
).
Quel type de donneuses ?
La majorité des naissances après TU a été obtenue à partir de dons vivants. Les avantages sont de mieux sélectionner la donneuse (bilans prétransplantation…) et de programmer l’intervention, diminuant ainsi la durée d’ischémie froide subie par le greffon. En revanche, des complications parfois graves ont été décrites (plaies du tractus urinaire et digestif, hémorragies, déhiscence vaginale). 4
Le recours aux donneuses en état de mort encéphalique permet de s’affranchir de ces risques, d’autant qu’il s’agit d’un organe non vital, au prix d’une organisation chirurgicale plus complexe (lignes d’astreintes, déplacement pour récupérer l’organe…) et d’un temps d’ischémie froide prolongé. De plus, le nombre des donneuses potentielles, compte tenu des critères stricts d’inclusion, est faible. Malgré différentes tentatives, une seule naissance a eu lieu pour le moment dans cette situation.
Le recours aux donneuses en état de mort encéphalique
Une procédure complexe
C’est une chirurgie longue et difficile nécessitant un travail en double équipe (une qui prélève et une autre qui greffe) et du personnel expérimenté. Les premiers prélèvements chez des donneuses vivantes ont été faits par laparotomie, avec des durées d’intervention dépassant 10 heures en raison de dissections vasculaires complexes. La chirurgie robot-assistée est une voie prometteuse, 5 l’objectif étant de diminuer au maximum la morbidité. La transplantation est toujours réalisée par laparotomie chez la receveuse et comprend des anastomoses artérielles et veineuses iliaques bilatérales. Le succès est défini par l’apparition de menstruations. Les trompes de Fallope ne sont pas greffées en raison du risque de nécrose tubaire et de grossesse extra-utérine. Ainsi, les patientes bénéficient d’une fécondation in vitro avant la greffe, qui ne peut être programmée que si un nombre suffisant d’embryons est obtenu.
Leur transfert nécessite de s’assurer de la stabilité du greffon et de l’absence de rejet. En pratique, la majorité des équipes attend 1 an après l’intervention. C’est d’ailleurs le délai recommandé par l’association américaine de transplantation entre une greffe d’organe solide et le début d’une grossesse. Cependant, l’équipe américaine du Pr Testa a récemment obtenu une naissance après avoir réduit le délai à 6 mois, 6 permettant de diminuer la durée d’exposition aux IS et donc leurs effets indésirables. En effet, une étude récente a mis en évidence une immunisation HLA intense au niveau de l’utérus justifiant des protocoles d’immunosuppression similaires à ceux utilisés en transplantation rénale. 7
La grossesse, jugée à risque,doit être suivie dans une maternité de niveau 3. Même si les données concernant les gestations conduites sous immunosuppresseurs sont rassurantes à la fois pour la mère, le fœtus et le transplant, 8 un risque d’accouchement prématuré, de retard de croissance in utero et de prééclampsie a été décrit. 1 De plus, il faut s’assurer régulièrement de l’absence d’épisode de rejet, par biopsies cervicales.
La TU est une greffe éphémère. Une fois le projet parental accompli (une ou plusieurs grossesses), l’utérus est retiré afin de limiter l’exposition aux IS.
Leur transfert nécessite de s’assurer de la stabilité du greffon
La grossesse, jugée à risque,
La TU est une greffe éphémère.
Où en est-on début 2019 ?
La première naissance obtenue en Suède s’inscrivait dans une étude de 9 TU ayant abouti à 7 succès de greffes et 8 naissances au total (soit 77,7 % de réussite et 88,8 % de gestations).
Ensuite, les programmes se sont multipliés à travers le monde. L’équipe suédoise du Pr Brännström développe actuellement une nouvelle série de TU avec prélèvement robot-assisté. Aux États-Unis, à Cleveland, une greffe a été réalisée à partir d’une donneuse décédée, mais l’utérus a dû être retiré à cause d’une infection ; une équipe de Dallas a effectué 5 TU, qui ont abouti à 3 explantations et 2 naissances. La première naissance à partir d’une donneuse décédée a été rapportée récemment au Brésil. En juin 2018, en Italie, une TU a été réalisée entre sœurs jumelles homozygotes, évitant ainsi la prise d’immunosuppresseurs par la receveuse. D’autres tentatives ont également eu lieu en Chine, Allemagne, Inde et République tchèque. Au total, on dénombre une quarantaine de TU et la naissance de 12 enfants en bonne santé, sans prématurité sévère ni retard de croissance. 9 Des recrutements sont actuellement en cours en Égypte, Belgique ou encore à Philadelphie.
En France, deux équipes ont obtenu l’autorisation de mener des transplantations utérines : celle de l’hôpital Foch à Suresnes à partir de donneuses vivantes et la nôtre à Limoges à partir de donneuses en état de mort encéphalique (le programme est temporairement suspendu pour des raisons administratives). D’autres (à Rennes et Paris) développent des modèles animaux expérimentaux .
Ensuite, les programmes se sont multipliés à travers le monde.
En France, deux équipes ont obtenu l’autorisation
Références
1. Brännström M, Johannesson L, Bokström H, et al. Livebirth after uterus transplantation. Lancet 2015;385:607-16.
2. Gauthier T, Garnault D, Therme JF, et al. [Uterine transplantation: is there a real demand?]. Gynecol Obstet Fertil 2015;43:133-8.
3. Huet S, Tardieu A, Filloux M, et al. Uterus transplantation in France: for which patients? Eur J Obstet Gynecol Reprod Biol 2016;205:7-10.
4. Kisu I, Kato Y, Obara H, et al. Emerging problems in uterus transplantation. BJOG 2018;125:1352-6.
5. Brännström M, Dahm-Kähler P, Kvarnström N. Robotic-assisted surgery in live-donor uterus transplantation. Fertil Steril 2018;109:256-7.
6. Testa G, McKenna GJ, Gunby RT, et al. First live birth after uterus transplantation in the United States. Am J Transplant 2018;18:1270-4.
7. Gauthier T, Filloux M, Guillaudeau A, et al. Uterus human leucocyte antigen expression in the perspective of transplantation. J Obstet Gynaecol Res 2016;42:1789-95.
8. Coscia LA, Constantinescu S, Davison JM, et al. Immunosuppressive drugs and fetal outcome. Best Pract Res Clin Obstet Gynaecol 2014;28:1174-87.
9. Favre-Inhofer A, Rafii A, Carbonnel M, Revaux A, Ayoubi JM. Uterine transplantation: review in human research. J Gynecol Obstet Hum Reprod 2018;47:213-21.
2. Gauthier T, Garnault D, Therme JF, et al. [Uterine transplantation: is there a real demand?]. Gynecol Obstet Fertil 2015;43:133-8.
3. Huet S, Tardieu A, Filloux M, et al. Uterus transplantation in France: for which patients? Eur J Obstet Gynecol Reprod Biol 2016;205:7-10.
4. Kisu I, Kato Y, Obara H, et al. Emerging problems in uterus transplantation. BJOG 2018;125:1352-6.
5. Brännström M, Dahm-Kähler P, Kvarnström N. Robotic-assisted surgery in live-donor uterus transplantation. Fertil Steril 2018;109:256-7.
6. Testa G, McKenna GJ, Gunby RT, et al. First live birth after uterus transplantation in the United States. Am J Transplant 2018;18:1270-4.
7. Gauthier T, Filloux M, Guillaudeau A, et al. Uterus human leucocyte antigen expression in the perspective of transplantation. J Obstet Gynaecol Res 2016;42:1789-95.
8. Coscia LA, Constantinescu S, Davison JM, et al. Immunosuppressive drugs and fetal outcome. Best Pract Res Clin Obstet Gynaecol 2014;28:1174-87.
9. Favre-Inhofer A, Rafii A, Carbonnel M, Revaux A, Ayoubi JM. Uterine transplantation: review in human research. J Gynecol Obstet Hum Reprod 2018;47:213-21.