Plus de 65 ans après la première intervention réussie sur le plan chirurgical, la greffe rénale est aujourd’hui le traitement de choix pour tout patient ayant une insuffisance rénale chronique (IRC) terminale car, dans la majorité des cas, elle augmente la survie par rapport à la dialyse, et améliore la qualité de vie. Depuis ses débuts, les indications ont été considérablement élargies. Ainsi, on a assisté au cours des dix dernières années à 2 changements majeurs :
– la réalisation de greffes ABO- et HLA-incompatibles (barrières immunologiques réputées difficilement franchissables) ;
– l’extension aux sujets de plus de 65 ans, qui sont la majorité des patients au stade d’IRC terminale (20 % des greffés aujourd’hui contre 3 % en 2000).
Pour quels patients ?
La greffe doit être discutée pour tout patient au stade d’IRC terminale ou préterminale, quelle que soit la néphropathie. Il n’y a pas de vraie limite d’âge, mais au-delà de 70 ans, les bénéfices par rapport à la dialyse sont inconstants (cf. infra).2 Les contre-indications absolues sont devenues rares, et concernent essentiellement des comorbidités qui ne peuvent pas être améliorées :
– hémopathies ou cancers évolutifs, un délai minimal devant être observé après rémission ;
– cardiopathie sévère non améliorable ;
– artériopathie aorto-iliaque non revascularisable rendant l’implantation chirurgicale impossible (encadré 1).
L’attribution des greffons provenant de donneurs décédés repose, comme dans les autres pays, sur un système complexe et modélisé. L’Agence de la biomédecine le supervise, grâce notamment à plusieurs antennes régionales très impliquées dans la logistique.
La probabilité d’obtenir un greffon rénal pour un patient donné dépend de multiples facteurs, parmi lesquels : la région, le groupe sanguin, l’âge du receveur (priorité aux jeunes de moins de 18 ans), la compatibilité HLA et l’immunisation anti-HLA, l’ancienneté de la dialyse et de l’inscription.
Quand faire les démarches ?
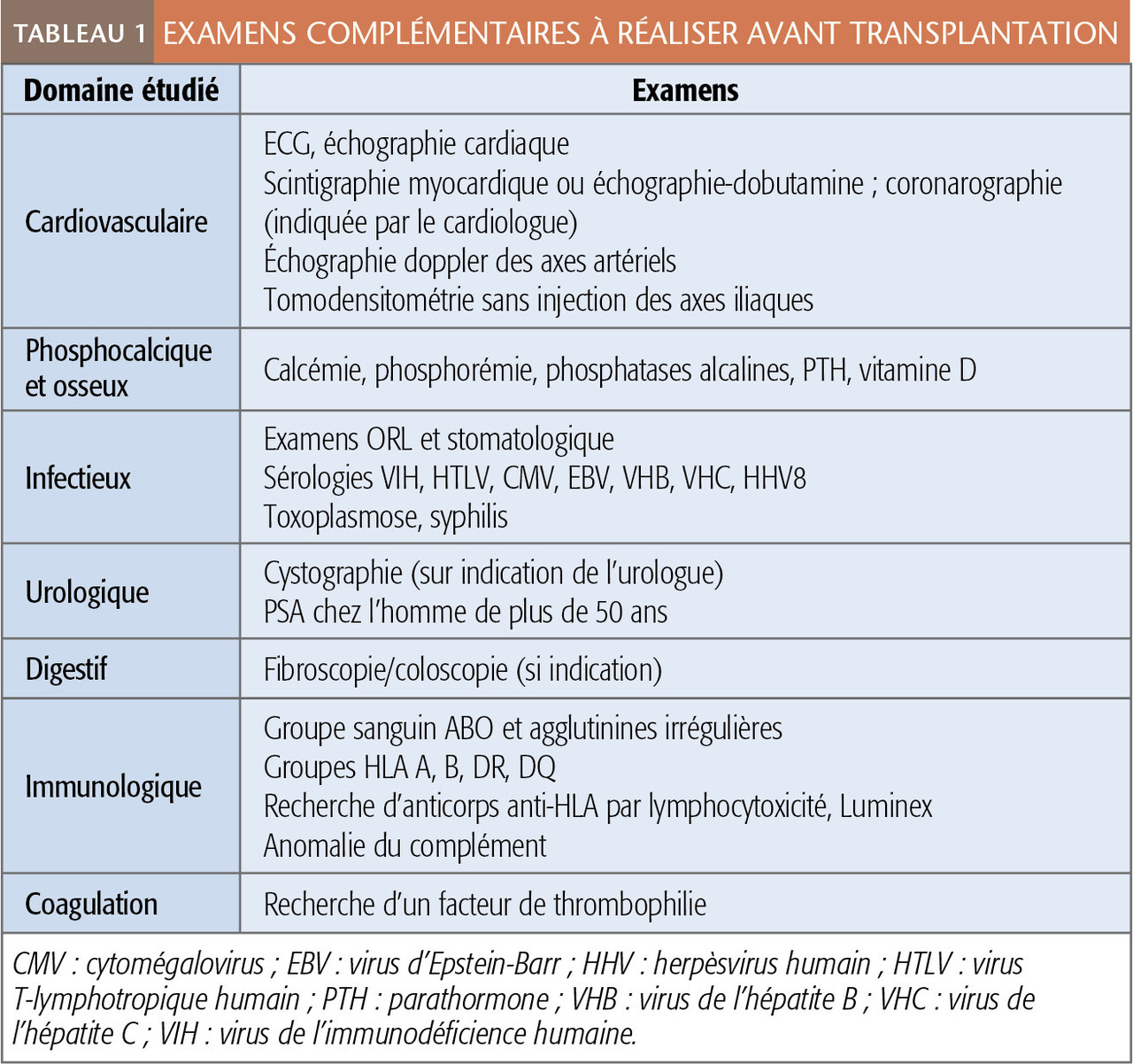
Le plus souvent, le patient est adressé par son néphrologue référent (celui qui l’a suivi durant la progression de l’IRC et/ou qui le prend en charge en dialyse) au médecin du centre de transplantation qui, après une évaluation très complète (tableau 1), l’inscrit sur la liste d’attente nationale gérée par l’Agence de la biomédecine.
Si l’IRC est diagnostiquée avant le stade terminal, il faut informer le malade des différentes modalités de prise en charge (dialyse, transplantation rénale), sans attendre sa demande, dans un souci d’équité d’accès à la greffe.1
Compte tenu du délai d’attente pour un rein de donneur décédé (27,6 mois en moyenne), il est important que le candidat soit référé au centre de transplantation pour une inscription dite préemptive (en général, dès que son DFG estimé à l’aide des formules CKD-EPI ou MDRD est < 20 mL/min/1,73 m2). On parle de transplantation préemptive lorsque le patient en bénéficie avant d’être dialysé.
Quels bénéfices ?
Survie des patients et des greffons
La presque totalité des travaux confirme que les transplantés rénaux ont une durée de vie plus longue, comparés aux sujets inscrits sur liste mais qui restent dialysés ; selon l’étude la plus récente portant sur plus de 600 000 patients américains, la survie médiane est de 12,4 ans contre 5,4 ans en dialyse.3
En France, une étude de registre4 montre un risque de décès augmenté de 45 % par année sur liste d’attente, par rapport à la transplantation.
Malgré une période de surmortalité immédiate post-greffe, liée au risque opératoire, pouvant durer quelques semaines ou mois selon les essais et les patients (sujets âgés, diabétiques, type de donneur…), un bénéfice de survie à 1 an est rapporté dans toutes les études, avec un taux de mortalité moyen de 3 % variant avec l’âge du patient5 (encadré 2).
La survie du greffon a augmenté entre 1991 et 2011. Ainsi, dans la cohorte des patients transplantés entre 2006 et 2011, elle s’élève à 92,6 % et 80 % respectivement à 1 an et 5 ans, en incluant les pertes liées au décès du patient (encadré 2).6 à long terme (valeur médiane actuelle : 14 ans), elle a moins progressé, en raison probablement de l’élargissement des critères de sélection des donneurs (pour greffer un plus grand nombre de patients).
Les facteurs influençant ce paramètre sont l’âge et le statut du donneur (vivant ou décédé), le niveau d’incompatibilité HLA, la présence d’anticorps anti-HLA dirigés contre le donneur (cf. infra) et les retransplantations.
Qualité de vie
Comparativement à l’hémodialyse, 3 items sont améliorés : qualité de vie globale (capacité fonctionnelle, acceptation de la maladie, activités habituelles, bien-être général), fonctions physi-ques (mobilité, performances, amélioration de la sensation de fatigue, capacité de travail), domaine psycho-social (relations, état émotionnel, emploi, adaptation psycho-sociale).8
Fertilité
Pour nombre de femmes en âge de procréer, une meilleure fonction rénale restaure une fertilité efficace, l’IRC entraînant un dysfonctionnement hypothalamo-gonadotrope. Cependant, compte tenu du risque accru de rejet aigu, des complications des premiers mois après transplantation et des adaptations de traitement nécessaires (immunosuppresseurs, antihypertenseurs), il est recommandé d’attendre 1 an avant d’envisager une grossesse. Bien qu’elles aboutissent à un taux de naissance comparable à celui de la population générale, ces gestations sont néanmoins à considérer comme pathologiques (prééclampsie et accouchement prématuré plus fréquents).
Chez les sujets âgés
L’âge médian à l’initiation de la dialyse étant de 70 ans, la transplantation rénale est maintenant envisagée à un âge avancé, même au-delà de 80 ans. Dans cette population, la mortalité est moindre que celle des sujets inscrits sur liste (jusqu’à 40 %),9 avec néanmoins une extension de la période de surmortalité postopératoire. Si l’on exclut les décès, la survie du greffon rénal n’est pas influencée par l’âge du receveur.
Il n’y a pas d’étude comparant clairement les qualités de vie, mais l’expérience montre que certains malades ne tirent pas de bénéfice de la greffe. C’est là probablement la spécificité du sujet âgé : il faut non seulement évaluer les comorbidités mais aussi estimer la « réserve fonctionnelle » du patient lui permettant de récupérer du stress de l’intervention chirurgicale, des complications précoces et des effets du traitement. Le phénotype de « fragilité » (cf. infra) est associé à une mortalité accrue, aux réhospitalisations et à une mauvaise qualité de vie.2 Une évaluation gériatrique du candidat est donc tout à fait souhaitable avant l’intervention.
pas assez de donneurs !
Le nombre annuel de transplantations rénales est en constante augmentation, mais il reste inférieur à celui des nouveaux inscrits chaque année : la liste d’attente continue donc à s’allonger et la situation de pénurie s’aggrave (encadré 2). Ce constat a conduit à diversifier les types de donneurs. à noter que, jusque dans les années 2000 en France, 90 % des greffes étaient issues de donneurs en état de mort encéphalique après AVC ou traumatisme crânien.
Sous l’impulsion de l’Agence de la biomédecine, créée en 2004 :
– les prélèvements ont augmenté et les critères de sélection des donneurs ont été élargis (sujets âgés et/ou hypertendus, ayant une fonction rénale sub-optimale) ;
– les transplantations à partir de vivants ont été encouragées (grâce notamment à l’élargissement du cercle des donneurs potentiels et aux progrès techniques permettant les greffes ABO- incompatibles) : elles représentent aujourd’hui 16 % des interventions versus 4 % en 2000 ;
– un programme de prélèvement de donneurs décédés après arrêt circulatoire a été mis en place (spontané ou attendu lors d’un arrêt des thérapeutiques de suppléance).
Grâce aux révisions des lois de bioéthique (en 2004 puis en 2011), le cercle des donneurs vivants (DV) – auparavant restreint aux ascendants et descendants directs et à la fratrie – a été élargi à tous les membres de la famille, conjoints compris, et à toute personne apportant la preuve d’un lien affectif étroit et stable depuis au moins 2 ans avec le receveur (encadré 3).
Les résultats des transplantations à DV sont meilleurs : en France, la survie à 10 ans des greffons est de 76,5 % contre 61,3 % pour ceux issus de sujets décédés. Les raisons sont multiples :
– au terme d’explorations exhaustives, on sélectionne des donneurs en bonne santé, avec une fonction rénale normale mesurée de façon fiable, alors qu’on ne fait qu’estimer (et souvent de façon imprécise) celle des sujets décédés en réanimation ;
– le temps d’ischémie froide (pendant lequel le rein n’a pas de circulation sanguine) est très court, l’organe étant prélevé immédiatement avant l’intervention ;
– la durée d’attente de la greffe est réduite, rendant possible une transplantation préemptive (31 % des premières greffes réalisées à partir de donneurs vivants).
Selon les données internationales, le risque de mortalité pour le donneur est de 3/10 000. Depuis la tenue du registre français en 2004, aucun n’est décédé en France. Concernant les conséquences à court terme après le don, en 2015, chez 548 donneurs vivants, le taux de réhospitalisations était de 4,7 %, celui de réintervention chirurgicale de 0,7 %. Complications les plus fréquentes : douleurs postopératoires (20,4 %) et infections (5,1 %).6
à long terme, selon les études les plus récentes (comparant les donneurs à des patients qui auraient été éligibles), le risque d’IRC terminale reste très faible mais supérieur à celui de contrôles sains (cf. encadré « Donneurs vivants : quel risque d’insuffisance rénale ? », page 872).
Pour minimiser ces risques, il est essentiel de respecter les recommandations internationales concernant notamment les comorbidités des donneurs. De plus, en France, ces derniers doivent être suivis annuellement (PA, mesure de la créatininémie et de la protéinurie) afin de prendre en charge, dès leur apparition éventuelle, une HTA et/ou une insuffisance rénale débutantes.
Moins de barrières immunes
Transplantations ABO-incompatibles
Autrefois considérées comme impossibles, ces greffes se sont développées à partir des années 1980, d’abord au Japon, puis depuis une quinzaine d’années dans les pays occidentaux. Elles ne peuvent s’envisager qu’avec un donneur vivant car le receveur doit être préparé médicalement avant l’intervention, qui est donc programmée. En effet, le principe est de diminuer le titre des anticorps naturels anti-A ou anti-B (dirigés contre les antigènes A/B exprimés par l’endothélium du greffon) afin que celui-ci soit le plus bas possible le jour de la transplantation. Les protocoles se sont beaucoup allégés, et le traitement préalable repose sur deux principes :
– l’injection de rituximab, un anticorps monoclonal anti-CD20 dirigé contre les lymphocytes B ;
– l’élimination des anticorps par des séances d’échanges plasmatiques ou d’immuno-adsorption.
En France, les premières données montrent une survie du greffon à 1 an similaire à celle des transplantations ABO-compatibles (95,6 %). à long terme, elle est également excellente selon l’expérience japonaise.
Transplantations HLA-incompatibles
Un des progrès majeurs des 10 dernières années a été de reconnaître le rôle péjoratif central des anticorps anti-HLA (produits au cours de la transplantation ou à la suite des grossesses et des transfusions sanguines) sur la survie du greffon rénal, responsables de rejet « humoral ».7 Cela a été permis par des techniques très sensibles de détection des anticorps dirigés contre le donneur et par l’identification de signes histologiques spécifiques. Parallèlement, des protocoles (utilisant les plasmaphérèses, les anticorps anti-CD20, les immunoglobulines intraveineuses) ont été mis au point pour permettre des transplantations HLA- incompatibles.
Néanmoins, même si ces greffes dites à haut risque immunologique apportent un bénéfice de survie par rapport à la dialyse, elles sont associées à une augmentation des infections et à une moins bonne survie du greffon.
Ces protocoles sont donc réservés aux patients à risque de rejet humoral important (largeur d’immunisation ou avec certains anticorps anti-greffon de titre élevé capables d’activer le complément…).
Quels traitements après greffe ?
Pour prévenir le rejet, une combinaison de 2 ou 3 immunosuppresseurs doit être prise scrupuleusement tous les jours pendant la durée de fonctionnement du greffon rénal.
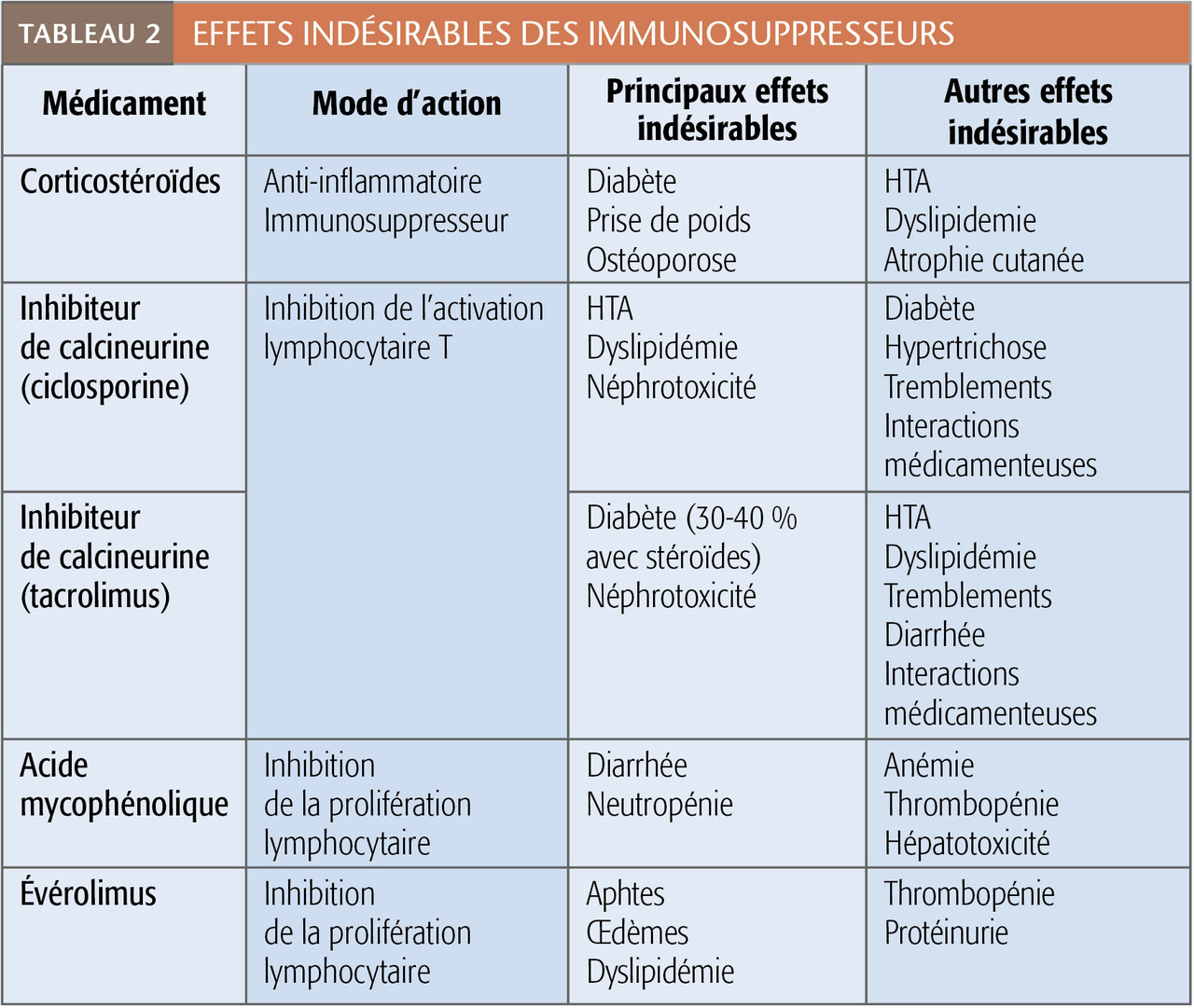
L’association la plus classique comporte des corticostéroïdes, un inhibiteur de la calcineurine (tacrolimus, Prograf, Advagraf, dans 85 % des cas, et ciclosporine, Neoral dans 10 à 15 % actuellement) et un traitement antiprolifératif (mycophénolate mofétil, Cellcept ou mycophénolate de sodium, Myfortic). Certains patients ne reçoivent pas de stéroïdes. D’autres sont traités par un inhibiteur de la mTOR (sirolimus, Rapamune ; évérolimus, Certican) à la place des inhibiteurs de calcineurine ou des antiprolifératifs (encadré 4).
Les effets indésirables (tableau 2) sont nombreux : néphrotoxicité, risque augmenté d’infections (communautaires ou opportunistes) et de cancers (notamment viro-induits, comme les tumeurs cutanées – spinocellulaires –, les lymphomes, le sarcome de Kaposi et les cancers des reins).
Un nouvel immunosuppresseur, le bélatacept (Nulojix), administré par voie injectable tous les mois, a une efficacité équivalente à celle des anticalcineurines, sans les effets indésirables et notamment la néphrotoxicité, mais il n’est pas remboursé pour l’instant.
Les changements posologiques éventuels sont réalisés par l’équipe médicale des centres de transplantation, en fonction des concentrations sanguines des molécules et des effets indésirables.
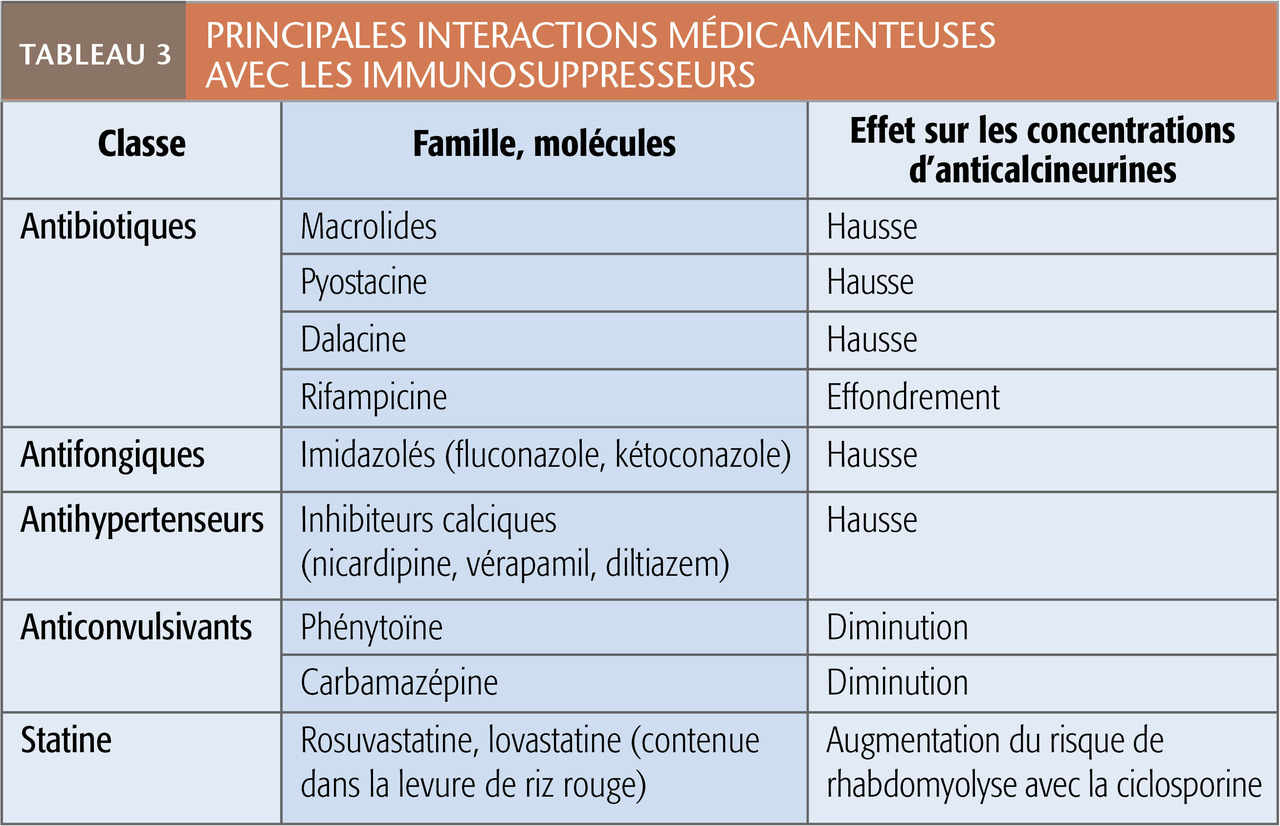
Néanmoins, il est important de connaître les principales interactions avec des médicaments potentiellement prescrits en ville (tableau 3). Compte tenu de leur grand nombre, dans le doute, il faut demander conseil au médecin référent ou au pharmacien. Bêtalactamines, fluoroquinolones (pas d’interaction), rovamycine, azithromycine, amlodipine (faible interaction) peuvent être utilisées. Rappelons que les patients sous inhibiteurs de calcineurine ne doivent pas consommer de jus de pamplemousse en raison de l’augmentation des concentrations sériques du médicament.
Enfin, les transplantés ont souvent une baisse du DFG, qui doit être systématiquement estimé à l’aide des formules déjà mentionnées, lors de l’introduction d’un nouveau médicament, pour adapter sa posologie.
DCD : donneur décédé ; DDCE : donneur décédé à critères étendus ; DDCS : donneur décédé à critères standard ; DV : donneur vivant.
1. Quelle technique chirurgicale ?
• La transplantation rénale est réalisée dans l’une des deux fosses iliaques, par voie sous-péritonéale, et ne nécessite pas l’ablation des reins natifs dans la majorité des cas.
• L’artère et la veine du greffon sont anastomosées en termino-latéral sur les vaisseaux iliaques externes ou primitifs.
• L’uretère est réimplanté sur la vessie (le plus souvent) ou sur l’uretère natif du patient.
• Le greffon, situé à quelques centimètres sous la peau, est facilement accessible à une biopsie (réalisée sous anesthésie locale, elle est nécessaire au diagnostic de rejet).
2. Des résultats encourageants !
Survie du receveur• à 1 mois : 99,1 %
• à 1 an : 96,7 %
• à 5 ans : 89,2 %
• à 10 ans : 76,9 %
Survie du greffon
• à 1 mois : 95,9 %
• à 1 an : 91,6 %
• à 5 ans : 79,4 %
• à 10 ans : 59,6 %
Médiane : 165 mois
Survie du greffon à 5 ans selon le type de donneur
• DCD : 78,6 %
Patients avec un DFG > 60 mL/min/1,73 m2 à 1 an
• DV : 42,5 %
• DDCS : 45,9 %
• DDCE : 12 %
Patients avec un DFG < 30 mL/min/1,73 m à 1 an
• DV : 4,3 %
• DDCS : 5,7 %
• DDCE : 20,2 %
Incidence du rejet aigu : 10 à 15 %
Liste d’attente en 2015
• Nouveaux inscrits : 4 735
• Transplantations rénales réalisées : 3 486 :
– dont donneurs vivants : 47 (15,7 %)
– donneurs après arrêt circulatoire : 89 (2,6 %)
• Patients sur liste d’attente : 11 794
DCD : donneur décédé ; DDCE : donneur décédé à critères étendus ; DDCS : donneur décédé à critères standard ; DV : donneur vivant.
3. Consentement du donneur vivant : bien encadré !
Pour le donneur vivant, il est exprimé directement par le sujet (consentement explicite) mais il est contrôlé : ce donneur, après un bilan médical très lourd vérifiant qu’il est apte à donner, est informé par l’équipe qui le prendra éventuellement en charge de tous les risques qu’il encourt. S’il maintient sa décision, il est entendu par un comité indépendant de 5 experts : 3 médecins, 1 psychologue et 1 personne qualifiée en sciences humaines et sociales. Ce comité vérifie qu’il est bien informé, qu’il n’a pas subi de contrainte, notamment psychologique ou financière. Un procureur du tribunal de grande instance de son lieu de résidence est ensuite chargé de vérifier son identité, ses relations avec le receveur et la réalité de son consentement. Après avis du tribunal, le donneur signe un document de consentement, et le comité d’experts donne ou non son accord pour le don (quand le donneur est le père ou la mère du receveur, le comité ne peut pas s’y opposer, il ne peut que conseiller).
La loi impose donc un consentement explicite très surveillé. L’objectif est double : protéger la santé physique ou psychique du donneur, empêcher une dérive commerciale du don.
4. Thérapie immunosuppressive
Deux temps :
• Un traitement injectable dit « d’induction » donné les premiers jours de greffe, comportant un anticorps anti-IL2 récepteur (basiliximab, Simulect) ou du sérum antilympocytaire (thymoglobuline).
• Un traitement oral dit « de maintenance » débuté dès le jour de l’implantation et maintenu au long cours. C’est une bi- ou une trithérapie qui associe des stéroïdes (optionnel), un inhibiteur de calcineurine (ciclosporine ou tacrolimus) et un anti-prolifératif (acide mycophénolique ou évérolimus).
Phénomène de fragilité
Syndrome clinique défini par au moins 3 des 5 critères de Fried :
• perte de poids non intentionnelle
• faiblesse musculaire (évaluée par la force de préhension)
• vitesse de marche ralentie
• épuisement auto-reporté
• activité physique minime
1.HAS. Transplantation rénale. Accès à la liste d’attente nationale.Recommandation de bonne pratique. Octobre 2015. https://bit.ly/2FULYxL
2. Snanoudj R, Lazareth H, Desbuissons G, et al. Transplantation rénale du sujet âgé. EMC (Elsevier SAS, Paris), Néphrologie, 2016 [18-067-Q-10].
3. Rana A, Gruessner A, Agopian VG, et al. Survival benefit of solid-organ transplant in the United States. JAMA Surg 2015;150:252-9.
4. Bouaoun L, Villar E, Ecochard R, Couchoud C. Excess risk of death increases with time from first dialysis for patients on the waiting list: implications for renal allograft allocation policy. Nephron Clin Pract 2013;124:99-105.
5. Farrugia D, Cheshire J, Begaj I, Khosla S, Ray D, Sharif A. Death within the first year after kidney transplantation--an observational cohort study. Transpl Int 2014;27:262-70.
6. Agence de la biomédecine. Rapport médical et scientifique du prélèvement et de la greffe en France 2016. https://bit.ly/2ALd6cO
7. Lohéac C, Aubert O, Loupy A, Legendre C. étude des étiologies spécifiques de perte spécifique de greffon: place du rejet médié par les anticorps et approche en population. Nephrol Ther 2018;14(Suppl 1):S39-S50.
8. Tonelli M, Wiebe N, Knoll G, et al. Systematic review: kidney transplantation compared with dialysis in clinically relevant outcomes. Am J Transplant 2011;11:2093-109.
9. Rao PS, Merion RM, Ashby VB, Port FK, Wolfe RA, Kayler LK. Renal transplantation in elderly patients older than 70 years of age: results from the Scientific Registry of Transplant Recipients. Transplantation 2007;83:1069-74.

 Encadrés
Encadrés