Obstétrique. Seul traitement de la stérilité d’origine utérine, la transplantation de l’utérus (26 cas publiés dans le monde) est aussi la seule à but fonctionnel éphémère.
L’infertilité utérine concerne 1 femme sur 500 en âge de procréer.1 Dans une étude observationnelle française, les infertilités d’origine utérine étaient principalement dues au syndrome de Mayer-Rokitansky-Küster-Hauser (MRKH) pour 75 % des femmes, à des causes iatrogéniques (hystérectomie pour cancer pour 7,2 %, causes bénignes pour 7,2 % et hémorragie de la délivrance pour 5 %) et en second lieu le syndrome d’insensibilité complète aux androgènes (2,2 %) et les malformations liées au Distilbène (0,7 %).2 En dehors de la gestation pour autrui et de l’adoption, la seule solution pour ces femmes d’atteindre la maternité est la transplantation utérine.
La première greffe utérine a été réalisée en Arabie saoudite à partir d’une donneuse vivante en 2002.3 La receveuse avait subi une hystérec- tomie d’hémostase après une hémorragie grave de la délivrance. Malheureusement, une exérèse du greffon a été nécessaire à 99 jours de la transplantation à cause d’une nécrose utérine. La deuxième greffe a eu lieu en Turquie à partir d’une jeune femme en état de mort encé- phalique.4 La receveuse avait alors 26 ans et était porteuse du syndrome de MRKH. Toutes ses grossesses se sont soldées par une fausse couche.5
Après plus de 15 ans d’expérimentation animale, c’est l’équipe suédoise menée par le Pr Brännström qui a permis d’obtenir la première naissance après greffe utérine.6 Depuis, cette équipe a réalisé neuf greffes utérines à partir de donneuses vivantes : parmi elles, sept ont été un succès, huit enfants bien portants sont nés dont deux pour deux patientes.7 Cette chirurgie expérimentale a ensuite diffusé. La conférence internationale de transplantation utérine de septembre 2017 a regroupé toutes les équipes s’essayant à cette technique.8 Sur les 38 greffes utérines pratiquées dans le monde, un premier tiers a été réalisé entre 2000 et 2015, alors que les deux tiers suivants ont eu lieu les deux dernières années. Les données publiées sont résumées dans le tableau 1.7 Dix enfants bien portants issus de ces programmes ont pu voir le jour : huit en Suède, deux aux États-Unis et le dernier au Brésil. La majorité des greffes ont été réalisées à partir de donneuses vivantes, et la seule naissance après une greffe issue d’une donneuse décédée a eu lieu au Brésil.
Deux équipes françaises ont obtenu l’autorisation de mener des transplantations utérines : l’équipe de l’hôpital Foch à Suresnes à partir de donneuses vivantes et l’équipe de Limoges à partir de donneuses décédées.
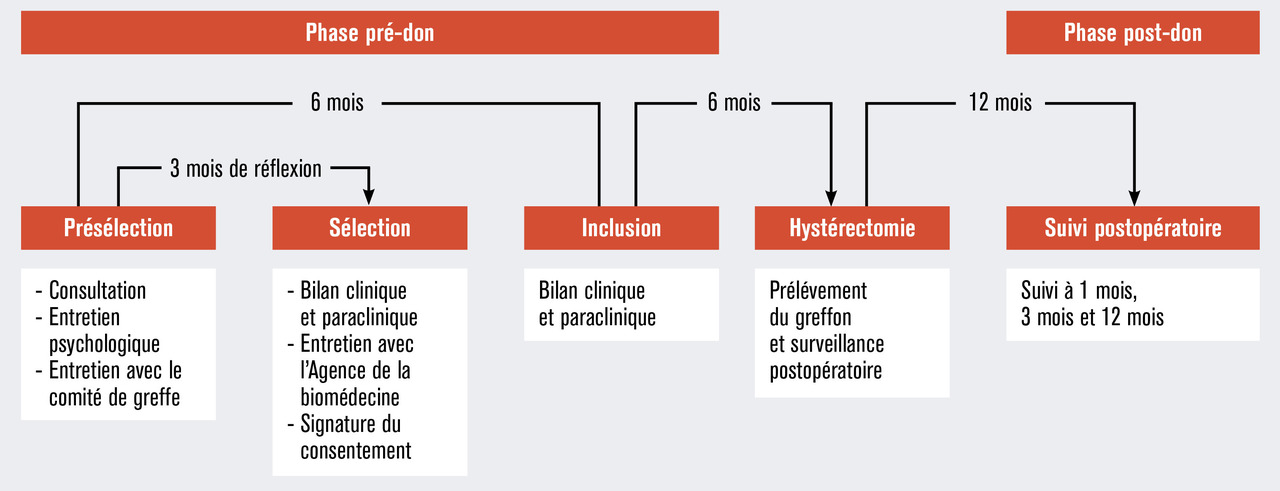
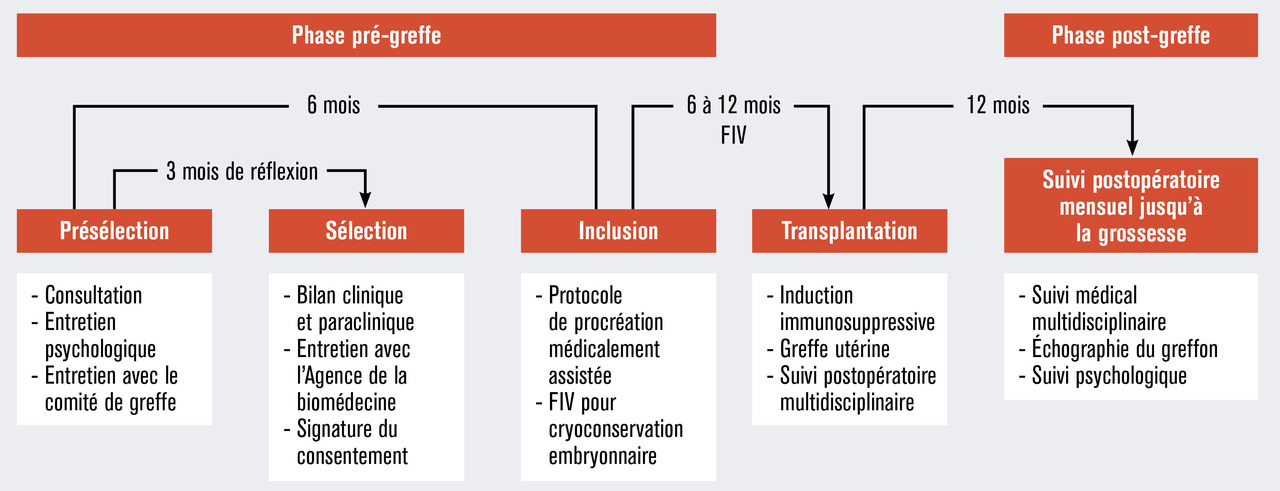
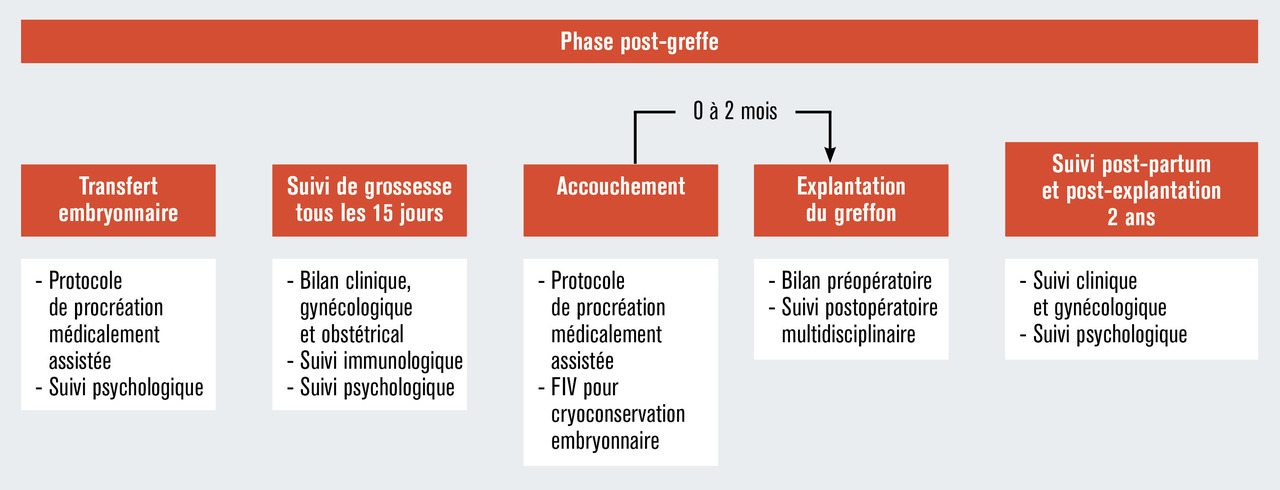
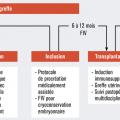
Les critères d’éligibilité des donneuses et receveuses sont décrits dans le tableau 2 et les schémas de déroulement des procédures sont illustrés dans les figures 1, 2 et 3. À ce jour, les premières patientes ont été reçues en consultation.
La première greffe utérine a été réalisée en Arabie saoudite à partir d’une donneuse vivante en 2002.3 La receveuse avait subi une hystérec- tomie d’hémostase après une hémorragie grave de la délivrance. Malheureusement, une exérèse du greffon a été nécessaire à 99 jours de la transplantation à cause d’une nécrose utérine. La deuxième greffe a eu lieu en Turquie à partir d’une jeune femme en état de mort encé- phalique.4 La receveuse avait alors 26 ans et était porteuse du syndrome de MRKH. Toutes ses grossesses se sont soldées par une fausse couche.5
Après plus de 15 ans d’expérimentation animale, c’est l’équipe suédoise menée par le Pr Brännström qui a permis d’obtenir la première naissance après greffe utérine.6 Depuis, cette équipe a réalisé neuf greffes utérines à partir de donneuses vivantes : parmi elles, sept ont été un succès, huit enfants bien portants sont nés dont deux pour deux patientes.7 Cette chirurgie expérimentale a ensuite diffusé. La conférence internationale de transplantation utérine de septembre 2017 a regroupé toutes les équipes s’essayant à cette technique.8 Sur les 38 greffes utérines pratiquées dans le monde, un premier tiers a été réalisé entre 2000 et 2015, alors que les deux tiers suivants ont eu lieu les deux dernières années. Les données publiées sont résumées dans le tableau 1.7 Dix enfants bien portants issus de ces programmes ont pu voir le jour : huit en Suède, deux aux États-Unis et le dernier au Brésil. La majorité des greffes ont été réalisées à partir de donneuses vivantes, et la seule naissance après une greffe issue d’une donneuse décédée a eu lieu au Brésil.
Deux équipes françaises ont obtenu l’autorisation de mener des transplantations utérines : l’équipe de l’hôpital Foch à Suresnes à partir de donneuses vivantes et l’équipe de Limoges à partir de donneuses décédées.
Les critères d’éligibilité des donneuses et receveuses sont décrits dans le tableau 2 et les schémas de déroulement des procédures sont illustrés dans les figures 1, 2 et 3. À ce jour, les premières patientes ont été reçues en consultation.
Caractéristiques des receveuses et des donneuses
Parmi les données publiées (tableau 1), la majorité (87 %) des patientes receveuses étaient atteintes du syndrome de MRKH. Les autres avaient dû subir une hystérectomie : l’une pour un cancer du col et l’autre pour une hémorragie grave de la délivrance. L’âge médian des receveuses était de 28 ans, et l’indice de masse corporelle (IMC) médian de 22,4 kg/m² ; 28 % des receveuses fumaient et 22 % avaient une malformation rénale (3 reins uniques et 1 rein unique pelvien). Toutes les patientes étaient dans une relation durable et étaient psychologiquement stables. Dans l’équipe suédoise, elles avaient entre 27 et 38 ans et devaient avoir un IMC inférieur à 25 kg/m².9
Seule la donneuse de l’équipe turque a été décrite : une patiente de 22 ans, n’ayant jamais eu d’enfant en état de mort cérébrale à la suite d’un accident de la route.10
Seule la donneuse de l’équipe turque a été décrite : une patiente de 22 ans, n’ayant jamais eu d’enfant en état de mort cérébrale à la suite d’un accident de la route.10
Déroulement de la phase de pré-greffe
Des explorations extensives étaient nécessaires aussi bien pour la donneuse que pour la receveuse. Elles incluaient des examens radiologi- ques, cliniques, des bilans sanguins généraux et spécifiques (prélèvements bactériologiques, sérologies virales, tests de compatibilité ABO et HLA), ainsi que des consultations chez tous les spécialistes concernés (gynécologue, psychologue, anes-thésiste, chirurgien transplanteur, interniste ou néphrologue, radiologue).9 En dehors de la compatibilité entre la donneuse et la receveuse, ces bilans cherchaient à explorer l’absence de pathologie associée contre-indiquant la greffe (pathologie utérine, dysplasie du col, portage de papillomavirus, maladie de système), l’absence d’infection, la qualité des vaisseaux de la donneuse, la réserve ovarienne de la receveuse et le spermogramme du conjoint. L’évaluation psychologique de la donneuse, de la receveuse et de son conjoint ainsi qu’une information détaillée sur les différents risques de la procédure étaient éga- lement un temps majeur de la préparation à la greffe. En effet, l’hystérectomie élargie réalisée chez la donneuse vivante exposait à des risques de complications non négligeables : plaies du tractus urinaire9 et digestif, hémorragies et déhiscence vaginale en particulier.11 Les risques potentiels pour la receveuse en dehors des risques opératoires classiques étaient l’échec de la greffe, l’infection, et les rejets nécessitant le retrait du greffon. Les effets indésirables du traitement immunosuppresseur dont les risques carcinologiques devaient être également abordés. L’échec de la grossesse, le risque de fausses couches ou de complications lors de la grossesse devaient être expliqués. Enfin, la nécessité de retirer le greffon après l’obtention d’un ou de deux enfants bien portants ou après 5 ans de greffe devait être connue par la patiente.
Le protocole d’assistance médicale à la procréation avait lieu avant la greffe. Il avait pour nécessité d’obtenir 10 embryons afin d’autoriser la greffe.12
Le protocole d’assistance médicale à la procréation avait lieu avant la greffe. Il avait pour nécessité d’obtenir 10 embryons afin d’autoriser la greffe.12
Déroulement de la greffe
Le prélèvement chez la donneuse vivante passait la plupart du temps par une incision médiane pour permettre un accès aisé au pelvis et l’obtention de pédicules vasculaires (artères et veines utérines) d’une longueur suffisante. Une urétérolyse complète était nécessaire et un patch vaginal de 2 cm était récupéré pour permettre une anastomose au vagin de la receveuse.9 Les artères et veines utérines étaient disséquées méti- culeusement jusqu’aux vaisseaux iliaques internes. Les temps opératoires variaient entre 8 et 12 heures. Deux équipes ont réussi une approche mini-invasive en utilisant le robot chirurgical Da Vinci.13
Chez la donneuse en état de mort encéphalique, la technique était moins unanime mais permettait d’emporter de larges pédicules vasculaires rendant les anastomoses plus aisées.4
L’utérus était ensuite préparé et perfusé avec un liquide de conservation. Le but était de minimiser les durées d’ischémie chaude et froide. La transplantation chez la receveuse commençait par une laparotomie et se poursuivait par la dissection du fond vaginal et des vaisseaux iliaques externes. Les vaisseaux utérins étaient anastomosés sur ces derniers par une anastomose latéro-terminale et la cupule vaginale sur le fond vaginal de la receveuse. En raison du calibre des vaisseaux utérins, l’anastomose était le temps le plus délicat de la greffe. L’utérus était ensuite fixé à ses ligaments pour éviter les risques de torsion du greffon.9 L’intervention durait entre 4 et 8 heures.
Chez la donneuse en état de mort encéphalique, la technique était moins unanime mais permettait d’emporter de larges pédicules vasculaires rendant les anastomoses plus aisées.4
L’utérus était ensuite préparé et perfusé avec un liquide de conservation. Le but était de minimiser les durées d’ischémie chaude et froide. La transplantation chez la receveuse commençait par une laparotomie et se poursuivait par la dissection du fond vaginal et des vaisseaux iliaques externes. Les vaisseaux utérins étaient anastomosés sur ces derniers par une anastomose latéro-terminale et la cupule vaginale sur le fond vaginal de la receveuse. En raison du calibre des vaisseaux utérins, l’anastomose était le temps le plus délicat de la greffe. L’utérus était ensuite fixé à ses ligaments pour éviter les risques de torsion du greffon.9 L’intervention durait entre 4 et 8 heures.
Déroulement de la période post-greffe
Dans la série suédoise, les patientes étaient hospitalisées en moyenne 4 jours, avec 6 à 8 semaines d’arrêt de travail. Aucun cas de transfusion et d’hospitalisation en réanimation n’a été déploré.9 Les complications per- et postopératoires décrites étaient :14 deux plaies urétérales, une déhiscence vaginale, un fécalome, une infection urinaire et des douleurs transitoires dans les jambes.
Chez la receveuse, la majorité des suites postopératoires ont été simples. Les échecs recensés de la greffe étaient secondaires soit à une torsion utérine,3 soit à une infection chronique du greffon à Enterococcus faecalis évoluant en septicémie,9 soit encore à quatre cas de nécrose utérine par thrombose.15 Dans la série suédoise, les patientes receveuses étaient hospitalisées 6 jours en moyenne sans réanimation, puis en arrêt de travail 4 à 10 semaines.9
Le traitement immunosuppresseur chez la receveuse était similaire à celui prescrit lors d’une greffe rénale.4 Le protocole incluait des thymoglobulines et des corticoïdes en peropératoire suivis de tacrolimus, mycophénolate mofétil et de prednisolone en postopératoire.9 Les protocoles de prophylaxie antivirale et antibiotique étaient variables d’une équipe à l’autre. Les patientes étaient suivies de manière rapprochée en postopératoire avec l’évaluation du retour des menstruations, l’évaluation clinique et échographique du greffon, et des biopsies du col afin de rechercher des épisodes de rejet nécessitant une adaptation du traitement immunosuppresseur.16 Aucun cas de rejet aigu ou chronique ayant mené à une hystérectomie n’a été rapporté à ce jour.
Chez la receveuse, la majorité des suites postopératoires ont été simples. Les échecs recensés de la greffe étaient secondaires soit à une torsion utérine,3 soit à une infection chronique du greffon à Enterococcus faecalis évoluant en septicémie,9 soit encore à quatre cas de nécrose utérine par thrombose.15 Dans la série suédoise, les patientes receveuses étaient hospitalisées 6 jours en moyenne sans réanimation, puis en arrêt de travail 4 à 10 semaines.9
Le traitement immunosuppresseur chez la receveuse était similaire à celui prescrit lors d’une greffe rénale.4 Le protocole incluait des thymoglobulines et des corticoïdes en peropératoire suivis de tacrolimus, mycophénolate mofétil et de prednisolone en postopératoire.9 Les protocoles de prophylaxie antivirale et antibiotique étaient variables d’une équipe à l’autre. Les patientes étaient suivies de manière rapprochée en postopératoire avec l’évaluation du retour des menstruations, l’évaluation clinique et échographique du greffon, et des biopsies du col afin de rechercher des épisodes de rejet nécessitant une adaptation du traitement immunosuppresseur.16 Aucun cas de rejet aigu ou chronique ayant mené à une hystérectomie n’a été rapporté à ce jour.
Grossesse et suivi à long terme
Les transferts d’embryon ont eu lieu environ 1 an après la transplantation utérine,6 délai nécessaire afin de s’assurer de l’absence de rejet du greffon. Le traitement immunosuppresseur était au préalable modifié pour être compatible avec la grossesse (tacrolimus, azathioprine, prednisolone).6 Les grossesses obtenues étaient suivies de manière rapprochée avec des examens cliniques, échographiques et histologiques (biopsies cervicales).6 Deux cas de prééclampsie et deux cas de cholestase hépatique ont été rapportés.17 Les accouchements ont tous eu lieu par césarienne après 30 semaines d’aménorrhée et tous les enfants issus de ces greffes étaient bien portants.18 Deux patientes dans l’équipe suédoise ont donné naissance à un deuxième enfant grâce au greffon laissé en place.7 Le retrait du greffon est réalisé à quelques mois de la césarienne après une ou deux grossesses menées à terme.
Les questions éthiques soulevées
La transplantation utérine pose des questions éthiques concernant deux domaines très différents de la médecine : la transplantation d’organe, d’une part, et la procréation médicalement assistée, d’autre part.
Une greffe éthique ?
Elle est à l’heure actuelle la seule transplantation d’organe à but fonctionnel éphémère.19 L’utérus est un organe non vital. La décision de se soumettre à cette procédure découle d’une balance bénéfice-risque en faveur de la fertilité malgré les potentiels aléas et échecs encourus. En 2008, le comité de la Fédération internationale de gynécologie et d’obstétrique a considéré la greffe utérine comme inappropriée éthiquement.19 Sa position n’a pour l’heure pas encore évolué. En 2013, les critères révisés de Montréal présentés dans le tableau 3 décrivent selon leurs auteurs les exigences éthiques à trois niveaux (donneuse, receveuse et équipe soignante) avant d’envisager une greffe utérine.20
Il est important d’exposer les alternatives au couple avant d’envisager une transplantation utérine : l’adoption et la gestation pour autrui. Cette dernière est illégale dans beaucoup de pays et pose ses propres problèmes éthiques.21 Dans le cas de la gestation pour autrui, les risques sont pris par une tierce personne et son bénéfice est souvent uniquement pécuniaire.22
Il est important d’exposer les alternatives au couple avant d’envisager une transplantation utérine : l’adoption et la gestation pour autrui. Cette dernière est illégale dans beaucoup de pays et pose ses propres problèmes éthiques.21 Dans le cas de la gestation pour autrui, les risques sont pris par une tierce personne et son bénéfice est souvent uniquement pécuniaire.22
Donneuse vivante et donneuse décédée ?
Le choix de recourir à une donneuse vivante ou décédée dépend de plusieurs facteurs. La sélection des donneuses vivantes expose celles-ci à des risques de complications, et c’est donc sa limite principale. D’un point de vue technique, l’avantage principal du recours à une donneuse décédée réside dans la possibilité de prélever de façon élargie les vaisseaux utérins, partie la plus délicate du prélèvement. En contrepartie, l’organisation du prélèvement et de la greffe est plus difficile, les tests d’évaluation de l’organe et généraux de la donneuse sont moins poussés, l’impact sur l’utérus de l’inflammation systémique induite lors du décès de la donneuse n’est pas connu, et les temps d’ischémie froide peuvent influer négativement sur le résultat fonctionnel.23 De même, le nombre de donneuses décédées potentielles compte tenu des critères d’inclusion stricts est souvent faible.
Le recours possible aux personnes trans « female to male » est une autre piste explorable à ce jour. Elles seraient majoritairement favorables à un don d’utérus lors de leur changement de sexe.24 Inclure ce groupe de personnes dans la cohorte des donneuses potentielles amène d’autres considérations éthiques propres. Tout d’abord, utiliser des utérus de personnes qui étaient à l’origine des femmes biologiques permet de surseoir au choc psychologique vécu par la plupart des femmes ayant subi une hystérectomie. Ensuite, il paraît également préférable de ne pas donner l’information de la survenue ou non d’une grossesse. Enfin, ce don doit respecter la loi française et le fait qu’un don de tissu vivant est anonyme et non rémunéré.
Le choix de la donneuse vivante ou décédée pose des problèmes éthiques qu’il faut garder à l’esprit au moment du choix. Ce choix doit être adapté à chaque cas personnel et selon l’organisation médicale du centre transplanteur, mais il y a des points communs.
Dans l’une ou l’autre des situations, l’article 16 du code civil s’applique et assure la primauté de la personne et la non-patrimonialité du corps humain. Par voie de conséquence, le corps ne saurait faire l’objet d’aucun trafic marchand.
Le deuxième point éthique commun est la question du consentement qui est toujours nécessaire mais qui diffère selon qu’il s’agit d’un prélèvement post mortem ou d’un don entre vivants.
Dans le cas du prélèvement d’organe post mortem, la loi indique que le prélèvement peut être pratiqué dès lors que la personne n’a pas fait connaître son refus de son vivant. Le point de vue des proches doit être écouté mais n’a pas de valeur légale contraignante.
Le recours possible aux personnes trans « female to male » est une autre piste explorable à ce jour. Elles seraient majoritairement favorables à un don d’utérus lors de leur changement de sexe.24 Inclure ce groupe de personnes dans la cohorte des donneuses potentielles amène d’autres considérations éthiques propres. Tout d’abord, utiliser des utérus de personnes qui étaient à l’origine des femmes biologiques permet de surseoir au choc psychologique vécu par la plupart des femmes ayant subi une hystérectomie. Ensuite, il paraît également préférable de ne pas donner l’information de la survenue ou non d’une grossesse. Enfin, ce don doit respecter la loi française et le fait qu’un don de tissu vivant est anonyme et non rémunéré.
Le choix de la donneuse vivante ou décédée pose des problèmes éthiques qu’il faut garder à l’esprit au moment du choix. Ce choix doit être adapté à chaque cas personnel et selon l’organisation médicale du centre transplanteur, mais il y a des points communs.
Dans l’une ou l’autre des situations, l’article 16 du code civil s’applique et assure la primauté de la personne et la non-patrimonialité du corps humain. Par voie de conséquence, le corps ne saurait faire l’objet d’aucun trafic marchand.
Le deuxième point éthique commun est la question du consentement qui est toujours nécessaire mais qui diffère selon qu’il s’agit d’un prélèvement post mortem ou d’un don entre vivants.
Dans le cas du prélèvement d’organe post mortem, la loi indique que le prélèvement peut être pratiqué dès lors que la personne n’a pas fait connaître son refus de son vivant. Le point de vue des proches doit être écouté mais n’a pas de valeur légale contraignante.
La question du don
Le don entre personnes vivantes implique la mise en place d’une procédure qui assure que la personne donneuse ne subit aucune pression et décide en toute autonomie. L’information concernant toutes les éventualités de la procédure, y compris les conséquences graves, doit être particulièrement énoncée et entendue.
Mais le don est aussi, pour celui qui reçoit, une dette qui peut le mettre en position de rendre, voire de devoir rendre. Cependant, dans le cas de la greffe d’utérus, la femme qui donne, particulièrement si c’est la mère de la receveuse, se trouve elle-même bénéficiaire du fait de son accès au statut de grand-mère (ou de marraine). Le don, particulièrement s’il aboutit à la naissance d’un enfant, est une réciprocité. Cependant, en cas d’échec, surtout s’il existe des embryons conservés, les perturbations chez la donneuse et surtout chez la receveuse doivent être anticipées.
Le don entre personnes vivantes évite un autre problème éthique que l’on retrouve chez le donneur décédé, celui de la liste d’attente : sa gestion pourrait être dévoyée, mais, compte tenu de l’organisation de la greffe en France, c’est surtout l’attente du don qui pose problème. Souvent, la durée est importante et n’est pas sans créer des difficultés de vécu (cette attente de la mort d’autrui qui serait salvatrice) alors que le don entre vivants échappe à l’irruption de la mort dans le projet de vie.
Par ailleurs, le prélèvement de plusieurs organes laisserait penser que le corps n’est qu’une batterie d’organes ou un pourvoyeur de ceux-ci et évoque une atteinte à l’intégrité physique, à une vision mécaniste du corps, corps qui ne serait qu’un ensemble de pièces détachées ou une ressource sociale produite par la mort (Comité consultatif national d’éthique, avis 115).25
S’il n’y a pas de solutions éthiques sans risques, l’énoncé des points de tension doit permettre d’éviter un blocage et une impasse corollaire, une souffrance éthique
Mais le don est aussi, pour celui qui reçoit, une dette qui peut le mettre en position de rendre, voire de devoir rendre. Cependant, dans le cas de la greffe d’utérus, la femme qui donne, particulièrement si c’est la mère de la receveuse, se trouve elle-même bénéficiaire du fait de son accès au statut de grand-mère (ou de marraine). Le don, particulièrement s’il aboutit à la naissance d’un enfant, est une réciprocité. Cependant, en cas d’échec, surtout s’il existe des embryons conservés, les perturbations chez la donneuse et surtout chez la receveuse doivent être anticipées.
Le don entre personnes vivantes évite un autre problème éthique que l’on retrouve chez le donneur décédé, celui de la liste d’attente : sa gestion pourrait être dévoyée, mais, compte tenu de l’organisation de la greffe en France, c’est surtout l’attente du don qui pose problème. Souvent, la durée est importante et n’est pas sans créer des difficultés de vécu (cette attente de la mort d’autrui qui serait salvatrice) alors que le don entre vivants échappe à l’irruption de la mort dans le projet de vie.
Par ailleurs, le prélèvement de plusieurs organes laisserait penser que le corps n’est qu’une batterie d’organes ou un pourvoyeur de ceux-ci et évoque une atteinte à l’intégrité physique, à une vision mécaniste du corps, corps qui ne serait qu’un ensemble de pièces détachées ou une ressource sociale produite par la mort (Comité consultatif national d’éthique, avis 115).25
S’il n’y a pas de solutions éthiques sans risques, l’énoncé des points de tension doit permettre d’éviter un blocage et une impasse corollaire, une souffrance éthique
DES QUESTIONS TECHNIQUES ET ÉTHIQUES
La greffe utérine, ce transfert éphémère, continue à poser ses questions techniques et éthiques. Quelle va être la place de la chirurgie mini-invasive dans cette procédure ? Quelles vont être les conséquences à long terme des enfants issus de ces greffes ?
La transplantation utérine en France se situe dans un avenir proche et va permettre à des femmes souffrant de stérilité d’origine utérine de concevoir un enfant issu de leur patrimoine génétique. Cette procédure chirurgicale, même si elle est difficile techniquement et qu’elle nécessite une collaboration pluridisciplinaire, va susciter un nouvel espoir.
La transplantation utérine en France se situe dans un avenir proche et va permettre à des femmes souffrant de stérilité d’origine utérine de concevoir un enfant issu de leur patrimoine génétique. Cette procédure chirurgicale, même si elle est difficile techniquement et qu’elle nécessite une collaboration pluridisciplinaire, va susciter un nouvel espoir.
Références
1. Johannesson L, Järvholm, S. Uterus transplantation: current progress and future prospects. Int J Womens Health 2016;8:43.
2. Huet S, Tardieu A, Filloux M, et al. Uterus transplantation in France: for which patients? Eur J Obstet Gynecol Reprod Biol 2006;205:7-10.
3. Fageeh W, Raffa H, Jabbad H, Marzouki A. Transplantation of the human uterus. Int J Gynaecol Obstet 2002;76:245-51.
4. Ozkan O, Akar ME, Ozkan O, et al. Preliminary results of the first human uterus transplantation from a multiorgan donor. Fertil Steril 2013;99:470-6.
5. Erman Akar M, Ozkan O, Aydinuraz B, et al. Clinical pregnancy after uterus transplantation. Fertil Steril 2013;100:1358-63.
6. Brännström M, Johannesson L, Bokström H, et al. Livebirth after uterus transplantation. Lancet 2015;385:607-16.
7. Brännström M, Dahm Kähler P, Greite R, Mölne J, Díaz-García C, Tullius SG. Uterus transplantation: A rapidly expanding field. Transplantation 2018;102:569-77.
8. International Society of Uterus Transplantation. http://www.isutx.org/
9. Brännström M, Johannesson L, Dahm-Kähler P, et al. First clinical uterus transplantation trial: a six-month report. Fertil Steril 2014;101:1228-36.
10. Ozkan O, Akar ME, Erdogan O, Ozkan O, Hadimioglu N. Uterus transplantation from a deceased donor. Fertil Steril 2013;100:e41.
11. Kisu I, Mihara M, Banno K, et al. Risks for donors in uterus transplantation. Reprod Sci 2013;20:1406-15.
12. Brännström M, Bokström H, Dahm-Kähler P, et al. One uterus bridging three generations: first live birth after mother- to-daughter uterus transplantation. Fertil Steril 2016;106:261-6.
13. Wei L, Xue T, Tao KS, et al. Modified human uterus transplantation using ovarian veins for venous drainage: the first report of surgically successful robotic-assisted uterus procurement and follow-up for 12 months. Fertil Steril 2017;108:346-56.
14. Kvarnström N, Järvholm S, Johannesson L, Dahm-Kähler P, Olausson M, Brännström M. Live donors of the initial observational study of uterus transplantation – psychological and medical follow-up until 1 year after surgery in the 9 cases. Transplantation 2017;101:664-70.
15. Testa G, Koon EC, Johannesson L, et al. Living donor uterus transplantation: a single center’s observations and lessons learned from early setbacks to technical success. Am J Transplant 2017;17:2901-10.
16. Mölne J, Broecker V, Ekberg J, Nilsson O, Dahm-Kähler P, Brännström M. Monitoring of human uterus transplantation with cervical biopsies: a provisional scoring system for rejection. Am J Transplant 2017;17:1628-36.
17. Castellón LAR, Amador MIG, González RED, et al. The history behind successful uterine transplantation in humans. JBRA Assist Reprod 2017;21:126-34.
18. Bokström H, Dahm-Kähler P, Hagberg H, Nilsson L, Olausson M, Brännström M. Uterus transplantation in Sweden - the 5 first children in the world born. Promising results - all the children are healthy. Lakartidningen 2016;113. pii: DX6H.
19. Milliez J. Uterine transplantation. Int J Gynecol Obstet 2009;106:270.
20. Lefkowitz A, Edwards M, Balayla J. Ethical considerations in the era of the uterine transplant: an update of the Montreal criteria for the ethical feasibility of uterine transplantation. Fertil Steril 2013;100:924-6.
21. Olausson M, Johannesson L, Brattgård D, et al. Ethics of uterus transplantation with live donors. Fertil Steril 2014;102:40-3.
22. Testa G, Koon EC, Johannesson, L. Living donor uterus transplant and surrogacy: ethical analysis according to the principle of equipoise. Am J Transplant 2017;17:912-6.
23. Brännström M. Uterus transplantation. Fertil Steril 2013;99:348-9.
24. Api M, Boza A, Ceyhan M. Could the female-to-male transgender population be donor candidates for uterus transplantation? Turkish J Obstet Gynecol 2017;14:233-7.
25. Alpérovitch F, Beaufils A, Benmakhlouf S, et al. Comité consultatif national d’éthique pour les sciences de la vie et de la santé, avis n° 115. Questions d’éthique relatives au prélèvement et au don d’organes à des fins de transplantation.
26. Clavien PA, Barkun J, de Oliveira ML, et al. The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg 2009;250:187-96.
2. Huet S, Tardieu A, Filloux M, et al. Uterus transplantation in France: for which patients? Eur J Obstet Gynecol Reprod Biol 2006;205:7-10.
3. Fageeh W, Raffa H, Jabbad H, Marzouki A. Transplantation of the human uterus. Int J Gynaecol Obstet 2002;76:245-51.
4. Ozkan O, Akar ME, Ozkan O, et al. Preliminary results of the first human uterus transplantation from a multiorgan donor. Fertil Steril 2013;99:470-6.
5. Erman Akar M, Ozkan O, Aydinuraz B, et al. Clinical pregnancy after uterus transplantation. Fertil Steril 2013;100:1358-63.
6. Brännström M, Johannesson L, Bokström H, et al. Livebirth after uterus transplantation. Lancet 2015;385:607-16.
7. Brännström M, Dahm Kähler P, Greite R, Mölne J, Díaz-García C, Tullius SG. Uterus transplantation: A rapidly expanding field. Transplantation 2018;102:569-77.
8. International Society of Uterus Transplantation. http://www.isutx.org/
9. Brännström M, Johannesson L, Dahm-Kähler P, et al. First clinical uterus transplantation trial: a six-month report. Fertil Steril 2014;101:1228-36.
10. Ozkan O, Akar ME, Erdogan O, Ozkan O, Hadimioglu N. Uterus transplantation from a deceased donor. Fertil Steril 2013;100:e41.
11. Kisu I, Mihara M, Banno K, et al. Risks for donors in uterus transplantation. Reprod Sci 2013;20:1406-15.
12. Brännström M, Bokström H, Dahm-Kähler P, et al. One uterus bridging three generations: first live birth after mother- to-daughter uterus transplantation. Fertil Steril 2016;106:261-6.
13. Wei L, Xue T, Tao KS, et al. Modified human uterus transplantation using ovarian veins for venous drainage: the first report of surgically successful robotic-assisted uterus procurement and follow-up for 12 months. Fertil Steril 2017;108:346-56.
14. Kvarnström N, Järvholm S, Johannesson L, Dahm-Kähler P, Olausson M, Brännström M. Live donors of the initial observational study of uterus transplantation – psychological and medical follow-up until 1 year after surgery in the 9 cases. Transplantation 2017;101:664-70.
15. Testa G, Koon EC, Johannesson L, et al. Living donor uterus transplantation: a single center’s observations and lessons learned from early setbacks to technical success. Am J Transplant 2017;17:2901-10.
16. Mölne J, Broecker V, Ekberg J, Nilsson O, Dahm-Kähler P, Brännström M. Monitoring of human uterus transplantation with cervical biopsies: a provisional scoring system for rejection. Am J Transplant 2017;17:1628-36.
17. Castellón LAR, Amador MIG, González RED, et al. The history behind successful uterine transplantation in humans. JBRA Assist Reprod 2017;21:126-34.
18. Bokström H, Dahm-Kähler P, Hagberg H, Nilsson L, Olausson M, Brännström M. Uterus transplantation in Sweden - the 5 first children in the world born. Promising results - all the children are healthy. Lakartidningen 2016;113. pii: DX6H.
19. Milliez J. Uterine transplantation. Int J Gynecol Obstet 2009;106:270.
20. Lefkowitz A, Edwards M, Balayla J. Ethical considerations in the era of the uterine transplant: an update of the Montreal criteria for the ethical feasibility of uterine transplantation. Fertil Steril 2013;100:924-6.
21. Olausson M, Johannesson L, Brattgård D, et al. Ethics of uterus transplantation with live donors. Fertil Steril 2014;102:40-3.
22. Testa G, Koon EC, Johannesson, L. Living donor uterus transplant and surrogacy: ethical analysis according to the principle of equipoise. Am J Transplant 2017;17:912-6.
23. Brännström M. Uterus transplantation. Fertil Steril 2013;99:348-9.
24. Api M, Boza A, Ceyhan M. Could the female-to-male transgender population be donor candidates for uterus transplantation? Turkish J Obstet Gynecol 2017;14:233-7.
25. Alpérovitch F, Beaufils A, Benmakhlouf S, et al. Comité consultatif national d’éthique pour les sciences de la vie et de la santé, avis n° 115. Questions d’éthique relatives au prélèvement et au don d’organes à des fins de transplantation.
26. Clavien PA, Barkun J, de Oliveira ML, et al. The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg 2009;250:187-96.