Dans l’hémisphère Nord, l’épidémie a débuté dès la fin septembre 2018 au Qatar et en Arabie saoudite, fin octobre en Asie orientale, en novembre aux États-Unis et Canada, et en décembre en Europe. Elle a culminé mi-janvier 2019 en Asie, de mi-janvier à mi-février en Europe et de mi-février à mi-mars jusqu’à fin avril aux États-Unis et Canada. Un 2e pic a été détecté en mai 2019 en Arabie saoudite. Les souches A(H1N1)pdm09 ont prédominé ou co-circulé avec les A(H3N2) dans les pays d’Europe du Nord et de l’Est, en Afrique du Nord (Maroc) et en Asie, la proportion des A(H3N2) augmentant au cours du temps. Ces derniers ont été majoritaires dans le Sud-Ouest de l’Europe, en Amérique du Nord et dans certains pays d’Asie et d’Afrique. Pour les États-Unis et le Canada, les souches A(H1N1)pdm09 ont prédominé en début de saison puis les A(H3N2) ont circulé plus largement en 2e partie. Très peu d’influenza B, sauf en Chine, notamment lors du 2e pic.
Impact en France
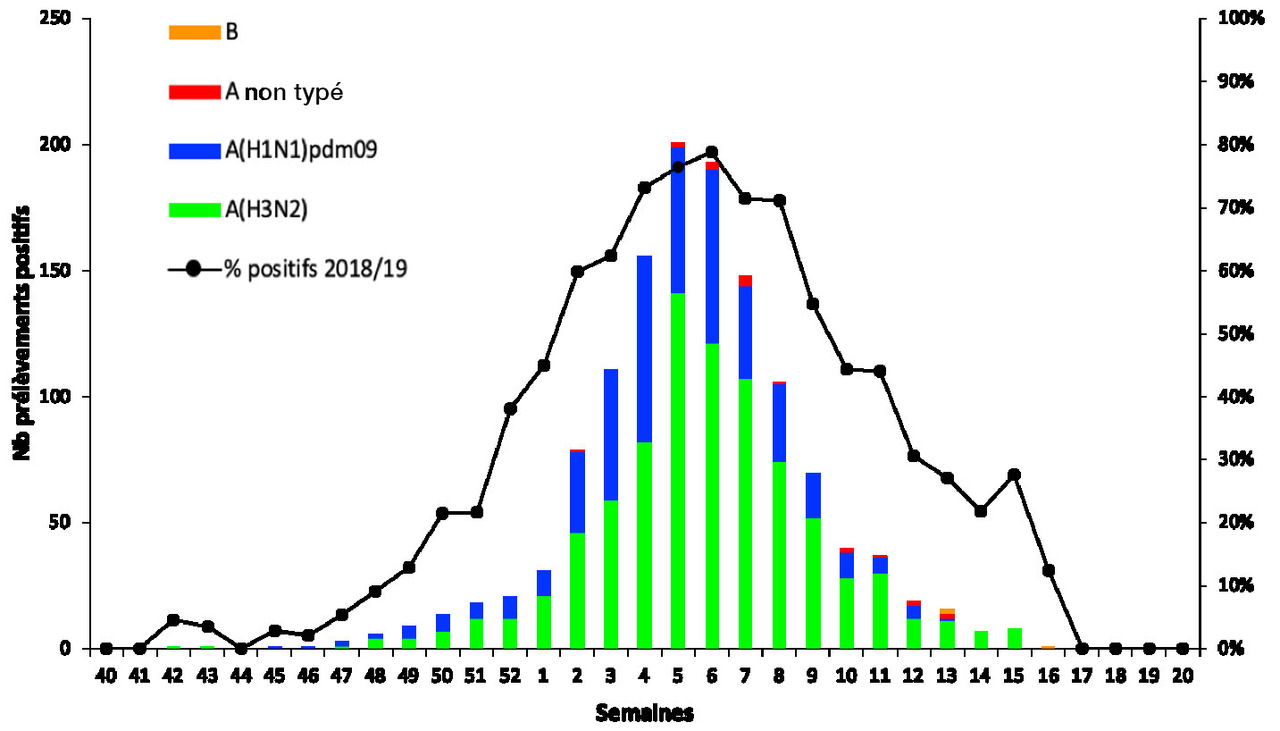
La part relative des virus A(H3N2) a progressivement augmenté pour devenir majoritaire après la semaine 05/2019 (
La sévérité a été importante avec 10 723 hospitalisations après recours aux urgences pour syndrome grippal. La surmortalité a été estimée à 8 100 décès dont 84 % survenus chez des personnes de 75 ans et plus. Le taux d’attaque le plus élevé était constaté chez les enfants, mais la majorité (62 %) des patients hospitalisés avaient plus de 65 ans.
Parmi les 1 886 cas graves admis en réanimation (signalés à Santé publique France), la majorité avait au moins un facteur de risque : âge 65 ans (52 % des cas) ou une pathologie chronique pour les plus jeunes (pulmonaire, cardiaque, diabète ; 29 %). Un syndrome de détresse respiratoire aiguë (SDRA) a été observé chez 45 % des patients et 4 % ont eu besoin d’une oxygénation par membrane extracorporelle (vs 1 % en 2016-17 et 7 % en 2015-16). Parmi les 335 décès répertoriés chez les sujets admis en réanimation, 90 % avaient au moins un facteur de risque. Les personnes infectées par un virus A(H3N2) étaient plus âgées et susceptibles de faire des complications, alors que celles contaminées par A(H1N1)pdm09 ont eu davantage de SDRA.2
Baloxavir-marboxil : bilan au Japon et aux États-Unis
D’autres antiviraux (pimodivir) sont aussi étudiés en France.3
Quelle efficacité vaccinale ?
Grippe : quand prescrire l’oséltamivir ?
(chez l’adulte : 75 mg x 2/j pendant 5 jours) :
• sujets symptomatiques, quel que soit l’âge, jugés à risque de complications ciblées par la vaccination, y compris les femmes enceintes ;
• ayant une grippe grave d’emblée ou dont l’état clinique s’aggrave, même au-delà des 48 heures après le début des symptômes ;
• dont l’état justifie une hospitalisation pour grippe.
(dose curative pendant 5 jours, 75 mg x 2/j ; posologie adulte) : chez les personnes encore asymptomatiques mais jugées à risque très élevé de complications, quel que soit l’âge, et en contact étroit avec un cas confirmé ou cliniquement typique de grippe.
(75 mg x 1/j pendant 10 jours ; posologie adulte) :
• chez les individus à risque de complications, âgés de 1 an et plus, y compris les femmes enceintes, ciblés par la vaccination, après un contact étroit datant de moins de 48 heures avec un cas confirmé ou ayant une symptomatologie typique ;
• en collectivités de personnes à risque (surtout sujets âgés).
Le traitement doit être initié le plus précocement possible sans attendre la confirmation virologique du cas ou du contact étroit.
2. Hayden FG, Sugaya N, Hirotsu N, et al. Baloxavir Marboxil for Uncomplicated Influenza in Adults and Adolescents. N Engl J Med 2018;379:913-23.
3. Finberg RW, Lanno R, Anderson D, et al. Phase 2b Study of Pimodivir (JNJ-63623872) as Monotherapy or in Combination With Oseltamivir for Treatment of Acute Uncomplicated Seasonal Influenza A: TOPAZ Trial. J Infect Dis 2019;219:1026-34.

 Encadrés
Encadrés