C’est avec l’arrivée du concept de vision fonctionnelle, venu d’Amérique du Nord et surtout de Scandinavie, que se développèrent les prises en charge médicales de ce qui devait s’appeler par la suite la basse vision.
Ces techniques de réadaptation furent revues en France par les orthoptistes, les ophtalmologistes et les opticiens pour se concrétiser en 1996 par la création de la Société francophone de basse vision, ARIBa, forte de plus de 800 membres et parrainée par la Société française d’ophtalmologie (SFO). Ce domaine ne prit une dimension de santé publique que lorsque ces techniques s’adressèrent à un problème majeur lié au vieillissement que représente la dégénérescence maculaire liée à l’âge (DMLA), en particulier par la découverte et l’exploitation en orthoptie des points de fixation de suppléance.
Aujourd’hui, ce concept de basse vision a acquis ses lettres de noblesse, et sa reconnaissance comme part entière de l’ophtalmologie est admise par tous. Cette reconnaissance s’est concrétisée en 2017 par la parution du premier rapport de la SFO sur le thème de la basse vision sous la direction du Pr Pierre-Yves Robert.
Mais malheureusement le développement et la qualité de ces prises en charge ne s’accompagnent pas sur notre territoire d’un maillage territorial de l’offre de soins capable de répondre aux besoins qui ne feront que croître avec le vieillis- sement de la population.
De quoi parle-t-on ?
Qu’appelle-t-on la déficience visuelle ? Le problème est complexe car il ne peut pas se limiter à la simple mesure de l’acuité visuelle, comme on pourrait le faire en s’inspirant des barèmes de l’Organisation mondiale de la santé. Il convient dès lors de distinguer :
– la cécité clinique avec absence de toute vision fonctionnelle ;
– la cécité légale avec une acuité visuelle inférieure à 1/20 et/ou un champ visuel central inférieur à 10° ;
– et la malvoyance, beaucoup plus difficile à définir.
Il vaut mieux ici associer à la mesure de la déficience la prise en compte du handicap avec les notions de perte d’autonomie tant dans les problèmes de vie journalière que dans les capacités de déplacements. On pourra ainsi estimer le nombre d’aveugles atteints de cécité clinique a environ 150 000 répartis pour deux tiers chez les adultes et un tiers chez les moins de 18 ans.
Mais à ce chiffre il faut ajouter le nombre important de patients malvoyants, en grande majorité représentés en France par les patients atteints de DMLA. Le nombre de patients atteints par cette pathologie doit approcher les 2 millions et la part de ces patients menacés par la perte d’autonomie, et donc le handicap visuel et la situation de dépendance, représente au minimum le quart de cette population, soit environ 500 000 personnes.
Si on y ajoute le nombre de malvoyants atteints par d’autres pathologies (v. infra), il est très probable que le nombre de personnes en situation de handicap d’origine visuelle avoisine le million. Rajoutons aux raisons de ce flou et de ces imprécisions le fait que la reconnaissance officielle et la compensation du handicap s’arrêtent à l’âge de 60 ans
Quelles causes ?
DMLA
La conservation de la vision périphérique rend souvent ce handicap difficile à identifier même par l’entourage proche dans la mesure où le patient évolue dans un environ- nement connu.
Le seul traitement en partie efficace consiste en l’injection intravitréenne (IVT) de substances antiangiogéniques qui permettent souvent la stabilisation des formes les plus graves et les plus évolutives de cette pathologie. Il s’agit des formes œdémateuses compliquées par la proli- fération de vaisseaux choroïdiens qui accélèrent de façon majeure l’évolutivité de cette maladie.
Glaucome
De plus, le nombre de patients non dépistés (ou dépistés trop tardivement) est important, et les patients mal suivis ont souvent une mauvaise observance thérapeutique.
Myopie dégénérative et évolutive
Diabète
Autres pathologies responsables de déficience visuelle
– les rétinopathies pigmentaires parfois associées à des troubles de l’audition dans les syndromes de Usher. Ces maladies génétiques évolutives débutent par des cécités crépusculaires, puis évoluent peu à peu par le rétrécissement du champ visuel à un tableau de vision « en canon de fusil » (fig. 2). Ensuite, l’atteinte de la vision centrale conduit en quelques années à la cécité totale ;
– les atteintes du nerf optique ne sont pas rares non plus : neuropathies éthylotabagiques ; neuropathie de Leber qui atteint le sujet jeune assez brutalement et se bilatéralise en règle générale en moins d’un an ; traumatisme oculaire avec ou sans corps étranger intraoculaire ; causes neurologiques (accident vasculaire cérébral, traumatismes, tumeurs, dégénérescence, atrophie corticale postérieure de Benson) ;
– la cataracte qui, si elle est parfaitement curable et représente une indication chirurgicale très fréquente et parfaitement contrôlée et codée dans les pays riches, est encore une des premières causes de cécité dans le pays en voie de développement.
Différentes formes cliniques
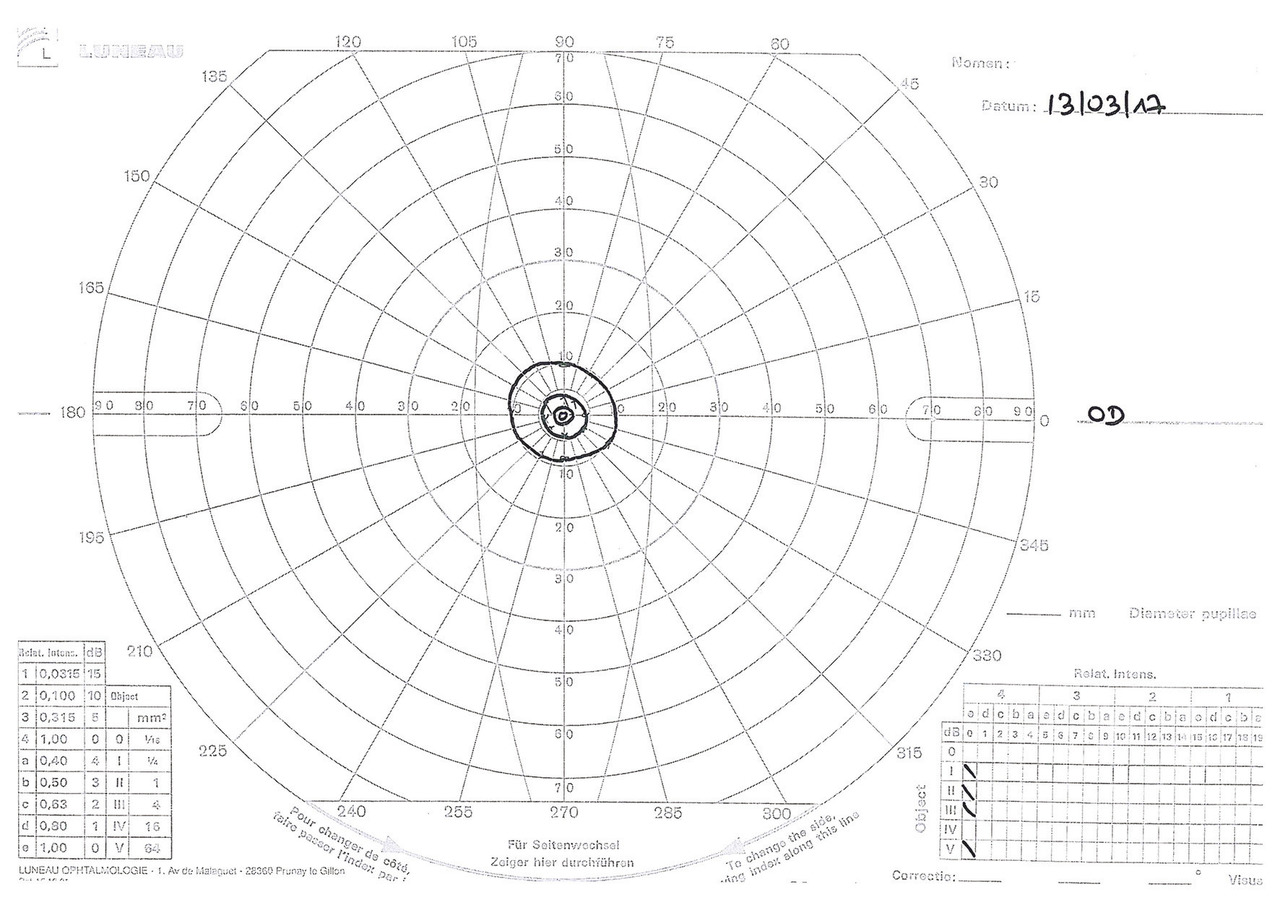
– le déficit central (fig. 1), en rapport avec l’atteinte maculaire ou du faisceau central du nerf optique dans les DMLA, les maculopathies myopiques ou juvéniles ;
– le déficit périphérique, avec la réduction du champ visuel et la vision en canon de fusil (fig. 2) des rétinites pigmentaires ;
– les déficits systématisé surtout dus aux atteintes des voies optiques : hémianopsies, hémianospie latérale homonyme, quadranopsies… ;
– les déficits diffus, par exemple dans la rétinopathie diabétique ;
– les déficits mixtes, avec conservation d’une vision centrale et d’un îlot de vision en périphérie temporale (neuropathies glaucomateuses) ;
– les déficits associés avec atteintes cognitives, atteintes motrices (sclérose en plaques, cérébrolésions…), et atteintes sensorielles (syndrome de Usher).
À chacune de ces formes cliniques va correspondre un projet spécifique de réponse orthoptique, par exemple le développement des points de fixation de suppléance dans les déficits centraux ou la stratégie de balayage, repérage et poursuite dans les déficits périphériques.
Quelles conséquences ?
– les déplacements, avec nécessité d’aider le patient à se réapproprier la notion d’espace, de schéma corporel et d’orientation. C’est le rôle de la psychomotricité et de la réadap- tation en locomotion ;
– les activités de vie journalière, repas, ménage, entretien du linge, courses, etc.
– la communication orale, avec altération de la part non verbale de la communication par perte de l’accès à l’expression du visage, ou écrite, pouvant nécessiter l’usage du braille, et grandement améliorée aujourd’hui par les progrès numériques avec des différentes interfaces (synthèse vocale, braille, logiciel agrandisseur…).
Quels moyens de lutte ?
La rééducation basse vision comprend le développement de nouvelles stratégies visuelles après évaluation de la vision fonctionnelle des patients ; c’est le rôle des trois « O » : ophtalmologistes, orthoptistes, opticiens avec prescriptions des aides optiques. Ainsi que le développement des sens compensatoires, sens tactile, visio-tactile et coordination œil-main en ergothérapie avec rééducation des activités de la vie quotidienne et des moyens de communication (braille, informatique) et sens de l’orientation et mobilité en unité de psychomotricité et locomotion.
Recherche fondamentale et clinique
Ces trois domaines de recherche sont encore au stade de l’expérimentation en laboratoire et des études précliniques ou cliniques. Un long chemin reste à parcourir, mais le principe de chacune de ces voies de recherche a pu être validé.
Il est même envisagé dans certains cas de faire appel dans le même projet à deux de ces solutions, comme c’est par exemple le cas dans les projets d’optogénétique développés à l’Institut de la vision à Paris
UNE PRISE EN CHARGE ENCORE INSUFFISANTE
Il ne reste plus qu’à souhaiter que les pouvoirs publics soient à l’écoute des projets et permettent ainsi que tous les déficients visuels de notre pays puissent bénéficier de la prise en charge de leur déficience sensorielle, à l’instar de ce qui existe déjà et depuis longtemps sur le plan du déficit moteur.
Quelles ressources pour la réponse au handicap lié à la déficience visuelle ?
Celles-ci sont multiples et se déclinent à différents niveaux de complexité et de prise en charge médicale et médicosociale :
– les services de suite et réadaptation à la déficience visuelle (SSR DV), soit en hospitalisation complète avec trois établissements en France, 70 lits au total, soit en hospitalisation de jour, avec une quinzaine d’établissements souvent développés à l’initiative du mouvement mutualiste ;
– les cabinets libéraux d’orthoptie, d’ergothérapie et les unités basse vision des magasins d’optique ;
– les réponses médico-sociales : les services d'accompagnement médico-social pour adultes handicapés déficients visuels (SAMSAH DV) dont la mission est avant tout la transposition des acquis de la rééducation sur les lieux de vie des patients ;
– les services d’aide à la vie sociale (SAVS) ;
Certains services proposent la prise en charge des enfants déficients visuels :
– les services d’accompagnement familial et d’éducation précoce (SAFEP) ;
– les centres d’aide médicosociale précoce pour enfants déficients visuels (CAMSP DV) ;
– les services d’aide à l’acquisition de l’autonomie et à la scolarisation (SAAAS).
Il existe ainsi de nombreuses réponses, en lien avec les maisons départementales des personnes handicapées (MDPH), mais leur nombre reste toutefois encore très limité avec une inégalité majeure dans le maillage territorial.
Rééducation basse vision d’un patient atteint de DMLA
Il existe de nombreuses formes cliniques et de nombreux programmes de rééducation basse vision. La forme la plus répandue est la rééducation d’un patient atteint de dégénérescence maculaire liée à l’âge (DMLA) avec atteinte de l’acuité visuelle centrale et présence d’un scotome central.
La prise en charge du patient commence par un bilan orthoptique basse vision visant à évaluer ses capacités résiduelles, à savoir sa vision fonctionnelle : acuité visuelle mesurée sur l’échelle ETDRS ; évaluation de nombreux autres paramètres tels que la vitesse de lecture, l’endurance visuelle, la vision des contrastes ; champ visuel très précis définissant les limites du scotome central en utilisant autant la périmétrie cinétique de Goldman que la campimétrie statique informatisée.
Un moment essentiel de ce bilan consiste à rechercher des points de fixation de suppléance, notamment le point préférentiel de suppléance qui est recherché par des moyens cliniques. Commence alors la réadaptation proprement dite en développant des stratégies oculomotrices visant à permettre au patient d’utiliser cette fixation de suppléance.
La rééducation est d’abord statique, puis dynamique, et ensuite appliquée aux activités de lecture et d’écriture.
Une prise en charge en ergothérapie développe également les techniques de coordination œil-main pour coordonner les actes de préhension de la vie quotidienne avec ce nouveau point de fixation.
Le programme de rééducation comprend également un bilan psychomoteur et une évaluation des déplacements du patient de façon à sécuriser sa locomotion.
Enfin, des conseils sont prodigués au patient concernant l’organisation de son environnement habituel à domicile.
Ainsi avec une prise en charge relativement courte, estimée à une période de 4 à 6 semaines à raison de 3 heures de rééducation par jour, peut-on obtenir dans la plupart des cas une baisse importante de la dépendance du patient et permettre le maintien à domicile d’une personne qui autrement aurait été menacée de placement en milieu spécialisé.
Quelle prise en charge par l’assurance maladie ?
Ces programmes de rééducation sont pris en charge par l’assurance maladie, soit sous la forme d’une prise en charge libérale par des séances d’évaluation et de rééducation orthoptique, soit au sein d’établissements spécialisés tels que les services de soins de suite et de réadaptation avec des programmes proposés le plus souvent en hôpital de jour mais également, dans certains cas, en hospitalisation complète.
2. Augood CA, Vingerling JR, de Jong PTVM, et al. Prevalenceof age-related maculopathy in older Europeans: the Europeans Eye Study (EUREYE). Arch Ophthalmol 2006;124:529-35.
3. Wong WL, Su X, Li X, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health 2014;2:e106-16.
4. Rudnicka AR, Kapetanakis VV, Jarrar Z, et al. Incidence of late-stage age-related macular degeneration in American whites: systematic review and meta-analysis. Am J Ophthalmol 2015;160:85-93.e3.
5. Rudnicka AR, Mt-Isa S, Owen CG, Cook DG, Ashby D. Variations in primary open-angle glaucoma prevalence by age, gender, and race: a Bayesian meta-analysis. Invest Ophthalmol Vis Sci 2006;47:4254-61.
6. Friedman DS, Jampel HD, Munoz B, West SK. The prevalence of open-angle glaucoma among blacks and whites 73 years and older: the Salisbury Eye Evaluation Glaucoma study. Arch Ophthalmol 2006;124:1625-30.
7. IDF diabetes atlas. 7th edition. http://www.diabetesatlas.org/
8. Prevents Blindness America, National Eye Institut. Vision problems in the US – Prevalence of adult vision impairment and age-related eye disease in America, 2012. www.visionproblemsus.org/
9. Hatwell Y. Psychologie cognitive de la cécité précoce. Paris: Dunod, 2003.
10. Cyrulnik B, Bustany P, Oughourlian JM, et al. Votre cerveau n’a pas fini de vous étonner. Paris : Librairie générale française, 2014.
11. Cheung SH, Legge GE. Functional and cortical adaptations to central vision loss. Vis Neurosci 2005;22:187-201.
12. Crossland MD, Engel SA, Legge GE. The preferred retinal locus in macular disease: toward a consensus definition. Retina 2011;31:2109-14.
13. Mangione CM, Philipps RS, Sedon JM, et al. Development of the « Activities of daily vision scale ». Med Care 1992;30:1111-26.
14. Bremond-Gignac D, Tixier J, Missotten T, Laroche L, Beresniak A. Évaluation de la qualité de vie en ophtalmologie. Presse Med 2002;31:1607-12.
15. Robert PY, et al.; Société française d’ophtalmologie. Déficiences visuelles. Issy-les-Moulineaux : Elsevier Masson, 2017.

 Encadrés
Encadrés