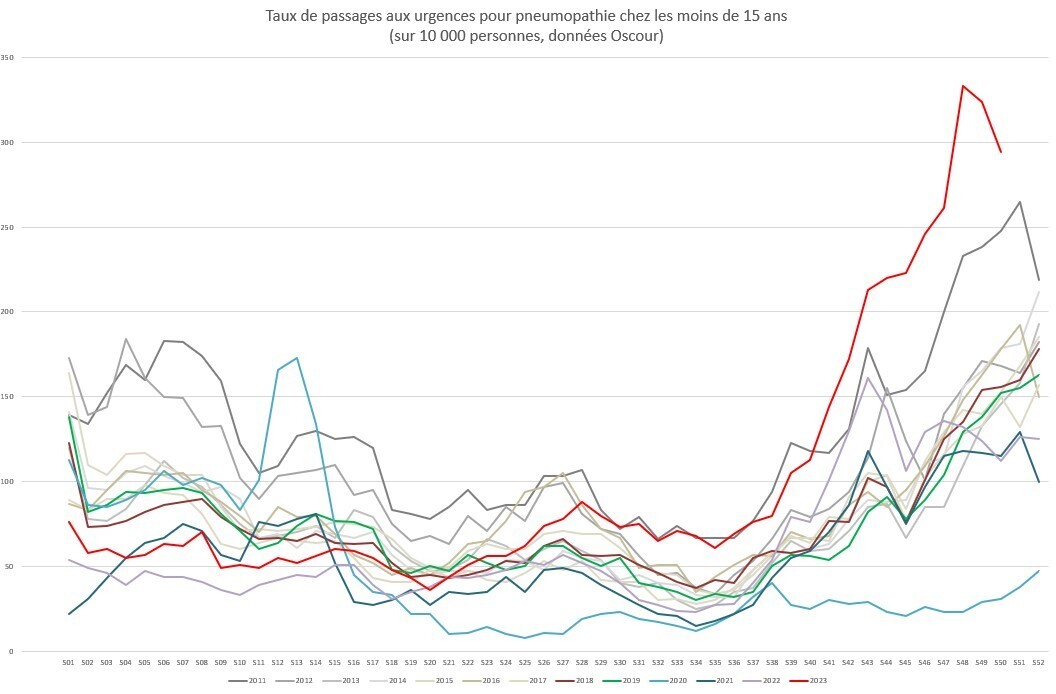
On constate depuis quelques semaines une forte hausse des pneumopathies chez les enfants : le taux de passage aux urgences pour pneumopathie chez les moins de 15 ans a atteint un niveau inédit depuis au moins 10 ans (figure). Cette augmentation est liée à une recrudescence des infections à Mycoplasma pneumoniae.
Mycoplasma pneumoniae (Mp) est une petite bactérie strictement humaine, dépourvue de paroi cellulaire, responsable de rhinopharyngites, trachéobronchites et pneumonies. La transmission, interhumaine, se fait par gouttelettes de salive et nécessite un contact étroit et prolongé. D’où l’effondrement des contaminations constaté à la suite de mesures mises en place pendant la pandémie. Les infections à Mp surviennent par poussées épidémiques, qui ont lieu tous les quatre à sept ans. L’épidémie actuelle semblant plus intense que les années précédentes (en Chine notamment), certains ont incriminé la « dette immunitaire » post-Covid (concept qui fait toujours débat parmi les spécialistes). Toutefois, des épidémies plus intenses cycliques ont déjà été rapportées à plusieurs reprises.
Les infections à Mp touchent particulièrement les enfants âgés de 5 à 15 ans. Elles sont rares chez les moins de 4 ans et les plus de 60 ans. C’est le deuxième agent bactérien, après le pneumocoque, responsable de pneumonies communautaires.
Le germe peut persister dans les voies respiratoires plusieurs semaines après l’infection (portage asymptomatique) : une PCR positive est donc fréquente chez l’enfant en l’absence de symptômes (jusqu’à 20 % dans certaines études).
L’immunité après l’infection étant de courte durée, les réinfections sont possibles. Cependant, les modèles expérimentaux montrent que les patients ayant les symptômes les plus sévères sont ceux qui n’avaient pas préalablement d’anticorps.
L’absence de paroi bactérienne explique son insensibilité totale aux bêtalactamines. Sa résistance aux macrolides est en augmentation depuis les années 2000, avec des taux documentés chez l’enfant de l’ordre de 5 à 10 % en France (mais elle serait de 80 % en Chine !).
Clinique et imagerie peu spécifiques
Aucun signe clinique ou radiographique n’est spécifique d’une pneumonie à Mp.
La durée d’incubation est de 1 à 4 semaines. Dans la majorité des cas, l’infection se traduit par de simples rhino-pharyngites, trachéobronchites avec toux traînante. Dans sa forme la plus caractéristique, elle réalise un tableau de pneumonie atypique primitive, d’installation souvent progressive, avec un syndrome fébrile, des signes de la sphère ORL et une toux sèche, des douleurs musculaires, voire une éruption cutanée, le plus souvent maculopapulaire (chez environ 10 % des enfants). L’évolution est lente et favorable. La toux, initialement non productive, peut devenir productive, persister pendant 3 à 4 semaines et être accompagnée de sifflements.
Les anomalies radiographiques sont variables : des infiltrats diffus bilatéraux (pneumopathie atypique) ou des pneumonies d’allure franche lobaire aiguë mais résistantes aux pénicillines, parfois un épanchement pleural. Les investigations complémentaires dépendent de la gravité de la pneumonie et ne doivent pas retarder la mise en route d’un traitement probabiliste.
Plus rarement, la bactérie est impliquée dans des affections extrapulmonaires plus sévères, notamment cutanées (syndrome de Stevens-Johnson), neurologiques (encéphalites avant tout), mais aussi hématologiques (anémie hémolytique, purpura thrombopénique) et cardiaques (myocardites, péricardites).
Confirmation diagnostique difficile
Les examens sérologiques à 2 semaines d’intervalle, test biologique de référence, donnent un diagnostic rétrospectif et ont ainsi peu d’intérêt face à une situation aiguë, le plus souvent peu sévère et d’évolution favorable.
La détection de l’ADN bactérien par PCR au niveau du nasopharynx dans les 7 jours qui suivent le début des signes, avec méthode multiplex (détection simultanée de plusieurs bactéries atypiques et virus respiratoires) est plus rapide, mais une PCR positive ne permet pas de différencier un simple portage d’une infection en cours. En pratique, elle est réalisée si besoin en milieu hospitalier (pas remboursée en ville).
Traitement
L’immense majorité des infections à Mp guérissent spontanément. Les preuves du bénéfice de l’antibiothérapie pour les enfants non hospitalisés ayant une infection respiratoire basse attribuable à Mp sont limitées. Cependant, selon les pédiatres, il est raisonnable de traiter les pneumopathies atypiques s’accompagnant de symptômes marqués et les infections extrapulmonaires graves telles que les maladies du système nerveux central ou l’arthrite septique chez un patient immunodéprimé.
Les antibiotiques actifs sur Mp sont :
- les macrolides, traitement de référence (mais 5 à 10 % des souches seraient résistantes dans les pays occidentaux et 80 % en Chine) :
- clarithromycine 7 jours,
- azithromycine 3 jours ;
- la doxycycline (qui n’est plus contre-indiquée pour les moins de 8 ans pour des traitements de moins de 2 semaines) pendant 7 jours ;
- les quinolones (en principe contre-indiquées chez l’enfant).
Ces deux dernières familles d’antibiotiques seraient plus efficaces pour les formes neurologiques.
Attention : le « DGS urgent » du 29 novembre 2023 précise que devant une pneumopathie bactérienne sans signe d’emblée évocateur de bactérie atypique (début progressif, signes extrarespiratoires, état général conservé, opacité non systématisée), le traitement de première intention reste l’amoxicilline ou l’association amoxicilline-acide clavulanique selon les recos habituelles. Dans ce cas, la réévaluation clinique à 48 - 72 h est impérative et le diagnostic de Mycoplasma pneumoniae doit être évoqué en cas d’échec, incitant à réaliser un changement antibiotique pour un macrolide après avoir réalisé une radiographie de thorax pour éliminer un épanchement pleural et/ou une CRP (généralement peu augmentée dans les infections à mycoplasmes et virales, contrairement aux infections à pneumocoque).
La DGS rappelle également que cette alerte ne doit pas faire oublier la recherche en premier lieu d’une pneumopathie virale grippale, Covid ou VRS.
Cohen R, Launay O, Thollot F, et al. Bulletin Supplémentaire N°11 – Novembre 2023 – Mycoplasma pneumoniae. Infovac-France 28 novembre 2023.
Ministère de la santé. DGS urgent. Augmentation des cas d’infections respiratoires à Mycoplasma pneumoniale en France. 24 novembre 2023.
Pereyre S, Bebear C. Mycoplasma pneumoniae. Société française de microbiologie 1er juillet 2019.
« Mycoplasma pneumoniae » In: Kimberlin DW, Barnett ED, Lynfield R, et al. Red Book: 2021 Report of the Committee on Infectious Diseases. American Academy of Pediatrics 2021:343-8.
Meyer Sauteur P, Beeton M. Mycoplasma pneumoniae: gone forever? Lancet 29 juin 2023
Benoist G, Grimwood C, Loraud C. Mycoplasme chez l’enfant. Rev Prat Med Gen 2018;32(996);150-1.
Spuesens EB, Fraaij PL, Visser EG, et al. Carriage of Mycoplasma pneumoniae in the upper respiratory tract of symptomatic and asymptomatic children: an observational study. PLoS Med 2013;10(5):e1001444.