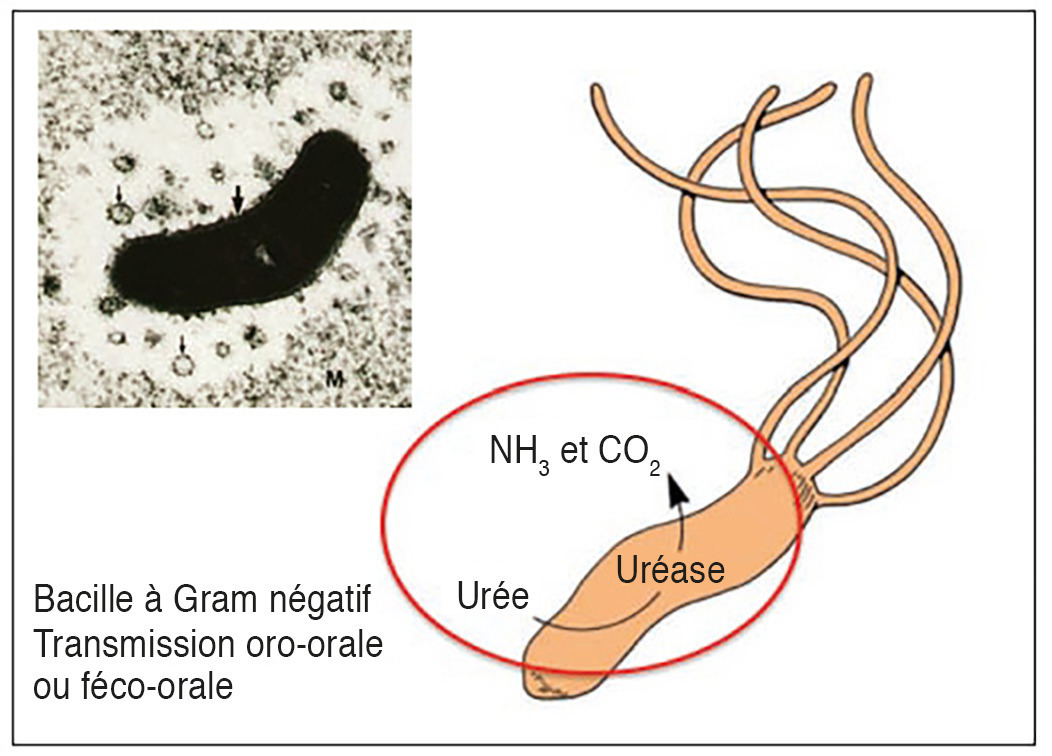
Bactérie à Gram négatif, de forme hélicoïdale, mesurant environ 3
Très commune dans l’estomac humain. Seule bactérie capable de résister à un environnement acide.
Responsable de 80
Infection très fréquente
Environ la moitié de la population mondiale est infestée, avec de grandes variations selon les âges et les pays (fig. 2). Surtout dans les pays en voie de développement en fonction des conditions locales d’hygiène.2 En France, prévalence = 5 % chez l’enfant et 50 % après 60 ans. En moyenne, 15 à 30 % dans la population.
Aux États-Unis, plus de 50 % des sujets concernés ont plus de 60 ans contre 20 % chez les moins de 40 ans. Après infestation : risque de 3 % de faire un cancer gastrique et de 10 à 15 % un ulcère gastroduodénal. Le rôle de H. pylori a été évoqué dans différentes pathologies neurologiques (Alzheimer, Parkinson), dermatologiques (rosacée, urticaire chronique), hématologiques (anémie ferriprive, thrombopénie) ou autres (diabète).3
Infection latente
Après ingestion d’aliments ou d’eau contaminée, souvent dans l’enfance, probablement favorisée par la promiscuité, persistance durant toute la vie, en l’absence de traitement. Le système immunitaire humain ne peut pas l’éradiquer.
Latente dans 70 % des cas ou se manifestant par divers symptômes non spécifiques : épigastralgies, douleurs abdominales, régurgitations, vomissements, nausées, éructations, flatulence, constipation, voire somnolence. La rechercher si : gastrite, ulcère gastroduodénal, cancer de l’œsophage ou de l’estomac, prolifération monoclonale des lymphocytes B (lymphome du MALT), antécédent familial de cancer gastrique ou encore anémie ferriprive ou carence inexpliquée en vitamine B12.
Autres indications : avant une chirurgie bariatrique de type by-pass ; dyspepsie chronique avec gastroscopie normale.
Diagnostic par test respiratoire
Le plus fiable, non invasif, simple et rapide : analyse de l’air expiré détectant le CO2 marqué, après ingestion d’urée marquée au carbone
Si infection, H.
En cas de gastroscopie, recommandée chez les patients suspects de pathologie digestive haute et ceux aux antécédents familiaux de cancer gastrique avant 40
Culture et PCR permettent de la détecter et d’établir la sensibilité à certains antibiotiques (
Diagnostic possible dans les selles par immuno-chromatographie ou par dosage d’anticorps spécifiques, mais sans pouvoir dater ni surveiller la guérison, les anticorps persistant plusieurs mois après l’éradication. Tests moins utilisés, mais parfois encore en dépistage, chez un patient jamais traité.
Associer antibiotiques et IPP
Démontrer l’infestation avant tout traitement d’éradication +++
Deux cas de figure :
- soit prescription ciblée d’emblée (H. pylori retrouvé sur culture de biopsies gastriques, permettant antibiogramme ou bien PCR – non remboursée) ;
- soit traitement probabiliste par défaut. Les recommandations de la HAS concernent des molécules particulières, non des familles d’antibiotiques. Pas de substitution au sein d’une même famille.
Traitement ciblé
Souche sensible à la clarithromycine. Trithérapie 10 jours : IPP (oméprazole 20 mg matin et soir) + amoxicilline 1 g x 2/j + clarithromycine 500 mg x 2/j.
Souche résistante à la clarithromycine mais sensible à la lévofloxacine. Trithérapie 10 jours : IPP + amoxicilline 1 g x 2/j + lévofloxacine 500 mg/j.
Souche résistante à la clarithromycine et à la lévofloxacine. Quadrithérapie bismuthée pendant 10 jours : oméprazole, sels de bismuth, tétracycline et métronidazole. Les 3 derniers réunis dans Pylera, 3 gélules 4 x/j (après les repas du matin, du midi, du soir et au coucher, avec un grand verre d’eau) sans dépasser 10 jours. Si échec : avis spécialisé.
Traitement probabiliste
Quadrithérapie bismuthée pendant 10
Quadrithérapie concomitante pendant 14
En cas d’échec, prescrire en 2e
Inefficacité de 2
Impératif : vérifier la guérison par la négativation du test respiratoire à l’uréase, pratiqué au moins 1
Les probiotiques auraient un effet protecteur en réduisant la concentration de la bactérie faisant régresser les symptômes en quelques semaines. Ils forment avec H.
Essais vaccinaux non concluants.
À retenir
H. pylori : retrouvé chez la moitié de la population mondiale.
Grâce à sa forme hélicoïdale et ses flagelles, s’attache aux cellules épithéliales gastriques et les détériore.
Cause la plus fréquente des ulcères gastroduodénaux et des cancers gastriques.
Diagnostic : sur test respiratoire par détection du CO2 marqué, après ingestion d’urée marquée au carbone 13.
Antibiotiques + IPP = éradication dans 95 % des cas.
1. Bravo D, Hoare A, Soto C, et al. Helicobacter pylori in human health and disease: mechanism for local gastric and systemic effects. World J Gastroenterol 2018;24:3071-89.
2. Hooi JKY, Lai WY, Ng WK, et al. Global prevalence of Helicobacter pylori infection. Systematic review and meta-analysis. Gastroenterology 2017;53:420-9.
3. Gravina HG, Zaguri RM, de Musis; et al. Helicobacter pylori and extragastric diseases. A review. World J Gastroenterol 2018;24:3204-21.
4. Pohl D, Keller PM, Bordier V, et al. Review of current diagnostic methods and advance in Helicobacter pylori diagnostics in the era of next generation sequency. World J Gastroenterol 2019;25:4629-60.
5. de Klerk N, Maudsdotter L, Gebreegziabher H, et al. Lactobacilli reduce Helicobacter pylori attachement to host gastric epithelial cells by inhibiting adhesion gene expression. Infect Immun 2016;84:1526-35.

 Encadrés
Encadrés