Si l’origine est traumatique, l’augmentation de volume est d’origine inflammatoire (
Quand y penser ?
Traumatisme crânien (inaperçu dans 25 % des cas).
Facteurs favorisants : anticoagulant ou antiagrégant plaquettaire (APP) [dans presque la moitié des cas], éthylisme chronique (lui-même pourvoyeur de traumatismes crâniens ou de troubles de l’hémostase), hypotension intracrânienne secondaire (ponction lombaire, dérivation ventriculaire, déshydratation) ; plus rarement, kyste arachnoïdien, malformation vasculaire ou tumeur hémorragique.
Apparition des symptômes habituellement après un intervalle libre de durée variable (au moins 2 semaines) selon l’atrophie cérébrale pré-existante.
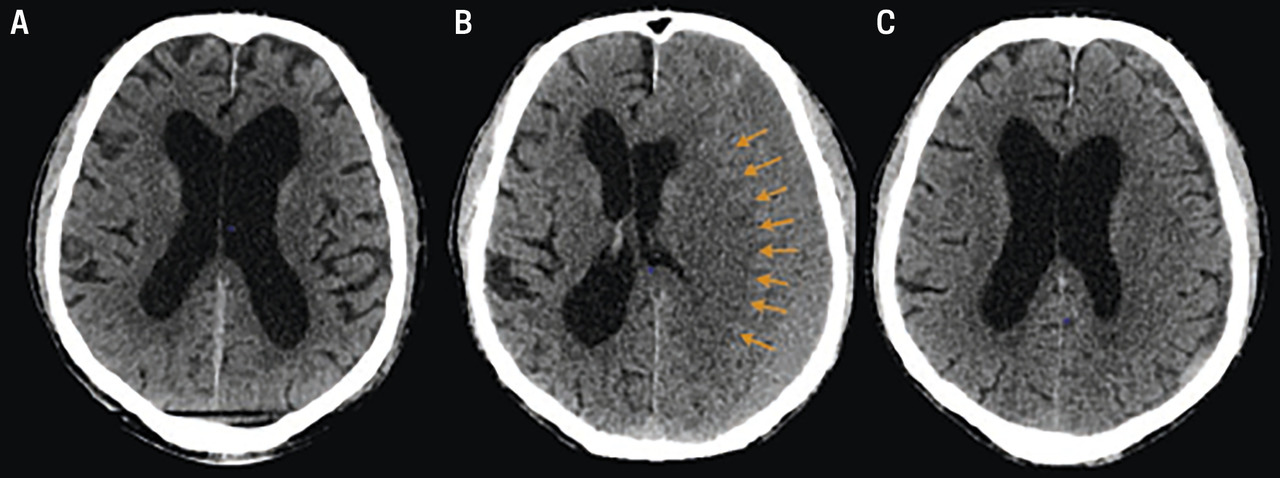
Au scanner cérébral :
– hypo- (hématome chronique datant de plus de 3 semaines) ou isodensité (subaigu, < 3 semaines), classiquement en forme de « croissant » péricérébral, avec souvent un effet de masse sur le cerveau (
– parfois saignements d’âges différents, voire cloisonnements.
Le grand simulateur
Parmi les formes atypiques, connaître celle à révélation psychiatrique ou cognitive, ou pseudo-démence curable (signes rapidement évolutifs).
Syndrome anxiodépressif, signes paranoïdes ou triade clinique d’hydrocéphalie chronique de l’adulte (troubles de la marche, sphinctériens et des fonctions supérieures).
Jusque dans 10 % des cas : troubles du langage ou sensitifs transitoires (l’effet de masse dû à l’HSDC contrarie la perfusion cérébrale sur l’hémisphère considéré).
Crises d’épilepsie (mais rarement révélatrices) : si compression directe du cortex homolatéral, parfois intermittente (selon les variations de la pression intracrânienne avec la position de la tête).
Syndromes extrapyramidaux rapidement évolutifs, de bon pronostic après traitement de l’hématome.
Syndrome pyramidal homolatéral à l’HSDC (ou de Kernohan, par compression du pédoncule cérébral controlatéral sur le bord libre de la tente du cervelet).
Chirurgie : bien peser les indications
Pour décomprimer l’effet de masse et minimiser le risque de récidive.
Incontournable en cas de dégradation neurologique (risque de resaignement aigu dans la cavité opératoire, qui peut être fatal).
Contre-indications potentielles : démence préalable sans lien avec l’hématome ou comorbidités lourdes (qualité de vie inacceptable après traitement ou procédure trop risquée).
À discuter si troubles de la coagulation sévères : myélodysplasie, cirrhose évoluée ou anticoagulants difficiles à arrêter en cas de valves cardiaques mécaniques ou de stents actifs.
Plusieurs techniques :
– évacuation par craniotomie (à l’aide d’une tréphine) ou par un simple trou de trépan ;
– ou craniostomie à la mèche oblique permettant l’évacuation « à crâne fermé » ;
– généralement sous anesthésie générale (mais chez certains sujets fragiles comorbides, une anesthésie locale peut suffire) ;
– objectif : laver l’espace sous-dural en limitant la pneumencéphalie => le drainage de l’espace sous-dural est la technique validée (taux de récidive passant de 24 à 9 %) ;
– en postopératoire : pas de preuve d’efficacité des anticonvulsivants systématiques (mais habituellement administrés pendant les 48 heures de drainage sous-dural) ni du décubitus dorsal strict durant plusieurs jours.
Quel pronostic ?
Céphalées secondaires à une hypertension intracrânienne : bon pronostic.
Éthylisme chronique : délétère car responsable de troubles de la coagulation, chutes à répétition, altération de l’état général et atrophie cérébrale par toxicité directe de l’alcool et via des phénomènes carentiels.
Facteurs péjoratifs :
– pneumencéphalie postopératoire :
. favorise les complications immédiates (absence de réveil liée à un effet de masse persistant, risque accru de resaignement aigu dans la cavité opératoire) ;
. gêne la bonne réexpansion du cerveau augmentant le délai de récupération et favorisant la récidive ;
– traitement retardé : lésions neurologiques irréversibles, par engagement cérébral ou compression prolongée du névraxe ; réexpansion cérébrale plus tardive ;
– épaisseur de l’hématome (> 2 cm) et faible score de Glasgow ;
– caractère bilatéral.
Gestion des anticoagulants et AAP
Pour les anticoagulants : réversion en cas de menace vitale immédiate ou alors contrôle INR ou TCA (on opère quand l’isocoagulation est obtenue).
Reprise du traitement, selon les habitudes du service : en général, après un arrêt de 1 mois, si scanner cérébral satisfaisant (mais aucune étude de bon niveau de preuve).
HSDC : un processus inflammatoire
En conditions normales, l’espace sous-dural est virtuel, dure-mère et arachnoïde étant en continuité histologique. Un traumatisme peut induire une séparation de ces 2 feuillets méningés et une prolifération fibroblastique, amenant à la formation de membranes fibreuses, notamment une coque externe contenant des néovaisseaux croissant sous l’effet du VEGF.
Ces vaisseaux ont une paroi inflammatoire et une perméabilité augmentée, contribuant à la production du liquide sous-dural. D’autres facteurs de l’inflammation sont présents : IL-6 et 8, facteur d’activation plaquettaire.
L’hématome sous-dural chronique (HSDC) serait un phénomène inflammatoire, néo-angiogénétique et fibrinolytique auto-entretenu. Ainsi, la corticothérapie pourrait être une alternative à la chirurgie. Le lavage chirurgical de l’espace sous-dural fait baisser drastiquement la concentration en facteurs nocifs, alors que les membranes sont laissées en place.
Que dire à vos patients ?
(suites simples).
.
dans les 3 mois.
Proscrire anticoagulants/antiagrégants plaquettaires dans les semaines suivant l’intervention.
Pas de précautions ou de règles hygiénodiététiques spécifiques par la suite.

 Encadrés
Encadrés