Le taux élevé de passage à la chronicité – de 70 % – explique qu’environ 71 millions d’individus étaient concernés dans le monde en 2017.1 Ce virus est, au moins dans les pays industrialisés, l’une des causes principales de transplantation hépatique et de carcinome hépatocellulaire, dont l’augmentation est prévue jusqu’à environ 2030.2-3
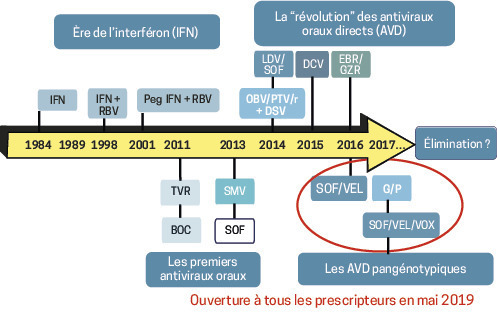
On assiste aujourd’hui à une véritable révolution thérapeutique marquée par la rapidité de développement de nouveaux traitements (constamment plus efficaces et mieux tolérés ;
Le contexte est unique : d’une part, c’est la seule infection chronique dont on puisse espérer guérir ; d’autre part, le foie ayant une capacité unique de régénération, la fibrose est en permanence remodelée par des enzymes hépatiques, et peut donc régresser, en l’absence de comorbidité hépatique, si l’activité nécrotico-inflammatoire est modeste ou absente. Cette « réparation » partielle (ou complète) concerne également les atteintes extrahépatiques, notamment vasculaires.
Épidémiologie
La prévalence du VHC dans le monde décroît : 170 millions de porteurs chroniques en 1999 versus 71 millions en 2017. Cette réduction est liée non seulement à l’accès aux traitements (encore minoritaire) mais aussi à la baisse de la mortalité des sujets infectés et des risques de contamination nosocomiale.
On considère ainsi que 1 % de la population mondiale est actuellement contaminée (
Le risque de transmission sexuelle est faible (< 1 %) chez les couples hétérosexuels stables mais peut être accru en cas de rapports sexuels traumatiques, en particulier chez les hommes ayant des relations sexuelles avec des hommes (HSH), surtout ceux infectés par le VIH. Le risque est alors sans doute plus parentéral (fist fucking, chemsex) que sexuel.
Rappelons qu’un nombre non négligeable de patients (environ 20 %) sont porteurs du virus sans aucun facteur de risque retrouvé, d’où la recommandation de faire un dépistage au moins une fois chez chaque adulte au cours de sa vie.
La mortalité attribuable aux hépatites virales était en 2015 d’environ 720 000 décès par cirrhose et 470 000 par carcinome hépatocellulaire (CHC), avec une augmentation de 22 % depuis 2000. Si celle liée à l’infection virale B est pratiquement 2 fois plus importante, et ce malgré un vaccin disponible depuis plus de 30 ans, environ 400 000 sujets meurent tous les ans d’une infection chronique par le VHC, principalement en raison de la cirrhose (environ deux tiers) mais aussi du CHC.
Un diagnostic sérologique
Depuis l’isolement de l’ARN viral par l’équipe de Michael Houghton à partir du sang d’un sujet infecté par les virus non A non B, de nombreux tests diag- nostiques ont été développés. La RT-PCR (reverse transcriptase-polymerase chain reaction) a permis le séquençage du virus et l’identification de différents génotypes (numérotés de 1 à 7) et sous-types (a, b, c)…
Aujourd’hui, le diagnostic repose sur la détection des anticorps anti-VHC par la méthode immuno- enzymatique ELISA (tests de 3e génération), qui témoigne d’une rencontre antérieure avec le virus. Il n’est plus nécessaire qu’elle soit confirmée par un deuxième prélèvement.
En cas de positivité, le caractère actif de l’infection, c’est-à-dire la présence d’une réplication virale, est affirmé par l’identification de l’ARN viral par RT-PCR. Attention : la séroconversion a lieu quelques semaines après la contamination, alors que la virémie est détectable (par RT-PCR) dans les 4 jours suivant l’exposition au virus. Ainsi, un patient ayant des anticorps anti-VHC et un ARN viral C indétectable est guéri de son infection.
Notons que les tests sérologiques ont permis également un screening de masse des sujets infectés, notamment des donneurs de sang : le risque de contamination virale C transfusionnelle s’est effondré, il est actuellement de l’ordre de 1 pour 700 000-1 million.
Une maladie systémique
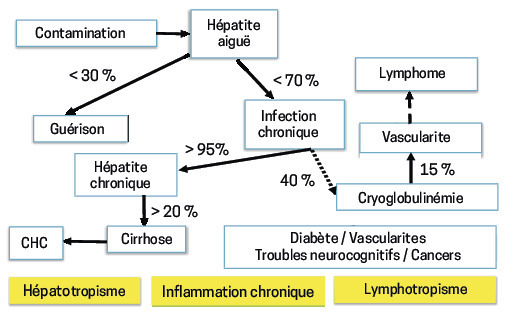
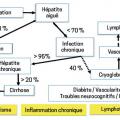
Les manifestations liées à l’infection témoignent d’un hépatotropisme et d’un lympho- tropisme du VHC, et de l’inflammation chronique associée.
L’hépatotropisme explique les risques d’hépatite chronique pouvant évoluer vers la cirrhose et le carcinome hépatocellulaire. Cependant, l’atteinte hépatique est davantage due à des mécanismes immuno-médiés qu’à une toxicité directe du virus : les hépatocytes infectés sont détruits par les lymphocytes T cytotoxiques spécifiques, qui reconnaissent les antigènes viraux exprimés à la surface des cellules.
Le lymphotropisme, qui se traduit par la multiplication du virus à l’intérieur des lymphocytes B ou par leur stimulation chronique, est responsable d’une cryoglobulinémie chez environ la moitié des patients, majoritairement de type II.
En effet, un complexe protéique associant VHC, anticorps antiviraux et facteur rhumatoïde peut se déposer sur les parois des vaisseaux de petit et moyen calibre et être à l’origine d’une vascularite cryoglobulinémique.
Elle est potentiellement responsable de manifestations cutanées (purpura), rhumatologiques (polyarthrite des petites articu- lations), rénales (glomérulonéphrite membrano- proliférative) ou neurologiques (neuropathies périphériques fréquentes).
Dans les cas les plus graves, elle peut conduire à une sélection clonale induisant des lymphomes (surtout non hodgkiniens B de type splénique mais parfois plus diffus).
L’infection chronique qui s’installe chez trois quarts des sujets est aussi responsable d’une inflammation persistante, entraînant des manifestations extrahépatiques : troubles neurocognitifs, insulinorésistance (risque x 1,5 de diabète), pathologies cardio-, cérébro- ou réno-vasculaires (x 2-3) et cancers extrahépatiques.
Toutes ces atteintes rendent compte d’une mortalité hépatique multipliée par 10 chez les patients anti- VHC+ avec un ARN viral C détectable, et par 2 pour la mortalité extrahépatique par comparaison à ceux sans ARN-VHC détectable ou aux patients n’ayant jamais rencontré le virus, anti-VHC-.
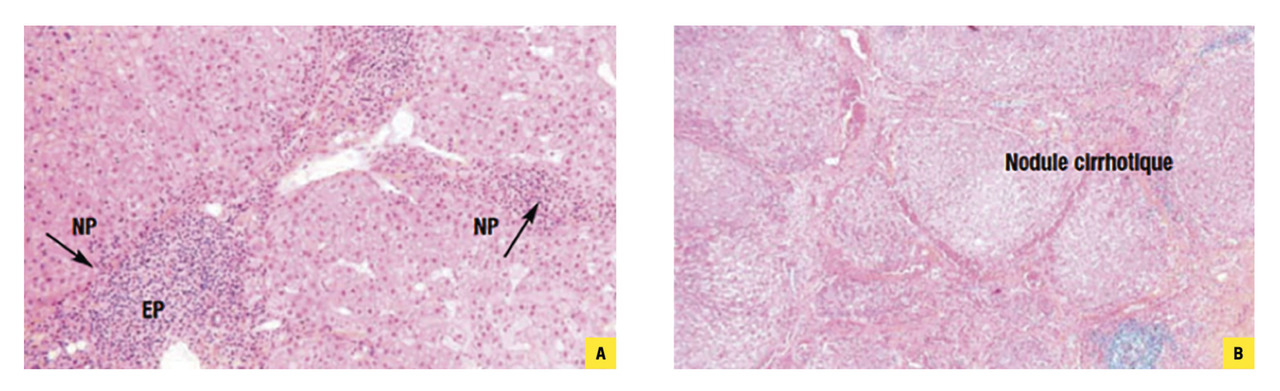
Ainsi, lorsque l’infection virale C est confirmée, il faut en évaluer les conséquences cliniques, hépatiques et extrahépatiques. Les lésions du foie, historiquement détectées par biopsie (
La fibrose (F) est évaluée sur une échelle classique de 0 à 4 (F0 et F1 : nulle ou minime ; F2 : moyenne ; F3 : extensive ; F4 : cirrhotique, ce stade avancé justifiant non seulement une prise en charge thérapeutique mais aussi un suivi semestriel en raison du risque de carcinome hépatocellulaire). Le risque de cirrhose est augmenté par les comorbidités.
Guérison : possible
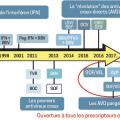
L’inhibition spécifique de ces protéines à partir de 2005 a permis un contrôle de la multiplication du VHC (
Ainsi, une réponse virologique prolongée (RVP) correspond à une vraie guérison : elle est définie par un ARN VHC indétectable 12 semaines après l’infection aiguë (guérison spontanée) ou 12 semaines après la fin du traitement. Le virus n’est pas retrouvé dans le sérum ni dans les cellules mononucléées du sang périphérique ni dans les hépatocytes. Il n’y a pas de rechute tardive même dans un contexte d’immunosuppression puissante, comme après transplantation (ce n’est pas le cas pour le VHB).
Bénéfices associés à la guérison
La baisse de la mortalité hépatique est en rapport avec la capacité de remodelage de la fibrose qui peut régresser à tous les stades de l’hépatopathie, même en cas de cirrhose.
Dans la cohorte prospective CIRVIR de l’Anrs- Inserm (1 350 cirrhoses compensées, histologiquement prouvées, liées à une infection par le VHC), l’incidence du carcinome hépatocellulaire est diminuée à 3 et 5 ans après guérison virologique (13,6 vs 1,9 et 21,8 vs 3,3 %) ; le CHC ne survient qu’en cas de syndrome métabolique ou de comorbidité hépatique (surpoids, diabète, suralcoolisation ;
On observe également une réduction significative du risque de décompensation cirrhotique, une baisse de la même amplitude des infections bactériennes (par rapport aux patients non guéris) et une diminution encore plus marquée des complications vasculaires (infarctus, AVC ou artériopathie oblitérante des membres inférieurs ; de 9,1 à 2,3 % à 3 ans et de 12,3 à 3,5 % à 5 ans). Si la fibrose extensive ou la cirrhose ont été associées à une augmentation du risque d’athéro- sclérose carotidienne, il est intéressant de noter que l’épaisseur intima-média carotidienne diminue après prise d’antiviraux oraux.
Des traitements efficaces
Sa pégylation a permis d’espacer les injections sous-cutanées (hebdomadaires plutôt que trihebdomadaires) et l’adjonction de ribavirine, un analogue nucléosidique, d’en augmenter significativement l’efficacité. Toutefois, la limite était une mauvaise tolérance clinique (syndrome pseudo-grippal, exacerbation des pathologies dysimmunitaires, troubles neurocognitifs aggravés par la ribavirine) et biologique (myélosuppression avec neutropénie et thrombopénie pour l’interféron, anémie hémolytique pour la ribavirine).
Le taux de guérison était au mieux de 50 % avec des traitements de 48 semaines pour les génotypes 1 et 4, les plus fréquents, et de 24 semaines pour les types 2 et 3. Un grand nombre de facteurs limitaient l’effi- cacité : fibrose extensive, surpoids, génotypes 1, co-infection VIH, insulinorésistance.
Les inhibiteurs spécifiques des protéines virales ou antiviraux directs (AVD) ont été une grande avancée thérapeutique. Les premiers inhibiteurs de protéase, télaprévir et bocéprévir, combinés à interféron pégylé + ribavirine, ont permis d’obtenir une guérison virologique chez environ trois quarts des patients, avec des durées de traitement réduites de moitié.
La vraie révolution a été le développement de stratégies thérapeutiques combinant des antiviraux directs, souvent coformulés en une seule gélule, s’affranchissant des produits injectables.
Aujourd’hui, grâce à l’association de 2 à 3 AVD, on obtient la guérison chez environ 98 % des patients en 8 à 12 semaines : glécaprévir/pibentrasvir (Maviret) pendant 8 semaines ou sofosbuvir/velpatasvir sans (Epclusa) ou avec voxilaprévir (Vosevi, souvent réservé aux échecs) durant 12 semaines (
Dans les essais contrôlés randomisés en double aveugle, la fréquence de ces effets secondaires n’était pas supérieure à celle sous placebo. Dans la cohorte HEPATHER, il n’y a pas de différence de prévalence des événements indésirables graves (cardiovasculaires, hypertension artérielle pumonaire, cancers, décès…) chez les patients traités par AVD par comparaison aux sujets non traités.
Depuis 2017, les recommandations préconisent de traiter tous les patients infectés par le VHC, en priorisant ceux ayant des maladies hépatiques (fibrose) ou extrahépatiques (vascularite) avancées, ou un risque de progression rapide de la fibrose (comorbidités hépatiques ou transplantation).
Le bénéfice est non seulement individuel mais aussi collectif, en diminuant les risques d’infection et de réinfection dans les communautés les plus touchées comme les HSH ou les usagers de drogues. Les seules limites (parfaitement gérables) sont l’observance thérapeutique, les rares effets secondaires et les interactions médicamenteuses. Celles-ci justifient un échange avec un pharmacien ou un pharmacologue, ou la consultation de sites internet (https://www.hep-druginteractions.org par exemple), de façon à vérifier la compatibilité des co-médications utilisées : principalement les antirétroviraux du VIH, certains anticoagulants ou anti-arythmiques, des statines, des bloqueurs des canaux calciques, des anticalcineurines, des contraceptifs oraux ou des antiépileptiques. L’adapation de l’un ou l’autre de ces traitements peut être nécessaire.
Élimination : un objectif réaliste ?
Pour l’instant, moins de 5 % de la population mondiale infectée a été traitée, en raison d’un dépistage insuffisant et d’un accès aux soins difficile pour une grande partie des patients mais aussi du prix élevé des médicaments (
En France, le rapport d’experts de 2015 suggérait de dépister tous les hommes de plus de 18 ans et toutes les femmes enceintes, négligeant l’important contingent de femmes septuagénaires majoritairement infectées lors des transfusions de la délivrance ou de chirurgies gynécologiques avant 1990 ; c’est pourquoi l’actualisation de 2016 proposait un dépistage universel.
Selon les sociétés savantes, tout Français sans facteur de risque viral devrait avoir une fois dans sa vie une sérologie VHC dans le cadre d’un bilan usuel.
La HAS a considéré que le dépistage universel n’était pas coût-efficace. Il est donc logique de réserver le dépistage ciblé aux patients à haut risque de contamination (usagers de drogues intraveineuses ou intranasales, prisonniers, migrants, HSH notamment infectés par le VIH) chez lesquels infections et réinfections sont possibles et justifient des dépistages réguliers, en cas de prise de risque, pour un traitement de l’hépatite aiguë dans une perspective communautaire.
Tous les sujets exposés à une prise en charge médico- chirurgicale avant 1990 (mise à disposition des tests sérologiques de dépistage de l’infection virale) relèvent d’un dépistage ciblé sachant que 20 % des sujets infectés n’ont pas de facteur de risque identifié expliquant que le dépistage ciblé ne puisse être totalement efficace. Dépister le VHC chez les femmes enceintes est recommandé, comme pour le VHB.
La politique d’élimination du VHC défendue par l’OMS justifie une délocalisation du dépistage et du traitement. Ces derniers étaient jusqu’à présent hospitalocentrés : dans les structures hospitalières en charge des patients « faciles à dépister », incluant les maternités, un test sérologique classique est réalisé et, en cas de positivité, un test virologique par RT-PCR identifie des infections actives (ARN-VHC positif) qui seront traitées.
La délocalisation de la cascade de soins suppose que certaines structures autres qu’hospitalières (Centre de soins, d’accompagnement et de prévention en addictologie [CSAPA] ; centre d’accueil et d’accompagnement à la réduction des risques pour usagers de drogues [CARRUD], prisons, centres de santé pour les migrants, centres de santé sexuelles…) réalisent des tests rapides d’orientation diagnostique (TROD OraQuick HCV et TOYO VHC). Un TROD sérologique positif conduit à un test «Point of Care» virologique (type GeneXpert de Cepheid ou Drivegene d’Epistem, capables de détecter et quantifier l’ARN viral) permettant ainsi une politique de Test and Treat dans les populations les plus difficiles à diagnostiquer et à traiter qui sont aussi les plus transmettrices.
Baisser le coût des traitements est un autre défi crucial (environ 28 500 € en France pour la guérison). Comme pour le VIH, la mise à disposition de génériques, avec ou sans brevet partagé avec les compagnies pharmaceutiques, permet d’espérer aujourd’hui des prix entre 125 dollars américains (USD) [générique de sofosbuvir et daclatasvir au Cambodge], 295 USD (générique de sofosbuvir et ravidasvir en Égypte) ou 500 USD (sofosbuvir/lédipasvir distribué en Inde par Mylan mais qui peut être commandé à l’échelle individuelle en France).
Notons que parmi les 5 millions de sujets traités dans le monde, environ – probablement – 3 millions l’ont été avec des médicaments génériques à bas prix.
1. Prévalence de l’hépatite C : de grandes disparités géographiques
Les zones les plus exposées sont l’égypte (15 % de la population historiquement infectée) et la Mongolie. Dans ces pays, la contamination est principalement nosocomiale, due à l’absence d’hémovigilance en Mongolie ou aux traitements systématiques de la bilharziose sans matériel à usage unique en égypte. D’autres régions comme l’Afrique de l’Ouest ou centrale sont massivement touchées, avec environ 5 à 8 % des individus contaminés ; en cause : les transmissions nosocomiales mais aussi certaines pratiques rituelles comme les scarifications.
On a observé une baisse constante ces 20 dernières années : par exemple, en France, elle est passée de 1,2 % en 1996 à 0,8 % en 2011 chez les assurés sociaux (d’après Santé publique France) ; elle serait actuellement de moins de 0,40 % selon les estimations les plus récentes par modélisation (40 % des patients n’auraient pas été diagnostiqués, soit 70 000 personnes).
2. VHC : quelle surveillance après guérison ?
En cas d’hépatopathie modérée sans comorbidités hépatiques : suspension du suivi envisageable 2 ans après la guérison (recommandations internationales).
Si fibrose extensive ou cirrhose initiales : échographie semestrielle, bilan biologique annuel : dépister le carcinome hépatocellulaire.
En cas de comorbidité hépatique (syndrome métabolique dont diabète, obésité ou alcoolisme) : suivi biologique et échographique annuel car risque d’aggravation d’une maladie hépatique non plus viro-induite mais toxique (40 % des sujets guéris prennent du poids).
Si facteurs de risque d’exposition (usagers de drogues actifs, HSH, migrants recevant des soins médico-chirurgicaux dans leur pays d’origine...) : rechercher une réinfection potentielle par PCR.
– négative à 2 ans (chez environ la moitié des patients) : le suivi peut être suspendu ;
– encore détectable : surveillance biologique discutée.
3. élimination du VHC : quels moyens ?
Améliorer les politiques de dépistage par des tests rapides d’orientation diagnostique (TROD) voire des tests Point of Care (POC).
élargir la prescription à tous les médecins, au-delà des structures hospitalières et spécialisées en hépato-gastroentérologie, infectiologie ou médecine interne (ce qui a été fait en France en mai 2019).
Favoriser le diagnostic (identification des sujets avec infection virale C active ; ARN VHC+), et l’initiation du traitement précoce (test and treat) dans les différentes structures soignant des populations à risque : prisons, centres d’addictologie, services de psychiatrie, maternités, centres de soins aux migrants.
2. AASLD-IDSA. Recommendations for testing, managing, and treating hepatitis C, 2017. http://www.hcvguidelines.org
3. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol 2011; 55:245-64.
4. Buhler S, Bartenschlager R. New targets for antiviral therapy of chronic hepatitis C. Liver Int 2012;32(suppl 1):9-16.
• POL S. L’hépatite C face au défi de la guérison. Rev Prat 2018;68:269-75. https://bit.ly/2R8Djvq
• Pol S. éradiquer l’hépatite C. Rev Prat Med Gen 2018;32:721-2. https://bit.ly/2sKcuEs
• Pol S (sous la dir.). Dossier Hépatites virales. Rev Prat 2018;68:267-93. https://bit.ly/38m6jW5
• Pariente A. Cirrhoses et complications. Rev Prat 2018;68: e135-e147. https://bit.ly/2R7ThpB

 Encadrés
Encadrés