Environ 3,5 % de la population mondiale est infectée par le VHB et, si la vaccination a induit une réduction de la prévalence chez les enfants de moins de 5 ans, de 4,7 à 1,3 % entre 2000 et 2015, on compte toujours 257 millions de sujets chroniquement infectés, particulièrement en Afrique subsaharienne et en Asie, où la prise en charge n’est pas encore optimale.
Parmi eux, près d’un million meurent chaque année, moins d’hépatite fulminante que de cirrhose ou de carcinome hépatocellulaire (CHC), alors que la vaccination est disponible depuis le début des années 80.
En France, la prévalence du portage de l’antigène de surface (Ag HBs) est estimée à 0,65 % dans la population générale et jusqu’à 5,25 % chez les individus nés en Afrique subsaharienne.
Le plan de l’OMS prévoyait une réduction de 30 % des nouvelles infections en 2020 et de 90 % en 2030, avec une baisse de la mortalité de 10 % et 65 % à ces 2 échéances. Il repose sur 3 interventions principales : diffusion de la vaccination antivirale B, prévention de la transmission materno-infantile, et amélioration du diagnostic et de l’accès aux traitements.
Le risque de progression de la maladie de la fibrose vers la cirrhose, de décompensation de cirrhose ou de cancer du foie, à l’origine du décès, est moindre si l’ADN du VHB est réduit à des taux indétectables, grâce aux antiviraux.
Cette virosuppression, recommandée en cas d’hépatite chronique antigène HBe positif ou négatif, augmente également le taux de perte (séroconversion) de l’Ag HBe et de l’Ag HBs. Après l’interféron (IFN), les analogues nucléosidiques ou nucléotidiques (NUC : inhibiteurs oraux de l’activité transcriptase inverse de la polymérase du VHB) au long cours ont transformé la prise en charge. Ils ne permettent que rarement d’obtenir une « guérison fonctionnelle » (définie par un ADN du VHB indétectable et une perte de l’Ag HBs avec apparition des anticorps anti-HBs hors traitement) en raison de la biologie du VHB (persistance sous forme d’ADN superenroulé, capacité d’intégration dans le génome de l’hôte ; cf. infra).
La récente initiative « HBV cure », dont l’objectif est cette guérison fonctionnelle, est portée par le développement de nouvelles stratégies médicamenteuses combinant inhibiteurs d’entrée, modulateurs de la capside, inhibiteurs de la polymérase, interférence ARN et immunomodulateurs.
Qui et comment dépister ?
On préconise plus généralement un dépistage de tous les individus de 18 à 60 ans et des femmes enceintes dès la première consultation prénatale.
Par ailleurs, la recherche d’une infection par le VHB ou d’une hépatite B doit être réalisée devant toute élévation des transaminases : recherche de l’antigène HBs, de l’anticorps anti-HBc – qui témoigne d’un contact avec le VHB – et des anticorps anti-HBs neutralisants qui sont le témoin soit d’une guérison, soit d’une vaccination antérieure (
La détection de l’antigène et des anticorps anti-HBe et le dosage de l’ADN du VHB ne sont effectués que dans un second temps chez les patients ayant un antigène HBs ou un anticorps anti-HBc isolé pour éliminer une infection occulte (cf. page455).
Limites à la guérison virologique
Une fois entré dans le noyau, l’ADN viral devient superenroulé (ou ADNccc), puis est emballé par des histones formant un minichromosome qui sert de modèle transcriptionnel pour la synthèse de toutes les protéines virales, responsable de la persistance de l’infection. Sous cette forme, le virus est peu sensible à l’action des antiviraux, ce qui explique les risques de réactivation du VHB chez tout porteur chronique.
Les mécanismes de l’hépatocarcinogenèse virale B,complexes, sont liés à l’intégration du génome viral (tout ou en partie) dans celui de l’hôte. Ils associent réarrangements chromosomiques, mécanismes de cis- et de trans-activation. Une mutagenèse insertionnelle (cis-activation) est décrite au niveau des gènes de la cycline A, du récepteur β de l’acide rétinoïque et de celui codant pour la mévalonate kinase humaine. Des phénomènes de trans-activation sont probables (par la protéine X du VHB, qui peut agir sur de nombreux promoteurs hétérologues ou homologues).
Ils interagissent avec d’autres cofacteurs : alcool, carcinogènes chimiques, hormones notamment sexuelles (le CHC est plus fréquent chez l’homme que chez la femme), virus de l’hépatite delta et C, cirrhose.
Histoire naturelle de la maladie
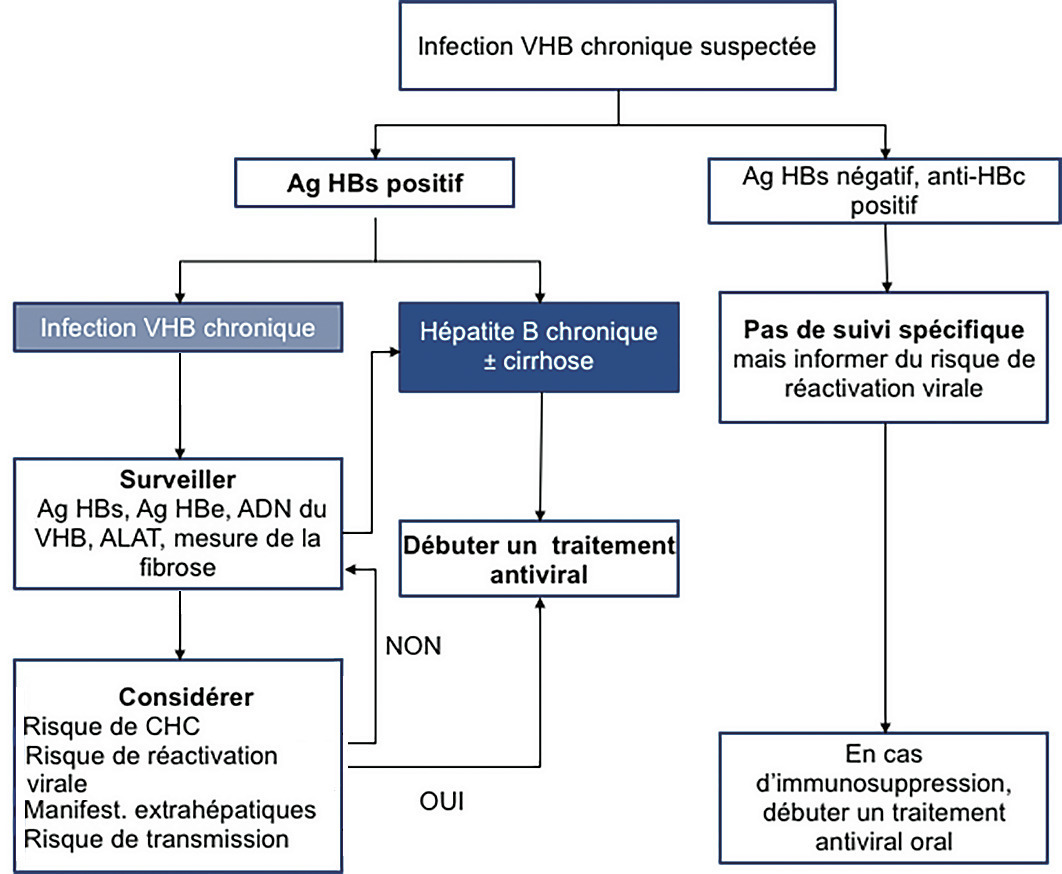
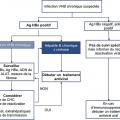
D’après les nouvelles recommandations européennes, on peut distinguer 5 phases selon la présence ou non d’une infection ou d’une hépatite et de l’antigène HBe (
Dans ce groupe, on isole l’infection B occulte qui concerne peu de patients et se caractérise par un anticorps anti-HBc isolé et un ADN du VHB très faiblement positif (très inférieur à 2 000 UI/mL).
Qui traiter ?
Doivent être traités les patients :
- ayant une hépatite B chronique (Ag HBs+) avec ou sans Ag HBe (ADN VHB > 2000 UI/mL, ALAT > N et/ou au moins une activité nécrotico- inflammatoire ou une fibrose modérées à la PBH ou aux tests non invasifs) ;
– avec cirrhose et ADN du VHB détectable quelles que soient les transaminases ; en cas de cirrhose décompensée, le traitement par analogues est urgent ;
– avec un taux d’ADN du VHB > 20 000 UI/mL et des ALAT > 2N, quelle que soit la sévérité des lésions histologiques.
Pourraient être traités ceux avec infection VHB :
– HBe positifs, de plus de 30 ans, quelle que soit la sévérité des lésions histologiques ;
– HBe positifs ou négatifs, ayant une histoire familiale de CHC ou de cirrhose ou des manifestations extrahépatiques du VHB (glomérulonéphrite extramembraneuse, périarthrite noueuse, vascularite, purpura, arthralgies, neuropathie periphérique...).
Le traitement préemptif par analogues nucléos(t)- idiques en cas d’immunosuppression est justifié :
– chez tout patient ayant un Ag HBs positif ;
– en cas d’anti-HBc positif isolé si haut risque de réactivation.
La prescription de ténofovir (entécavir contre-indiqué) des femmes enceinte au 3e trimestre de grossesse en cas d’ADN du VHB > 200 000 UI/mL vise à éviter la contamination materno-foetale qui peut survenir dans cette situation malgré la sérovaccination (contamination in utero). Le traitement sera poursuivi 12 semaines après l’accouchement puis stoppé sous surveillance biologique rapprochée.
La transplantation hépatique est la dernière option envisageable chez les patients ayant une cirrhose virale B décompensée ou un CHC. Ils reçoivent ou poursuivent un traitement virosuppresseur (analogues nucléos(t)idiques) de même qu’une prophylaxie passive par immunoglobulines spécifiques anti-HBs (HBIG) en prévention de la récidive virale sur le greffon, d’autant plus fréquente que la charge virale à la greffe est élevée.
Antiviraux : quelle efficacité ?
Le traitement doit être le plus précoce possible pour éviter la cascade hépatite chronique/cirrhose/CHC. L’arrêt de la multiplication virale au stade d’hépatite chronique évite l’évolution vers la cirrhose. Diminuer l’activité de l’hépatopathie abaisse le risque de carcinome hépatocellulaire, même si l’intégration génomique est toujours possible. L’éradication complète du virus n’est que très tardive et exceptionnelle.
Bien que l’interféron alpha (injections sous-cutanées hebdomadaires) soit efficace par son action antivirale et immunostimulatrice, il a un intérêt limité. Il peut toutefois être utilisé si on décide d’un traitement à durée définie (48 semaines). Ses avantages théoriques (pégylé ou non) sont l’absence de résistance, l’opportunité d’obtenir une réponse virologique soutenue après l’arrêt du traitement et une chance (10 % environ) de perdre l’Ag HBs pour ceux qui ont un taux d’ADN indétectable.
Les NUC sont les molécules de choix : ténofovir disoproxil fumarate (TDF, Viread) et entécavir (ETV, Baraclude). La posologie est de 1 comprimé par jour dosé à 245 mg et 0,5 mg respectivement, à adapter à la clairance de la créatinine chez l’insuffisant rénal. Le bilan préthérapeutique comporte la créatininémie, complété sous TDF par phosphorémie, protéinurie et glycosurie. Ces dosages sont répétés tous les 3 mois la première année, puis tous les 6 mois. L’absence de réponse virologique complète (charge virale détectable après 48 semaines de traitement) doit faire suspecter une mauvaise observance.
Leurs avantages sont nombreux :effet antiviral puissant, bonne tolérance, administration orale. Au prix de quelques inconvénients : durée indéfinie de traitement dans la majorité des cas, risque de résistance. Si les risques rénaux (tubulopathie) et osseux (ostéoporose) sont décrits sous ténofovir, la toxicité potentielle à long terme des analogues n’est pas connue. Sous entécavir ou ténofovir, chez les patients Ag HBe positifs, les taux de rémission virologique (ADN du VHB indétectable par PCR) sont supérieurs à 90 % après 3-5 ans de traitement ; la séroconversion HBe est de l’ordre de 20 % la première année et augmente avec le temps sauf en cas de résistance ; les taux de perte de l’Ag HBs sont de 2 à 3 % la première année et croissent par la suite (environ 9 % à 5 ans avec le ténofovir).
Chez les patients Ag HBe négatifs, les taux de rémission virologique sont supérieurs à 95 % après plus de 5 ans mais la perte de l’Ag HBs est moindre < 1 %.
Selon les recommandations, tout patient ayant une infection virale B devant être traitée doit recevoir un antiviral au long cours (éventuellement à vie) efficace et à barrière génétique élevée (faible taux de résistance), c’est-à-dire (depuis 2015, et selon la disponibilité des médicaments dans les pays) principalement l’entécavir ou le ténofovir.
Le choix du traitement de première ligne (interféron pégylé ou analogues) est fonction d’un certain nombre de critères liés à l’hôte (âge, comorbidité) ou au virus (génotype viral, virémie quantitative…) mais les NUC restent les principaux antiviraux. L’interféron est prescrit chez moins de 5 % des patients à l’heure actuelle.
À long terme, interféron-α pégylé et NUC ont montré un bénéfice clinique chez les patients avec ou sans cirrhose (lié à la virosuppression), qui est d’autant plus vrai que l’hépatopathie est sévère :
– chez les cirrhotiques graves : réduction du taux de mortalité, de transplantation hépatique ou de récidive virale sur le greffon ;
– en cas de fibrose significative (fibrose extensive ou cirrhose) : diminution de la progression de l’hépatopathie et du carcinome hépatocellulaire à 5 ans.
La virosuppression induit une amélioration histologique significative, se prolongeant dans le temps avec réduction de la fibrose, voire réversion de la cirrhose.
Si le traitement antiviral de l’hépatite chronique B s’est simplifié, certains défis persistent : la tolérance au long cours des NUC, la place des combinaisons thérapeutiques associant interféron et NUC ou NUC nucléosidique et nucléotidique, l’arrêt des NUC. Ce dernier ne peut s’envisager qu’en l’absence de fibrose extensive (F3) ou de cirrhose. Il est possible de le proposer aux patients Ag HBe positifs, 6 à 12 mois après la séroconversion dans le système HBe. Des essais sont en cours chez les patients Ag HBe négatifs après au moins 3 ans de traitement.
Prévention
Hautement immunogène, son innocuité semble totale même si de rares complications ont été rapportées (polyradiculonévrite, myélite transverse ou sclérose en plaques) pour lesquelles la responsabilité du vaccin n’est pas prouvée.
Idéalement, elle devrait être universelle, particulièrement dans les zones d’endémie du VHB et dans les populations à risque où sa pénétration est paradoxalement faible.
Pour des raisons principalement financières, une telle stratégie est encore illusoire. Rappelons qu’en France, elle fait partie des vaccinations obligatoires des nourrissons depuis le 1er janvier 2018.
D’après des simulations mathématiques, confirmées par les données de vraie vie, une prophylaxie proposée aux nouveau-nés, aux adolescents avant l’apparition de comportements à risque et aux sujets à risque réduit de 50 % en 10 ans l’incidence des infections par le VHB et diminue la fréquence du carcinome hépatocellulaire.
La sérovaccination néonatale la plus précoce possible en salle d’accouchement annule les risques de transmission materno-infantile, justifiant le dépistage obligatoire de toutes les femmes enceintes au deuxième trimestre depuis 1991.
Enfin, l’immunoprophylaxie passive (immunoglobulines anti HBs) réduit les risques de transmission nosocomiale dans les centres de dialyse par exemple, et les risques de récidive d’infection du greffon chez les patients transplantés pour une infection virale B.
Le schéma vaccinal standard comporte 1 injection intramusculaire à M0 et M1 et un rappel entre 6 et 12 mois plus tard. Un titre d’anticorps anti-HBs > 10 UI/L (considéré comme protecteur), mesuré 4 à 8 semaines après la dernière injection, est obtenu dans plus de 90 % des cas. Certains facteurs acquis ou génétiques participent à la réponse vaccinale : cette dernière est meilleure chez la femme et avant 50 ans. En revanche, l’immunosuppression diminue sa qualité en termes de titres d’anticorps et de pourcentage de réponses effectives. Chez les hémodialysés, les transplantés rénaux, les sujets ayant une dépendance à l’alcool ou traités par immunosuppresseurs, les patients infectés par le VIH, en cas d’échec d’une première vaccination, des schémas renforcés (double dose ou injection intradermique) doivent être proposés.
« HBV cure » : vers la guérison ?
Cette guérison n’est envisageable qu’en combinant différentes stratégies ciblant les diverses étapes du cycle viral, de l’endocytose à la réplication (
Les inhibiteurs d’entrée, comme le bulévirtide, Myrcludex (disponible en ATU pour le VHD uniquement pour l’instant) bloquent le récepteur NTCP et donc réduisent la diffusion de l’infection aux hépatocytes. Les inhibiteurs de la polymérase, c’est-à-dire de la réplication virale, et donc les traitements usuels, interféron et analogues nucléos(t)idiques, doivent leur être associés.
Le contrôle de l’ADN superenroulé (silencing and eradicating) est un objectif crucial : on pourrait obtenir sa dégradation grâce à des méthodologies CRISPR/Cas9 ou la suppression de sa transcription.
Le développement de médicaments ciblant chacune des protéines virales est en cours : modulateurs de la capside, de la protéine HBx… D’autres pistes concernent l’inhibition des ARN spécifiques du VHB (interférence ARN) et le développement des oligo- nucléotides anti-sens ciblant les transcrits viraux et les inhibiteurs de la nucléocapside.
Enfin, l’amélioration de la réponse immunitaire spécifiquede l’hôte est essentielle. L’immunothérapie pourrait contribuer à éliminer les cellules infectées, prévenir la diffusion du virus depuis les hépatocytes infectés vers les cellules non infectées et bloquer les mécanismes utilisés par le virus pour échapper à la réponse immune de l’hôte. Des modulateurs de l’immunité adaptative comme les inhibiteurs de check point (anticorps anti-PD1/PDL-1) – dont l’efficacité antivirale reste modeste – et des agents impliqués dans l’immunité innée comme des cellules T spécifiques transformées (Chimeric Antigen Receptor, CAR-T cells), déjà utilisées dans certains cancers, sont intéressants. L’immunostimulation, spécifique ou non, comprend l’induction de cytokines antivirales, l’inhibition de celles immunosuppressives, les agonistes des Toll-like récepteurs 7 (TLR7) et la vaccinothérapie.
L’espoir de la guérison est grand mais le développement de chaque molécule, testée plutôt en monothérapie, en retarde la concrétisation.
L’objectif principal de cette approche est de pouvoir arrêter les traitements par NUC sans risque de rechute, de progression de la maladie hépatique et de carcinome hépatocellulaire.
1. Marqueurs sériques et interprétation
Ag HBs +
Hépatite B aiguë ou chronique
Ag HBe +
Infection en cours : multiplication virale importante Son absence n’élimine pas une infection virale chronique
Anticorps anti-HBs +
Guérison-protection (spontanée ou vaccination), titre > 10 mUI/mL
Anticorps anti-HBc (IgG +)
IgM + : hépatite B aiguë (ou réactivation)
IgM – et Ag HBs – : hépatite B guérie
IgM – et AgHBs + : hépatite B chronique
Dosage de l’ADN viral sérique
Il permet de quantifier la réplication virale
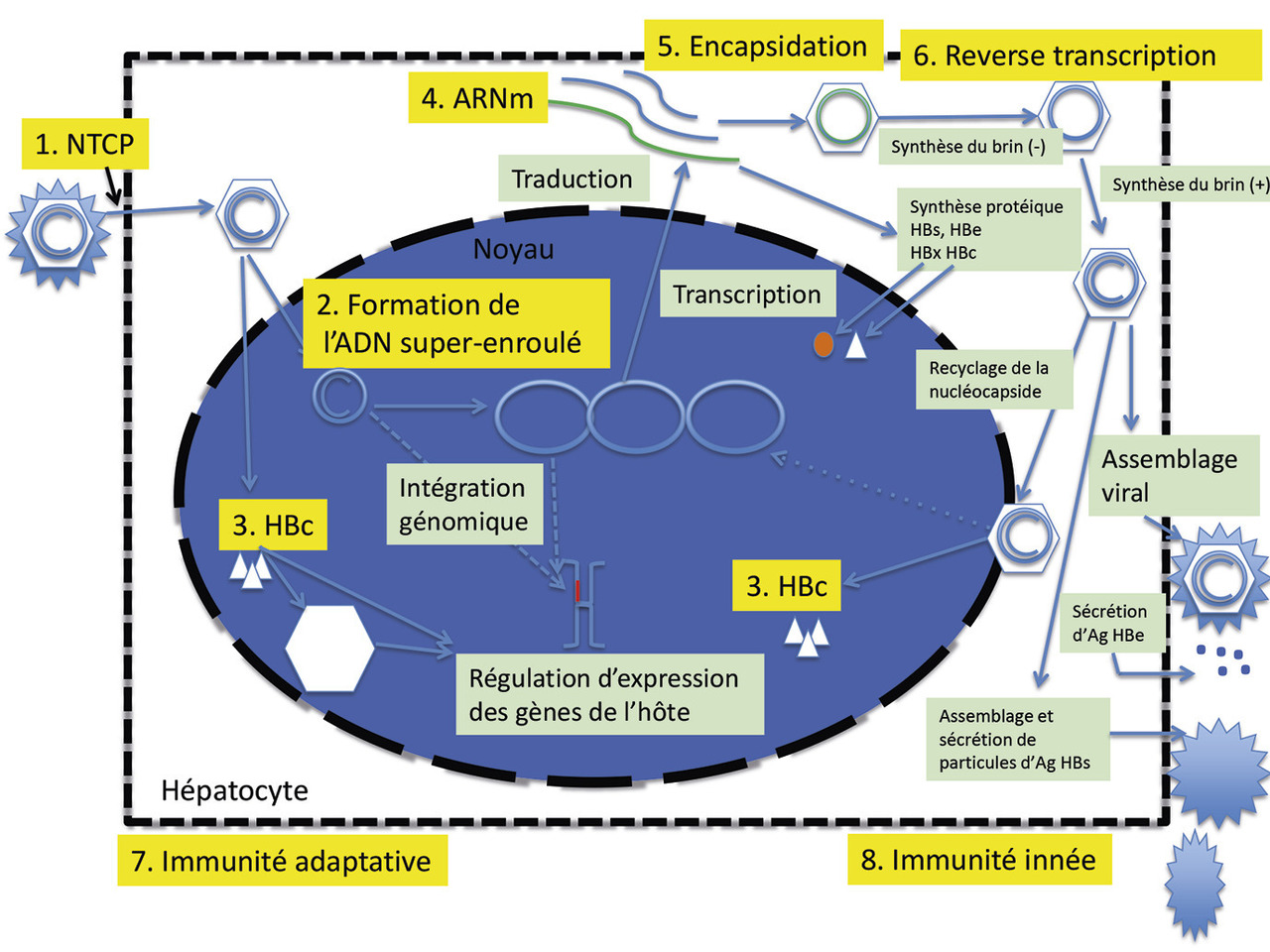
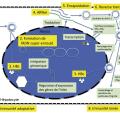
2. Cycle viral de l’agent de l’hépatite B : complexe !
Le VHB s’attache à la membrane des hépatocytes via les protéoglycanes à sulfate d’héparane, et notamment le glypican 5. Le domaine pré-S1 des larges protéines d’enveloppe interagit ensuite directement avec un récepteur, le sodium taurocholate cotransporting polypeptide (NTCP, transporteur des acides biliaires, spécifique du foie), au niveau du pôle baso-latéral des hépatocytes, ce qui se traduit par une inhibition de l’import des acides biliaires et par une altération du métabolisme du cholestérol. Cette interaction induit l’internalisation de la particule virale par endocytose, entraînant la libération de la nucléocapside dans le cytoplasme.
Cette dernière migre vers le noyau et l’ADN du VHB y pénètre. Par un mécanisme encore mal connu, l’ADN asymétrique ouvert (le brin court du génome viral), présent dans la particule, devient double brin circulaire fermé dans le noyau. Cet ADNccc (covalently closed circular DNA), ou ADN superenroulé, s’associe à des histones cellulaires pour former un minichromosome : c’est la forme de persistance du VHB dans les hépatocytes.
À partir de son brin L–, l’ARN prégénomique (ARN pg) est transcrit par une ARN polymérase II cellulaire et migre dans le cytoplasme où il sert de matrice pour la synthèse de l’antigène HBc et de la polymérase d’une part, et où il est encapsidé avec la polymérase virale d’autre part, servant de matrice à la rétro-transcription. Après synthèse des brins de polarité négative et positive, la nucléocapside contient un ADN circulaire relâché partiellement double brin qui peut, soit acquérir une enveloppe via le réticulum endoplasmique et/ou le compartiment intermédiaire pour être ensuite secrété à l’extérieur des hépatocytes, soit retourner vers le noyau pour augmenter le pool d’ADN superenroulé et être intégré au génome de l’hôte (fig. 1).
– EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol 2017;67:370-98.
– Terrault NA, Lok ASF, McMahon BJ, et al. Update on Prevention, Diagnosis, and Treatment of Chronic Hepatitis B: AASLD 2018 Hepatitis B Guidance. Clin Liver Dis(Hoboken) 2018;12:33-4.
– Sarin SK, Kumar M, Lau GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update. Hepatol Int 2016;10:1-98.
– Testoni B, Levrero M, Zoulim F. Challenges to a Cure for HBV Infection. Semin Liver Dis 2017;37:231-42.
– Bourlière M, Oules V, Adhoute X. Hépatite B : contrôler ou guérir ? S’assurer de la guérison fonctionnelle par un traitement prolongé. Rev Prat 2018;68:276-82.

 Encadrés
Encadrés