Hépatite C (VHC)
Aujourd’hui, le diagnostic d’une hépatite C se pose sur la présence d’anticorps anti-VHC dans le sérum ou le plasma, détectés par des tests immunologiques de 3e ou 4e génération, associée, en cas de positivité, à la mise en évidence de l’ARN du VHC. Mais attention : la séroconversion a lieu quelques semaines après la contamination, alors que la virémie est détectable (par RT-PCR) dans les 4 jours suivant l’exposition au virus ; ainsi, un patient ayant des anticorps anti-VHC et un ARN viral C indétectable est guéri de son infection.
La prise en charge de cette hépatite a beaucoup progressé ces dernières années grâce à la mise à disposition depuis 2017 en France, pour tous les patients infectés, de traitements antiviraux à action directe (AAD) très efficaces et bien tolérés. Selon la HAS, le traitement de référence est l’association Epclusa-Maviret (pangénotypique), qui permet une guérison virologique chez 98 % des patients. La guérison permet quant à elle de prévenir, réduire ou annuler les complications hépatiques, les manifestations extrahépatiques et les décès liés au VHC. Le suivi dépend de l’atteinte hépatique (encadré 1).
En France, grâce aux efforts faits ces dernières années, on peut espérer répondre à l’objectif de l’OMS : éliminer l’hépatite C d’ici 2025. Cependant, selon le Pr Stanislas Pol, pour l’atteindre il faudrait améliorer le dépistage dans certaines populations précaires ou « oubliées »…
Pour plus d’information :
- Pol S. Hépatite C. Rev Prat Med Gen 2020 ;34(1034) ;59 - 64.
- HAS. Recommandations de prise en charge des personnes infectées par le virus de l’hépatite C. 21 septembre 2023.
Hépatite B (VHB)
Malgré l’existence d’un vaccin efficace, l’infection chronique par le VHB reste un problème de santé publique majeur, touchant 316 millions de personnes dans le monde et responsable d’une morbi-mortalité importante par son risque d’évolution vers la cirrhose et le carcinome hépatocellulaire (CHC).
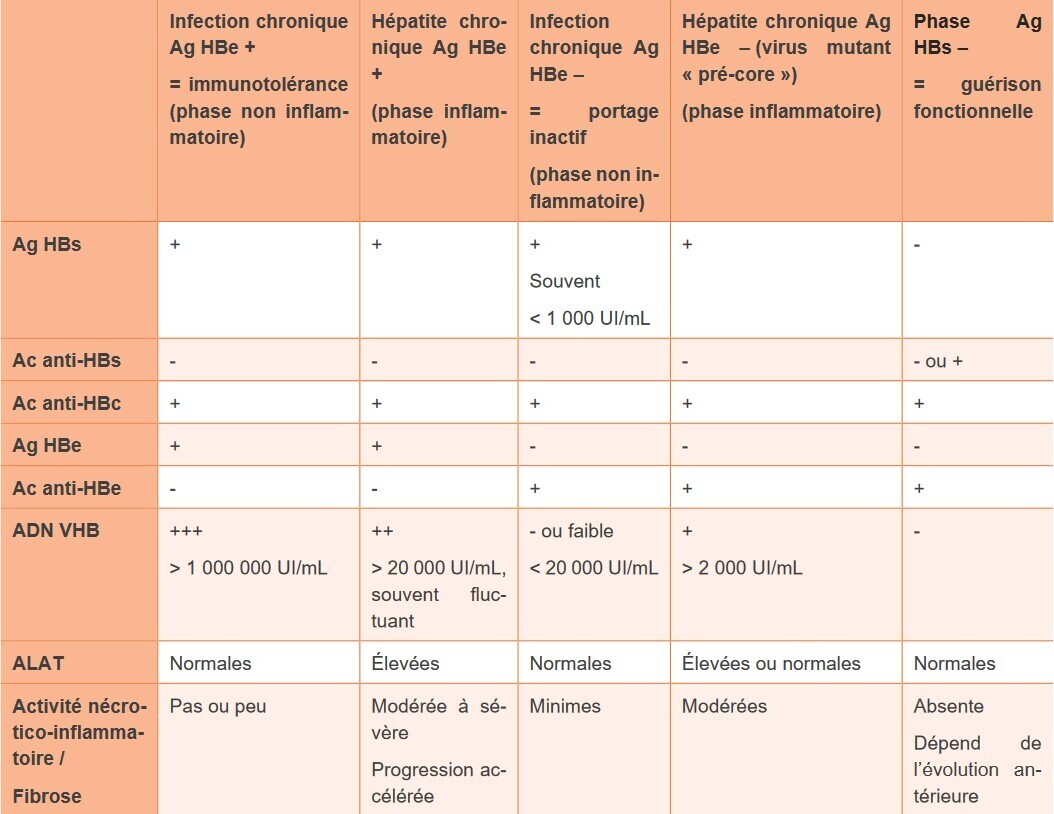
Après une hépatite aiguë, le plus souvent résolutive, l’infection à VHB est définie comme chronique lorsque l’AgHBs persiste au-delà de 6 mois. Le portage chronique du VHB comporte 5 phases non obligatoirement consécutives, définies par la présence ou non d’AgHBe, le taux des ALAT, de l’ADN du VHB, l’activité nécrotico-inflammatoire et le niveau de fibrose hépatique (tableau). Les sujets AgHBe négatifs (anticorps anti-HBe positifs) représentent le plus grand nombre des patients infectés par le VHB dans le monde. Au sein de ce groupe, la distinction entre les infections (ex-portages inactifs du VHB) et les hépatites est parfois difficile. Chez les sujets AgHBe positifs (anticorps anti-HBe négatifs), on différencie les infections (ex-immunotolérance) des hépatites. L’infection B résolutive est caractérisée par l’absence d’antigène HBs, des anticorps anti-HBc avec ou sans anti-HBs, des transaminases normales, une charge virale indétectable ; l’ADN du VHB persiste sous sa forme superenroulée dans le foie. Dans ce groupe, on isole l’infection B occulte qui concerne peu de patients et se caractérise par un anticorps anti-HBc isolé et un ADN du VHB très faiblement positif (très inférieur à 2 000 UI/mL).
L’indication thérapeutique dépend de la phase de l’infection.
Qui traiter ?
En pratique, l’introduction d’un traitement antiviral est recommandée en cas de cirrhose (compensée ou décompensée) avec ADN VHB détectable. En cas de cirrhose décompensée, il est recommandé d’adresser le patient à un centre de transplantation hépatique, en parallèle de l’instauration d’un traitement antiviral.
En cas de cirrhose avec ADN VHB indétectable et sans co-infection, le traitement antiviral n’est pas indiqué, sous réserve de la possibilité de suivi.
Le traitement antiviral doit être considéré de façon systématique en cas d’antécédent familial de cirrhose ou de CHC.
Pour réduire le risque de transmission mère-enfant, il est recommandé de proposer un traitement par TDF au 3e trimestre de la grossesse, jusqu’à 12 semaines après l’accouchement aux femmes enceintes avec forte charge virale (ADN VHB ≥ 200 000 UI), sans indication préalable de traitement.
Les traitements actuels, indiqués dans l’encadré 2, ne permettent pas une véritable guérison virologique. L’objectif du traitement est l’obtention d’une virosuppression stable sur le long terme authentifiée par un ADN VHB quantitatif indétectable (ADN VHB < 10 - 15 UI/mL).
Quels messages importants
- Rechercher systématiquement une hépatite D devant un Ag HBs positif (cf. ci-dessous) car le VHD est responsable d’une évolution péjorative de la maladie hépatique avec accélération de la fibrose, de la cirrhose et du CHC. En cas de négativité, dépister annuellement chez les personnes exposées au risque d’infection delta (ex. : voyages réguliers en zone d’endémie, usagers de drogues, populations à risque sexuel…).
- Dépister l’entourage des patients porteurs chroniques du VHB (partenaires sexuels, personnes partageant le foyer, enfants) et leur proposer la vaccination si leur sérologie est négative.
- Avant l’introduction d’un traitement immunosuppresseur ou d’une immunothérapie, il est nécessaire de dépister le VHB ; vacciner en cas de sérologie négative ; discuter une surveillance rapprochée ou un traitement en fonction du profil des marqueurs du VHB.
Hépatite D (VHD)
L’infection par le virus de l’hépatite delta (VHD) ne s’observe que chez les patients infectés par le VHB (il s’agit d’un virus satellite du VHB). Elle doit impérativement être dépistée devant tout AgHBs positif afin de diminuer les complications sévères telles que cirrhose, décompensation hépatique et CHC.
Le dépistage repose sur la recherche dans le sérum des anticorps anti-VHD par des techniques de type ELISA commerciales et automatisées ; en cas de positivité : rechercher une réplication virale active par RT-PCR quantitative.
Les indications de traitement sont un ARN VHD positif, associé à une activité et/ou une fibrose significative (METAVIR ≥ A2 et/ou ≥ F2).
La prise en charge repose classiquement sur l’IFN-PEG (Pegasys 180 µg/semaine en sous-cutané), mais seule la moitié des patients est éligible, et la réponse virologique soutenue après un traitement d’au moins 1 an ne dépasse pas 30 %. Récemment, un nouveau traitement, le bulévirtide (BLV, Hepcludex 2 mg/j en sous-cutané), a reçu une AMM, mais son efficacité au long terme reste mal connue. D’après la HAS, la stratégie thérapeutique actuellement recommandée – malgré l’absence de données suffisantes – est l’association IFN-PEG/BLV pendant au moins 48 mois.
Pour plus d’information : HAS. Recommandations de prise en charge des personnes infectées chroniquement par le virus de l’hépatite B +/- de l’hépatite delta. 21 septembre 2023.
1. VHC : quelle surveillance après guérison ?
En cas d’hépatopathie modérée sans comorbidités hépatiques : suspension du suivi envisageable 2 ans après la guérison (recommandations internationales).
Si fibrose extensive ou cirrhose initiales : échographie semestrielle, bilan biologique annuel : dépister le carcinome hépatocellulaire.
En cas de comorbidité hépatique (syndrome métabolique dont diabète, obésité ou alcoolisme) : suivi biologique et échographique annuel car risque d’aggravation d’une maladie hépatique non plus viro-induite mais toxique (40 % des sujets guéris prennent du poids).
Si facteurs de risque d’exposition (usagers de drogues actifs, HSH, migrants recevant des soins médico-chirurgicaux dans leur pays d’origine...) : rechercher une réinfection potentielle par PCR :
- négative à 2 ans (chez environ la moitié des patients) : le suivi peut être suspendu ;
- encore détectable : surveillance biologique discutée.
Source : Pol S. Hépatite C. Rev Prat Med Gen 2020 ;34(1034) ;59 - 64.
2. Traitement de l’infection chronique par le VHB
1. Molécules :
- analogues nucléos(t)idiques à forte barrière de résistance : entécavir (ETV) et ténofovir disoproxil fumarate (TDF), en prise quotidienne par voie orale ;
- interféron pégylé α (IFN-PEG) : traitement sous-cutané à durée limitée, mais indications très limitées, nombreux effets secondaires ; très peu utilisé.
2. Règles d’arrêt : le traitement par analogues nucléos(t)idiques doit être poursuivi jusqu’à perte de l’AgHBs ; un arrêt avant perte de l’AgHBs comporte le risque de réactivation.
3. Suivi sous traitement : un suivi rénal régulier (créatinine, phosphorémie, glycosurie, protéinurie) est recommandé après 2 à 4 semaines de traitement puis tous les 3 à 6 mois sous TDF.
Prise en charge des personnes infectées par le virus de l’hépatite C – Fiche synthétique.
Prise en charge des personnes infectées chroniquement par le virus de l’hépatite B +/- de l’hépatite delta – Fiche synthétique.
Prise en charge des personnes infectées chroniquement par le virus de l’hépatite B – Recommandations.
Prise en charge des personnes infectées par le virus de l’hépatite C – Recommandations.
Prise en charge des personnes infectées par le virus de l’hépatite delta – Recommandations.

 Encadrés
Encadrés