La compréhension de l’histoire naturelle de la bronchopneumopathie chronique obstructive (BPCO) a évolué : outre le tabagisme et l’exposition à des toxiques inhalés, des facteurs de prédisposition génétique et des événements respiratoires dans l’enfance sont impliqués dans sa genèse. Le concept de pré-BPCO a été récemment décrit. La classification de la BPCO en phénotypes guide la prise en charge thérapeutique et définit l’évolution de la maladie.
La bronchopneumopathie chronique obstructive (BPCO) est une pathologie respiratoire chronique fréquente dont les premières descriptions remontent à plus de deux cents ans. Selon l’Organisation mondiale de la santé (OMS), cette pathologie représente actuellement la troisième cause de mortalité dans le monde, avec 3,3 millions de décès en 2019. En France, le nombre de patients atteints de BPCO est estimé à 3,5 millions et 17 000 décès étaient liés à cette pathologie en 2017.
La BPCO est caractérisée par une obstruction permanente et progressive des voies aériennes associée à la présence de symptômes respiratoires avec, à divers degrés, dyspnée, toux, expectoration et infections respiratoires basses à répétition. Le diagnostic requiert la réalisation d’une épreuve fonctionnelle respiratoire mettant en évidence un trouble ventilatoire obstructif, défini par une diminution du rapport du volume expiratoire maximal à la première seconde (VEMS) que divise la capacité vitale forcée (CVF), soit un rapport VEMS/CVF inférieur à 70 %, non complètement réversible après inhalation de bronchodilatateurs. Le tabagisme est la principale cause du développement d’une BPCO. Cependant, le fait que plus de la moitié des fumeurs ne développe pas cette pathologie met en évidence la responsabilité d’autres facteurs jouant un rôle majeur dans la dégradation progressive de la fonction respiratoire. Ces facteurs influencent le développement de différents phénotypes de BPCO, dépassant les descriptions historiques des patients « pink puffer »* et « blue bloater »** et impactent l’histoire naturelle de la maladie.
La BPCO est caractérisée par une obstruction permanente et progressive des voies aériennes associée à la présence de symptômes respiratoires avec, à divers degrés, dyspnée, toux, expectoration et infections respiratoires basses à répétition. Le diagnostic requiert la réalisation d’une épreuve fonctionnelle respiratoire mettant en évidence un trouble ventilatoire obstructif, défini par une diminution du rapport du volume expiratoire maximal à la première seconde (VEMS) que divise la capacité vitale forcée (CVF), soit un rapport VEMS/CVF inférieur à 70 %, non complètement réversible après inhalation de bronchodilatateurs. Le tabagisme est la principale cause du développement d’une BPCO. Cependant, le fait que plus de la moitié des fumeurs ne développe pas cette pathologie met en évidence la responsabilité d’autres facteurs jouant un rôle majeur dans la dégradation progressive de la fonction respiratoire. Ces facteurs influencent le développement de différents phénotypes de BPCO, dépassant les descriptions historiques des patients « pink puffer »* et « blue bloater »** et impactent l’histoire naturelle de la maladie.
Histoire naturelle de la BPCO, individuelle et évolutive
Des trajectoires respiratoires de la BPCO variables
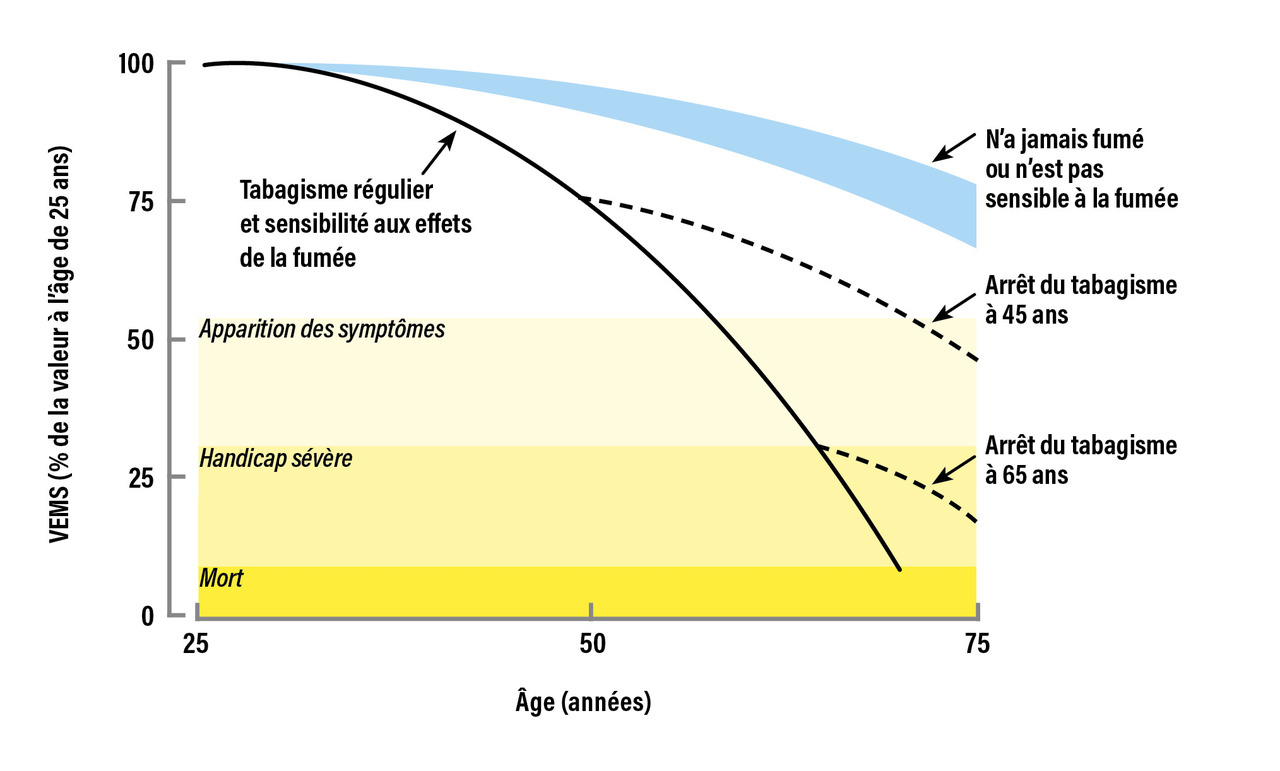
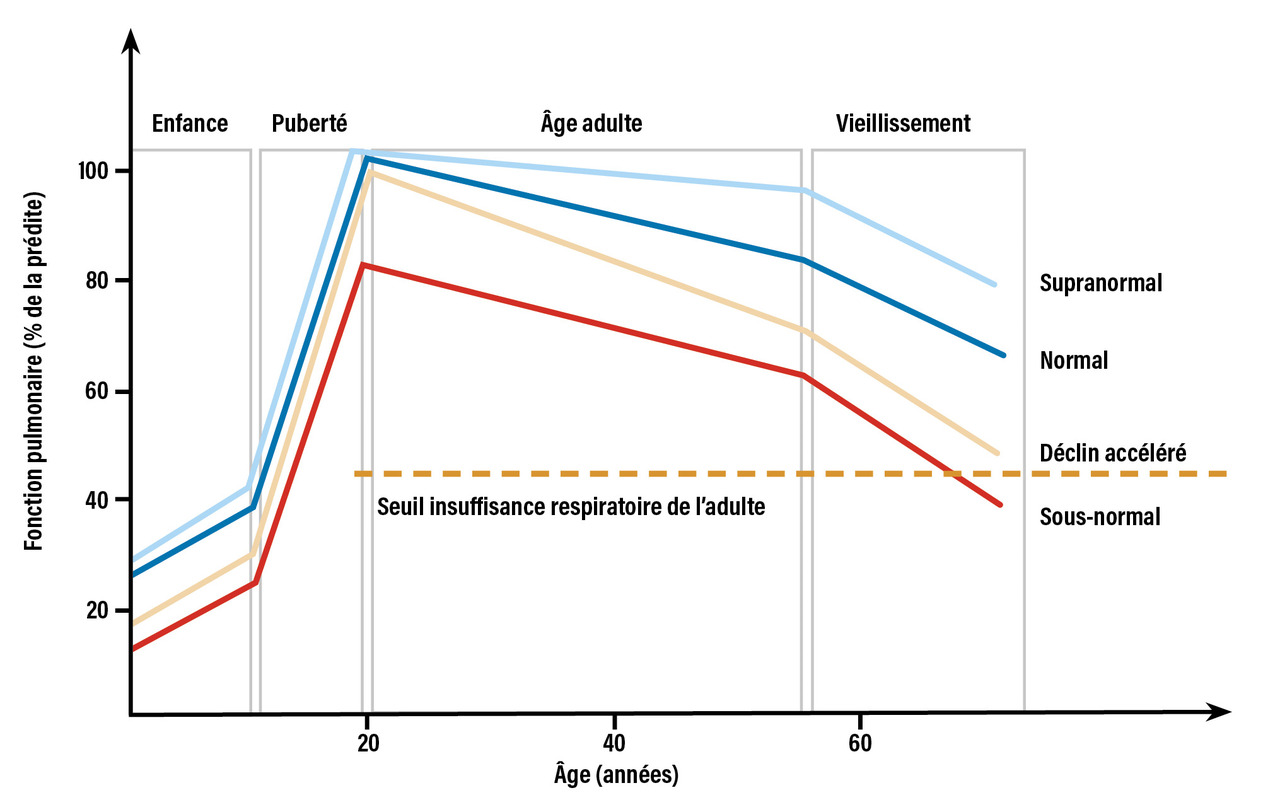
L’évolution de la fonction respiratoire au cours de la vie reposait jusqu’à récemment sur un concept de trajectoire respiratoire commune à tous les individus. La fonction respiratoire était décrite comme atteignant un plateau maximal identique pour tous vers l’âge de 20 à 25 ans, avant d’entamer un déclin physiologique progressif, évalué par la diminution du VEMS (fig. 1 ). Dès lors, seul un déclin accéléré de la fonction respiratoire favorisé par des facteurs génétiques ou une exposition environnementale pouvait entraîner une maladie respiratoire. De récentes études de cohortes longitudinales de grande ampleur ont cependant remis en cause ce concept.1 L’évolution de la fonction respiratoire n’est en réalité pas homogène entre les individus et peut suivre diverses trajectoires (fig. 2 ). Parmi ces trajectoires, certaines sont caractérisées par une fonction respiratoire diminuée au début de l’âge adulte susceptible d’aboutir à la survenue d’une insuffisance respiratoire chronique.2 Ces trajectoires respiratoires sont de plus fragilisées par l’exposition aux toxiques inhalés responsables de la BPCO. Le déclin de la fonction respiratoire avec le temps est accéléré par cette pathologie, jusqu’à aboutir à un stade d’insuffisance respiratoire chronique nécessitant une oxygénothérapie à long terme, parfois une ventilation non invasive, voire une transplantation pulmonaire.
Facteurs génétiques prédisposants
La principale cause de BPCO est l’exposition à la fumée de cigarette (tableau). Cependant, certaines prédispositions génétiques jouent un rôle dans la susceptibilité de développer cette maladie.
Le déficit en alpha-1-antitrypsine est la cause génétique la plus connue. Elle est liée à la mutation du gène SERPINA1 et concerne 1 % des patients atteints de BPCO. Cette protéine produite par le foie inhibe l’activité des protéases, limitant ainsi leurs activités enzymatiques et inflammatoires. Ce déficit est permanent, mais l’administration hebdomadaire d’alpha-1-antitrypsine par voie intraveineuse au long cours pourrait réduire l’évolution de la maladie.3 En dehors de ce déficit, de grandes cohortes ont défini des scores de risque génétique (MESA Lung et SPIROMICS) ou des locus spécifiques (COPDGene) pouvant être en lien avec un risque accru de développer une BPCO.
Le déficit en alpha-1-antitrypsine est la cause génétique la plus connue. Elle est liée à la mutation du gène SERPINA1 et concerne 1 % des patients atteints de BPCO. Cette protéine produite par le foie inhibe l’activité des protéases, limitant ainsi leurs activités enzymatiques et inflammatoires. Ce déficit est permanent, mais l’administration hebdomadaire d’alpha-1-antitrypsine par voie intraveineuse au long cours pourrait réduire l’évolution de la maladie.3 En dehors de ce déficit, de grandes cohortes ont défini des scores de risque génétique (MESA Lung et SPIROMICS) ou des locus spécifiques (COPDGene) pouvant être en lien avec un risque accru de développer une BPCO.
Implication d’événements survenant précocement
Des événements intervenant au début de la vie ont été décrits dans plusieurs études épidémiologiques comme des éléments essentiels modulant la santé à l’âge adulte.
La cause la plus importante de développement anormal du poumon est la prématurité.4 Le poumon immature présente de nombreuses anomalies, comme une réduction de la surface d’échanges gazeux, une diminution de la compliance et une réduction du calibre des voies aériennes. Les traitements utilisés en cas de grande prématurité (oxygène, ventilation) améliorent la survie des enfants mais sont des causes reconnues d’agression respiratoire.
Certains facteurs maternels affectent également le développement pulmonaire et sont associés à une augmentation de l’incidence de la BPCO. Le tabagisme durant la grossesse est une cause majeure de développement pulmonaire anormal, avec une augmentation du risque de développer une BPCO chez un enfant dont la mère fume dix cigarettes par jour.5
Les autres causes reconnues de déterminants précoces des maladies respiratoires sont le retard de croissance intra-utérin, les anomalies génétiques, les infections respiratoires durant la petite enfance ou le tabagisme à l’adolescence.6
La cause la plus importante de développement anormal du poumon est la prématurité.4 Le poumon immature présente de nombreuses anomalies, comme une réduction de la surface d’échanges gazeux, une diminution de la compliance et une réduction du calibre des voies aériennes. Les traitements utilisés en cas de grande prématurité (oxygène, ventilation) améliorent la survie des enfants mais sont des causes reconnues d’agression respiratoire.
Certains facteurs maternels affectent également le développement pulmonaire et sont associés à une augmentation de l’incidence de la BPCO. Le tabagisme durant la grossesse est une cause majeure de développement pulmonaire anormal, avec une augmentation du risque de développer une BPCO chez un enfant dont la mère fume dix cigarettes par jour.5
Les autres causes reconnues de déterminants précoces des maladies respiratoires sont le retard de croissance intra-utérin, les anomalies génétiques, les infections respiratoires durant la petite enfance ou le tabagisme à l’adolescence.6
Concept de pré-BPCO
Récemment, un nouveau concept, celui de pré-BPCO, a été décrit. En effet, certains patients ont des facteurs de risque de BPCO et peuvent avoir des signes cliniques de cette pathologie sans toutefois avoir les critères fonctionnels respiratoires permettant un diagnostic formel. Ce concept de pré-BPCO7 permet d’inclure ces patients dans un suivi adapté afin de ne pas méconnaître une évolution péjorative de leur fonction respiratoire et d’éviter des facteurs aggravants connus, principalement le tabagisme.8
Trois à cinq phénotypes de BPCO
La BPCO est une maladie complexe, avec des présentations cliniques différentes. Plusieurs études ont tenté de classer la BPCO en phénotypes afin de guider la prise en charge thérapeutique et de définir l’évolution de la maladie. Entre trois et cinq phénotypes sont décrits en moyenne dans les grandes cohortes de patients. Cependant, chez un même individu, il existe une variabilité dans la persistance d’un phénotype et il serait simpliste de classer de façon stricte chaque patient. Nous présentons ici les présentations cliniques les plus classiques.
Fréquence des exacerbations
Les exacerbations de BPCO jouent un rôle majeur dans l’histoire naturelle de cette pathologie. Elles sont définies par une aggravation en quelques heures ou jours de la dyspnée, de la toux et/ou de l’expectoration (volume, purulence) au-delà des variations quotidiennes et parfois associée à une tachypnée et/ou à une tachycardie. L’exacerbation de BPCO est associée à une inflammation des voies aériennes, une augmentation des sécrétions et de l’obstruction bronchique.8 Avec 100 000 à 160 000 hospitalisations par an en France, ces événements respiratoires ont un retentissement socio-économique majeur. Les causes d’exacerbations sont multiples mais relèvent en premier lieu d’infections respiratoires, le plus souvent virales. D’un point de vue individuel, les exacerbations de BPCO ont un impact négatif sur la qualité de vie, les taux d’hospitalisation et contribuent à une accélération du déclin du VEMS. Elles peuvent être un mode de révélation de la maladie. La fréquence des exacerbations, souvent plus élevée chez les patients ayant une maladie plus sévère, est variable pour un même patient au cours du temps. Il existe également une grande variabilité entre les patients, certains présentant un phénotype « exacerbateur fréquent », défini par au moins deux exacerbations dans l’année ou une exacerbation nécessitant une hospitalisation, d’autres n’ayant que pas ou peu d’exacerbations dans leur histoire.
Emphysème, des lésions irréversibles
L’emphysème pulmonaire est caractérisé par une destruction du parenchyme pulmonaire au-delà des bronchioles terminales et correspond à la composante alvéolaire de la BPCO. Dans l’histoire naturelle de la BPCO, l’emphysème constitue un événement de mauvais pronostic. En effet, les patients avec emphysème ont un déclin fonctionnel respiratoire accéléré. L’emphysème favorise le développement d’une insuffisance respiratoire chronique nécessitant une oxygénothérapie. Une fois les lésions d’emphysème installées, il n’existe aucun traitement permettant une régénération des tissus et, si certaines thérapeutiques inhalées sont reconnues comme efficaces sur la composante bronchique de la maladie, aucun traitement médical n’améliore l’emphysème. Les traitements interventionnels peuvent améliorer la fonction respiratoire et la qualité de vie. Ils comprennent en particulier la résection chirurgicale de bulle d’emphysème et la pose de valve endobronchique pour l’exclusion de territoires peu ventilés. La transplantation pulmonaire dans les cas les plus sévères peut être également proposée.
Intrication avec l’asthme
Il existe un phénotype de patients atteints de BPCO dont l’évolution et la présentation clinique sont proches de celles d’une maladie asthmatique. La définition de ce phénotype est peu claire et a été décrite de façon controversée comme un syndrome de chevauchement asthme-BPCO. L’évolution de ces patients est caractérisée par des exacerbations fréquentes, avec souvent une hyperéosinophilie. Ce syndrome peut être associé à un déclin accéléré de la fonction respiratoire, une augmentation du taux d’hospitalisations et une diminution de la survie. La présence de ce phénotype avec une éosinophilie sanguine supérieure à 300 éléments/mm3 en état stable oriente la prise en charge vers des traitements inhalés incluant une corticothérapie inhalée au long cours.9
Hypertension pulmonaire, complication tardive fréquente
Une hypertension pulmonaire, habituellement modérée, peut apparaître au cours d’une BPCO, en particulier en cas d’hypoxémie chronique. Sa prévalence a été estimée à 35 % chez les patients avec BPCO sévère et jusqu’à 82 % chez les patients inscrits sur liste de transplantation pulmonaire. Il s’agit ainsi d’une complication fréquente de la BPCO survenant habituellement tardivement dans l’histoire naturelle de celle-ci. Elle entraîne une aggravation des symptômes, une altération des échanges gazeux et une augmentation de la mortalité des patients. Le traitement de l’insuffisance respiratoire par oxygénothérapie, le sevrage tabagique, les traitements bronchodilatateurs et la réadaptation respiratoire restent alors les piliers de la prise en charge. Cependant, certains rares patients présentent une hypertension pulmonaire sévère associée à une hypoxémie importante, contrastant avec un trouble ventilatoire obstructif modéré. Cette atteinte vasculaire proche de l’hypertension artérielle pulmonaire peut faire discuter l’introduction de traitements de l’hypertension artérielle pulmonaire, au sein d’un centre expert.10
Comorbidités délétères
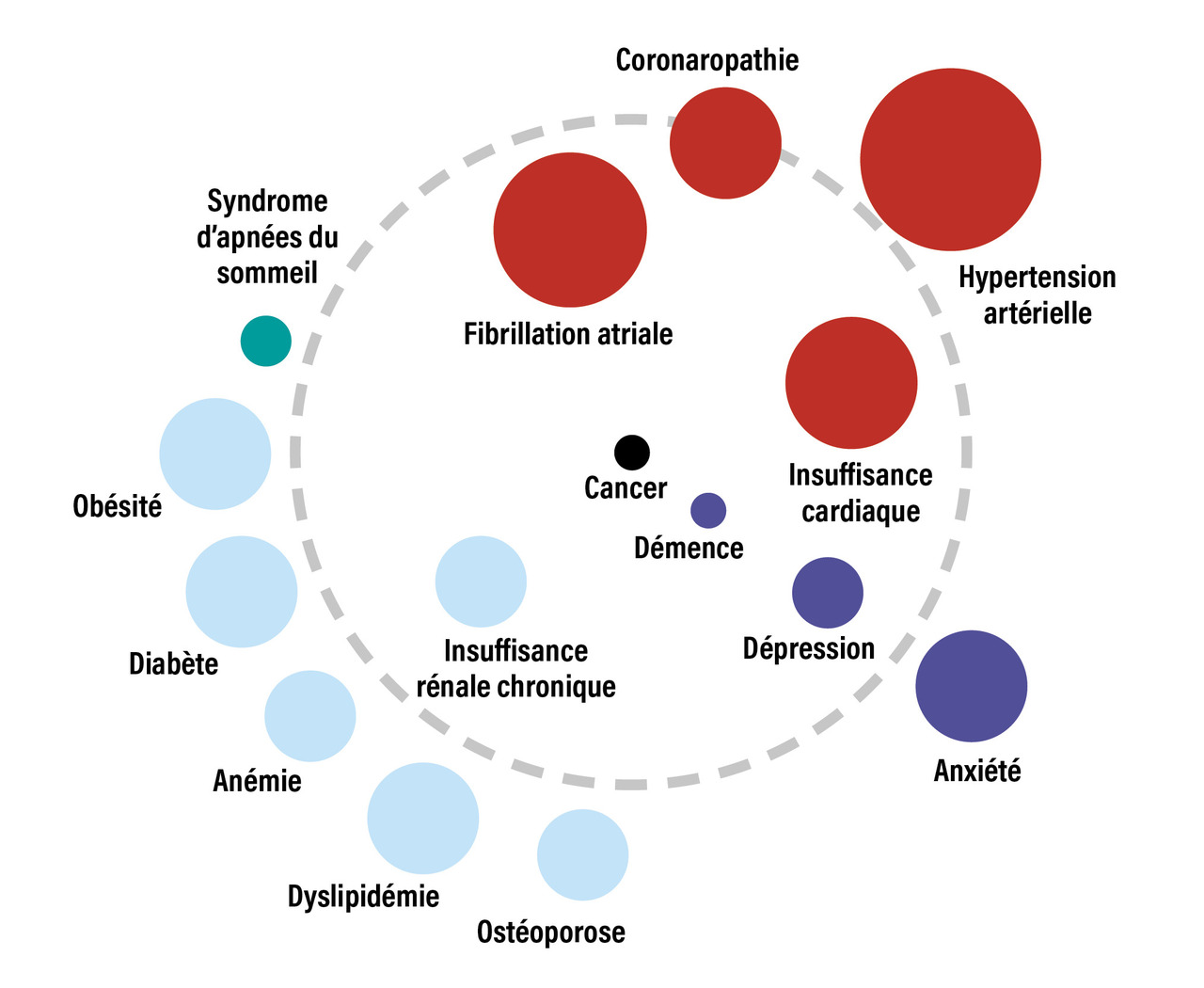
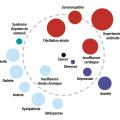
Au cours de la BPCO, d’autres maladies chroniques (comorbidités) sont fréquemment associées (fig. 3 ), incluant des affections cardiovasculaires, un syndrome métabolique ou au contraire une cachexie, une dysfonction musculosquelettique, une ostéoporose, une anxiété, avec parfois des traits dépressifs, ainsi que des néoplasies, dont le cancer bronchique. Ces comorbidités, associées de manière variable aux différents phénotypes de la BPCO, sont parfois regroupées en clusters. Elles doivent être recherchées et traitées en raison de leur impact sur l’état de santé, le risque d’hospitalisation et la mortalité, indépendamment de la sévérité de l’obstruction bronchique de la BPCO. En moyenne, un patient atteint de BPCO présente cinq comorbidités.
Comprendre les phénotypes pour guider les traitements
La BPCO est une maladie complexe entraînant une altération de la fonction respiratoire, pouvant, dans les cas les plus sévères, aboutir à une insuffisance respiratoire chronique. Les causes sont multiples mais impliquent en priorité le tabagisme, qui est évitable. Une compréhension des différents phénotypes peut guider de façon personnalisée les traitements proposés au patient afin de limiter l’évolution péjorative de la maladie.
*« rose poussif » : emphysémateux**« bleu bouffi » : bronchitiques chroniques
Références
1. Belgrave DCM, Granell R, Turner SW, Curtin JA, Buchan IE, Le Souëf PN, et al. Lung function trajectories from pre-school age to adulthood and their associations with early life factors: A retrospective analysis of three population-based birth cohort studies. Lancet Respir Med 2018;6(7):526-34.
2. Lange P, Celli B, Agustí A. Lung-function trajectories and chronic obstructive pulmonary disease. N Engl J Med 2015;373(16):1575.
3. Chapman KR, Burdon JGW, Piitulainen E, Sandhaus RA, Seersholm N, Stocks JM, et al. Intravenous augmentation treatment and lung density in severe α1 antitrypsin deficiency (RAPID): A randomised, double-blind, placebo-controlled trial. The Lancet 2015;386(9991):360-8.
4. Silverman M, Kuehni CE. Early lung development and COPD. Lancet Lond Engl 2007;370(9589):717-9.
5. Upton MN, Smith GD, McConnachie A, Hart CL, Watt GCM. Maternal and personal cigarette smoking synergize to increase airflow limitation in adults. Am J Respir Crit Care Med 2004;169(4):479-87.
6. Martinez FD. Early-life origins of chronic obstructive pulmonary disease. N Engl J Med 2016;375(9):871-8.
7. Han MK, Agusti A, Celli BR, Criner GJ, Halpin DMG, Roche N, et al. From GOLD 0 to pre-COPD. Am J Respir Crit Care Med 2020;203(4):414-23.
8. Agustí A, Celli BR, Criner GJ, Halpin D, Anzueto A, Barnes P, et al. Global initiative for chronic obstructive lung disease 2023 Report: GOLD Executive Summary. Eur Respir J 2023;61(4):2300239.
9. Zysman M, Ribeiro Baptista B, Soumagne T, Marques da Silva V, Martin C, Thibault de Menonville C, et al. Optimisation du traitement médicamenteux des patients atteints de BPCO en état stable. Position de la Société de pneumologie de langue française. Actualisation 2021. Rev Mal Respir 2021;38(5):539-61.
10. Humbert M, Kovacs G, Hoeper MM, Badagliacca R, Berger RMF, Brida M, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J 2023;61(1):2200879.
2. Lange P, Celli B, Agustí A. Lung-function trajectories and chronic obstructive pulmonary disease. N Engl J Med 2015;373(16):1575.
3. Chapman KR, Burdon JGW, Piitulainen E, Sandhaus RA, Seersholm N, Stocks JM, et al. Intravenous augmentation treatment and lung density in severe α1 antitrypsin deficiency (RAPID): A randomised, double-blind, placebo-controlled trial. The Lancet 2015;386(9991):360-8.
4. Silverman M, Kuehni CE. Early lung development and COPD. Lancet Lond Engl 2007;370(9589):717-9.
5. Upton MN, Smith GD, McConnachie A, Hart CL, Watt GCM. Maternal and personal cigarette smoking synergize to increase airflow limitation in adults. Am J Respir Crit Care Med 2004;169(4):479-87.
6. Martinez FD. Early-life origins of chronic obstructive pulmonary disease. N Engl J Med 2016;375(9):871-8.
7. Han MK, Agusti A, Celli BR, Criner GJ, Halpin DMG, Roche N, et al. From GOLD 0 to pre-COPD. Am J Respir Crit Care Med 2020;203(4):414-23.
8. Agustí A, Celli BR, Criner GJ, Halpin D, Anzueto A, Barnes P, et al. Global initiative for chronic obstructive lung disease 2023 Report: GOLD Executive Summary. Eur Respir J 2023;61(4):2300239.
9. Zysman M, Ribeiro Baptista B, Soumagne T, Marques da Silva V, Martin C, Thibault de Menonville C, et al. Optimisation du traitement médicamenteux des patients atteints de BPCO en état stable. Position de la Société de pneumologie de langue française. Actualisation 2021. Rev Mal Respir 2021;38(5):539-61.
10. Humbert M, Kovacs G, Hoeper MM, Badagliacca R, Berger RMF, Brida M, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J 2023;61(1):2200879.