En effet, parmi les HPV à tropisme muqueux du genre alpha, on distingue :
– ceux à bas risque oncogène (HPV BR), essentiellement responsables de condylomes génitaux, avec pour chefs de file HPV 6 et 11 ;
– ceux à haut risque oncogène (HPV HR), impliqués dans les cancers muqueux : HPV 16 le plus souvent, suivi, en termes de prévalence, des HPV 18, 31, 33, 45, 52 et 58.
Dans le monde, plus de 600 000 nouveaux cas de cancers liés aux HPV sont diagnostiqués par an. En France, il s’agit de la première cause de cancers induits par des agents infectieux.1, 2 Ainsi, ces HPV HR sont responsables de cancers cervicaux (100 %), anaux (90 %), du pénis (50 %), vulvaires (25 %), du vagin (80 %) et de l’oropharynx (30 %).3 En France métropolitaine, en 2012, le cancer du col de l’utérus était le 11e en fréquence chez la femme avec plus de 3 000 cas, et le 12e le plus meurtrier (plus d’un tiers de décès).4
Depuis les années 80, ces cancers à HPV sont en nette augmentation (à l’exception de celui du col de l’utérus), et même considérés comme une épidémie dans la plupart des pays industrialisés. Les nouvelles stratégies de dépistage, les vaccins préventifs et les thérapies ciblées laissent espérer un inversement de la tendance dans les années futures.5
De multiples localisations
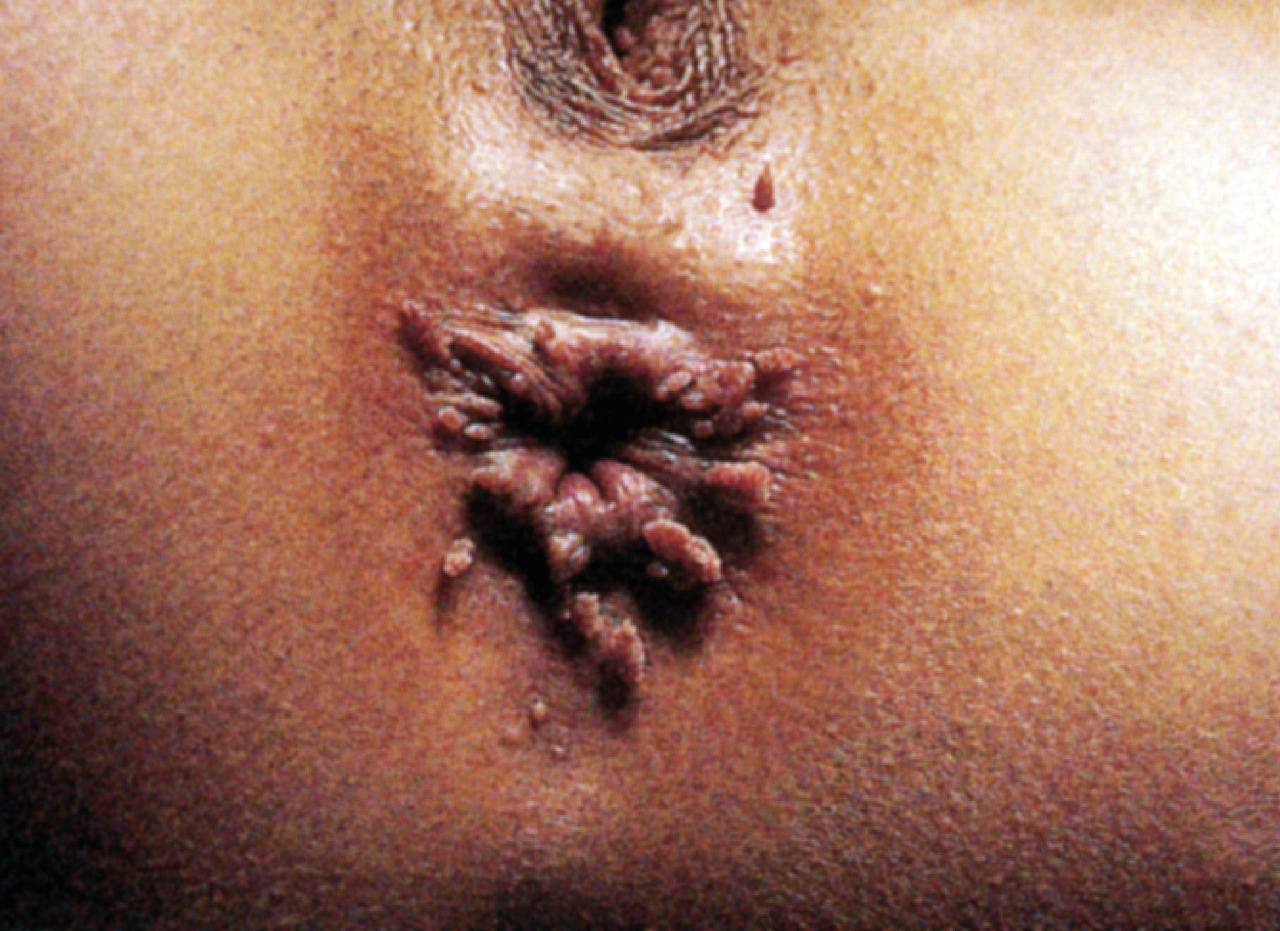
Cancers ano-génitaux
Environ 10 % des femmes sont infectées, mais cette prévalence varie fortement selon la région géographique et l’âge. Un pic d’infection est observé chez les filles de moins de 25 ans (environ 23 % en Europe), puis le taux décroît avec l’âge. Dans certaines populations, un second pic, plus faible, est rapporté après 50 ans.
La longue période séparant la primo-infection de l’apparition du cancer a permis de mettre en place un dépistage – visant à détecter les lésions précancéreuses ou les cancers à un stade précoce – fondé sur la lecture du frottis cervico-utérin (FCU) par un anatomocytopathologiste. Ainsi, l’application des recommandations (FCU tous les 3 ans entre 25 et 65 ans après 2 FCU normaux à 1 an d’intervalle) a fait diminuer l’incidence du cancer du col en France. Cependant, encore 30 % de nouveaux cas par an concernent des femmes suivies et ayant des FCU normaux.
L’association du test moléculaire HPV (par PCR) au frottis, déjà mise en place dans d’autres pays, est aujourd’hui envisagée afin d’augmenter la sensibilité du dépistage.
Les infections à HPV au niveau anal (
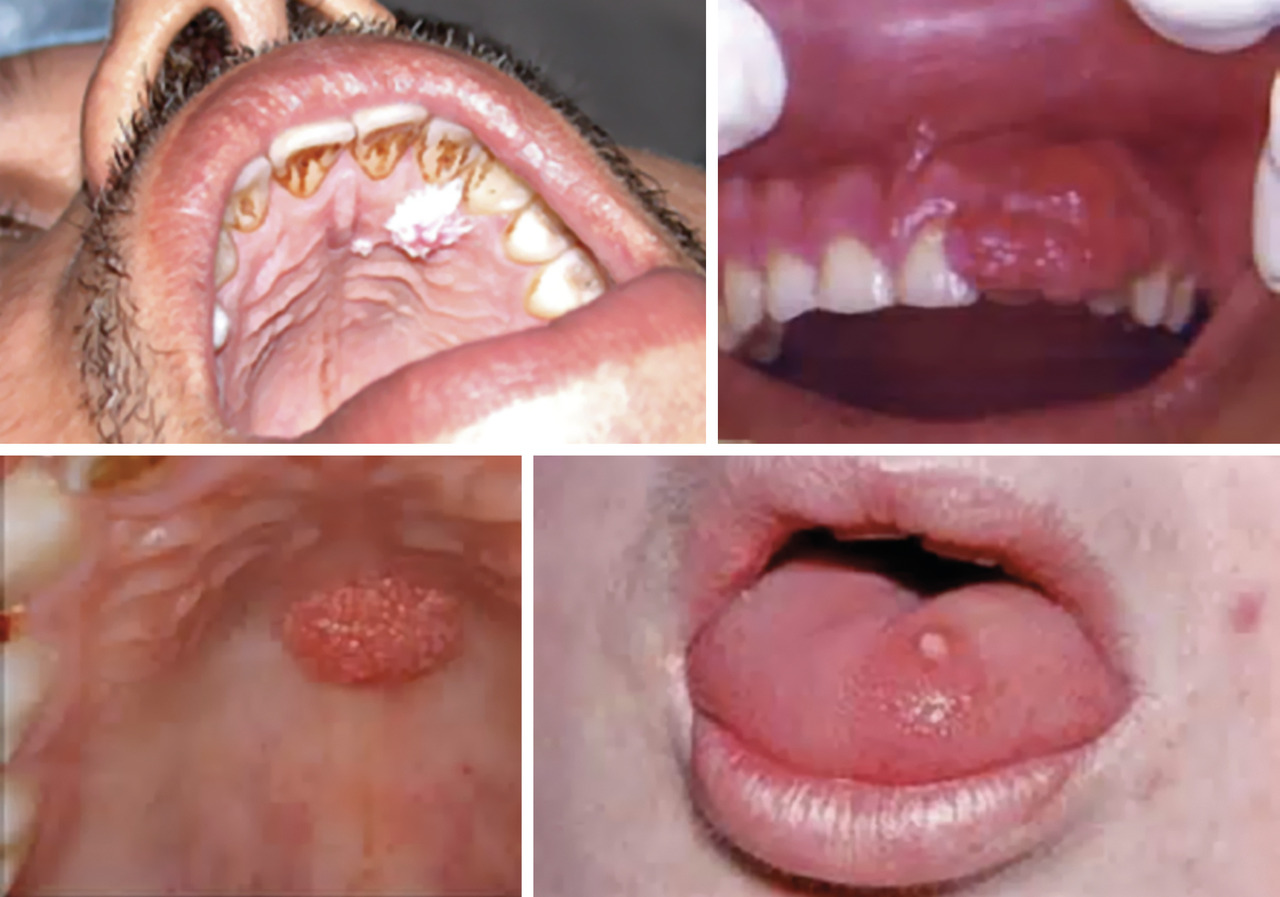
Cancers des voies aérodigestives supérieures
Les patients atteints sont en général des hommes entre 40 et 50 ans, non ou peu fumeurs. Le pronostic est bon, avec un taux de survie à 3 ans de 82 % pour les cancers liés à HPV versus 45 % pour ceux non induits par ces virus.7
Notons qu’une transmission mère- enfant au moment de l’accouchement peut être responsable de papillomes laryngés chez l’enfant (souches HPV 6 et 11, de bas risque).
Vaccins prophylactiques
Ces VLP sont antigéniquement identiques aux virions naturels, mais non infectieuses. Leur administration aboutit à la production d’anticorps neutralisants anti-L1 spécifiques de chaque génotype présent dans le vaccin. Bien qu’injecté par voie intramusculaire, ce dernier induit des anticorps capables de migrer des vaisseaux sanguins jusqu’à la surface de la muqueuse génitale et de neutraliser le virion au site d’entrée, empêchant ainsi son internalisation par les cellules souches malpighiennes basales, réservoir du virus.
Les vaccins disponibles à l’heure actuelle sont : Cervarix (GSK, bivalent, ciblant les génotypes à haut risque HPV 16 et 18), Gardasil (Merck, tétravalent, dirigé aussi contre les génotypes à bas risque 6 et 11) et – depuis août 2018 – Gardasil 9, nonavalent, contre HPV 6, 11, 16, 18, 31, 33, 45, 52 et 58. Ces 5 valences supplémentaires permettraient d’augmenter la protection attendue contre les cancers du col de l’utérus à 90 %.
En France, la vaccination a été recommandée initialement chez les jeunes filles âgées de 11 à 14 ans (avec un rattrapage possible jusqu’à 19 ans) en prévention des lésions du col. Elle est également préconisée chez les personnes immunodéprimées des 2 sexes. Récemment, il a aussi été recommandé de vacciner les HSH (à haut risque de cancer anal) jusqu’à l’âge de 26 ans. Le schéma vaccinal est réduit à 2 doses si la première injection est réalisée avant 14 ans.
En Australie, pays pionnier dans ce domaine, le vaccin est aussi administré, depuis 2007, aux jeunes garçons de 11 à 14 ans, ce qui a abouti à une diminution drastique (- 90 %) du nombre de lésions cervicales de haut grade. Les États-Unis, le Canada et l’Autriche ont également appliqué ces recommandations. Notons qu’en France, le faible taux de couverture chez les filles (20 %) ne permet pas d’obtenir une « protection de groupe » chez les garçons à risque de cancer anal et de la sphère ORL.
Un vaccin décrié ?
Le risque d’anaphylaxie est estimé à 1,7 cas par million de doses (OMS 2017 : https://bit.ly/2DqXI7M).
En France, selon la HAS, plus de 5 millions de doses de Gardasil ont été distribuées, avec un total de 435 effets indésirables graves (0,008 %) dont 135 cas de maladies auto-immunes (0,0003 %) incluant 15 scléroses en plaques (0,00003 %). L’Ansm a mené une étude prospective sur une cohorte de près de 850 000 jeunes filles vaccinées et de 1 500 000 non vaccinées nées entre 1992 et 1996 et suivies sur une période allant de 2008 à 2012. Le taux d’hospitalisation pour des maladies auto-immunes (données du Programme de médicalisation des systèmes d’information) est similaire dans les 2 groupes : 2,01 pour 10 000 patientes/année chez les jeunes filles vaccinées versus 2,09 pour 10 000 patientes/année chez les non vaccinées. Cependant, cette étude montre une association probable avec le syndrome de Guillain-Barré, estimé à 1 à 2 cas supplémentaires pour 100 000 jeunes filles, qui n’a cependant pas été confirmée par une autre série anglaise reposant sur plus de 10 millions de doses administrées.8
Ainsi, compte tenu de la rareté de ces effets indésirables, l’Ansm et l’Assurance maladie estiment que les résultats de ces études ne remettent pas en cause la balance bénéfice-risque des vaccins concernés. Il persiste chez les Français une défiance liée à plusieurs facteurs dont l’âge des candidats à la vaccination : elle doit être faite avant toute exposition au virus.9 Il s’agit donc pour les parents d’anticiper le début de l’activité sexuelle de leurs jeunes adolescents. Enfin, les bénéfices de la vaccination prophylactique ne sont pas immédiatement visibles, en raison du long délai entre primo-infection et apparition d’un cancer invasif, de l’ordre de 15 à 25 ans.
Quelles perspectives ?
En France, il est aussi indispensable d’avoir une réflexion plus globale sur la vaccination de l’ensemble des adolescents, et pas seulement des jeunes filles.
Enfin, le développement d’outils de détection innovants, fiables et utilisables en routine, semble incontournable pour améliorer le dépistage des lésions précancéreuses et des cancers à HPV.
Pour en savoir plus
• Consultation multidisciplinaire papillomavirus (HPV) : http://toutsavoir-hpv.org/• Association 1000 femmes 1000 vies : http://1000femmes1000vies.org/• Santé publique France : http://sexosafe.fr/• CRIPS île-de-France : https://bit.ly/2ZlIpXg• Institut Pasteur. Cancer du col de l’utérus et papillomavirus. https://bit.ly/2vallwJDépistage : sur le site de l’INCa • Dépistage du cancer du col de l’utérus : https://bit.ly/2GkZKa2• Conduite à tenir devant une femme ayant une cytologie cervico-utérine anormale : https://bit.ly/2GnAfEZ• Le proctologue-gastroentérologue, acteur de la prévention du cancer de l’anus auprès des patients infectés par le VIH : https://bit.ly/2UMlWE0• Dépliant cancer et VIH - prévenir le cancer de l’anus : https://bit.ly/2V9gYRkVaccination• Calendrier simplifié des vaccinations 2019 : https://bit.ly/2dUuoeS• HCSP. Infections à HPV des jeunes filles : révision de l’âge de vaccination : https://bit.ly/2DmMOzV• HAS. Rappel d’information sur la vaccination contre les papillomavirus humains par le Gardasil : https://bit.ly/2Vbqgfp• INCa. Vaccination contre les HPV et cancers : https://bit.ly/2TewNVO
2. Badoual C, Tartour E, Roussel H, et al. HPV (Human Papilloma Virus) implication in other cancers than gynaecological. Rev Med Interne 2015;36:540-7.
3. de Martel C, Plummer M, Vignat J, Franceschi S. World- wide burden of cancer attributable to HPV by site, country and HPV type. Int J Cancer 2017;141:664-70.
4. Duport N, Heard I, Barré S, Woronoff AS. Le cancer du col de l’utérus : état des connaissances en 2014. InVS BEH (N° 13-14-15); mai 2014.
5. Pernot S, Pavie J, Péré H, et al. Papillomavirus, could we speak about cancer and prevention? Bull Cancer 2018;105:137-9.
6. Lin C, Franceschi S, Clifford GM. Human papillomavirus types from infection to cancer in the anus, according to sex and HIV status: a systematic review and meta- analysis. Lancet Infect Dis 2018;18:198-206.
7. D’Souza G, Anantharaman D, Gheit T, et al. Effect of HPV on head and neck cancer patient survival, by region and tumor site: A comparison of 1362 cases across three continents. Oral Oncol 2016;62:20-7.
8. Andrews N, Stowe J, Miller E. No increased risk of Guillain-Barré syndrome after human papilloma virus vaccine: A self-controlled case-series study in England. Vaccine 2017;35:1729-32.
9. Karaki S, Pere H, Badoual C, Tartour E. Hope in the Long Road Toward the Development of a Therapeutic Human Papillomavirus Vaccine. Clin Cancer Res 2016;22:2317-9.

 Encadrés
Encadrés