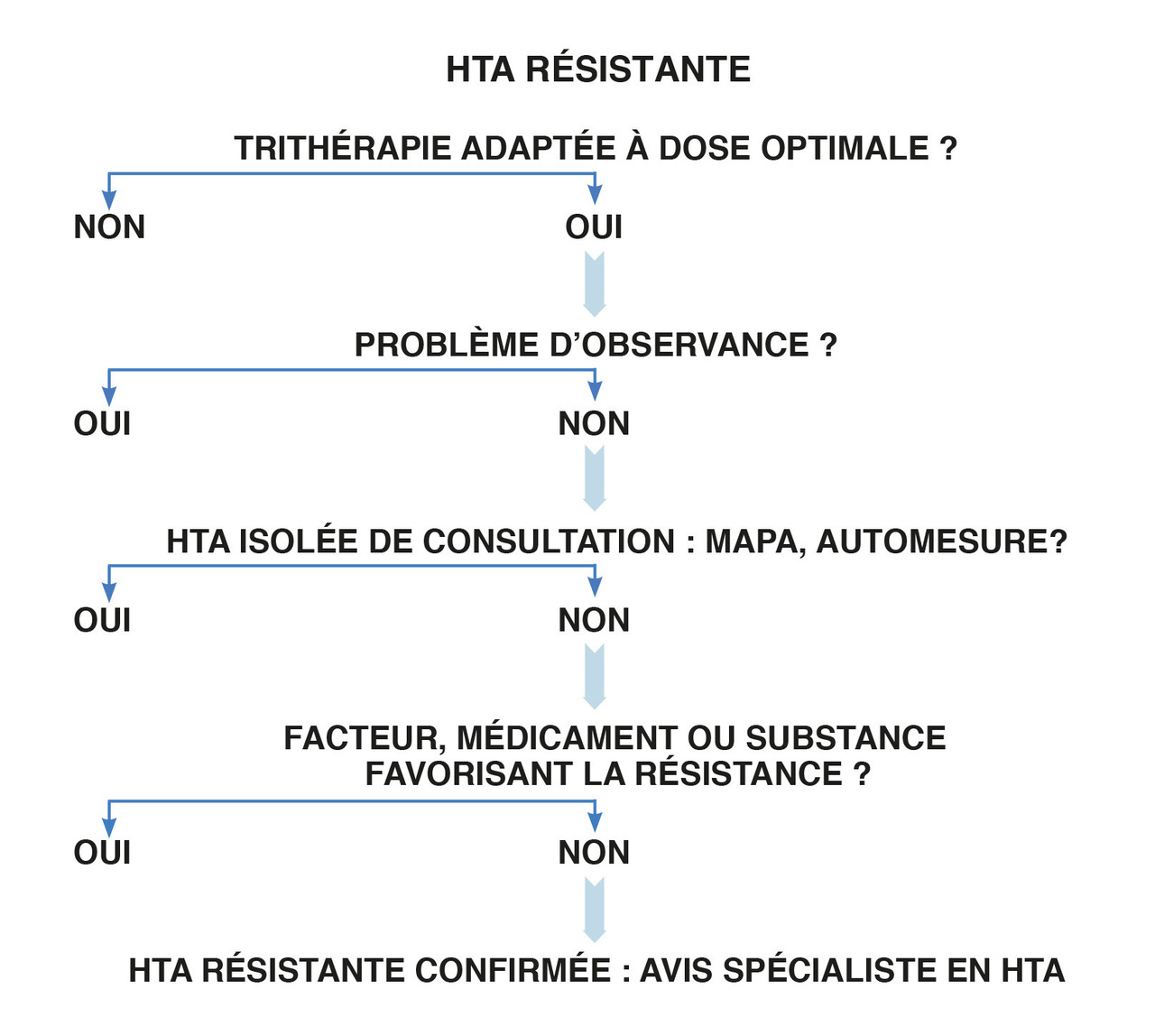
Longue et difficile, la démarche diagnostique est systématisée.
L’ hypertension artérielle résistante (HTAR) est caractérisée par la non-atteinte de la cible tensionnelle (< 140/90 mmHg) malgré un traitement antihypertenseur approprié pendant au moins 4 semaines : 3 antihypertenseurs de 3 classes différentes à doses maximales tolérées. L’un des trois est toujours un diurétique.1 La SFHTA recommande une trithérapie comportant un diurétique thiazidique, un bloqueur du système rénine-angiotensine (inhibiteur de l’enzyme de conversion de l’angiotensine I, IEC ou antagoniste du récepteur de l’angiotensine, ARA II) et un inhibiteur calcique.1 La prévalence de l’HTAR est difficile à évaluer et varie selon les études. Selon des données récentes recueillies chez plus d’un million de patients, elle est d’environ 6 %.2
Diagnostic et prise en charge sont essentiels car l’HTAR a un mauvais pronostic : hausse du risque d’insuffisance cardiaque (34 %), de mortalité cardiovasculaire (20 %) et totale (12 %).3
La démarche, longue et difficile, gagne à être systématisée pour ne pas méconnaître l’une des nombreuses causes favorisant la résistance au traitement. Pour ce faire, nous avons mis au point un questionnaire en ligne (Hy-Quest) qui permet au patient de préparer sa consultation (www.hy-quest.com) et aide le soignant à ne pas omettre les questions à aborder.
Diagnostic et prise en charge sont essentiels car l’HTAR a un mauvais pronostic : hausse du risque d’insuffisance cardiaque (34 %), de mortalité cardiovasculaire (20 %) et totale (12 %).3
La démarche, longue et difficile, gagne à être systématisée pour ne pas méconnaître l’une des nombreuses causes favorisant la résistance au traitement. Pour ce faire, nous avons mis au point un questionnaire en ligne (Hy-Quest) qui permet au patient de préparer sa consultation (www.hy-quest.com) et aide le soignant à ne pas omettre les questions à aborder.
Mesurer la pression artérielle
Une des difficultés d’évaluation de la prévalence est liée à la mesure de la pression artérielle (PA), qui est clinique dans la majorité des études. Il est recommandé d’utiliser une technique objective, de préférence en dehors du milieu médical, comme la mesure ambulatoire de la pression artérielle (MAPA) ou l’automesure tensionnelle (AMT) pour conclure qu’il y a bien résistance au traitement. Tout patient sous 3 antihypertenseurs doit désormais en bénéficier.
Une fois le diagnostic confirmé, le praticien doit procéder par étapes bien codifiées.
Une fois le diagnostic confirmé, le praticien doit procéder par étapes bien codifiées.
Des facteurs favorisants ?
Inobservance thérapeutique (encadré ). La démocratisation de la détection de médicaments dans le sang ou les urines par spectrométrie de masse en a modifié l’approche. Plusieurs études utilisant ces dosages ont prouvé que 50 % des hypertendus ne prennent pas l’intégralité de leur traitement et que 15 à 20 % n’absorbent aucune des molécules prescrites.
L’obésité est associée à une réduction significative du contrôle de la PA.
Un syndrome d’apnées obstructives du sommeil (SAOS) accompagne fréquemment l’HTAR, en particulier chez les obèses, avec une prévalence de 60 à 80 %.
Inertie thérapeutique. De nombreuses publications montrent que bon nombre de médecins ne majorent pas la thérapeutique lorsque le patient est en HTAR. Les raisons invoquées sont la méconnaissance des objectifs tensionnels, la variabilité de la PA, les effets indésirables, les comorbidités. Le mesure objective de la PA est donc essentielle pour poser le diagnostic avec certitude.
Consommation de substances vasopressives : alcool, pilule (5 % des cas), AINS, réglisse, corticothérapie (20 % des patients), inhibiteurs de la recapture de la noradrénaline (venlafaxine, duloxetine), substances illicites…
Absorption sodée excessive : se méfier des sauces à base de soja, des rehausseurs de goût, etc.
Une fois ces facteurs éliminés, on passe à l’étape suivante.
L’obésité est associée à une réduction significative du contrôle de la PA.
Un syndrome d’apnées obstructives du sommeil (SAOS) accompagne fréquemment l’HTAR, en particulier chez les obèses, avec une prévalence de 60 à 80 %.
Inertie thérapeutique. De nombreuses publications montrent que bon nombre de médecins ne majorent pas la thérapeutique lorsque le patient est en HTAR. Les raisons invoquées sont la méconnaissance des objectifs tensionnels, la variabilité de la PA, les effets indésirables, les comorbidités. Le mesure objective de la PA est donc essentielle pour poser le diagnostic avec certitude.
Consommation de substances vasopressives : alcool, pilule (5 % des cas), AINS, réglisse, corticothérapie (20 % des patients), inhibiteurs de la recapture de la noradrénaline (venlafaxine, duloxetine), substances illicites…
Absorption sodée excessive : se méfier des sauces à base de soja, des rehausseurs de goût, etc.
Une fois ces facteurs éliminés, on passe à l’étape suivante.
Est-ce une HTA secondaire ?
La prévalence de l’hyperaldostéronisme primaire va jusqu’à 20 % lors d’une HTAR. Le dépistage se fait par mesure du rapport aldostérone sur rénine plasmatique (la première est élevée, la seconde est basse). Ces dosages doivent être réalisés le matin, en position assise, en normovolémie et normokaliémie après arrêt des molécules susceptibles d’interférer avec les prélèvements : bloqueurs du système rénine-angiotensine, diurétiques, bêtabloquants 15 jours avant ; antagonistes de l’aldostérone 6 semaines avant. Les inhibiteurs calciques non dihydropyridine n’interfèrent pas avec les dosages.
À noter que l’absence d’hypokaliémie n’élimine pas ce diagnostic, puisque 70 % des patients touchés n’ont pas d’hypokaliémie.
Sténose de l’artère rénale, athéromateuse ou par dysplasie fibromusculaire. On peut la rechercher avec un doppler artériel, mais c’est un examen difficile qui requiert un opérateur entraîné. La dysplasie fibromusculaire est éliminée par angioscanner des artères rénales lorsqu’il existe une suspicion forte. Certaines atteintes distales ne sont en effet pas visualisées au doppler.4
Une néphropathie est soupçonnée selon le contexte, la fonction rénale et l’analyse du sédiment urinaire (néphropathie à IgA – maladie de Berger notamment).
D’autres causes plus rares sont évoquées au cas par cas selon l’examen clinique : phéochromocytome, hypercortisolisme, coarctation de l’aorte…
À noter que l’absence d’hypokaliémie n’élimine pas ce diagnostic, puisque 70 % des patients touchés n’ont pas d’hypokaliémie.
Sténose de l’artère rénale, athéromateuse ou par dysplasie fibromusculaire. On peut la rechercher avec un doppler artériel, mais c’est un examen difficile qui requiert un opérateur entraîné. La dysplasie fibromusculaire est éliminée par angioscanner des artères rénales lorsqu’il existe une suspicion forte. Certaines atteintes distales ne sont en effet pas visualisées au doppler.4
Une néphropathie est soupçonnée selon le contexte, la fonction rénale et l’analyse du sédiment urinaire (néphropathie à IgA – maladie de Berger notamment).
D’autres causes plus rares sont évoquées au cas par cas selon l’examen clinique : phéochromocytome, hypercortisolisme, coarctation de l’aorte…
Prise en charge
Intervention hygiénodiététique
L’instauration et/ou le renforcement de ces règles incluent une réduction pondérale en cas de surpoids ou d’obésité, l’exercice physique d’intensité modérée pendant 30 minutes par jour, la réduction des apports sodés (à 6 g/j, recommandations de l’OMS) et de la prise de substances vasopressives (réglisse, alcool, automédication à risque ; encadré 2). à noter que dans l’HTA, une perte de poids de 10 kg est associée à une diminution moyenne de 6 mmHg de PA systolique et 4,6 mmHg de PA diastolique.5
Prescription médicamenteuse
La trithérapie usuelle est constituée d’un bloqueur du système rénine-angiotensine (ARA II ou IEC), d’un inhibiteur calcique et d’un diurétique thiazidique. Pour ce dernier, il faut préférer l’indapamide LP 1,5 mg ou l’hydrochlorothiazide 25 mg si le débit de filtration glomérulaire (DFG) est supérieur à 30 mL/min. Dans le cas contraire (DFG < 30 mL/min), le thiazidique doit être remplacé par un diurétique de l’anse : furosémide, dose usuelle de 40 à 120 mg/j (selon la fonction rénale) à répartir en 2 prises à partir de 80 mg/j (40 mg le matin et 40 mg à midi).
Lorsque la PA n’est toujours pas contrôlée après mesure objective par cette trithérapie à dose optimale, que l’observance a été vérifiée et une HTA secondaire éliminée, il s’agit bien d’une HTA essentielle résistante.
La majoration du traitement antihypertenseur privilégie l’augmentation de la déplétion sodée. La spironolactone est actuellement recommandée en 4e ligne chez les patients ayant un DFG supérieur à 45 mL/min et une kaliémie inférieure à 4,5 mmol/L.
La dose usuelle est de 25 mg à l’initiation du traitement et peut monter à 50 mg/j selon la réponse tensionnelle et la tolérance. Il faut surveiller la kaliémie et la fonction rénale à court terme, ainsi que la survenue d’une gynécomastie, d’une dysménorrhée ou d’une dysfonction érectile à moyen terme.
Ce choix thérapeutique repose sur les résultats de l’essai croisé randomisé contre placebo PATHWAY 2, mené en 2015 chez des patients en HTAR : 230 ont reçu dans un ordre aléatoire 12 semaines de spironolactone (25 puis 50 mg), 12 semaines de bisoprolol (5 puis 10 mg), 12 semaines de doxazosine (4 puis 8 mg) et 12 semaines de placebo. La spironolactone a diminué la PA systolique de 8,7 mmHg [IC 95 % : 7,69-9,72] en automesure tensionnelle par rapport au placebo. La baisse tensionnelle moyenne induite par cette molécule est plus importante que celle obtenue sous doxazosine ou bisoprolol : elle est supérieure de 4,26 mmHg [IC 95 % : 3,38-5,13].6
Cependant, cette étude a quelques limites. L’absence de majoration des événements indésirables, le choix d’un diurétique (bendrofluméthiazide) moins efficace que l’indapamide ou la chlorthalidone, et le faible niveau de PA des patients avant traitement contrebalancent ses résultats positifs. On peut penser que, si la spironolactone permet de contrôler de nombreux patients, ce ne sera pas la totalité. Dans ce cas, le recours à des traitements non-médicamenteux peut-être envisagé.
Lorsque la PA n’est toujours pas contrôlée après mesure objective par cette trithérapie à dose optimale, que l’observance a été vérifiée et une HTA secondaire éliminée, il s’agit bien d’une HTA essentielle résistante.
La majoration du traitement antihypertenseur privilégie l’augmentation de la déplétion sodée. La spironolactone est actuellement recommandée en 4e ligne chez les patients ayant un DFG supérieur à 45 mL/min et une kaliémie inférieure à 4,5 mmol/L.
La dose usuelle est de 25 mg à l’initiation du traitement et peut monter à 50 mg/j selon la réponse tensionnelle et la tolérance. Il faut surveiller la kaliémie et la fonction rénale à court terme, ainsi que la survenue d’une gynécomastie, d’une dysménorrhée ou d’une dysfonction érectile à moyen terme.
Ce choix thérapeutique repose sur les résultats de l’essai croisé randomisé contre placebo PATHWAY 2, mené en 2015 chez des patients en HTAR : 230 ont reçu dans un ordre aléatoire 12 semaines de spironolactone (25 puis 50 mg), 12 semaines de bisoprolol (5 puis 10 mg), 12 semaines de doxazosine (4 puis 8 mg) et 12 semaines de placebo. La spironolactone a diminué la PA systolique de 8,7 mmHg [IC 95 % : 7,69-9,72] en automesure tensionnelle par rapport au placebo. La baisse tensionnelle moyenne induite par cette molécule est plus importante que celle obtenue sous doxazosine ou bisoprolol : elle est supérieure de 4,26 mmHg [IC 95 % : 3,38-5,13].6
Cependant, cette étude a quelques limites. L’absence de majoration des événements indésirables, le choix d’un diurétique (bendrofluméthiazide) moins efficace que l’indapamide ou la chlorthalidone, et le faible niveau de PA des patients avant traitement contrebalancent ses résultats positifs. On peut penser que, si la spironolactone permet de contrôler de nombreux patients, ce ne sera pas la totalité. Dans ce cas, le recours à des traitements non-médicamenteux peut-être envisagé.
Traitement non médicamenteux
Il est envisagé lorsque la PA n’est pas contrôlée sous tri- ou quadrithérapie. Plusieurs possibilités : dénervation rénale, stimulation du barorécepteur carotidien, création d’une fistule iliaque artérioveineuse. Elles sont en cours d’évaluation et pratiquées dans des protocoles de recherche.
La dénervation rénale est la plus étudiée. La procédure d’ablation intra-artérielle consiste à interrompre (par radiofréquence, ultrasons ou neurotoxines) l’innervation sympathique vasculaire, afférente et efférente, dans l’adventice des artères rénales. En effet, le système nerveux sympathique efférent stimule la sécrétion de rénine, augmente la réabsorption rénale de sodium, réduit le débit plasmatique rénal. Les signaux afférents partant du rein contribuent, eux, à la régulation centrale de la PA. Les différentes expériences menées ces dernières années ont fourni des résultats discordants, peut-être liés à l’amélioration technique des cathéters de dénervation, à la standardisation du traitement, à l’observance médicamenteuse, aux techniques de mesure de la PA… L’utilisation de molécules efficaces et à dose optimale permet d’améliorer nettement le contrôle tensionnel et réduit donc l’écart de PA entre le groupe « Traitement médicamenteux » et le groupe « Dénervation », comparativement aux première études où le choix de la thérapeutique était laissé à l’appréciation du médecin.
Dans l’étude française DENERHTN (106 patients suivis 6 mois), la baisse moyenne de la PA systolique en mesure ambulatoire diurne est de 15,8 mmHg dans le groupe dénervation + traitement antihypertenseur optimisé et de 9,9 mmHg dans le groupe contrôle (qui avait la même stratégie médicamenteuse).7
Actuellement, la dénervation rénale est considérée comme une voie de recherche convaincante, mais l’absence de « miracle tensionnel », l’hétérogénéité de la réponse (dont les causes sont en cours d’exploration) et l’évolution rapide du matériel font que cette technique est réservée à des centres spécialisés, au mieux dans des essais contrôlés. Un nouveau protocole est évalué en France.8
La stimulation du barorécepteur carotidien module le système nerveux autonome afin de restaurer l’équilibre sympathico-vagal (baisse des résistances périphériques, de la fréquence cardiaque donc de la PA). Elle est possible grâce à un stimulateur électrique implanté en sous-cutané, relié à une électrode suturée sur le sinus carotidien. De premiers résultats encourageants ont été publiés, et une étude (ESTIM) est en cours en France.
Créer une fistule artério-veineuse fémorale consiste à accoupler l’artère et la veine (en radiologie interventionnelle), ce qui permet au sang de passer du secteur artériel au secteur veineux. Cette stratégie hémodynamique réduit la pression artérielle en baissant la volémie. Efficacité et tolérance à long terme doivent encore être évaluées. l
La dénervation rénale est la plus étudiée. La procédure d’ablation intra-artérielle consiste à interrompre (par radiofréquence, ultrasons ou neurotoxines) l’innervation sympathique vasculaire, afférente et efférente, dans l’adventice des artères rénales. En effet, le système nerveux sympathique efférent stimule la sécrétion de rénine, augmente la réabsorption rénale de sodium, réduit le débit plasmatique rénal. Les signaux afférents partant du rein contribuent, eux, à la régulation centrale de la PA. Les différentes expériences menées ces dernières années ont fourni des résultats discordants, peut-être liés à l’amélioration technique des cathéters de dénervation, à la standardisation du traitement, à l’observance médicamenteuse, aux techniques de mesure de la PA… L’utilisation de molécules efficaces et à dose optimale permet d’améliorer nettement le contrôle tensionnel et réduit donc l’écart de PA entre le groupe « Traitement médicamenteux » et le groupe « Dénervation », comparativement aux première études où le choix de la thérapeutique était laissé à l’appréciation du médecin.
Dans l’étude française DENERHTN (106 patients suivis 6 mois), la baisse moyenne de la PA systolique en mesure ambulatoire diurne est de 15,8 mmHg dans le groupe dénervation + traitement antihypertenseur optimisé et de 9,9 mmHg dans le groupe contrôle (qui avait la même stratégie médicamenteuse).7
Actuellement, la dénervation rénale est considérée comme une voie de recherche convaincante, mais l’absence de « miracle tensionnel », l’hétérogénéité de la réponse (dont les causes sont en cours d’exploration) et l’évolution rapide du matériel font que cette technique est réservée à des centres spécialisés, au mieux dans des essais contrôlés. Un nouveau protocole est évalué en France.8
La stimulation du barorécepteur carotidien module le système nerveux autonome afin de restaurer l’équilibre sympathico-vagal (baisse des résistances périphériques, de la fréquence cardiaque donc de la PA). Elle est possible grâce à un stimulateur électrique implanté en sous-cutané, relié à une électrode suturée sur le sinus carotidien. De premiers résultats encourageants ont été publiés, et une étude (ESTIM) est en cours en France.
Créer une fistule artério-veineuse fémorale consiste à accoupler l’artère et la veine (en radiologie interventionnelle), ce qui permet au sang de passer du secteur artériel au secteur veineux. Cette stratégie hémodynamique réduit la pression artérielle en baissant la volémie. Efficacité et tolérance à long terme doivent encore être évaluées. l
Encadre
2. Substances ou médicaments
➜ Action vasopressive
• Anti-angiogéniques
• Ciclosporine, tacrolimus
• Corticostéroïdes
• Érythropoïétine
• Inhibiteur de CYP17A1 (kétoconazole, abiratérone acétate)
• Estrogènes de synthèse (contraception orale)
• Sympathomimétiques
• Inhibiteurs mixtes de la recapture de la sérotonine et de la noradrénaline : venlafaxine, duloxétine
• Alcool
• Cocaïne, amphétamines
• Herbes (éphédra ou ma huang, contenant de l’éphédrine)
• Réglisse (acide glycyrrhizinique)
➜ Pouvant interférer avec le métabolisme et/ou l’action des antihypertenseurs
• Anti-inflammatoires non stéroïdiens
• Inhibiteurs du CYP3A4 et/ou de la Pgp : jus de pamplemousse, macrolides, antifongiques azolés, antirétroviraux...
références
1. SFHTA; Denolle T, Chamontin B, Doll G, et al. Prise en charge de l’HTA résistante. Décembre 2013. www.sfhta.eu, rubrique HTA en France.
2. Sinnott SJ, Smeeth L, Williamson E, Douglas IJ. Trends for prevalence and incidence of resistant hypertension: population based cohort study in the UK 1995-2015. BMJ 2017;358:j3984.
3. Holmqvist L, Boström KB, Kahan T, et al. Cardiovascular outcome in treatment-resistant hypertension: results from the Swedish Primary Care Cardiovascular Database (SPCCD). J Hypertens 2017;36:402-9.
4. Persu A, Giavarini A, Touzé E, et al. ; ESH Working Group Hypertension and the Kidney. European consensus on the diagnosis and management of fibromuscular dysplasia. J Hypertens 2014;32:1367-78.
5. Aucott L, Poobalan A, Smith WC, et al. Effects of weight loss in overweight/obese individuals and long-term hypertension outcomes: a systematic review. Hypertension 2005;45:1035-41.
6. Williams B, MacDonald TM, Morant S, et al. Spironolactone versus placebo, bisoprolol, and doxazosin to determine the optimal treatment for drug-resistant hypertension (PATHWAY-2): a randomised, double-blind, crossover trial. Lancet 2015;386:2059-68.
7. Azizi M, Sapoval M, Gosse P, et al. Optimum and stepped care standardised antihypertensive treatment with or without renal denerva-tion for resistant hypertension (DENERHTN): a multicentre, open-label, randomised controlled trial. Lancet 2015;385:1957-65.
8. Mauri L, Kario K, Basile J, et al. A multinational clinical approach to assessing the effectiveness of catheter-based ultrasound renal denerva-tion: The RADIANCE-HTN and REQUIRE clinical study designs. Am Heart J 2018;195:115-29.
2. Sinnott SJ, Smeeth L, Williamson E, Douglas IJ. Trends for prevalence and incidence of resistant hypertension: population based cohort study in the UK 1995-2015. BMJ 2017;358:j3984.
3. Holmqvist L, Boström KB, Kahan T, et al. Cardiovascular outcome in treatment-resistant hypertension: results from the Swedish Primary Care Cardiovascular Database (SPCCD). J Hypertens 2017;36:402-9.
4. Persu A, Giavarini A, Touzé E, et al. ; ESH Working Group Hypertension and the Kidney. European consensus on the diagnosis and management of fibromuscular dysplasia. J Hypertens 2014;32:1367-78.
5. Aucott L, Poobalan A, Smith WC, et al. Effects of weight loss in overweight/obese individuals and long-term hypertension outcomes: a systematic review. Hypertension 2005;45:1035-41.
6. Williams B, MacDonald TM, Morant S, et al. Spironolactone versus placebo, bisoprolol, and doxazosin to determine the optimal treatment for drug-resistant hypertension (PATHWAY-2): a randomised, double-blind, crossover trial. Lancet 2015;386:2059-68.
7. Azizi M, Sapoval M, Gosse P, et al. Optimum and stepped care standardised antihypertensive treatment with or without renal denerva-tion for resistant hypertension (DENERHTN): a multicentre, open-label, randomised controlled trial. Lancet 2015;385:1957-65.
8. Mauri L, Kario K, Basile J, et al. A multinational clinical approach to assessing the effectiveness of catheter-based ultrasound renal denerva-tion: The RADIANCE-HTN and REQUIRE clinical study designs. Am Heart J 2018;195:115-29.

 Encadrés
Encadrés