L’hydrocéphalie à pression normale (HPN), dorénavant nommée « hydrocéphalie chronique de l’adulte », est une entité clinique définie en 1965 par Raymond D. Adams et Salomon Hakim.1
Elle est une cause potentiellement réversible de troubles de la marche. Le diagnostic reste difficile à poser et requiert un faisceau d’arguments cliniques, radiologiques et hydrodynamiques. Les patients susceptibles d’avoir une HPN idiopathique sont souvent âgés et polypathologiques ; plusieurs diagnostics différentiels peuvent être évoqués.
L’objectif ici est de pouvoir classer les patients selon la probabilité qu’ils aient une HPN : diagnostic probable, possible ou improbable, en utilisant le triptyque clinique-imagerie-bilan de la marche après ponction lombaire évacuatrice et/ou test de perfusion. Le traitement consiste à poser une dérivation permanente du liquide céphalo-rachidien chez des patients minutieusement sélectionnés.
Incidence et physiopathologie
Il est probable que l’HPN idiopathique soit sous-diagnostiquée, surtout lorsqu’elle est associée à d’autres pathologies neurodégénératives ou neurovasculaires. L’incidence dépend de l’âge : de 0,2 % entre 70 et 79 ans, elle dépasse 5,9 % au-delà de 80 ans.2
La physiopathologie reste mal connue ; l’hypothèse du vieillissement des villosités arachnoïdiennes est délaissée. Les tests de perfusion ont démontré que la résistance à l’écoulement du liquide céphalo-rachidien est augmentée dans l’HPN,3 probablement par augmentation des résistances vasculaires. Un lien a été identifié avec l’hypertension artérielle, le syndrome d’apnées du sommeil et le diabète.4 La découverte récente des réseaux glymphatiques et lymphatiques méningés pourrait améliorer notre compréhension de la physiopathologie.
Quand suspecter une HPN ?
La triade d’Adams et Hakim, associant troubles de la marche, troubles cognitifs et troubles urinaires, est typique mais non pathognomonique.
Le tableau est monosymptomatique dans deux tiers des cas, souvent dominé par les troubles de la marche. Le début est insidieux et les troubles peuvent se décompenser après un épisode intercurrent (anesthésie générale, fracture du col du fémur ou chirurgie du rachis).
Troubles de la marche et de l’équilibre
Les troubles de la marche sont présents dans 95 % des HPN. Le plus souvent, les patients se plaignent initialement de quelques troubles de l’équilibre, puis de chutes isolées. Apparaît ensuite un trouble d’initiation de la marche (« freezing »), puis une marche aimantée, à petits pas, avec un élargissement du polygone de sustentation et une tendance à la rétropulsion. Ce tableau est parfois appelé « apraxie de la marche ». La richesse des symptômes contraste avec un examen clinique pauvre. Il est à noter que les patients ayant un trouble moteur isolé ou prédominant sont ceux qui voient leur état s’améliorer le plus après la mise en place d’une dérivation du liquide céphalo-rachidien.
Troubles psycho-intellectuels et cognitifs
Ces troubles sont plutôt cognitifs sous-corticaux que démentiels. La fatigabilité mentale et la lenteur idéatoire sont significatives. L’orientation temporelle et spatiale, les potentiels mnésiques et les rétentions d’apprentissage sont souvent altérés. La dépression est plutôt réactionnelle au début des troubles et peut les masquer.
Certains symptômes doivent orienter vers d’autres diagnostics de démence : troubles du langage, hallucinations, agnosie, oublis non améliorés par l’indiçage…
Les troubles cognitifs, à l’exception de la fatigabilité mentale, sont peu améliorés après la dérivation du liquide céphalo-rachidien.
Troubles sphinctériens
Ils sont essentiellement mictionnels, à type d’impériosités et d’incontinence urinaire. Ils touchent 60 à 75 % des patients. Il est nécessaire d’éliminer une cause urologique, qui pourrait expliquer ces symptômes ou les aggraver.
Quels examens réaliser devant une suspicion d’HPN ?
L’imagerie de référence est l’IRM cérébrale ; elle permet d’éliminer les diagnostics différentiels et d’obtenir une analyse morphologique et vélocimétrique.
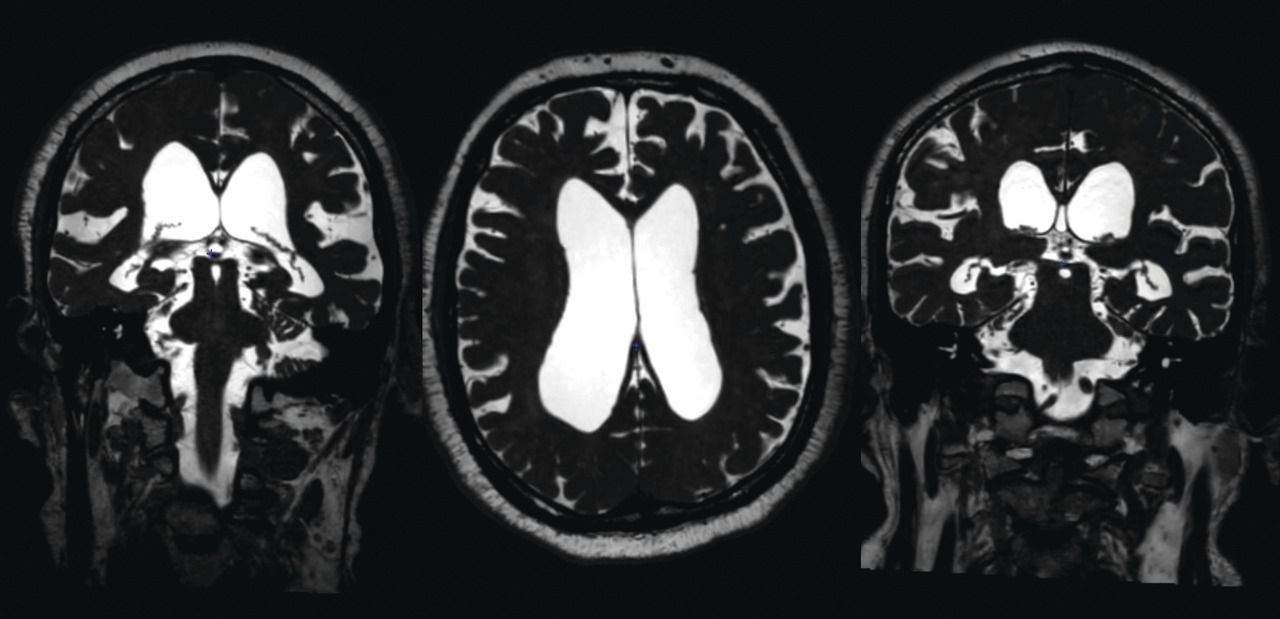
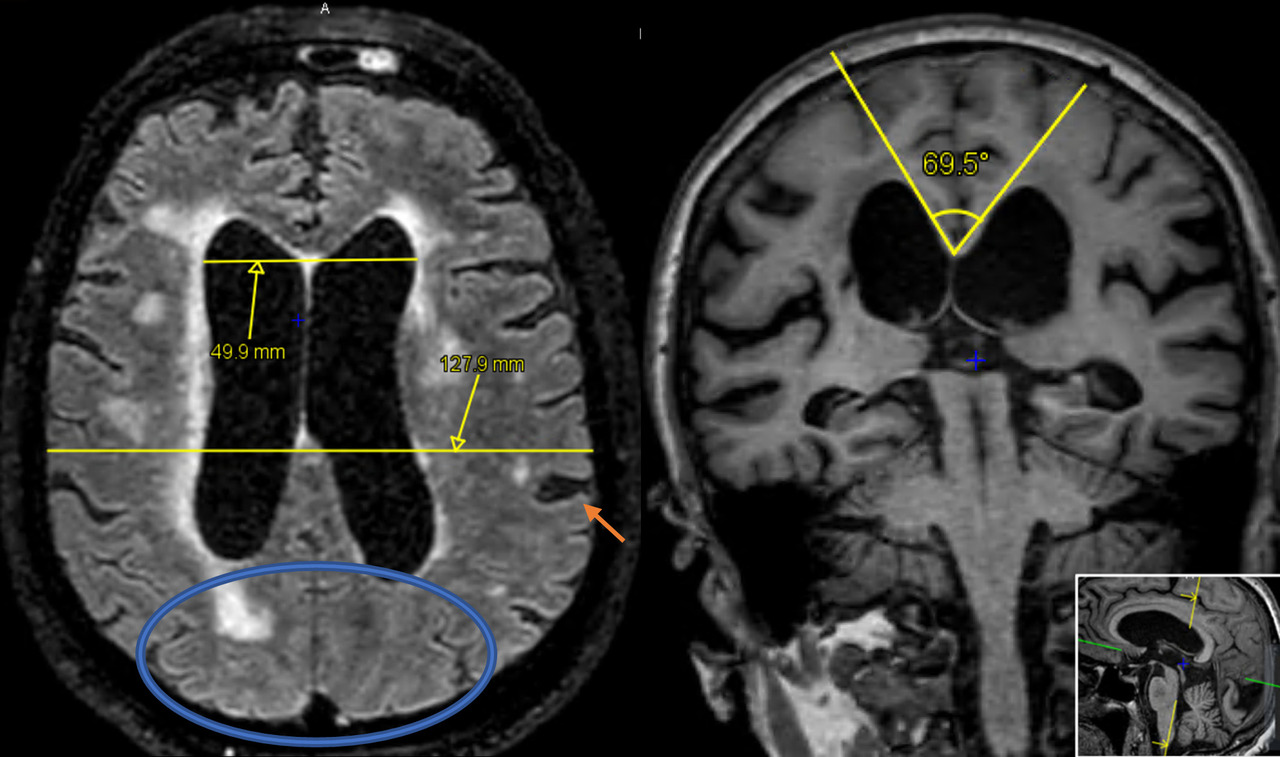
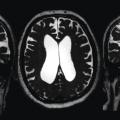
Le signe le plus important est la ventriculomégalie objectivée par l’indice d’Evans (rapport entre le diamètre interne maximal des cornes frontales et le diamètre interne maximal du crâne, sur la même coupe axiale) [fig. 1].
Des sillons de la convexité médiane étroits, des dilatations focales des sillons de la convexité et un angle calleux aigu inférieur à 90 ° (fig. 1)5 constituent les autres signes radiologiques pertinents.
Complétant les séquences morphologiques, une IRM de flux permet de mesurer la vitesse et la pulsatilité du liquide céphalo-rachidien, qui sont élevées dans l’HPN.
Bien qu’il n’existe pas de critères diagnostiques définitifs, un score IRM a été développé il y a quelques années afin de regrouper les signes évocateurs ; il permet de prédire le pronostic après traitement (tableau 1).5
Quels tests complémentaires pour aider au diagnostic ?
Devant une clinique évocatrice et une IRM compatible avec une HPN, les deux tests les plus fréquemment réalisés sont la ponction lombaire (PL) évacuatrice et le test de perfusion.
Il est aussi utile de réaliser un bilan neuropsychologique visant à dépister un trouble mental passé inaperçu et mesurer quantitativement les troubles avant et après traitement.
Les bilans sont réalisés en hospitalisation courte avec évaluation de la marche avant et après PL, IRM de flux, bilan neuropsychologique, PL évacuatrice et/ou test de perfusion.
Ponction lombaire soustractive
Elle a deux rôles :
- éliminer les diagnostics différentiels par la recherche du nombre de cellules dans le liquide céphalo-rachidien, d’une glycorachie, d’une protéinorachie et des marqueurs de la maladie d’Alzheimer ;
- simuler l’effet de la dérivation.
La pression d’ouverture est dite normale entre 60 et 240 mmH2O. Le drainage de 30 à 50 mL a un intérêt prédictif. L’amélioration clinique, notamment des troubles de la marche, est corrélée à une amélioration après dérivation du liquide céphalo-rachidien.3,6,7
Il est primordial d’obtenir une analyse objective filmée de la marche entre deux repères fixes, avant et après évacuation du liquide céphalo-rachidien. En pratique, le nombre de pas et la vitesse de marche sont mesurés sur une distance de 10 mètres.
L’intérêt prédictif de la PL évacuatrice se situe entre 60 et 73 %, mais sa sensibilité est faible puisque 30 % des patients non améliorés par la PL le sont quand même par la dérivation.
Tests hydrodynamiques
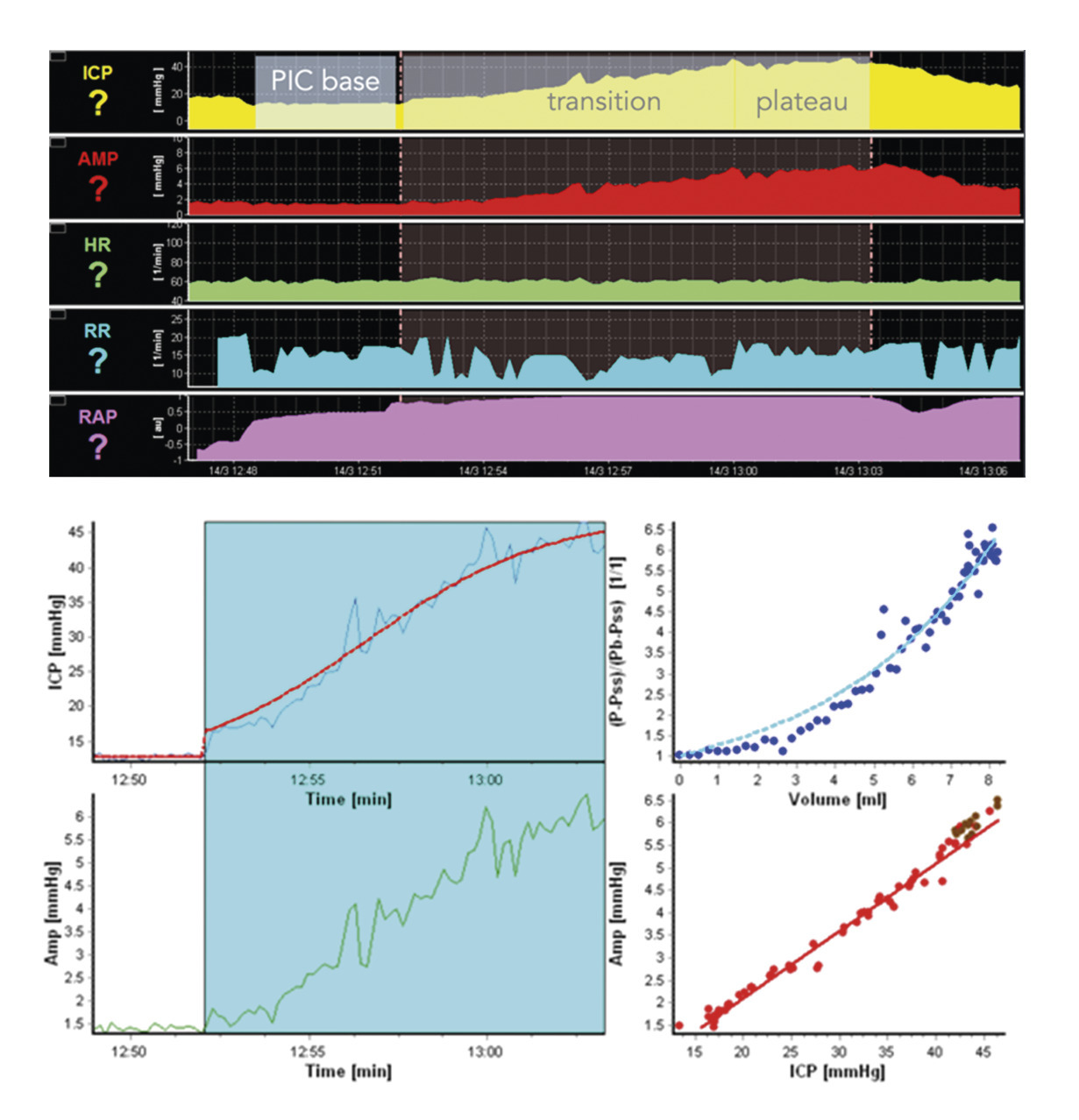
Le test de perfusion permet de combiner une PL évacuatrice à une mesure objective de la résistance à l’écoulement du liquide céphalo-rachidien. Sa sensibilité est meilleure que celle de la PL seule, et la valeur prédictive positive est supérieure à 80 %.8
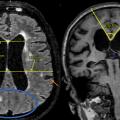
Une PL est réalisée avec mesure de la pression d’ouverture. Dans un second temps, une perfusion de sérum physiologique est administrée avec mesure continue concomitante de la pression, qui augmente jusqu’à atteindre une phase plateau. La différence entre la pression de départ et la pression de plateau ainsi que la vitesse de perfusion permet de calculer la résistance à l’écoulement du liquide céphalo-rachidien (fig. 2). À la fin du test, une évacuation de 50 mL est réalisée.
Critères diagnostiques : une classification aidante
Identifier les patients ayant une HPN idiopathique et qui tireront un bénéfice du traitement chirurgical peut s’avérer difficile.
Plusieurs auteurs ont proposé de classer les patients en trois groupes : HPN idiopathique probable, possible et improbable (tableau 2).
Quel traitement pour l’HPN ?
À ce jour, il n’existe aucun traitement médical efficace. Il n’y a pas d’indication à l’acétazolamide ni aux diurétiques.
Le seul traitement est chirurgical, avec la pose d’une dérivation interne du liquide céphalo-rachidien.
Qui peut bénéficier d’une dérivation ?
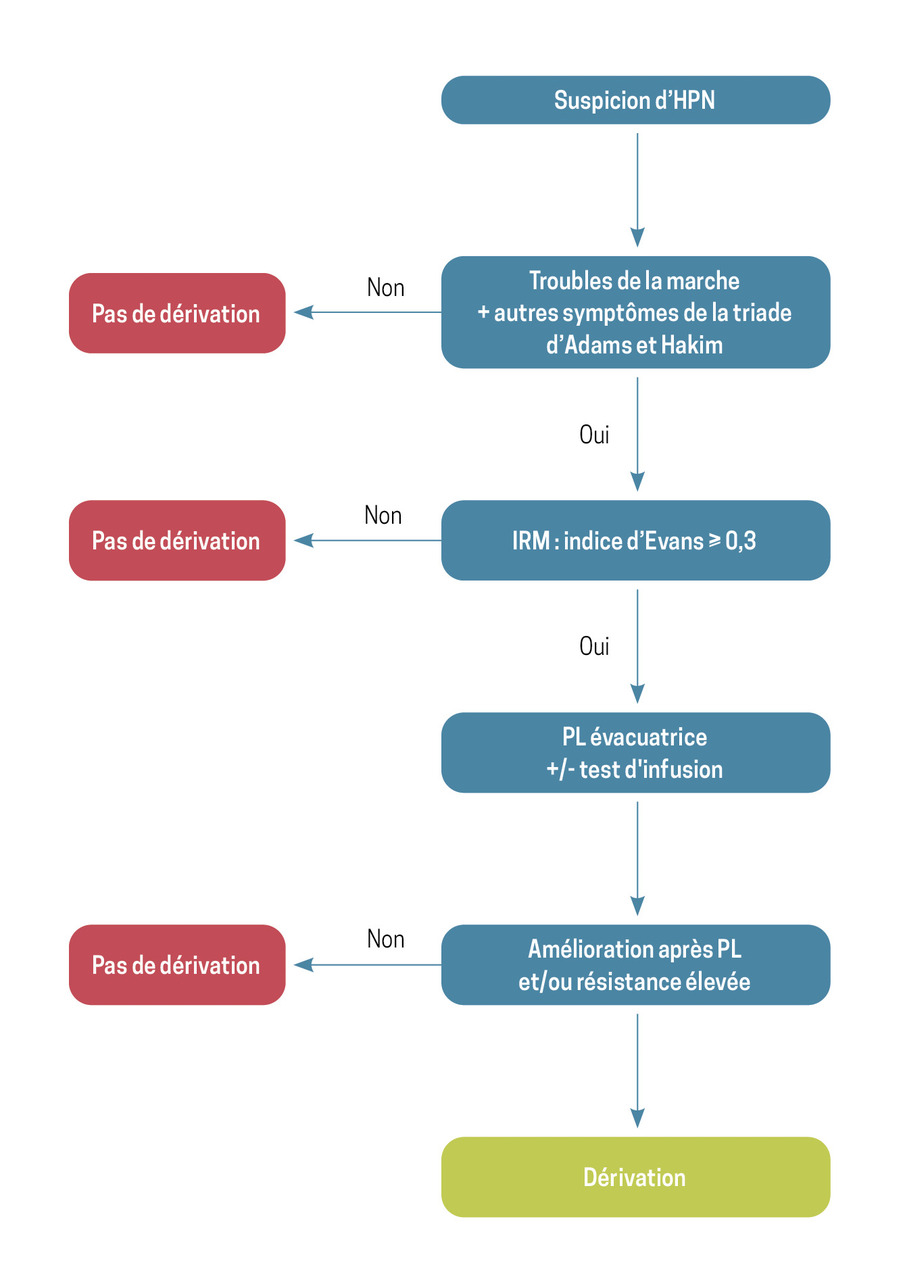
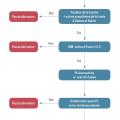
Selon la classification détaillée dans le tableau 2, une dérivation est proposée aux patients classés en « HPN probable » et à ceux classés en « HPN possible » avec un test de perfusion positif.9 Une aide à la décision est proposée dans la fig. 3.
Il s’agit des patients qui ont une triade d’Adams et Hakim prédominant sur les troubles de la marche, une IRM typique (ventriculomégalie, angle calleux fermé, sillons étroits, peu d’atteinte de la substance blanche) et une bonne réponse à la PL évacuatrice et/ou une résistance à l’écoulement du liquide céphalo-rachidien élevée.
Dérivation ventriculo-atriale ou ventriculo-péritonéale
La dérivation permet d’évacuer le liquide céphalo-rachidien depuis les ventricules vers l’oreillette droite ou la cavité abdominale.
Le cathéter implanté dans le carrefour ventriculaire est connecté à une valve placée derrière l’oreille.
Il existe plusieurs types de valves. Les plus couramment utilisées sont réglables et permettent d’adapter au besoin la pression de la valve et le débit de drainage, apportant une solution aux problèmes d’hyperdrainage (hypotension intracrânienne, collections, voire hématomes sous-duraux) ou de drainage insuffisant.
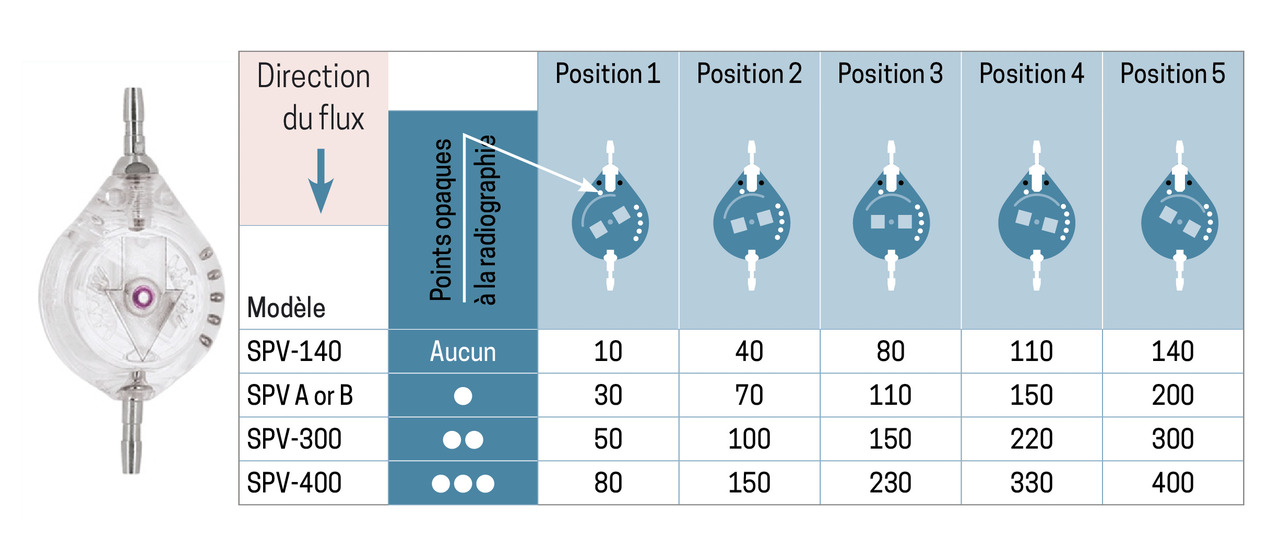
Il est important de souligner que même les valves réglables de dernière génération peuvent se dérégler lors d’une IRM cérébrale ou cervicale, d’où l’intérêt de réaliser une radiographie du crâne de profil après chaque IRM. Le réglage des valves est facilement identifiable sur les radiographies (fig. 4) ; une consultation en neurochirurgie doit être rapidement organisée en cas de doute sur un déréglage.
Le cathéter distal est tunnelisé en sous-cutané, puis introduit dans la veine jugulaire ou dans le péritoine. Le choix du site d’implantation distale dépend de plusieurs facteurs : un antécédent de chirurgie abdominale prédispose à un risque d’obstruction du cathéter par des brides ; une hypertension artérielle pulmonaire, une veine jugulaire thrombosée ou la présence d’une valve cardiaque mécanique contre-indiquent la pose d’un cathéter atrial.
La dérivation est une intervention de routine qui se fait au cours d’une hospitalisation de vingt-quatre heures, parfois même en ambulatoire. Les complications varient entre 3 et 10 %, les plus fréquentes étant : un saignement peropératoire, une infection du matériel, un dysfonctionnement mécanique (déconnexion, migration) et un dysfonctionnement hydrodynamique (céphalées d’hypotension intracrânienne, hématomes sous-duraux d’hyperdrainage).
Pronostic
À un an de la dérivation, 69 % des patients ont une amélioration marquée du score de Rankin modifié (tableau 3), et la proportion de patients capables de mener une vie en autonomie passe de 53 % avant la chirurgie à 82 %.6 Il est toutefois important de noter que les patients ont principalement une amélioration de la marche (jusqu’à 93 %) mais presque deux fois moins d’amélioration des symptômes cognitifs et de l’incontinence urinaire.
Des troubles de la marche prédominants, pas ou peu d’incontinence urinaire, peu de troubles cognitifs, une pulsatilité élevée du liquide cérébro-spinal dans l’aqueduc, peu ou pas de lésions de la substance blanche profonde, une résistance au flux de liquide céphalo-rachidien supérieure à 18 mmHg et une franche amélioration à la ponction lombaire sont des facteurs de bon pronostic.
Les patients qui s’améliorent le moins après chirurgie sont ceux ayant des troubles cognitifs prédominants ou inauguraux, une atrophie cérébrale majeure associée à la dilatation ventriculaire, une atteinte extensive de la substance blanche ou ceux opérés tardivement.
L’HPN survient surtout chez des patients âgés ; d’autres comorbidités peuvent donc apparaître avec le temps, limitant l’efficacité secondaire de la dérivation.
Quel suivi pour les patients porteurs d’une dérivation ?
Une consultation postopératoire est prévue à deux mois avec un scanner cérébral. Le neurochirurgien vérifie la cicatrisation, l’absence de céphalées d’hyperdrainage et de complications hémorragiques, et il évalue l’amélioration de la marche.
En l’absence d’amélioration, il peut procéder au réglage de la valve ; plusieurs tentatives de réglages peuvent être nécessaires avant de trouver la pression de la valve qui convient le mieux au patient.
Quand la pression cible est atteinte, le patient est revu à un an avec une IRM cérébrale, puis tous les deux à trois ans. L’IRM cérébrale de contrôle permet une analyse morphologique (les sillons de la convexité réapparaissent et l’angle calleux s’ouvre) et vélocimétrique (la vitesse du liquide céphalo-rachidien dans l’aqueduc diminue). Le volume ventriculaire varie peu après une dérivation, ce n’est donc pas un critère utile pour juger de l’efficacité de l’intervention.
Que dire à vos patients ?
Le contrôle de l’HTA et du diabète ainsi que l’appareillage pour le syndrome d’apnées obstructives du sommeil (SAOS) permettent de diminuer le risque cardiovasculaire, le risque cérébrovasculaire et probablement celui d’hydrocéphalie à pression normale.
Les troubles de l’équilibre et de la marche ne sont pas une fatalité chez la personne âgée, certains sont d’ailleurs réversibles.
L’association Tête en l’air propose plusieurs ressources en ligne concernant l’hydrocéphalie (enfant et adulte) ainsi que des informations et des conseils pour la vie quotidienne des patients porteurs de valves (https ://teteenlair.asso.fr/ hydrocephalie)
L’application pour smartphones HydroApp permet d'aider les patients porteurs d’une dérivation pour le suivi de leur pathologie.
2. Jaraj D, Rabiei K, Marlow T, et al. Prevalence of idiopathic normal-pressure hydrocephalus. Neurology 2014;82(16):1449-54.
3. Caire F, Moreau JJ. Méthode et résultats du test de perfusion dans l’hydrocéphalie à pression normale : revue de la littérature. Rev Neurol 2010;166(5):494-501.
4. Jaraj D, Agerskov S, Rabiei K, et al. Vascular factors in suspected normal pressure hydrocephalus: A population-based study. Neurology 2016;86(7):592-9.
5. Shinoda N, Hirai O, Hori S, et al. Utility of MRI-based disproportionately enlarged subarachnoid space hydrocephalus scoring for predicting prognosis after surgery for idiopathic normal pressure hydrocephalus: clinical research. J Neurosur 2017;127(6):1436-42.
6. Klinge P, Hellström P, Tans J, et al. One-year outcome in the European multicentre study on iNPH. Acta Neurol Scand 2012;126(3):145-53.
7. Nakajima M, Yamada S, Miyajima M, et al. Guidelines for Management of Idiopathic Normal Pressure Hydrocephalus (Third Edition): Endorsed by the Japanese Society of Normal Pressure Hydrocephalus. Neurol Med Chir (Tokyo) 2021;61(2):63-97.
8. Beck J, Fung C, Ulrich CT, et al. Cerebrospinal fluid outflow resistance as a diagnostic marker of spontaneous cerebrospinal fluid leakage. J Neurosurg Spine 2017;27(2):227-34.
9. Meier U, Lemcke J. Diagnostic methods of normal- pressure hydrocephalus. Schweiz Arch Neurol Psychiatr 2007;158:139-49.

 Encadrés
Encadrés