Argumenter les principales hypothèses diagnostiques et justifier les examens complémentaires pertinents.
Identifier les situations d’urgence et planifier leur prise en charge.
Introduction
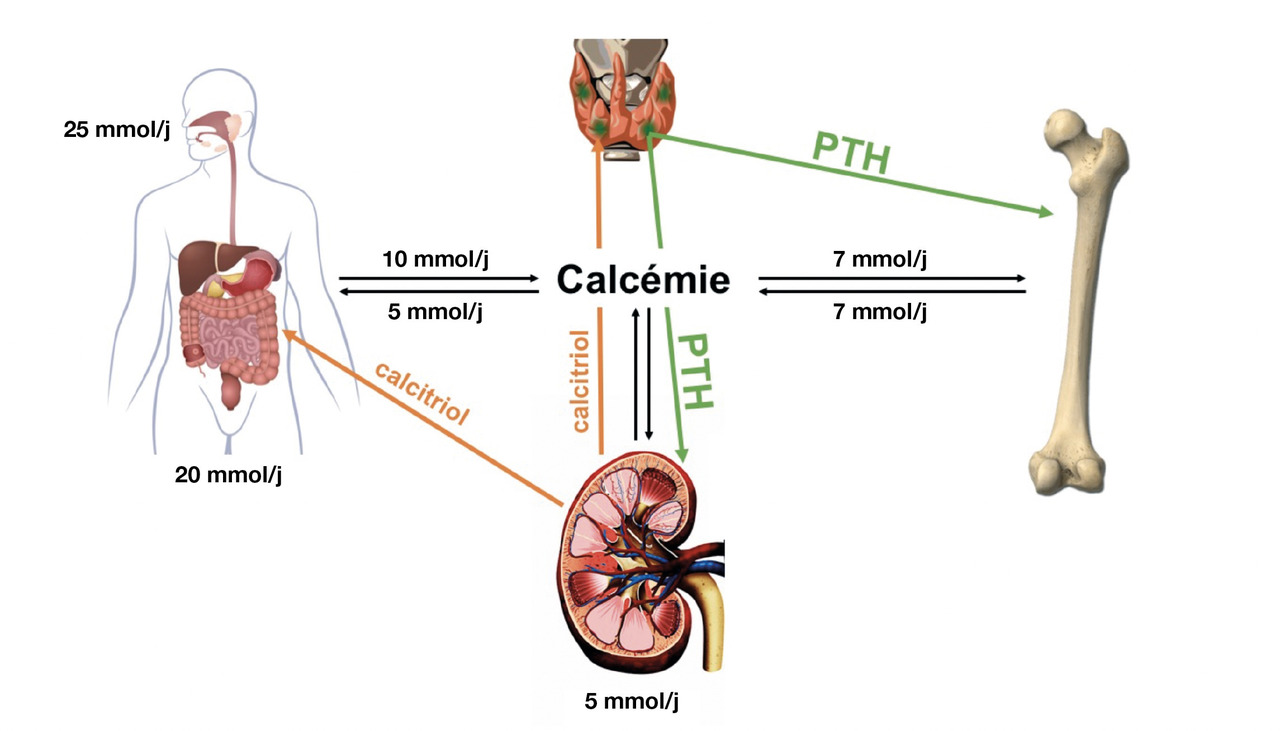
Maintien de la calcémie : rappels physiologiques (fig. 1)
La concentration extracellulaire de calcium libre (dit « ionisé ») est captée en continu par le récepteur membranaire sensible au calcium (CaSR), présent à la surface des cellules parathyroïdiennes. Lors d’une diminution (même infime) de la calcémie, les cellules libèrent plus de PTH dans la circulation ; et inversement, lors d’une augmentation (même infime) de la calcémie. La PTH agit directement sur le rein, via son récepteur PTHR1, en augmentant l’hydroxylation de la vitamine D (tubule proximal) en calcitriol, en augmentant la réabsorption de calcium (anse de Henle et tube contourné distal) et en diminuant celle de phosphate (tubule proximal). Le calcitriol agit, d’une part, sur le tube digestif où il augmente l’absorption à la fois de calcium et de phosphate et, d’autre part, sur le rein, où il potentialise les effets rénaux de la PTH. Par ailleurs, le calcitriol exerce un rétrocontrôle négatif sur la sécrétion (et la synthèse) de PTH au niveau des glandes parathyroïdes. Sur l’os, la PTH stimule le remodelage (l’ostéoformation et l’ostéorésorption). À l’âge adulte, la balance nette osseuse est normalement nulle : l’os libère autant de calcium qu’il n’en capte. À l’état stable, la calciurie reflète les entrées de calcium dans ce système, principalement digestives.
Qu’est-ce qu’une hypercalcémie ?
À noter, comme la plupart des paramètres de biochimie, les valeurs normales sont établies chez des sujets sains à jeun, le matin. Par ailleurs, chaque laboratoire établit ses propres « normes » en fonction des caractéristiques spécifiques de ses appareils de mesure. On retiendra, cependant, qu’il faut évoquer une hypercalcémie devant une concentration circulante de calcium total > 2,55 mmol/L et/ou de calcium ionisé > 1,32 mmol/L.
Quelles causes créent et/ou entretiennent une hypercalcémie ? (tableau 1)
Causes dépendantes de la PTH
Plus rare, l’hypercalcémie hypocalciurique familiale (HHF) est une maladie génétique autosomique dominante des gènes (dont celui codant pour CaSR) de la relation calcémie-sécrétion de PTH : comme le CaSR est exprimé par les cellules parathyroïdiennes et celles de l’épithélium rénal, la relation calcémie-sécrétion de PTH est décalée vers l’hypercalcémie, qui constitue alors un état d’équilibre « physiologique » pour ces patient(e)s. De ce fait, ils sont le plus souvent asymptomatiques et développent peu (voire pas) de complications osseuses ou rénales.
À part, les traitements prolongés par sels de lithium (comme au cours des troubles de l’humeur) entraînent des anomalies de la relation calcémie-sécrétion de PTH. Après plusieurs années de traitement, la présentation biologique est initialement proche de celle de la HHF (hypercalcémie + PTH dans l’intervalle des valeurs normales + calciurie basse) avant de se rapprocher, plus tard, de celle de la pHPT.
Causes indépendantes de la PTH
Un des cas les plus fréquents est alors la présence anormale d’une molécule qui partage une homologie de séquence peptidique avec la PTH : le PTH related peptide ou « PTHrp ». Il est présent à l’état physiologique au cours de la grossesse et de l’allaitement mais aussi en tant qu’agent auto-/paracrine dans le tissu dentaire et cutané (pour contrôler la croissance des poils et des cheveux). Certaines tumeurs (solides ou hématologiques) sécrètent de façon ectopique ce PTHrp (± d’autres peptides ayant une séquence proche) et sont alors accompagnées d’un syndrome paranéoplasique dont le phénotype biologique est proche de celui de la pHPT (activant PTHR1) : une hypercalcémie (mais sans hypercalcitriolémie), une hypercalciurie et une augmentation de la résorption osseuse. On parle alors d’« hypercalcémies humorales des cancers » (HHC) : elles représentent environ 80 % des causes d’hypercalcémie au cours des cancers.
Certains cancers, notamment le myélome multiple, peuvent sécréter des cytokines (ligand RANK, par exemple) ayant une action indépendante du PTHR1 rénal et/ou du PTHrp n’agissant que localement sur la résorption osseuse. Ils peuvent aussi infiltrer directement le tissu osseux et en libérer son contenu comme en cas de métastases (des cancers à tropisme osseux) ou par la présence de géodes (myélome multiple). Ces causes sont regroupées sous le terme « lyse osseuse » et représentent 20 % des hypercalcémies des cancers. Comme l’os contient du calcium et du phosphate, la calcémie et la phosphatémie augmentent, de même que la calciurie et la phosphaturie. Sans rapport avec les cancers, l’os peut libérer des quantités importantes de calcium lors d’immobilisations prolongées : il s’agit ici d’un diagnostic d’exclusion dont les mécanismes sont mal compris.
Lors d’une augmentation du calcitriol par augmentation de sa production et/ou diminution de sa dégradation, on parle de « formes vitamine D-dépendantes ». L’augmentation de la production est le plus souvent le fait d’une expression ectopique de 1a-hydroxylase (l’enzyme rénale qui active la vitamine D native en calcitriol) par des granulomes, qu’ils soient tumoraux (lymphomes), infectieux (tuberculose) ou inflammatoires (sarcoïdose). Une forme beaucoup plus rare est liée à une anomalie du gène CYP24A1 responsable de la production de l’enzyme (rénale aussi) chargée d’inactiver le calcitriol : dans ce cas, l’hypercalcémie est intermittente. Enfin, les apports pharmacologiques de vitamine D native (ergo- ou cholécalciférol) et/ou ses dérivés actifs (alfacalcidol ou calcitriol) peuvent entraîner des hypercalcémies lorsqu’ils sont utilisés à doses supraphysiologiques. Dans tous ces cas, l’hypercalcémie est due à une augmentation de l’absorption intestinale de calcium, qui est accompagnée d’une augmentation de celle de phosphate.
Parmi les autres intoxications, il existe la rare possibilité de l’administration de doses supraphysiologiques de calcium par voie orale ou intraveineuse. Le « syndrome des buveurs de lait », observé quasi exclusivement chez les patients avec insuffisance rénale, associe une alcalose métabolique. Enfin, il faut retenir que l’hyperthyroïdie, l’intoxication par la vitamine A et d’autres rares endocrinopathies (comme l’acromégalie ou le phéochromocytome) peuvent entraîner des hypercalcémies. À part, les diurétiques thiazidiques augmentent la réabsorption du calcium (principalement au niveau du tubule proximal) mais ne génèrent pas en eux-mêmes d’hypercalcémie, tout au plus ils révèlent une pHPT.
Signes cliniques évocateurs d’une hypercalcémie
À noter, le plus souvent, l’hypercalcémie est diagnostiquée fortuitement, donc en l’absence de signes cliniques très évocateurs, et c’est l’interrogatoire a posteriori qui retrouvera les signes suivants.
Urgence absolue : le cœur
Urgence relative : les signes neuropsychiques
Chronicité
Quels examens complémentaires réaliser lors d’une hypercalcémie ?
En premier lieu, évaluer le degré d’urgence
Suivre un raisonnement physiopathologique
- une calcémie (l’hypercalcémie doit être confirmée au moment des explorations) ;
- une mesure de la concentration de calcium ionisé ou de la protidémie (voire l’albuminémie) dans les situations douteuses ;
- une mesure de la concentration de PTH circulante : compte tenu de sa durée de vie (très courte) dans la circulation, elle doit être concomitante de la mesure de la calcémie ;
- la phosphatémie est un élément qui permet d’orienter le diagnostic, notamment dans les calcémies PTH-indépendantes ;
- la créatininémie permet d’évaluer le retentissement rénal et le terrain ;
- la calcitriolémie n’est pas indispensable en première intention mais peut être utile dans les hypercalcémies PTH-indépendantes ;
- la calciurie est un élément diagnostique important des hypercalcémies PTH-dépendantes : on préférera la calciurie des 24 heures (associée à la créatininurie pour s’assurer d’un recueil urinaire complet). Cela dit, lorsque le recueil des 24 heures est difficile (voire impossible), une analyse sur échantillon (de préférence le matin à jeun) peut orienter.
- les marqueurs de remodelage osseux (ostéorésorption et ostéoformation) sanguins ou urinaires peuvent être utiles, mais ne relèvent pas de la première intention ;
- la concentration circulante de PTHrp est disponible dans peu de laboratoires en France, et sa performance est faible : nombreux faux négatifs (le peptide sécrété par les tumeurs n’est pas toujours entier) et faux positifs (en cas d’insuffisance rénale, les fragments mesurés s’accumulent) ;
- l’AMPc dit « néphrogénique » est le second messager de l’action de PTHR1 et peut être mesuré grâce à un ratio entre l’excrétion urinaire et sa concentration plasmatique. Malheureusement, elle n’est disponible que dans certains centres experts en France.
Imagerie
À part, l’imagerie des parathyroïdes (scintigraphie, échographie, scanner 4D, voire IRM) ne doit être envisagée que si une prise en charge chirurgicale est prévue pour guider le geste : en aucun cas, ces examens ne permettent de confirmer (ou infirmer) un diagnostic de pHPT.
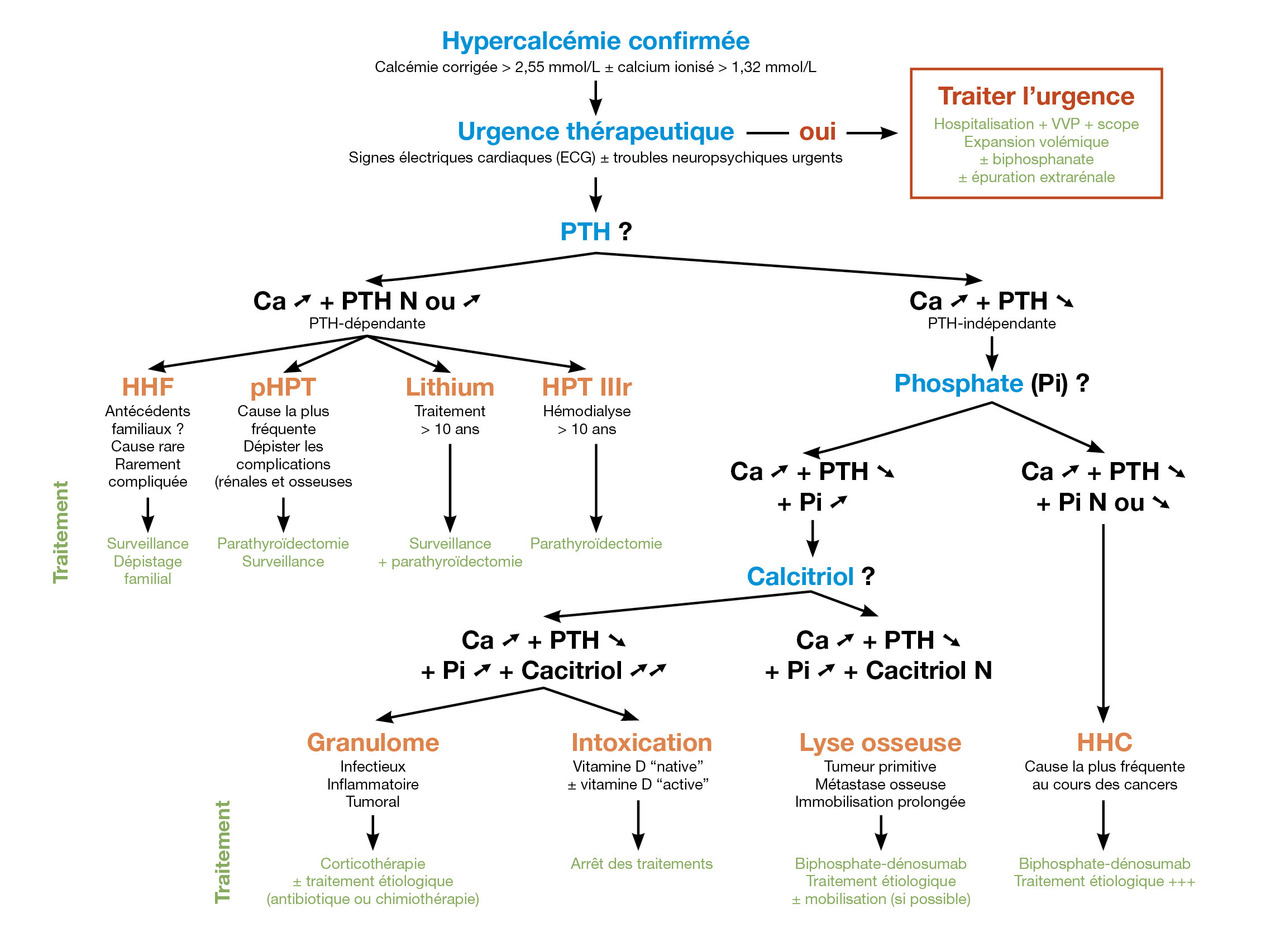
Démarche diagnostique face à une hypercalcémie non menaçante (fig. 2)
Dans le cadre d’une hypercalcémie PTH-dépendante, l’interrogatoire permettra d’éliminer la prise de sels de lithium et de chercher des antécédents familiaux. La mesure de la calciurie orientera vers une HHF si elle est basse. Dans le cas contraire, une pHPT est très probable. À noter, il existe des pièges diagnostiques (comme l’insuffisance rénale même modérée et/ou la prise de diurétiques) qu’il faut savoir prendre en compte. En cas de doute, une analyse moléculaire (génétique) et un recours à un centre expert sont recommandés.
Dans le cadre d’une hypercalcémie PTH-indépendante, la phosphatémie est un élément fortement évocateur : si elle est basse, elle oriente vers une hypercalcémie humorale des cancers ; si elle est élevée, il s’agit soit d’une forme vitamine D-dépendante soit d’une lyse osseuse. Le contexte est, ici, le plus souvent évocateur, mais il doit être étayé par la démarche physiopathologique. À noter, les patients ayant un myélome multiple ou une granulomatose (volontiers âgés) sont aussi ceux qui sont les plus à même d’avoir une pHPT.
Traitement
En cas d’urgence cardiaque et/ou neuropsychique
En l’absence d’urgence
Le seul traitement curatif de la pHPT est la parathyroïdectomie, qui est le plus souvent réalisée sans urgence. Un traitement par calcimimétique (mimant l’effet du calcium sur le CaSR) peut être proposé chez les patients qui ne peuvent être opérés, mais il n’existe pas de bénéfice (osseux ou rénal) à long terme. À noter, si l’hypercalcémie est modérée et bien tolérée, les apports calciques journaliers (ainsi que la supplémentation orale en vitamine D, le cas échéant) peuvent être maintenus identiques à ceux de la population générale. Les diètes pauvres en calcium ne modifient que peu la calcémie et sont à risque d’accélérer la déminéralisation osseuse. L’arrêt des sels de lithium ne permet pas de corriger l’hypercalcémie : leur poursuite ne doit donc être guidée que par l’intérêt de la prise en charge psychiatrique. Il n’existe pas de traitement spécifique des hypercalcémies humorales des cancers.
Dans le cas des hypercalcémies humorales des cancers et des lyses osseuses, il faut évidemment traiter le cancer initial, mais les biphosphonates, voire le dénosumab (anticorps monoclonal inhibant le ligand RANK) peuvent être utilisés. Les corticoïdes peuvent être utiles dans le cadre des hypercalcémies vitamine D-dépendantes et permettent dans tous les cas de diminuer l’absorption intestinale de calcium et de phosphate, mais leurs effets indésirables à court et long termes doivent être pris en compte avant de les initier.
POINTS FORTS À RETENIR
L’hyperparathyroïdie primitive est très fréquente (1re cause dans la population générale), même chez les patients ayant un cancer.
La prise en charge ne repose pas sur une valeur absolue de calcémie mais sur son retentissement, faisant redouter une complication aiguë (cardiaque ou neurologique) ou chronique (osseuse ou rénale).
L’hydratation parentérale par chlorure de sodium isotonique est le plus souvent la première ligne de traitement à mettre en œuvre dans le cadre d’une hypercalcémie nécessitant une hospitalisation (menaçante et/ou compliquée).
La prise en charge thérapeutique d’une hypercalcémie chronique, au mieux décidée de façon collégiale, dépend de la cause et des complications (déjà établies ou à prévenir).
Hypercalcémie
L’hypercalcémie est un item de choix pour un dossier multidisciplinaire progressif : regroupant à la fois des notions d’endocrinologie et de néphrologie, les causes peuvent être carcinologiques ou toxiques et les complications cardiaques, neurologiques, urinaires et osseuse surtout chez le patient âgé.
Les questions relatives au diagnostic seront certainement centrées sur l’identification des « fausses » hypercalcémies mais aussi et surtout sur la démarche : penser à mesurer la concentration circulante d’hormone parathyroïdienne, de façon concomitante à chaque hypercalcémie ! Une hypercalcémie à 3,0 mmol/L devra certainement faire retenir un degré d’urgence et il est très peu probable qu’elle soit fausse : il ne sera donc pas indispensable d’en attendre une « confirmation par la mesure du calcium ionisé ». Les deux causes à toujours avoir en tête sont l’hyperparathyroïdie primitive (très fréquente et qui peut se présenter sous de très multiples formes) et les hypercalcémies des cancers : le syndrome paranéoplasique par sécrétion de PTHrp est un classique, tout comme le myélome multiple révélé par une hypercalcémie et une insuffisance rénale. Cela dit, il ne faut pas oublier que l’hyperparathyroïdie primitive est très fréquente chez les patients qui ont un myélome multiple osseux.
Dans la prise en charge, il sera souvent demandé de vérifier l’absence de retentissement cardiaque et/ou neurologique mais aussi rénal et osseux. Il faut faire attention à ne pas non plus proposer une parathyroïdectomie chez un patient grabataire dont l’espérance de vie est courte, même s’il s’agit d’une hyperparathyroïdie primitive compliquée : la balance bénéfice-risque doit toujours être évaluée au cas par cas. L’imagerie parathyroïdienne peut faire débat mais le consensus actuel (rappelé par la Société française d’endocrinologie) est qu’elle n’est indiquée que pour la localisation d’une (ou plusieurs tumeurs) si une chirurgie est envisagée : ceci sous-entend que le diagnostic positif d’hyperparathyroïdie primitive a déjà été retenu et que le patient est opérable. Cette notion doit être retenue en particulier s’il s’agit d’un dossier d’une hyperparathyroïdie familiale et/ou s’il s’agit d’une récidive.
Un dossier avec une sarcoïdose peut tout à fait se présenter initialement par une hypercalcémie et faire discuter les diagnostics différentiels. Il reste cependant peu probable qu’une cause infectieuse de granulome (comme la tuberculose ou la lèpre) soit abordée compte tenu, de nos jours, de leur rareté. Les traitements pharmacologiques à garder en tête sont les bisphosphonates et le denosumab (pour les cancers uniquement) ainsi que les corticoïdes systémiques.
2. Bollerslev J, Pretorius M, Heck A. Parathyroid Hormone Independent Hypercalcemia in Adults Best Pract Res Clin Endocrinol Metab 2018 Oct;32(5):621-38.
3. Asonitis N, Angelousi A, Zafeiris C, Lambrou GI, Dontas I, Kassi E. Diagnosis, Pathophysiology and Management of Hypercalcemia in Malignancy: A Review of the Literature Horm Metab Res 2019 Dec;51(12):770-8.
Dans cet article
- Introduction
- Maintien de la calcémie : rappels physiologiques (fig. 1)
- Qu’est-ce qu’une hypercalcémie ?
- Quelles causes créent et/ou entretiennent une hypercalcémie ? (tableau 1)
- Signes cliniques évocateurs d’une hypercalcémie
- Quels examens complémentaires réaliser lors d’une hypercalcémie ?
- Démarche diagnostique face à une hypercalcémie non menaçante (fig. 2)
- Traitement

 Encadrés
Encadrés