Quelles causes ?
Voir tableau.
Hyperferritinémie du syndrome métabolique
Le syndrome métabolique est la première cause de consultation pour hyperferritinémie.
Le caractère prédictif de l’hyperferritinémie dans l’apparition d’un diabète et d’un syndrome métabolique est bien démontré.1 Elle peut donc être observée avant même l’apparition clinique du syndrome métabolique. L’association d’une hyperferritinémie à un ou plusieurs éléments du syndrome métabolique, avec une surcharge modérée en fer, constitue l’hépatosidérose dysmétabolique.
Hyperferritinémies secondaires sans surcharge hépatique
La consommation d’alcool peut être une source d’hyperferritinémie par des mécanismes directs ou indirects.
La ferritine étant une protéine de la phase aiguë de l’inflammation, elle peut être augmentée au cours d’un épisode infectieux aigu. Les maladies de système peuvent aussi s’associer à une hyperferritinémie (avec ou sans augmentation de la protéine C réactive).
Une souffrance, une nécrose de cellules riches en ferritine (hépatocytes, myocytes…) entraînent une cytolyse, avec relargage de ferritine dans la circulation. Ce phénomène fausse alors l’interprétation du dosage de la ferritinémie sur le stock en fer intracellulaire.
Les autres causes sont plus rares : syndrome paranéoplasique, hyperthyroïdie, maladie de Gaucher (organomégalie et atteinte osseuse), maladie de Still (fièvre, arthralgies et rash cutané).
Hyperferritinémies secondaires avec surcharge hépatique
La plupart des maladies chroniques du foie peuvent être associées à une surcharge hépatique en fer. Au stade de cirrhose, une surcharge en fer existe chez 30 % des patients ; elle est proportionnelle à la sévérité de la cirrhose. Elle peut parfois être massive, posant la question de son mécanisme dans des cirrhoses de cause incertaine ou mixte.2
Plusieurs supplémentations inappropriées (iatrogéniques ou automédication) en fer peuvent conduire à d’authentiques surcharges.
Enfin, à côté des surcharges induites par les transfusions, les anomalies chroniques de l’érythropoïèse sont susceptibles d’induire une surcharge en fer même en l’absence de transfusion.
Hyperferritinémie non hémochromatosique d’origine génétique
Le syndrome hyperferritinémie-cataracte (gène FTL) est caractérisé par une hyperferritinémie franche, sans surcharge en fer. La seule conséquence clinique est le risque – non systématique – de cataracte. Pas de traitement ni de surveillance à mettre en place.
Quelle démarche diagnostique ?
L’interrogatoire doit rechercher une cause de surcharge secondaire et des éléments en faveur d’une transmission génétique. L’examen clinique recherche les éléments du syndrome métabolique.
Les perturbations du bilan martial doivent être contrôlées sur un deuxième bilan et à distance, dans un délai adapté à la situation clinique, pour juger de la stabilité des anomalies.
Si une hyperferritinémie est confirmée, le bilan biologique doit être étendu pour rechercher :
– les causes de surcharge en fer acquises ;
– les hyperferritinémies secondaires sans lien avec le métabolisme du fer.
En seconde intention
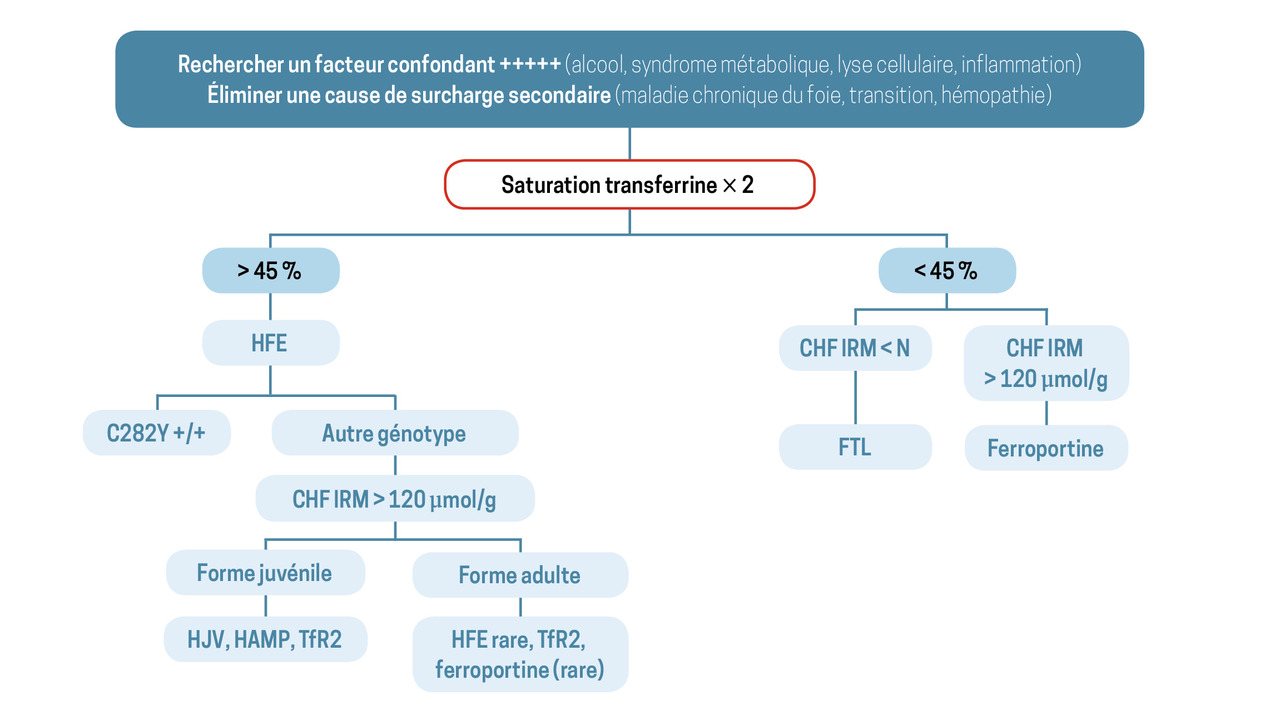
En l’absence de cause évidente de surcharge en fer secondaire, et devant la confirmation d’une hyperferritinémie non simplement expliquée par les facteurs confondants (alcool, syndrome métabolique, lyse cellulaire, inflammation), la suite de la démarche diagnostique est guidée par le niveau de saturation de la transferrine et la quantification du stock en fer par IRM hépatique (arbre décisionnel en figure).
Saturation de la transferrine élevée
Elle doit faire rechercher une hémochromatose HFE, donc le variant C282Y du gène HFE. L’homozygotie pose le diagnostic d’hémochromatose HFE classique. Une hétérozygotie ne permet pas de poser le diagnostic. La recherche des variants non délétères H63D et S65C, sans conséquence pathologique, n’est pas pertinente et n’est pas prise en charge par la Sécurité sociale.
En présence d’une surcharge significative sans variant C282Y du gène HFE, une cause génétique rare doit être évoquée. La saturation de la transferrine élevée oriente vers un mécanisme de déficit en hepcidine. Classiquement, deux groupes de gènes sont distingués en fonction de l’âge du patient (figure). En cas de doute sur la nécessité de réaliser un test génétique, un avis peut être pris auprès du Centre national de référence des hémochromatoses.
Saturation de la transferrine normale ou basse
En cas de concentration hépatique en fer élevée, l’hépatosidérose métabolique est la situation la plus fréquente. La surcharge en fer est habituellement modérée (CHF < 100 µmol/g), de même que la ferritine (800 ± 200 µg/L), mais toutes deux sont parfois plus importantes. La maladie de la ferroportine est un cause génétique rare de surcharge en fer à saturation normale, liée à l’atteinte du transporteur permettant l’export du fer par les cellules. Une histoire familiale de surcharge en fer est un argument fort en faveur de ce diagnostic. L’acéruloplasminémie, autre forme encore plus rare de cause génétique au profil atypique, associe, à des degrés de gravité variables, une anémie microcytaire, une atteinte neurologique, un diabète et une rétinopathie. Un dosage de la céruloplasmine sérique oriente le diagnostic.
En cas de concentration hépatique en fer normale, deux causes sont à évoquer : une hyperferritinémie métabolique et une anomalie du gène FTL (cf. supra).
Quelle prise en charge ?
Surcharge en fer d’origine génétique
Par analogie à l’hémochromatose HFE, il faut traiter efficacement les surcharges d’origine génétique liées à un déficit en hepcidine. En effet, la saturation de la transferrine haute signe une exposition toxique au fer pouvant induire des lésions organiques. Les saignées sont la méthode de choix. Ce traitement simple et bien toléré peut être réalisé au domicile du patient par une infirmière, une fois que les premières saignées en structures de soins se sont déroulées de façon satisfaisante. Le volume soustrait est habituellement de 7 mL/kg, sans dépasser 550 mL par saignée.
Dans les surcharges génétiques sans déficit en hepcidine (maladie de la ferroportine), il n’y a pas de données permettant d’évaluer la pertinence d’un traitement déplétif sur l’évolution à long terme. Par principe de précaution, un traitement par saignée est proposé pour tenter de normaliser le stock en fer. Les saignées ne sont pas toujours bien tolérées et doivent donc être proposées avec des volumes et une périodicité plus faibles que dans l’hémochromatose HFE.
Hépatosidérose métabolique
Des travaux récents ont démontré l’absence de bénéfice d’un traitement par saignée.3
Traitement des surcharges secondaires
Les surcharges en fer secondaires aux maladies hématologiques sont associées à une surmortalité. On met donc en place un traitement déplétif en considérant la balance bénéfices-risques pour chaque patient. Les traitements chélateurs sont l’option de choix (ferritine cible : < 500 µg/L). Il n’y a pas de données suffisantes pour établir des recommandations concernant les autres causes de surcharges secondaires : la prise en charge se discute en fonction des possibilités thérapeutiques et du contexte.
Une saturation de la transferrine augmentée incite à traiter pour limiter l’exposition aux formes toxiques de fer, mais le contexte n’est pas toujours compatible avec un traitement (cirrhose grave, insuffisance rénale chronique dialysée).
Traitement des hyperferritinémies sans surcharge
En l’absence de surcharge en fer, un traitement déplétif n’est pas indiqué.
2. Deugnier Y, Turlin B. Pathology of hepatic iron overload. World J Gastroenterol 2007;13(35):4755-60.
3. Lainé F, Ruivard M, Loustaud-Ratti V, et al. Metabolic and hepatic effects of bloodletting in dysmetabolic iron overload syndrome: A randomized controlled study in 274 patients. Hepatology 2017;65(2):465-74.
Mise à jour de cet article : Laland M, Bardou-Jacquet. Hyperferritinémie non hémochromatosique. Rev Prat Med Gen 2021;35(1057);235-8.