L’hyperferritinémie (> 300 μg/L chez l’homme, 200 μg/L chez la femme) est un motif très fréquent de consultation. La prise en charge dans le cadre d’une hémochromatose HFE C282Y est bien codifiée. Mais, dans la majorité des cas, l’hyperferritinémie ne relève pas de ce cadre, et la conduite à tenir est alors moins clairement établie.
Les différentes causes d’hyperferritinémie
(tableau )
Hyperferritinémie du syndrome métabolique
Le syndrome métabolique est la première cause de consultation pour hyperferritinémie.
Le caractère prédictif de l’hyperferritinémie dans l’apparition d’un diabète et la constitution d’un syndrome métabolique a bien été démontré1. Il peut donc exister une hyperferritinémie d’origine métabolique avant même l’apparition clinique du syndrome métabolique.
L’association d’une hyperferritinémie à un ou plusieurs éléments du syndrome métabolique, avec une surcharge modérée en fer, constitue l’hépatosidérose dysmétabolique.
Le caractère prédictif de l’hyperferritinémie dans l’apparition d’un diabète et la constitution d’un syndrome métabolique a bien été démontré1. Il peut donc exister une hyperferritinémie d’origine métabolique avant même l’apparition clinique du syndrome métabolique.
L’association d’une hyperferritinémie à un ou plusieurs éléments du syndrome métabolique, avec une surcharge modérée en fer, constitue l’hépatosidérose dysmétabolique.
Hyperferritinémies secondaires sans surcharge hépatique
La consommation d’alcool peut être une source d’hyperferritinémie par des mécanismes directs ou indirects.
Le syndrome inflammatoire et les maladies systémiques : la ferritine étant une protéine de la phase aiguë de l’inflammation, elle peut être augmentée au cours d’un épisode infectieux aigu. Les maladies de système peuvent aussi s’associer à une hyperferritinémie (avec ou sans augmentation de la protéine C- réactive).
La cytolyse : une souffrance, une nécrose de cellules riches en ferritine (hépatocytes, myocytes…), entraînent un relargage de ferritine dans la circulation. Ce phénomène fausse alors l’interprétation du dosage de la ferritinémie sur le stock en fer intracellulaire.
D’autres causes plus rares d’hyperferritinémie sans surcharge en fer associée peuvent être évoquées en deuxième ligne : syndrome paranéoplasique, hyperthyroïdie, maladie de Gaucher (organomégalie et atteinte osseuse), maladie de Still (fièvre, arthralgies et rash cutané).
Le syndrome inflammatoire et les maladies systémiques : la ferritine étant une protéine de la phase aiguë de l’inflammation, elle peut être augmentée au cours d’un épisode infectieux aigu. Les maladies de système peuvent aussi s’associer à une hyperferritinémie (avec ou sans augmentation de la protéine C- réactive).
La cytolyse : une souffrance, une nécrose de cellules riches en ferritine (hépatocytes, myocytes…), entraînent un relargage de ferritine dans la circulation. Ce phénomène fausse alors l’interprétation du dosage de la ferritinémie sur le stock en fer intracellulaire.
D’autres causes plus rares d’hyperferritinémie sans surcharge en fer associée peuvent être évoquées en deuxième ligne : syndrome paranéoplasique, hyperthyroïdie, maladie de Gaucher (organomégalie et atteinte osseuse), maladie de Still (fièvre, arthralgies et rash cutané).
Hyperferritinémies secondaires avec surcharge hépatique
La plupart des maladies chroniques du foie peuvent être associées à une surcharge hépatique en fer. Au stade de cirrhose, une surcharge en fer existe chez 30 % des patients. Elle est proportionnelle à la sévérité de la cirrhose. La surcharge en fer peut parfois être massive, posant la question de son mécanisme dans des cirrhoses de cause incertaine ou mixte.2
Plusieurs supplémentations inappropriées (iatrogéniques ou automédication) en fer peuvent conduire à d’authentiques surcharges.
Les maladies hématologiques : à côté des surcharges induites par les transfusions, les anomalies chroniques de l’érythropoïèse sont susceptibles d’induire une surcharge en fer même en l’absence de transfusion.
Plusieurs supplémentations inappropriées (iatrogéniques ou automédication) en fer peuvent conduire à d’authentiques surcharges.
Les maladies hématologiques : à côté des surcharges induites par les transfusions, les anomalies chroniques de l’érythropoïèse sont susceptibles d’induire une surcharge en fer même en l’absence de transfusion.
Hyperferritinémie non hémochromatosique d’origine génétique
Le syndrome hyperferritinémie-cataracte (gène FTL) : il s’agit d’une hyperferritinémie franche, sans surcharge en fer. La seule conséquence clinique est le risque – non systématique – de cataracte. Il n’y a aucun traitement ou surveillance à mettre en place.
Quelle démarche diagnostique ?
En première intention
L’interrogatoire doit rechercher une cause de surcharge secondaire et des éléments en faveur d’une transmission génétique.
L’examen clinique recherche les éléments du syndrome métabolique.
Les perturbations du bilan martial doivent être contrôlées sur un deuxième bilan et à distance, dans un délai adapté à la situation clinique, pour juger de la stabilité des anomalies et de l’influence des facteurs confondants éventuels.
De façon systématique, lors d’une hyperferritinémie confirmée, le bilan biologique doit être étendu pour rechercher :
– les causes de surcharge en fer acquises ;
– les hyperferritinémies secondaires sans lien avec le métabolisme du fer.
L’examen clinique recherche les éléments du syndrome métabolique.
Les perturbations du bilan martial doivent être contrôlées sur un deuxième bilan et à distance, dans un délai adapté à la situation clinique, pour juger de la stabilité des anomalies et de l’influence des facteurs confondants éventuels.
De façon systématique, lors d’une hyperferritinémie confirmée, le bilan biologique doit être étendu pour rechercher :
– les causes de surcharge en fer acquises ;
– les hyperferritinémies secondaires sans lien avec le métabolisme du fer.
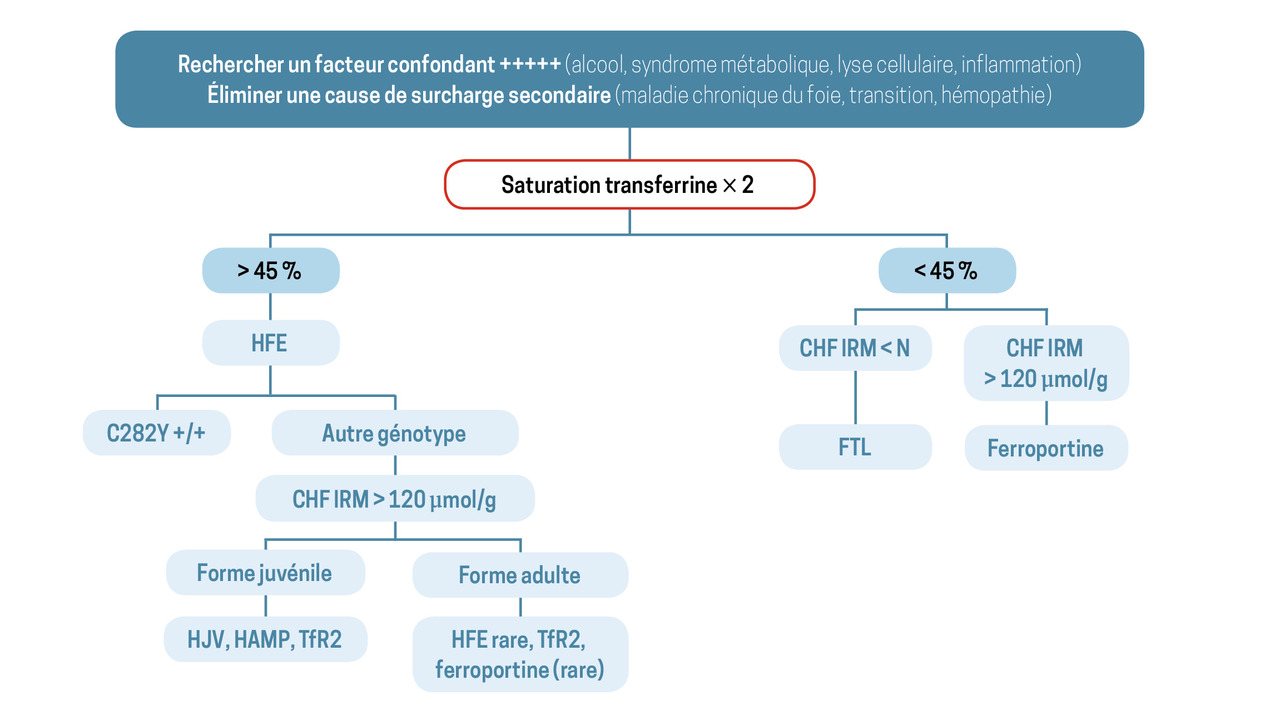
En seconde intention (figure)
En l’absence de cause évidente de surcharge en fer secondaire, et devant la confirmation d’une hyperferritinémie non simplement expliquée par les facteurs confondants (alcool, syndrome métabolique, lyse cellulaire, inflammation), la suite de la démarche diagnostique est guidée par le niveau de saturation de la transferrine et la quantification du stock en fer par IRM hépatique.
Saturation de la transferrine élevée
Une saturation de la transferrine élevée doit faire rechercher une hémochromatose HFE, donc le variant C282Y du gène HFE. L’homozygotie pose le diagnostic d’hémochromatose HFE classique. Une hétérozygotie ne permet pas de poser le diagnostic. La recherche des variants non délétères H63D et S65C, sans conséquence pathologique, n’est pas pertinente et n’est pas prise en charge par la Sécurité sociale.
En présence d’une surcharge significative sans variant C282Y du gène HFE, une cause génétique rare doit être évoquée. La saturation de la transferrine élevée oriente vers un mécanisme de déficit en hepcidine. Classiquement, deux groupes de gènes sont ici distingués en fonction de l’âge du patient (figure ).
En cas de doute sur la nécessité de réaliser un test génétique, un avis peut être pris auprès du Centre national de référence des hémochromatoses (https://centre-reference-fer-rennes.org/).
Saturation de la transferrine normale ou basse
Concentration hépatique en fer élevée
L’hépatosidérose métabolique est ici la situation la plus fréquente. Le syndrome métabolique associé peut être plus ou moins prononcé. La surcharge en fer est habituellement modérée (CHF < 100 µmol/g), de même que la ferritine (800 ± 200 µg/L), mais toutes deux peuvent parfois être plus importantes. Il s’agit d’un syndrome clinique dont le diagnostic se fait par élimination.
La maladie de la ferroportine, cause génétique rare de surcharge en fer à saturation normale, doit ensuite être évoquée. Maladie autosomique dominante, elle est une forme rare d’hémochromatose liée à l’atteinte du transporteur permettant l’export du fer par les cellules. Une histoire familiale de surcharge en fer est un argument fort en faveur de ce diagnostic.
L’acéruloplasminémie, autre forme encore plus rare de cause génétique au profil atypique, peut finalement être envisagée. Elle associe, à des degrés de gravité variables, une anémie microcytaire, une atteinte neurologique, un diabète et une rétinopathie. Un dosage de la céruloplasmine sérique oriente le diagnostic.
Concentration hépatique en fer normale
Deux causes d’hyperferritinémie sont à évoquer : une hyperferritinémie métabolique et une anomalie du gène FTL (cf. supra).
Saturation de la transferrine élevée
Une saturation de la transferrine élevée doit faire rechercher une hémochromatose HFE, donc le variant C282Y du gène HFE. L’homozygotie pose le diagnostic d’hémochromatose HFE classique. Une hétérozygotie ne permet pas de poser le diagnostic. La recherche des variants non délétères H63D et S65C, sans conséquence pathologique, n’est pas pertinente et n’est pas prise en charge par la Sécurité sociale.
En présence d’une surcharge significative sans variant C282Y du gène HFE, une cause génétique rare doit être évoquée. La saturation de la transferrine élevée oriente vers un mécanisme de déficit en hepcidine. Classiquement, deux groupes de gènes sont ici distingués en fonction de l’âge du patient (
En cas de doute sur la nécessité de réaliser un test génétique, un avis peut être pris auprès du Centre national de référence des hémochromatoses (https://centre-reference-fer-rennes.org/).
Saturation de la transferrine normale ou basse
Concentration hépatique en fer élevée
L’hépatosidérose métabolique est ici la situation la plus fréquente. Le syndrome métabolique associé peut être plus ou moins prononcé. La surcharge en fer est habituellement modérée (CHF < 100 µmol/g), de même que la ferritine (800 ± 200 µg/L), mais toutes deux peuvent parfois être plus importantes. Il s’agit d’un syndrome clinique dont le diagnostic se fait par élimination.
La maladie de la ferroportine, cause génétique rare de surcharge en fer à saturation normale, doit ensuite être évoquée. Maladie autosomique dominante, elle est une forme rare d’hémochromatose liée à l’atteinte du transporteur permettant l’export du fer par les cellules. Une histoire familiale de surcharge en fer est un argument fort en faveur de ce diagnostic.
L’acéruloplasminémie, autre forme encore plus rare de cause génétique au profil atypique, peut finalement être envisagée. Elle associe, à des degrés de gravité variables, une anémie microcytaire, une atteinte neurologique, un diabète et une rétinopathie. Un dosage de la céruloplasmine sérique oriente le diagnostic.
Concentration hépatique en fer normale
Deux causes d’hyperferritinémie sont à évoquer : une hyperferritinémie métabolique et une anomalie du gène FTL (cf. supra).
Quelle prise en charge ?
Surcharge en fer d’origine génétique
Par analogie à l’hémochromatose HFE, il est nécessaire de traiter efficacement les surcharges d’origine génétique liées à un déficit en hepcidine. En effet, la saturation de la transferrine haute signe une exposition toxique au fer pouvant induire des lésions organiques. Les saignées sont la méthode de choix. C’est un traitement simple et bien toléré, qui peut être réalisé au domicile du patient par une infirmière, une fois que les premières saignées en structures de soins se sont déroulées de façon satisfaisante. Le volume soustrait est habituellement de 7 mL/kg sans dépasser 550 mL par saignée.
Dans les surcharges génétiques sans déficit en hepcidine (maladie de la ferroportine), il n’y a pas de données permettant d’évaluer la pertinence d’un traitement déplétif sur l’évolution à long terme des patients. Par principe de précaution, un traitement par saignée est proposé pour tenter de normaliser le stock en fer. Les saignées ne sont pas toujours bien tolérées et doivent donc être proposées avec des volumes et une périodicité plus faibles que dans l’hémochromatose HFE.
Dans les surcharges génétiques sans déficit en hepcidine (maladie de la ferroportine), il n’y a pas de données permettant d’évaluer la pertinence d’un traitement déplétif sur l’évolution à long terme des patients. Par principe de précaution, un traitement par saignée est proposé pour tenter de normaliser le stock en fer. Les saignées ne sont pas toujours bien tolérées et doivent donc être proposées avec des volumes et une périodicité plus faibles que dans l’hémochromatose HFE.
Hépatosidérose métabolique
Des travaux récents ont démontré l’absence de bénéfice d’un traitement par saignée dans le cadre de l’hépatosidérose métabolique3 ou d’une stéatohépatite non alcoolique. Bien que certains éléments de ces travaux puissent être discutés (durée de suivi, population étudiée, modalités de traitement), il ne semble pas pertinent de proposer un traitement déplétif dans ce contexte.
Traitement des surcharges secondaires
Les surcharges en fer secondaires aux maladies hématologiques sont associées à une surmortalité. Il est donc recommandé de mettre en place un traitement déplétif en considérant la balance bénéfices-risques pour chaque patient. Dans ce contexte, les saignées sont rarement réalisables, et les traitements chélateurs sont alors l’option de choix. L’objectif est en général moins strict que dans l’hémochromatose avec une ferritine cible < 500 µg/L.
Il n’y a pas de données suffisantes pour établir des recommandations concernant les autres causes de surcharges secondaires. La prise en charge se discute en fonction des possibilités thérapeutiques et du contexte. La présence d’une saturation de la transferrine augmentée incite à traiter pour limiter l’exposition aux formes toxiques de fer Cependant, le contexte n’est pas toujours compatible avec un traitement (cirrhose grave, insuffisance rénale chronique dialysée).
Il n’y a pas de données suffisantes pour établir des recommandations concernant les autres causes de surcharges secondaires. La prise en charge se discute en fonction des possibilités thérapeutiques et du contexte. La présence d’une saturation de la transferrine augmentée incite à traiter pour limiter l’exposition aux formes toxiques de fer Cependant, le contexte n’est pas toujours compatible avec un traitement (cirrhose grave, insuffisance rénale chronique dialysée).
Traitement des hyperferritinémies sans surcharge
Il n’y a, en l’absence de surcharge en fer, aucune indication à mettre en place un traitement déplétif.
Références
1. Podmore C, Meidtner K, Schulze M, et al. Association of Multiple Biomarkers of Iron Metabolism and Type 2 Diabetes: The EPIC-InterAct Study. Diabetes Care 2016;39:572-81.
2. Deugnier Y, Turlin B. Pathology of hepatic iron overload. World J Gastroenterol 2007;13:4755-60.
3. Lainé F, Ruivard M, Loustaud-Ratti V, et al. Metabolic and hepatic effects of bloodletting in dysmetabolic iron overload syndrome: A randomized controlled study in 274 patients. Hepatology 2017;65:465-74.
2. Deugnier Y, Turlin B. Pathology of hepatic iron overload. World J Gastroenterol 2007;13:4755-60.
3. Lainé F, Ruivard M, Loustaud-Ratti V, et al. Metabolic and hepatic effects of bloodletting in dysmetabolic iron overload syndrome: A randomized controlled study in 274 patients. Hepatology 2017;65:465-74.