Expliquer la physiopathologie des réactions d’hypersensibilité : allergique et non allergique.
Expliquer l’épidémiologie, les facteurs favorisants et l’évolution des principales hypersensibilités de l’enfant et de l’adulte : alimentaire, respiratoire, cutanée, médicamenteuse et per-anesthésique, venins d’hyménoptères.
Expliquer les principales manifestations cliniques et biologiques et argumenter les procédures diagnostiques.
Argumenter les principes du traitement et de la surveillance au long cours d’un sujet hypersensible, en tenant compte des aspects psychologiques.
Définitions
➥ Allergène : antigène capable d’induire une réponse immunitaire de type allergique. Il en existe différents types :
- pneumallergènes (allergènes aéroportés, qui peuvent donc être inhalés ou entrer en contact avec les yeux ou la peau) ;
- trophallergènes (allergènes alimentaires) ;
- allergènes transcutanés ;
- allergènes médicamenteux ;
- allergènes professionnels ;
- venins.
➥ Allergie : hypersensibilité spécifique d’un allergène, de mécanisme immunologique prouvé (médiation humorale ou cellulaire), avec des conséquences cliniques.
➥ Sensibilisation : après contact avec un allergène, développement par l’organisme d’IgE spécifiques de cet allergène. La sensibilisation est mise en évidence par la présence d’IgE spécifiques dans le sang, ou la positivité d’un test cutané. Elle peut exister sans symptôme clinique associé, donc sans allergie vraie.
➥ Anaphylaxie : réaction systémique d’hypersensibilité sévère, potentiellement mortelle.
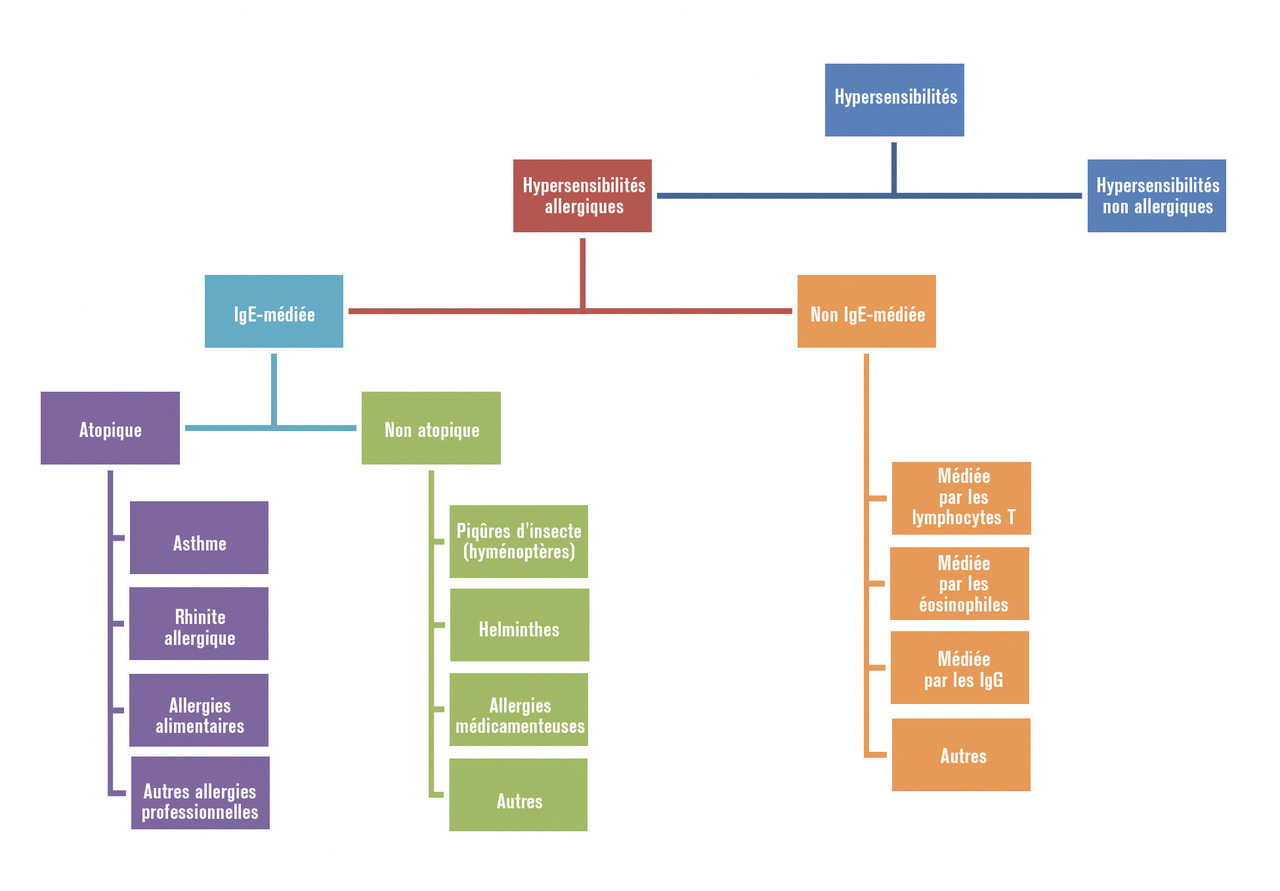
Physiopathologie des réactions d’hypersensibilité
Allergies
Hypersensibilité de type 1 = immédiate (HSI)
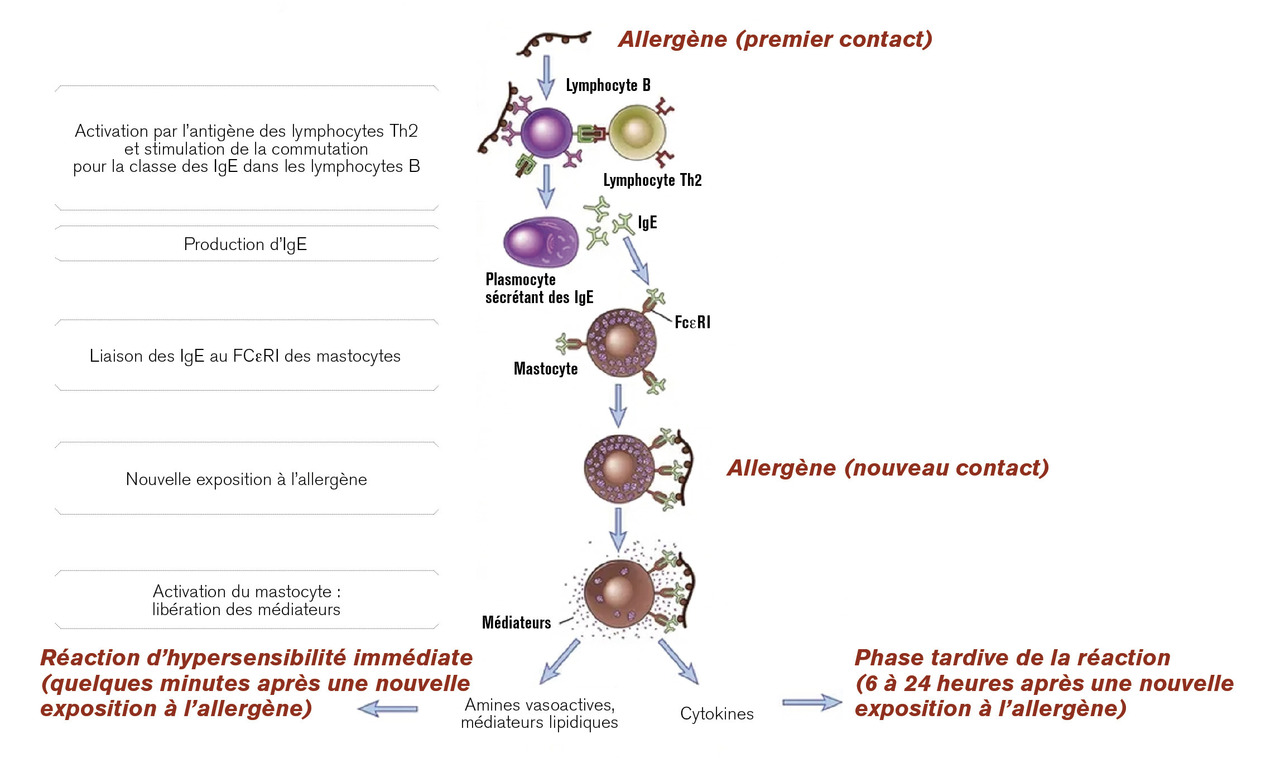
L’hypersensibilité de type 1 est médiée par les IgE, mécanisme le plus fréquemment en cause dans les réactions allergiques et se déroule en 2 phases (1) phase de sensibilisation (asymptomatique) : premier contact avec l’allergène, qui survient le plus souvent dans l’enfance, voire pendant la vie intra-utérine.
L’allergène est pris en charge par les cellules présentatrices d’antigènes, et présenté aux lymphocytes T CD4+, qui vont alors se différencier en lymphocytes T2, avec production d’interleukines (IL-4, IL-5, IL-13). Ces interleukines provoquent la synthèse d’IgE spécifiques de l’allergène par les lymphocytes B. Ces IgE vont se fixer par leur fragment constant aux mastocytes et polynucléaires basophiles par leur récepteur de haute affinité FcεRI et aux macrophages, aux polynucléaires éosinophiles, aux lymphocytes B et aux plaquettes par leur récepteur de basse affinité FcεRII = CD23 ;
2) phase effectrice (manifestations allergiques) : lors d’un nouveau contact avec l’allergène, celui-ci va ponter les IgE préformées se trouvant à la surface des mastocytes et basophiles, ce qui va activer la cellule inflammatoire.
À la phase aiguë, le pontage des IgE provoque une dégranulation brutale avec libération de médiateurs préformés (histamine, tryptase, cytokines) et néoformés (leucotriènes, prostaglandines), qui sont responsables des signes cliniques d’hypersensibilité immédiate : vasodilatation, œdème et hypersécrétion de mucus, bronchoconstriction.
La phase tardive, ou inflammatoire, est due au recrutement local d’éosinophiles, secondaire à la libération de cytokines et de chimiokines par les lymphocytes T CD4, les mastocytes et les basophiles. Cette deuxième phase survient quelques heures après la première. Son expression clinique est variable.
Hypersensibilité de type 2 = réaction de cytotoxicité liée aux anticorps
Elle est médiée par des anticorps IgG ou IgM dirigés contre des antigènes de la surface cellulaire. L’activation du complément et une phagocytose conduisent à la destruction de la cellule cible.Hypersensibilité de type 3 = réaction à complexes immuns
Les complexes antigène-anticorps solubles circulant se déposent dans certains tissus ; ils activent alors le système du complément, ce qui provoque inflammation et lésions tissulaires.Hypersensibilité de type 4 = hypersensibilité retardée
Reconnaissance de l’allergène par des lymphocytes T, qui entraînent une réaction cytotoxique de façon retardée (48-72 heures).Hypersensibilités non allergiques
Cependant, les mécanismes peuvent activer de manière non spécifique les mêmes effecteurs que dans l’hypersensibilité allergique, avec dans ce cas des symptômes cliniques très proches. Le médiateur principal peut aussi être l’histamine, on parle alors d’histaminolibération non spécifique.
Principales hypersensibilités de l’enfant et de l’adulte
Hypersensibilités alimentaires
Allergies respiratoires
Épidémiologie
En France, la prévalence de l’asthme est de 10 à 15 % chez l’enfant, environ 6 % chez l’adulte. La rhinite allergique touche environ 25 % de la population générale, et jusqu’à 80 % des asthmatiques. De même, le risque de développer un asthme est 6 fois plus important chez les patients ayant une rhinite allergique.Facteurs favorisants
Le développement de l’asthme est lié à l’interaction de facteurs génétiques et environnementaux.Les garçons sont plus à risque d’asthme que les filles, mais cette tendance s’inverse à l’âge adulte. Le terrain atopique familial au premier degré est un facteur de risque majeur, en particulier l’asthme maternel, ou si les 2 parents sont atopiques. L’hypothèse hygiéniste suggère que la diminution des maladies infectieuses liée à l’amélioration des conditions d’hygiène favorise le développement du phénotype Th2 et des maladies allergiques qui lui sont associées.
De multiples facteurs environnementaux sont associés au développement de l’asthme et des maladies allergiques : tabagisme passif (durant l’enfance) et actif (à l’adolescence), exposition allergénique (dans l’environnement intérieur ou extérieur), pollution atmosphérique (en particulier aux particules fines liées au trafic automobile), régime alimentaire (pauvre en oméga-3 et antioxydants), obésité.
Évolution
Une partie des asthmes infantiles entreront en rémission avec l’âge. Les facteurs de risque de persistance de l’asthme sont :- l’exposition précoce à certains virus (rhinovirus ou virus respiratoire syncytial [VRS]) ;
- l’asthme et plus généralement l’atopie chez les parents ;
- l’existence de sensibilisations allergéniques, respiratoires ou alimentaires, en particulier si elles sont précoces (avant 3 ans).
Hypersensibilités cutanées
Dermatite de contact
La dermatite (ou eczéma) allergique de contact est très fréquente. Elle est due à une sensibilisation à des substances en contact avec la peau, suivie d’une réaction d’hypersensibilité retardée (type 4, médiée par les lymphocytes T). Après la période de sensibilisation, qui peut durer plusieurs années, la réaction allergique survient 24 à 48 heures après une nouvelle exposition à l’allergène. Le diagnostic différentiel principal est la dermite d’irritation de contact qui ne fait pas intervenir l’immunité lymphocytaire T spécifique.L’éviction de l’allergène en cause est indispensable, et conditionne la guérison et l’absence de rechute. La dermatite de contact est une maladie professionnelle parmi les plus fréquentes. La localisation et la chronologie des lésions, notamment l’amélioration lors des week-ends et vacances, sont très informatives.
Dermatite atopique
La dermatite (ou eczéma) atopique touche jusqu’à 30 % des enfants et 10 % des adultes dans les pays à revenu élevé. Elle est causée par des modifications de la barrière cutanée et n’est généralement pas due à une allergie alimentaire ; cependant, les enfants atteints de dermatite atopique persistante modérée à sévère peuvent présenter un risque plus élevé de développer une allergie alimentaire. L’association à un asthme et/ou une rhinite allergique sont des facteurs de risque de persistance de la dermatite atopique à l’âge adulte.Hypersensibilités médicamenteuses et peranesthésiques
Épidémiologie
Les hypersensibilités médicamenteuses sont fréquemment suspectées, affectant jusqu’à 7 % de la population générale, mais leur prévalence exacte n’est pas connue. Dans la population pédiatrique, les hypersensibilités médicamenteuses sont confirmées chez moins de 10 % des patients explorés.Les symptômes cutanés sont les premiers symptômes faisant évoquer une hypersensibilité médicamenteuse (éruptions maculopapuleuses, urticaires). Or ces éruptions sont fréquentes, notamment en pédiatrie, lors d’épisodes infectieux, qu’ils soient d’origine virale ou bactérienne, y compris en dehors de toute prise médicamenteuse, ce qui rend donc difficile l’interprétation de ces manifestations. Plus rarement, les réactions d’hypersensibilité médicamenteuse sont sévères et peuvent engager le pronostic vital par un mécanisme immédiat (anaphylaxie, bronchospasme) ou retardé (nécrolyse épidermique toxique ou syndromes de Lyell et Stevens-Johnson, atteintes viscérales, etc.).
Facteur de risque
Contrairement à d’autres pathologies allergiques, le terrain atopique n’est pas un facteur de risque démontré d’hypersensibilité médicamenteuse. Cependant, dans de rares cas, le terrain génétique pourrait favoriser certaines hypersensibilités (HLA-B*5701 et l’hypersensibilité à l’abacavir). Certaines pathologies sous-jacentes peuvent favoriser l’apparition d’hypersensibilités médicamenteuses (urticaire chronique et hypersensibilité aux anti-inflammatoires non stéroïdiens [AINS] ; pathologie respiratoire et hypersensibilité à l’aspirine dans le syndrome de Widal).L’administration intermittente et répétée d’une même molécule est plus immunogène que son administration prolongée. La voie parentérale est la voie la plus immunogène, mais la voie cutanée est également pourvoyeuse d’hypersensibilités.
Les enfants sont moins atteints que les adultes. Dans la population adulte, les femmes semblent présenter plus d’hypersensibilités médicamenteuses que les hommes. En fonction de l’âge, les médicaments les plus pourvoyeurs d’hypersensibilités diffèrent : en pédiatrie ce sont les antibiotiques bêtalactames, suivis des antipyrétiques (AINS et paracétamol) et enfin des antibiotiques non bêtalactames. Alors que chez les adultes, les AINS sont la première cause d’hypersensibilités.
Évolution
Il y a très peu de données quant à l’évolution des hypersensibilités médicamenteuses. Certaines hypersensibilités aux pénicillines pourraient régresser avec le temps, mais une nouvelle sensibilisation serait possible après réexposition. Certaines hypersensibilités liées à une pathologie sous-jacente pourraient régresser en même temps que cette pathologie (hypersensibilité aux AINS chez les personnes ayant une urticaire chronique, par exemple).Venins d’hyménoptères
Épidémiologie
Selon les études épidémiologiques européennes, le taux de réactions systémiques autodéclarées varie de 0,3 à 7,5 % chez les adultes et jusqu’à 3,4 % chez les enfants. Concernant les réactions locales importantes, le taux varie entre 2,4 et 26,4 % dans la population générale. Les piqûres d’insectes sont responsables de près de la moitié de toutes les réactions anaphylactiques chez les adultes en Europe. Le taux de mortalité est évalué entre 0,03 et 0,48 pour 1 000 000 d’habitants mais très certainement sous-estimé en raison des décès inexpliqués dont certains peuvent être causés par des piqûres non reconnues.Facteurs de risque
Parmi les facteurs de risque d’une réaction anaphylactique systémique sévère après une piqûre d’hyménoptère figurent un antécédent de piqûre moins sévère, les piqûres de guêpe, une mastocytose, une tryptase basale augmentée, l’âge et le sexe masculin. En effet, plus de 80 % des anaphylaxies fatales surviennent chez les hommes âgés de 50 à 60 ans.Évolution naturelle
L’allergie aux hyménoptères n’est pas spontanément résolutive. L’immunothérapie au venin d’abeille est le seul traitement disponible qui peut protéger les patients allergiques des réactions de piqûres ultérieures. L’immunothérapie conventionnelle consiste en l’administration répétée d’extraits de venin d’abeille pendant 3 à 5 ans. Son efficacité a été prouvée chez 77 à 84 % des patients.Principales manifestations cliniques
Asthme allergique
Chez les enfants de moins de 6 ans, la définition est clinique (toux, sibilants, gêne respiratoire), avec un caractère récidivant et une probabilité augmentée en présence d’une atopie familiale. À partir de 6 ans, les signes cliniques peuvent être complétés par la réalisation d’examens complémentaires, comme une épreuve fonctionnelle respiratoire et la mise en évidence d’un trouble ventilatoire obstructif réversible après bêta-2-mimétiques.
Les diagnostics différentiels doivent toujours être éliminés. La radiographie thoracique est systématique.
Une fois le diagnostic d’asthme réalisé, il convient de rechercher les facteurs déclenchants allergiques (respiratoires, alimentaires) grâce à un interrogatoire précis des circonstances de survenue, répétition des situations, activités, loisirs, travail, etc., afin de répertorier les expositions. Les explorations seront orientées selon ce recueil, et ce quel que soit l’âge du patient. Les explorations allergologiques sont systématiques au-delà de 3 ans, et selon l’interrogatoire, les expositions et les critères de sévérité pour les moins de 3 ans .
L’asthme professionnel est une entité particulière avec des expositions à des allergènes spécifiques à chaque type de profession. L’exploration doit être réalisée par un praticien formé à cette pratique professionnelle. La périodicité est alors liée au travail. Les adolescents asthmatiques doivent être informés des risques potentiels lors du choix de leur orientation professionnelle.
Rhinite allergique
Conjonctivite allergique
Les recommandations de l’European Academy of Allergy and Clinical Immunology (EEACI) décrivent les atteintes allergiques et la classification de la conjonctivite allergique. L’interrogatoire est essentiel pour déterminer l’allergène en cause et pouvoir planifier les explorations, qui vont jusqu’à un test de provocation oculaire si les autres examens sont négatifs. Les principaux signes sont le larmoiement, l’érythème conjonctival, le prurit oculaire.
Urticaire allergique
Angiœdème laryngé
Choc anaphylactique
Les définitions ont évolué, et la prise en charge standardisée avec le recours à l’adrénaline le plus rapidement possible a été définie dans les recommandations de l’EAACI .
Allergie non IgE-médiée
Atteinte dermatologique : eczéma, toxidermie médicamenteuse.
Atteinte digestive : entéropathie allergique…
Diagnostic
Diagnostic de sensibilisation
Tests cutanés (ou prick-tests)
Méthode de référence recommandée pour étudier la sensibilisation IgE-dépendante : les IgE spécifiques fixées sur les mastocytes cutanés d’un sujet sensibilisé reconnaissent l’allergène et entraînent l’activation de ces mastocytes, la réaction d’inflammation locale peut alors être quantifiée.Les prick-tests sont utilisés pour l’exploration des allergies : respiratoires, alimentaires, aux hyménoptères et médicamenteuses.
Technique :
- en zone de peau saine (face antérieure avant-bras, bras, dos) ;
- à l’aide d’une microlance, ou d’une pointe, introduction épidermique d’une faible quantité d’allergène (extrait allergénique purifié et standardisé, médicament en concentration standardisée, ou aliment natif) ;
- lecture après 15 minutes : mesure du diamètre de la papule (induration) au centre, et de l’érythème autour. Comparaison aux témoins négatif (solvant) et positif (histamine ou codéine).
- en l’absence de dermographisme cutané (témoin négatif positif), source de faux positif ;
- en l’absence de prise médicamenteuse de type antihistaminique pouvant négativer la réactivité cutanée (témoin positif négatif), source de faux négatifs ;
- un test est considéré comme positif si le diamètre de la papule est supérieur de 3 mm par rapport au témoin négatif.
- chez l’adulte et l’enfant de plus de 3 ans, on teste habituellement plusieurs pneumallergènes de façon systématique : acariens (Dermatophagoides pteronyssinus, Dermatophagoides farinae) − pollens de graminées, pollens d’arbres (à adapter en fonction de l’exposition pollinique régionale), phanères d’animaux domestiques (chat, chien), blatte germanique, certaines moisissures (Alternaria). ;
- trophallergènes : tests orientés en fonction des suspicions cliniques ou du risque d’allergie croisée vis-à-vis d’allergie alimentaire déjà mise en évidence. Les tests natifs sont plus sensibles ;
- médicaments : les tests sont réalisés avec le ou les médicaments suspects à la concentration non irritante définie (EAACI/ENDA) ;
- venins d’hyménoptères : extraits standardisés à différentes concentrations.
- réaction locale étendue avec prurit et/ou œdème, parfois urticaire généralisée ou réaction syndromique (rhinite, asthme) ;
- les réactions anaphylactiques sont exceptionnelles avec cette méthode, décrites pour certains trophallergènes lors de la réalisation simultanée de plusieurs tests natifs mais également pour certains médicaments, notamment les bêtalactamines lors de l’exploration de choc anaphylactique ou de l’exploration des venins d’hyménoptères.
Intradermoréaction (IDR)
Les IDR sont utilisées dans l’exploration allergologique :- des allergènes médicamenteux en lecture immédiate et retardée ;
- des venins d’hyménoptères.
Les concentrations non irritantes des médicaments sont définies par le groupe européen EDNA. Ces concentrations peuvent être diluées au 1/10° ou 1/100° si la réaction clinique était sévère. Ces explorations doivent être réalisées par des praticiens formés et capables de réagir face à une réaction anaphylactique .
Dosage des IgE spécifiques
Un allergène purifié est couplé à un support solide, puis incubé avec le sérum du malade. Les IgE spécifiques libres se fixent sur l’allergène et sont révélées par un anticorps anti-IgE couplé à un marqueur enzymatique ou fluorescent. Les taux mesurés sont exprimés en unités kU/L.Les IgE spécifiques unitaires sont complétées par les recombinants, qui précisent la sensibilisation par famille protéique.
Tests multiallergéniques de dépistage
Tests sanguins permettant le dosage d’IgE spécifiques vis-à-vis d’un panel d’allergènes le plus souvent rencontrés dans l’allergie de type immédiat (ex : Phadiatop). La réponse est uniquement qualitative (positif ou négatif) mais permet de dépister une atopie avec une très bonne sensibilité (> 90 %). Cet examen peut être utile en vue d’un dépistage par un médecin n’ayant pas accès à des tests cutanés rapidement. En cas de positivité, l’exploration par tests cutanés reste indispensable afin de préciser l’allergène et pouvoir donner des consignes pour l’environnement du patient.Le test multiallergénique aux trophallergènes (ex : Trophatop) n’est pas utile car il ne permet pas de préciser un allergène précis et conduit souvent à des régimes d’éviction multiples non justifiés.
D’autres tests multiallergéniques ont été commercialisés ces dernières années, fondés sur la recherche des profils de sensibilisations protéiques (puces Immuno Solid-phase Allergen Chip [ISAC] et Allergy Explorer [ALEX]…) qui permettent la recherche de 112 ou plus types d’IgE spécifiques. L’unité est différente, et non quantitative. Elles peuvent parfois aider dans des situations complexes où les recherches unitaires n’ont pas permis de faire un diagnostic précis. Elles ne sont pour l’instant pas remboursées par la Sécurité sociale.
Test d’activation des basophiles (TAB)
Ce n’est pas une méthode de routine, et il est réservé au diagnostic des allergies alimentaires ou médicamenteuses.Autres examens biologiques
Aucun des trois tests suivants n’est indiqué pour le diagnostic d’hypersensibilité :- dosage des IgE totales : dosage indiqué pour la recherche d’une aspergillose bronchopulmonaire allergique ou de certains déficits immunitaires, et en cas d’asthme sévère avec indication d’une biothérapie ;
- dosage des éosinophiles sanguins ;
- tryptase sérique : son dosage (30 min à 2 h après la réaction) permet de confirmer la nature anaphylactique d’un choc et peut avoir une valeur médicolégale (choc peranesthésique).
Diagnostic de l’allergie
Interrogatoire
C'est est une étape fondamentale, qui oriente d’emblée le diagnostic et qui doit permettre de documenter l’étiologie. Parfois, la séquence des événements n’est pas typique : symptômes continus ; absence de facteur déclenchant évident ; présence d’une polysensibilisation (sensibilisation vis-à-vis de plusieurs allergènes) ; allergène masqué ou difficile à identifier. Il peut être nécessaire de compléter les explorations par un test de provocation.Test de provocation
Il pose le diagnostic de certitude (gold standard).Les tests de provocation sont potentiellement dangereux et ont des indications très précises et spécialisées. Ils ne sont faits que si le doute diagnostique persiste après le bilan de première intention, et seulement si le résultat change l’attitude thérapeutique.
Indications :
- rarement nécessaires dans les pathologies allergiques respiratoires ;
- parfois indiqués dans certaines allergies professionnelles, médicamenteuses ;
- fréquemment utilisés dans les allergies alimentaires.
Technique :
- en milieu hospitalier spécialisé, sous surveillance étroite (pouls, pression artérielle, scope, oxymétrie de pouls, débit de pointe), parfois chez un malade déjà perfusé ;
- administration d’une solution allergénique, parfois contre placebo, en simple ou mieux en double aveugle, par voie locale ou générale en fonction de la pathologie et des allergènes (voie nasale, conjonctivale, nébulisation, per os, voie injectable) ;
- la survenue de symptômes après administration de la solution active permet le diagnostic d’allergie. Le traitement des symptômes doit être prévu et administré rapidement.
Principes du traitement et de la surveillance au long cours
Le traitement pharmacologique est fonction de la sévérité tant pour l’asthme que pour la rhinite. Des recommandations internationales existent afin de graduer la réponse thérapeutique en fonction de la sévérité et du contrôle de la maladie (ARIA et GINA).
Prévention
La prévention secondaire consiste à limiter l’apparition des symptômes de maladie allergique chez les patients sensibilisés. Seule l’immunothérapie allergénique peut modifier l’histoire naturelle de l’allergie.
La prévention tertiaire consiste en l’éviction de l’allergène en cause dans une allergie déclarée, mais également l’immunothérapie spécifique afin de diminuer la réactivité clinique de la rhinoconjonctivite et de l’asthme allergique.
Traitements symptomatiques
Éviction allergénique
Toujours indiquée, elle n’est pas toujours possible en fonction de la nature de l’allergène en cause. Un conseiller médical en environnement intérieur (CMEI) peut visiter le domicile du patient et donner des conseils adaptés pour diminuer la charge allergénique au domicile.Acariens : les mesures sont d’autant plus efficaces qu’elles sont combinées.
Réduction de l’humidité relative intérieure ; aspiration, si possible avec filtre à haute efficacité pour les particules aériennes (HEPA) ; changement de la literie si infestation importante ; lavage des draps régulier à température élevée (60 °C) ; housses antiacariens pour le matelas, les couettes et oreillers ; privilégier un sommier à lattes ; vivre à une température ambiante inférieure à 20 °C, aérer largement les chambres.
Blattes : insecticides, interventions spécialisées.
Animaux domestiques : l’idéal est de ne pas en acquérir, la séparation de l’animal étant difficile à accepter et pouvant poser des problèmes relationnels ou psychologiques, en particulier chez l’enfant. Les animaux doivent rester à l’extérieur et ne doivent jamais séjourner dans la chambre à coucher. En cas d’éviction, les allergènes de chat peuvent persister pendant plusieurs mois dans l’habitat après le départ de l’animal.
Moisissures : nettoyage au vinaigre et doivent être évitées, entre autres, par une ventilation suffisante de l’habitat.
L’inhalation des pollens est difficilement évitable en période printanière, l’atmosphère intérieure est cependant moins à risque.
Antihistaminiques
Ce sont des bloqueurs du récepteur H1 à l’histamine, actifs sur la plupart des symptômes de rhinite (en dehors de l’obstruction nasale), de conjonctivite, et sur le prurit.Antihistaminiques de 2e génération : meilleure tolérance que les antihistaminiques de 1re génération, pour une même efficacité ; les molécules les plus courantes : cétirizine et lévocétirizine, loratadine et desloratadine, ébastine. Les effets secondaires discrets sont la somnolence chez certains, la stimulation de l’appétit.
La voie générale est la plus habituelle, la voie locale est disponible pour certaines molécules (soluté nasal et/ou collyre), avec une efficacité comparable au produit per os.
Corticoïdes
Action anti-inflammatoire puissante permettant de juguler la plupart des symptômes de l’allergie respiratoire.Par voie systémique : médicaments de l’urgence (exacerbation d’asthme…).
Leur utilisation au long cours doit en revanche être évitée en raison des effets secondaires. Les molécules le plus souvent utilisées sont : prednisone, prednisolone, méthylprednisolone, dexaméthasone.
Les effets secondaires sont classiques au long cours : rétention hydrosodée, ostéoporose, insuffisance surrénalienne, cataracte, immunosuppression, hypertension artérielle…
Par voie locale (nasale, inhalée, collyre ophtalmique) :
- aucune place dans le traitement symptomatique de l’urgence ;
- permettent de contrôler les allergies respiratoires au long cours et constituent le traitement de fond de choix de l’asthme .
Adrénaline
Il s’agit du traitement de première intention du choc anaphylactique, en urgence par voie intramusculaire.Bronchodilatateurs
Ils sont utilisés par voie inhalée en cas de bronchospasme.Biothérapies
Les anti-IgE : l’omalizumab est la première biothérapie qui a obtenue l’autorisation de mise sur le marché (AMM) dans les pathologies allergiques. Il est recommandé dans la prise en charge des patients asthmatiques sévères allergiques de plus de 6 ans non contrôlés par un traitement de fond composé de fortes doses de corticoïdes inhalés et traitements additionnels et/ou nécessitant une corticothérapie orale.L’AMM a également été obtenue dans la prise en charge de l’urticaire chronique récidivante sévère non contrôlée malgré un traitement systémique.
D’autres biothérapies plus récentes ont obtenu une AMM dans l’asthme sévère hyperéosinophilique, qui peut être allergique (anti-IL-5 ou anti-IL-13/anti-récepteur de l’IL-4).
Immunothérapie spécifique
Principe
Induction d’une tolérance immunitaire en administrant de faibles doses croissantes d’allergène. Les mécanismes d’acquisition de tolérance ont été décrits tant par voie sous-cutanée, sublinguale, orale qu’épicutanée. Utilisée dans les allergies respiratoires, alimentaires et aux venins d’hyménoptères.Modalités pratiques
Voie injectable : actuellement utilisée uniquement pour les venins d’hyménoptères.Des doses d’allergène purifié, standardisé sont injectées par voie sous-cutanée stricte (face externe du bras) par un médecin ou sous son contrôle direct, en respectant les précautions suivantes : abstention de toute injection chez un asthmatique ayant un DEP < 70 % théorique ; absence de prise de bêtabloquants ; possibilité de traiter un choc anaphylactique ; surveillance du malade 30 minutes après l’injection.
Le protocole d’immunothérapie spécifique se déroule avec une induction, ascension progressive des doses, puis espacement jusqu’à 4 semaines, et enfin entretien : injection mensuelle pendant 3 à 5 ans en fonction des allergènes.
Voie sublinguale : voie privilégiée actuellement pour les acariens, pollens d’arbres et graminées. Auto-administration d’une solution allergénique ou de comprimés orodispersibles sous la langue. Dépourvue d’effets secondaires graves.
Études robustes en double aveugle contre placebo pour les graminées, acariens, pollens d’arbres, avec des effets sur le score des symptômes de la rhinite allergique et de l’asthme et de réduction des traitements de secours pour la rhinite et l’asthme, ainsi qu’une diminution de la corticothérapie inhalée chez les patients asthmatiques. L’immunothérapie spécifique fait partie des recommandations GINA dans la prise en charge de l’asthme allergique depuis 2019.
Voie orale : utilisée principalement dans les inductions de tolérance alimentaire.
Contre-indications à l’immunothérapie
Ce sont :- les maladies allergiques non IgE-dépendantes ;
- les dysimmunités (maladies auto-immunes, vascularites, cancer, VIH… ;
- la grossesse (phase d’induction uniquement, la poursuite d’une immunothérapie spécifique étant permise) ;
- l'asthme sévère ;
- les mastocytoses ;
- la prise de bêtabloquants (contre-indication absolue) et d’IEC (relative).
Effets secondaires
Ils sont moins fréquents avec les voies sublinguales :- réaction locale : fréquente, sans incidence sur la poursuite du traitement, diminuant en général au fil des jours ;
- réaction syndromique type asthme, rhinite ou urticaire : elle constitue un signal d’alerte qui peut remettre le traitement en question s’il n’y a pas eu d’erreur technique lors de l’administration d’allergène ;
- réaction générale : hypotension, bronchospasme, choc anaphylactique. Doit faire interrompre le traitement.
Efficacité et surveillance
L’immunothérapie spécifique doit faire la preuve de son efficacité dans la première année (diminution des symptômes et/ou baisse de la consommation médicamenteuse) ; dans les autres cas, elle doit être interrompue. Une observance scrupuleuse du traitement est nécessaire à sa réussite.Après arrêt de l’immunothérapie spécifique entre 3 et 5 ans, la plupart des malades conservent un bénéfice thérapeutique pendant plusieurs années.
Autres dimensions du traitement : éducation thérapeutique
Elle est particulièrement importante dans l’asthme et l’allergie alimentaire. Elle a pour but l’acquisition de compétences de soins et psychosociales par le patient afin d’être autonome dans la gestion de sa maladie.
Des structures spécifiques existent, et le médecin référent doit pouvoir proposer cette approche à son patient.
Il doit également lui fournir et lui expliquer un plan d’action personnalisé tant pour l’asthme que pour les allergies alimentaires et s’assurer de la mise en place d’un projet d’accueil individualisé pour les enfants dans les structures d’accueil telles que l’école ou la crèche. Établi à la demande des parents, le projet d’accueil individualisé est une dérogation au secret professionnel du médecin et permet d’établir un protocole de soins en cas de réaction allergique accidentelle.
POINTS FORTS À RETENIR
Différencier sensibilisation (test cutané et/ou IgE spécifiques positifs) et allergie (sensibilisation associée à des signes cliniques d’allergie, avec relation de cause à effet).
Hypersensibilités allergiques les plus fréquentes : types 1 et 4.
Il est recommandé de faire un bilan allergologique devant tout asthme chez un patient de plus de 3 ans (avant 3 ans, à discuter selon l’interrogatoire et la sévérité de l’asthme).
Le test de provocation orale (TPO) est le gold standard pour le diagnostic de l’allergie alimentaire.
Les piqûres d’insectes sont responsables de près de la moitié de toutes les réactions anaphylactiques chez les adultes en Europe.
Le premier traitement de l’allergie est l’éviction de l’allergène (quand elle est possible).
L’immunothérapie spécifique (anciennement désensibilisation) a fait la preuve de son efficacité dans l’allergie respiratoire (asthme et/ou rhinoconjonctivite) liée aux acariens ou aux pollens, et dans l’allergie au venin d’hyménoptères.
Les allergies professionnelles peuvent faire l’objet d’une déclaration de maladie professionnelle, et d’une réparation.
2. Gomes ER, Demoly P. Epidemiology of hypersensitivity drug reactions. Curr Opin Allergy Clin Immunol 2005;5(4):309‑16.
3. Atanaskovic-Markovic M, Gomes E, Cernadas JR, du Toit G, Kidon M, Kuyucu S, et al. Diagnosis and management of drug-induced anaphylaxis in children: An EAACI position paper. Pediatr Allergy Immunol Off Publ Eur Soc Pediatr Allergy Immunol 2019;30(3):269‑76.
4. Clark S, Camargo CA Jr (2007) Epidemiology of anaphylaxis. Immunol Allergy Clin N Am 2007;27(2):145-63. https://doi.org/10.1016/j.iac.2007.03.002
5. Dhami S, Panesar SS, Roberts G, Muraro A, Worm M, Bilo MB, et al. Management of anaphylaxis: a systematic review. Allergy 2014 69(2):168-75.
6. www.ginasthma.org
7. www.has-sante.fr/upload/docs/application/pdf/2009-05/
8. https://medialibrary.eaaci.org/#
9. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy 2014;69:1026-45.
10. Intradermal Tests With Drugs: An Approach to Standardization. Front. Med., 15 May 2020. | https://doi.org/10.3389/fmed.2020.00156
11. EAACI Food Allergy and Anaphylaxis Guidelines: diagnosis and management of food allergy. Allergy 2014;69:1008-25.
12. www.ginasthma.or

 Encadrés
Encadrés