L’hypertension artérielle (HTA) est fréquente chez les patients insuffisants cardiaques : près de deux tiers d’entre eux ont un antécédent d’HTA.1,2
L’HTA est également un facteur de risque cardiovasculaire majeur impliqué dans le développement de l’insuffisance cardiaque, quel que soit le niveau final de la fraction d’éjection ventriculaire gauche (FEVG) – devenu récemment le paramètre pour classer l’insuffisance cardiaque.3 Par exemple, dans le score H2FpEF (score for heart failure with preserved ejection fraction), qui permet d’estimer la probabilité d’insuffisance cardiaque à fraction d’éjection préservée chez les patients dyspnéiques, l’HTA compte pour 1 point.4 D’une manière générale, à partir de certains seuils (au-delà de 115 mmHg pour la pression artérielle systolique [PAS] et au-delà de 75 mmHg pour la pression artérielle diastolique [PAD]), une augmentation de la pression artérielle prédit une augmentation de l’incidence d’insuffisance cardiaque. Enfin, le contrôle intensif de la pression artérielle apporte le bénéfice le plus prononcé sur le développement de l’insuffisance cardiaque dans l’étude SPRINT (participants âgés de 75 ans et plus).5
Insuffisance cardiaque : diagnostic et classification
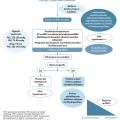
Le diagnostic d’insuffisance cardiaque repose sur plusieurs paramètres cliniques, biologiques (dosage des peptides natriurétiques [BNP et NT-proBNP]) et échographiques.
Les récentes recommandations de prise en charge distinguent trois classes d’insuffisance cardiaque selon le niveau de la FEVG (tableau). En revanche, il n’existe pas, à l’heure actuelle, de recommandations spécifiques pour la prise en charge de l’HTA dans l’insuffisance cardiaque, quelle que soit la forme de cette dernière.
Confirmer l’HTA
Pour poser le diagnostic d’HTA, il convient de s’assurer que la pression artérielle a été mesurée dans des conditions optimales.
Des conditions de mesure bien établies
Pour s’affranchir du fameux « effet blouse blanche », il est nécessaire de confirmer le diagnostic présumé au cabinet par des automesures tensionnelles (sauf si l’HTA est sévère, auquel cas le traitement spécifique est introduit dès la première consultation).
Lors de la première consultation, il est recommandé de mesurer la pression artérielle aux deux bras, puis, lors des consultations suivantes, au bras avec la mesure de pression artérielle la plus élevée (grade 1C). Il est préférable d’utiliser un brassard huméral adapté à la circonférence du bras (plus fiable qu’au poignet) ayant obtenu le marquage « CE » et validé.
Les mesures de pression artérielle au cabinet se font sur plusieurs consultations, en position assise ou couchée après quelques minutes de repos, sans parler ni avoir fumé. Trois mesures doivent être enregistrées, espacées de une à deux minutes. Des mesures supplémentaires doivent être effectuées si les deux premières diffèrent de plus de 10 mmHg (grade 1C).
En automesures tensionnelles, il est recommandé de réaliser 3 mesures le matin et 3 mesures le soir, pendant 7 jours d’affilée (au moins 3 jours). En cas de besoin, les résultats sont confirmés par une mesure ambulatoire de la pression artérielle (MAPA) sur vingt-quatre heures dont la pose et l’interprétation peuvent être faites par des cardiologues de ville ou à l’hôpital.
Ne pas méconnaître une HTA secondaire
La grande majorité des hypertensions artérielles chez le patient insuffisant cardiaque sont d’origine essentielle. Toutefois, il convient de rechercher les points d’appel pouvant orienter vers une HTA secondaire. La vérification de la kaliémie et de la fonction rénale est essentielle à la prise en charge du patient insuffisant cardiaque, particulièrement en cas d’hypertension associée.
Dans un contexte d’hypokaliémie avec HTA sévère ou résistante, il faut savoir évoquer un hyperaldostéronisme primaire, d’autant plus si un nodule surrénalien est visible sur le scanner (TDM) abdominal. Les dosages hormonaux sont difficilement interprétables chez ces patients pour lesquels les traitements antihypertenseurs ne peuvent pas être suspendus (traitements non neutres).
Une HTA résistante ou la survenue d’œdèmes aigus du poumon (OAP) flash à répétition est évocatrice de sténose des artères rénales. Un échodoppler des artères rénales est alors nécessaire.
Chez les patients en surpoids avec somnolence diurne excessive, il est également important de rechercher un syndrome d’apnées obstructives du sommeil (SAOS), possiblement responsable d’un déséquilibre de la pression artérielle.
Quelle prise en charge ?
Il n’existe pas actuellement d’études concernant les objectifs tensionnels et les recommandations thérapeutiques chez les patients insuffisants cardiaques et hypertendus. Les recommandations de prise en charge sont globalement identiques à celles de la population générale (
Objectifs tensionnels : gare à l’hypotension artérielle en cas d’ICFEP
Il n’existe pas de données d’études concernant les objectifs tensionnels dans l’insuffisance cardiaque à fraction d’éjection préservée (ICFEP) ni à fraction d’éjection réduite (ICFER). Les comorbidités (diabète, insuffisance rénale chronique, coronaropathie…) et l’âge des patients aident à préciser ce seuil.6
Une analyse récente de 22 672 patients atteints de coronaropathie stable, traités pour une HTA, mettait en évidence une « courbe en J » avec un risque accru d’événements cardiovasculaires sur un suivi médian de cinq ans lorsque la PAS et la PAD étaient respectivement supérieures ou égales à 140 mmHg et 80 mmHg7 mais également lorsque la PAS était inférieure à 120 mmHg et la PAD à 70 mmHg.6
Cependant, ce phénomène n’est pas mis en évidence dans d’autres études : par exemple, dans l’étude ONTARGET chez des patients coronariens sans insuffisance cardiaque congestive, la réduction de la pression artérielle n’avait pas d’effet sur le risque d’infarctus du myocarde mais permettait une baisse du risque d’accident vasculaire cérébral.8
Les dernières recommandations de la Société européenne de cardiologie proposent de viser une pression artérielle (en automesure et en MAPA) inférieure à 130/80 mmHg mais supérieure à 120/80 mmHg ; pour les patients âgés de plus de 65 ans, la PAS cible doit se situer entre 130 et 140 mmHg.9,10
En cas d’ICFEP, il faut éviter toute hypotension artérielle du fait de l’hypertrophie ventriculaire gauche et donc de la réserve limitée de précharge. En cas d’ICFER, de légères hypotensions artérielles peuvent être tolérées pour atteindre les doses optimales de traitement de l’insuffisance cardiaque.6,11
Éducation thérapeutique : indispensable !
L’éducation thérapeutique occupe une place majeure dans la gestion de ces deux maladies chroniques que sont l’hypertension artérielle et l’insuffisance cardiaque. Elle consiste à respecter un certain nombre de règles hygiénodiététiques (grade 1A) :
– régime hyposodé strict à visée symptomatique (moins de 6 g/j de sel) ;
– arrêt du tabac ;
– limitation de la consommation d’alcool ;
– activité physique régulière ;
– régime alimentaire équilibré, avec consommation de fruits et légumes et d’acides gras insaturés ;
– perte de poids (indice de masse corporelle cible entre 20 et 25 kg/m2).
Traitement médicamenteux : des principes identiques
Les traitements de l’insuffisance cardiaque sont également ceux de l’HTA et restent identiques que le patient soit hypertendu ou non.
La gestion de l’HTA chez les patients insuffisants cardiaques n’est pas différente, et les grandes lignes de traitement sont superposables à celles de la population générale.
En effet, il n’existe pas d’études évaluant les stratégies antihypertensives et les objectifs cibles de pression artérielle chez les patients insuffisants cardiaques hypertendus.
-
Cas de l’insuffisance cardiaque à FEVG réduite
Chez les patients ayant une insuffisance cardiaque à FEVG réduite, la pression artérielle basse est un marqueur d’insuffisance cardiaque avancée. Contrairement à ce qui est observé dans la population générale, l’existence de pressions artérielles basses avant traitement est un facteur prédictif de mortalité chez ces patients.12
L’objectif du traitement antihypertenseur dans cette population est de diminuer à la fois la pré- et la post-charge :
– pour la précharge, avec des diurétiques en cas de symptômes congestifs et/ou hypervolémie symptomatique ;
– pour la post-charge, avec des inhibiteurs du système rénine-angiotensine-aldostérone (SRAA), des antialdostérone et des bêtabloquants, en améliorant le débit cardiaque et la contractilité.
Si la pression artérielle n’est pas assez contrôlée et en l’absence de signes de surcharge surajoutée, un inhibiteur calcique non bradycardisant peut être ajouté (amlodipine ou félodipine).13 Les diurétiques sont utilisés en cas de signes de surcharge hydrique ; ils peuvent baisser la pression artérielle, en particulier lorsque le SRAA est inhibé.
Les alphabloquants n’ont pas d’effet sur la mortalité.
Les inhibiteurs calciques non dihydropyridines (diltiazem, vérapamil) et les antihypertenseurs centraux ne sont pas indiqués en première intention en raison de leurs effets secondaires.14
Les inhibiteurs de l’enzyme de conversion (IEC) apportent un bénéfice cardiovasculaire démontré. Cependant, il convient de rester prudent du fait de la possible augmentation de la créatininémie chez environ 30 % des patients (patients souvent déjà sous diurétiques à forte dose et plus à risque d’hypotension).
L’association valsartan-sacubitril (inhibiteurs des récepteurs de l’angiotensine et de la néprilysine) a également un bénéfice important puisque, comparée aux IEC seuls, elle réduit de 20 % la mortalité cardiovasculaire et les réhospitalisations pour insuffisance cardiaque.15
Les bêtabloquants améliorent la survie des patients ayant une insuffisance cardiaque modérée ou avancée ; le nébivolol et le carvédilol sont particulièrement efficaces pour diminuer la pression artérielle de ces patients.
Les antagonistes des récepteurs des minéralocorticoïdes améliorent la survie dans l’insuffisance cardiaque avancée par leur effet antihypokaliémiant et leur effet préventif sur la cardiotoxicité de l’hyperaldostéronisme.
-
Cas de l’insuffisance cardiaque à FEVG préservée
Les patients ayant une insuffisance cardiaque à fraction d’éjection préservée ont la prévalence d’HTA la plus élevée (entre 60 et 89 %).16 Ils ont également une réponse hypertensive exacerbée à l’effort, pouvant être responsable d’œdème aigu pulmonaire (OAP) hypertensif.17
La stratégie médicamenteuse se calque sur celle des ICFER bien que celle-ci n’ait pas été validée.6
Les traitements antihypertenseurs classiques (IEC/antagonistes de l’angiotensine II [ARA2], diurétiques, bêtabloquants, inhibiteurs calciques) retardent le développement de l’insuffisance cardiaque et préviennent les hospitalisations pour décompensation cardiaque.18
Un patient insuffisant cardiaque est généralement déjà sous traitement cardioprotecteur à doses maximales tolérées : IEC/ARA2, bêtabloquant et antagoniste des récepteurs des minéralocorticoïdes.
Pour un patient stable sur le plan cardiaque mais avec une HTA non contrôlée malgré la bithérapie, il est possible d’ajouter un inhibiteur calcique. Les diurétiques de l’anse sont recommandés pour traiter les signes congestifs. En outre, un traitement diurétique bien conduit apparaît particulièrement efficace pour contrôler la pression artérielle et limiter le développement de la dysfonction diastolique. En effet, dans une étude récente, la combinaison de plusieurs diurétiques (hydrochlorothiazide, furosémide, amiloride) chez des patients ayant une HTA résistante a permis une amélioration des marqueurs biologiques et échographiques de dysfonction diastolique, par rapport à une stratégie antihypertensive classique.19 Cette association reste néanmoins expérimentale et n’est pas recommandée en soins courants.
La diminution de la pression artérielle permet une régression notable de l’hypertrophie du ventricule gauche (HVG).6 Cette réduction de l’HVG est associée à une baisse des événements cardiovasculaires et de la mortalité. Les traitements efficaces sur l’HVG sont principalement les IEC/ARA2 et les inhibiteurs calciques et, dans une moindre mesure, les bêtabloquants et les diurétiques.20
Un mauvais contrôle tensionnel peut amener à la survenue d’épisodes de décompensation cardiaque et à une hospitalisation.
Nouveautés thérapeutiques dans l’insuffisance cardiaque
De nombreux progrès ont émergé ces dernières années dans le traitement de l’insuffisance cardiaque à fraction d’éjection réduite. En revanche, il n’existe pour l’heure aucun traitement ayant montré un bénéfice significatif dans l’insuffisance cardiaque à fraction d’éjection préservée.
Les inhibiteurs du cotransporteur sodium-glucose de type 2 (SGLT2), appelés gliflozines (empagliflozine, canagliflozine, dapagliflozine), ont initialement été développés pour traiter le diabète de type 2, avec une action hypoglycémiante (inhibition du SGLT2 au niveau rénal responsable d’une augmentation de la glycosurie). Les études initiales réalisées avec les gliflozines pour évaluer leur toxicité cardiovasculaire ont mis en évidence une diminution des hospitalisations pour insuffisance cardiaque (étude EMPA-REG).21 En raison de leur effet significatif sur la mortalité, ils sont actuellement recommandés dans le traitement de l’ICFER, de même que les inhibiteurs du SRAA, les bêtabloquants et les antialdostérone (grade 1A). Ce sont actuellement les seuls traitements de l’insuffisance cardiaque n’ayant pas un effet antihypertenseur prononcé. Il existe une petite diminution de pression artérielle sous gliflozine (environ 2 mmHg), potentiellement liée à son effet natriurétique. Le taux d’hypotension artérielle dans les essais conduits chez les insuffisants cardiaques est comparable à ceux observés sous placebo.
Le vériciguat, stimulateur direct de la guanylate cyclase soluble, améliore la vasorelaxation et la fonction cardiaque en produisant du guanosine monophosphate cyclique (GMPc).
Ce traitement peut être envisagé dans le traitement de l’insuffisance cardiaque à fraction d’éjection réduite (grade 2B) avec NYHA de classe II-IV (classification de la New York Heart Association) qui a eu une aggravation de l’insuffisance cardiaque malgré un traitement par IEC (ou association sacubitril-valsartan), bêtabloquant et antagoniste des récepteurs des minéralocorticoïdes. Le vériciguat réduit le risque de mortalité cardiovasculaire et/ou d’hospitalisation pour insuffisance cardiaque ; il permet un abaissement initial de la pression artérielle, notamment chez les patients de plus de 75 ans ou ceux traités également par l’association sacubitril-valsartan. Cependant, la pression artérielle se stabilise rapidement après instauration du traitement, et le taux d’hypotension artérielle rapporté dans les essais cliniques ne semble pas augmenter.22
Que dire à vos patients ?
– L’éducation thérapeutique tient une place majeure dans le contrôle de l’hypertension artérielle, d’autant plus en cas d’insuffisance cardiaque ; le respect des règles hygiénodiététiques est en effet doublement nécessaire (perte de poids, régime hyposodé…).
– Les automesures tensionnelles au domicile doivent pouvoir être réalisées (avec assistance si besoin) et les objectifs individualisés connus du patient.
– Le site www.automesure.com contient des informations utiles.
1. Crespo-Leiro MG, Anker SD, Maggioni AP, et al. European Society of Cardiology Heart Failure Long-Term Registry (ESC-HF-LT): 1-year follow-up outcomes and differences across regions. Eur J Heart Fail 2016;18(6):613‑25.
2. Rapsomaniki E, Timmis A, George J, et al. Blood pressure and incidence of twelve cardiovascular diseases: lifetime risks, healthy life-years lost, and age-specific associations in 1·25 million people. Lancet 2014;383(9932):1899‑911.
3. Ho JE, Enserro D, Brouwers FP, et al. Predicting Heart Failure With Preserved and Reduced Ejection Fraction: The International Collaboration on Heart Failure Subtypes. Circ Heart Fail 2016;9(6):e003116.
4. Reddy YNV, Carter RE, Obokata M, et al. A Simple, Evidence-Based Approach to Help Guide Diagnosis of Heart Failure With Preserved Ejection Fraction. Circulation 2018;138(9):861‑70.
5. Williamson JD, Supiano MA, Applegate WB, et al. Intensive vs Standard Blood Pressure Control and Cardiovascular Disease Outcomes in Adults Aged ≥75 Years: A Randomized Clinical Trial. JAMA 2016;315(24):2673‑82.
6. Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J 2018;39(33):3021‑104.
7. Vidal-Petiot E, Ford I, Greenlaw N, et al. Cardiovascular event rates and mortality according to achieved systolic and diastolic blood pressure in patients with stable coronary artery disease: an international cohort study. Lancet 2016;388(10056):2142‑52.
8. Redon J, Mancia G, Sleight P, et al. Safety and efficacy of low blood pressures among patients with diabetes: subgroup analyses from the ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial). J Am Coll Cardiol 2012;59(1):74-83.
9. Ettehad D, Emdin CA, Kiran A, et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet 2016;387(10022):957‑67.
10. Xie X, Atkins E, Lv J, et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: updated systematic review and meta-analysis. Lancet 2016;387(10017):435-43.
11. Cautela J, Tartiere JM, Cohen-Solal A, et al. Management of low blood pressure in ambulatory heart failure with reduced ejection fraction patients. Eur J Heart Fail 2020;22(8):1357‑65.
12. Kalantar-Zadeh K, Block G, Horwich T, et al. Reverse epidemiology of conventional cardiovascular risk factors in patients with chronic heart failure. J Am Coll Cardiol 2004;43(8):1439‑44.
13. Cohn JN, Ziesche S, Smith R, et al. Effect of the calcium antagonist felodipine as supplementary vasodilator therapy in patients with chronic heart failure treated with enalapril: V-HeFT III. Vasodilator-Heart Failure Trial (V-HeFT) Study Group. Circulation 1997;96(3):856‑63.
14. Cohn JN, Pfeffer MA, Rouleau J, et al. Adverse mortality effect of central sympathetic inhibition with sustained-release moxonidine in patients with heart failure (MOXCON). Eur J Heart Fail 2003;5(5):659‑67.
15. McMurray JJV, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371(11):993‑1004.
16. Chioncel O, Lainscak M, Seferovic PM, et al. Epidemiology and one-year outcomes in patients with chronic heart failure and preserved, mid-range and reduced ejection fraction: an analysis of the ESC Heart Failure Long-Term Registry. Eur J Heart Fail 2017;19(12):1574‑85.
17. Uijl A, Savarese G, Vaartjes I, et al. Identification of distinct phenotypic clusters in heart failure with preserved ejection fraction. Eur J Heart Fail 2021;23(6):973-982.
18. Vaduganathan M, Pareek M, Kristensen AMD, et al. Prevention of heart failure events with intensive versus standard blood pressure lowering across the spectrum of kidney function and albuminuria: a SPRINT substudy. Eur J Heart Fail 2021;23(3):384‑92.
19. Fouassier D, Blanchard A, Fayol A, et al. Sequential nephron blockade with combined diuretics improves diastolic function in patients with resistant hypertension. ESC Heart Fail 2020;7(5):2561-71.
20. Fagard RH, Celis H, Thijs L, et al. Regression of left ventricular mass by antihypertensive treatment: a meta-analysis of randomized comparative studies. Hypertension 2009;54(5):1084‑91.
21. Scheen AJ. Protection cardiorénale avec les inhibiteurs des SGLT2 : d’EMPA-REG OUTCOME à VERTIS CV. Rev Med Suisse 2020;16(703):1483-88.
22. Lam CSP, Mulder H, Lopatin Y, et al. Blood Pressure and Safety Events With Vericiguat in the VICTORIA Trial. J Am Heart Assoc 2021;10(22):e021094.

 Encadrés
Encadrés