objectifs
Expliquer l’épidémiologie, les principales causes et l’histoire naturelle de l’hypertension artérielle de l’adulte.
Réaliser le bilan initial d’une hypertension artérielle de l’adulte.
Argumenter l’attitude thérapeutique et planifier le suivi du patient (voir item 326).
Décrire les principes de la prise en charge au long cours.
Définition et épidémiologie
Définition
La distribution des pressions artérielles (PA) dans la population est continue, sans rupture de courbe franche. La pression sanguine normale est de 130 mmHg pour la systolique (PAS) et 85 mmHg pour la diastolique (PAD). En revanche, il existe une relation forte, indépendante, continue, progressive, constante, ayant une valeur de prédiction entre le niveau de la PA et l’incidence des accidents cardiaques (insuffisance ventriculaire gauche) et vasculaires (accidents coronariens aigus, accident vasculaire cérébral [AVC]).
Les limites de l’hypertension artérielle (HTA) sont définies en fonction des niveaux de PA à partir desquels le risque cardiovasculaire augmente de façon significative et rapidement progressive, mais baisse en revanche si une intervention thérapeutique ramène la pression artérielle à des valeurs plus basses. Le
Pour porter le diagnostic d’HTA, les mesures de consultation sont à confirmer par des mesures en ambulatoire par automesure ou MAPA. Le
Épidémiologie
Histoire naturelle et bénéfices du traitement
La PA est un indicateur indépendant du risque vasculaire. L’indication du risque est fournie autant par la PAS que par la PAD. En revanche, au-delà de 60 ans, la PAS et la pression pulsée (différence entre la PAS et la PAD) deviennent les indicateurs dominants.
Chez les hypertendus, et comparés à des normotendus, la mortalité cardiovasculaire est doublée du fait d’une plus grande incidence des :
- accidents vasculaires cérébraux (× 7) ;
- insuffisance cardiaque (× 4) ;
- insuffisance coronarienne (× 3) ;
- artériopathie des membres inférieurs (× 2).
La réversibilité du risque par correction des chiffres tensionnels par les médicaments antihypertenseurs (bénéfice relatif) a été montrée par les études interventionnelles randomisées. Une méta-analyse de 2015 indique que pour une réduction de PAD de 5 mmHg et une réduction de 10 mmHg de la PAS sur une durée de 5 ans, il est observé une diminution du risque d’insuffisance cardiaque de 46 %, d’accident vasculaire cérébral de 37 %, de cardiopathie ischémique de 22 %.
De plus, le suivi d’un traitement antihypertenseur pendant 5 ans chez des hypertendus permet d’observer une diminution du risque de mortalité cardiovasculaire de 20 % et de mortalité totale de 12 %.
Prévalence
L’HTA est la maladie chronique la plus fréquente dans le monde, elle affecte plus de 1,5 milliard des sujets. En France, en 2019, 10,2 millions de patients sont traités par des médicaments antihypertenseurs, soit 28 % de la population des sujets de 35 ans et plus. À titre de comparaison, les sujets traités pour une dyslipidémie sont 17 % (6,1 millions) et ceux traités pour un diabète sont 9 % (3,2 millions). Au total, 35 % (13 millions) des sujets âgés de 35 et plus sont traités pour au moins un de ces trois facteurs de risque cardiovasculaire. Chez les sujets de 75 ans et plus, 59 % de la population est traitée pour une HTA (3,6 millions).
La prévalence de l’HTA augmente avec l’âge et, en France, 80 % des hypertendus sont âgés de plus de 55 ans. Avant 55 ans, l’HTA systolo-diastolique (PAS et PAD élevées) prédomine, et après 70 ans, c’est l’HTA systolique (PAS et PP élevées) qui est la plus fréquente. En conséquence, le nombre des sujets traités par antihypertenseurs augmente avec l’âge. Il est de 3,6 millions chez les 75 ans et plus, de 5,5 millions chez les 55-74 ans, et de 1,3 million chez les 35-44 ans.
L’HTA est plus fréquente chez les sujets en surpoids, chez les sujets dont le père ou la mère a été hypertendu avant l’âge de 55 ans, chez les consommateurs de sel en excès (> 12 g/j), chez les diabétiques de type 2.
L’HTA est un des facteurs de risque principaux de l’athérosclérose, et le risque cardiovasculaire est augmenté en cas de concomitance avec d’autres facteurs de risque (tabagisme, dyslipidémie, diabète, obésité abdominale).
Physiopathologie
Rappel des systèmes régulateurs
La régulation à court terme de la PA est sous la dépendance du système nerveux. Le baroréflexe carotidien et aortique, dont les noyaux régulateurs sont situés dans la réticulée du tronc cérébral, est en connexion par les voies sympathiques efférentes et afférentes avec les reins, le cœur, les vaisseaux, les surrénales. Les neuromédiateurs sont α1-adrénergiques vasoconstricteurs ou β2-adrénergiques vasodilatateurs.
La régulation à moyen terme de la PA passe par la volémie et les mécanismes de régulation de la vasomotricité. Le système rénine-angiotensine-aldostérone (SRAA) joue un rôle majeur. Les cellules juxtaglomérulaires synthétisent la rénine, avec une régulation en partie dépendante des récepteurs β-adrénergiques. La rénine transforme l’angiotensinogène en angiotensine 1. L’enzyme de conversion transforme l’angiotensine 1 en angiotensine 2. L’angiotensine 2, en se fixant sur les récepteurs AT1, induit une vasoconstriction et provoque la sécrétion de l’aldostérone. L’angiotensine 2 est un peptide qui possède de nombreuses autres propriétés (inflammatoire, oxydante, fibrosante). La vasomotricité rénale et les actions sur la réabsorption du sodium sont sous l’action des composants du SRAA et d’autres peptides (ANP, BNP) qui participent de façon complexe à la régulation de la PA.
La régulation à long terme se fait par le phénomène dit de natriurèse de pression, qui correspond à une excrétion d’ions sodium par le rein en cas de surcharge de pression, avec une régulation par de nombreux systèmes, dont le système arginine-vasopressine.
D’autres systèmes interviennent dans la régulation de la pression artérielle qui agissent sur l’endothélium vasculaire : NO, bradykinine, endothéline.
Hypothèses physiopathologiques
Dans 90 % des cas, l’HTA est dite essentielle ou primaire, mais les facteurs les plus fréquemment associés sont le vieillissement artériel, le surpoids et l’hérédité. Dans 10 % des cas, l’HTA est dite secondaire à une pathologie rénale, surrénale ou artérielle. Les causes iatrogènes (médicaments, réglisse, toxiques) sont anecdotiques et réversibles. Des causes génétiques (anomalies rénales et surrénales) sont exceptionnelles.
Une augmentation de la contraction des artérioles est observée dans l’HTA essentielle du sujet de moins de 50 ans avec élévation de la PAD. La perte de souplesse des artères (baisse de la compliance) est observée dans l’HTA essentielle du sujet de plus de 60 ans avec élévation de la PAS. Ces anomalies du système artériel observées dans l’HTA essentielle font considérer aujourd’hui l’HTA essentielle comme une maladie du système artériel.
Un défaut des capacités d’excrétion du sodium par le rein a été montré comme étant un des mécanismes de l’HTA essentielle. Cette perturbation ne concerne que 40 % des hypertendus essentiels, qui sont décrits comme « sensibles au sel ». Pour dépister ces patients, il faut observer les conséquences sur la PA d’un régime alimentaire avec une réduction de 5 g/j de chlorure de sodium sur une période d’au moins une semaine.
Les autres mécanismes de l’HTA essentielle impliquent : le système nerveux sympathique, le système rénine-angiotensine-aldostérone, l’endothélium vasculaire. Il n’est pas possible actuellement de caractériser au cours de la prise en charge clinique le rôle joué par ces trois causes dans l’HTA essentielle du patient.
L’HTA essentielle est une maladie familiale chez 15 % des hypertendus. Elle débute chez un adulte avant l’âge de 30 ans avec une HTA chez le père ou la mère avec un début avant l’âge de 50 ans. Cette HTA est de cause polygénique, sans aujourd’hui de possibilité de réaliser un test génétique.
Certains comportements du mode de vie agissent comme facteurs favorisants de la survenue d’une HTA essentielle : la consommation excessive de sel (plus de 12 g/j de sodium sous forme de chlorure ou de glutamate), la prise de poids, les apports insuffisants en potassium contenu dans les aliments (fruits, légumes, graines), la sédentarité, la consommation excessive d’alcool.
Manifestations cliniques, complications et évolution
Circonstances de découverte
Le plus souvent, l’HTA est totalement asymptomatique et n’est qu’une découverte faite dans le cadre d’une visite médicale de prévention (médecine du travail) d’un acte médical autre.
Il devrait être suspecté une HTA en cas de signes cliniques : céphalées récentes, occipitale parfois battante, répondant bien aux antalgiques simples, phosphènes, acouphènes, pseudo-vertiges, nervosité, insomnie.
L’épistaxis n’est pas un critère de gravité de l’HTA.
Il n’est pas justifié de débuter un traitement antihypertenseur sans avoir confirmé le diagnostic d’une HTA par automesure ou MAPA.
Les symptômes disparaissent habituellement avec le traitement de l’HTA.
Complications
L’HTA peut être compliquée, avec une survenue de manière inaugurale ou chez un hypertendu connu et sous traitement antihypertenseur.
Complications neurologiques
Accident ischémique (80 % des AVC dans l’HTA) :
- lésion de lacunes (spécifique de l’HTA) ;
- lésion des grosses artères thrombotiques (embolique après troubles du rythme cardiaque, fibrillation atriale fréquente chez l’hypertendu).
Hémorragie cérébrale (20 % des AVC dans l’HTA) :
- intraparenchymateuse par rupture de micro-anévrisme ou du fait d’une lésion d’angiopathie amyloïde, méningée (dans cette éventualité, une association avec une malformation vasculaire est souvent retrouvée), parfois cérébroméningée ;
- encéphalopathie hypertensive, possible dans toutes les formes d’hypertension mais surtout dans les hypertensions s’élevant vite (hypertension maligne, toxémie gravidique, glomérulonéphrite aiguë) : céphalées récentes ne cédant pas aux antalgiques, troubles de la vision, convulsions, vomissements, troubles de la conscience, PRES syndrome ;
- démence vasculaire (l’HTA à 50 ans est un facteur de risque de démence après 70 ans) ;
- rétinopathie hypertensive de stade 4 : œdème papillaire et hémorragie rétinienne, au cours de l’encéphalopathie hypertensive. Présence indispensable pour le diagnostic de « l’HTA maligne ».
Complications cardiovasculaires
Insuffisance cardiaque systolique, conséquence des atteintes ischémiques et nécrotiques liées à l’insuffisance coronarienne. Il s’agit alors d’une insuffisance ventriculaire gauche avec diminution de la fraction d’éjection sur un cœur à la fois dilaté et hypertrophié (HVG).
Insuffisance ventriculaire gauche par anomalie du remplissage ventriculaire (troubles de la compliance et de la relaxation), insuffisance cardiaque dite à fonction systolique conservée (fraction d’éjection normale) sur un cœur hypertrophié et non dilaté.
Cardiopathie ischémique : SCA, angor, infarctus du myocarde. L’angine de poitrine chez un hypertendu peut être liée à une athérosclérose coronaire ou à l’HTA elle-même (diminution de la réserve coronaire due à l’HVG) ou aux deux.
Fibrillation atriale (FA) dont l’HTA est la première cause (un sujet en fibrillation atriale sur deux est hypertendu). La phase d’installation de la FA est parfois très mal tolérée, marquée par une insuffisance cardiaque aiguë due au fait que le raccourcissement de nombreuses diastoles (tachyarythmie) et la perte de la systole auriculaire sont particulièrement mal supportés par le ventricule lorsqu’il connaît des difficultés de remplissage liées à l’HVG. L’HTA est un facteur de risque thromboembolique au cours de la FA (1 point dans le score CHADS2).
Enregistrements électriques continus : ils montrent la fréquence d’épisodes de tachycardie ventriculaire méconnus. L’incidence des arythmies ventriculaires est d’autant plus importante qu’il existe une HVG et une ischémie.
Risque de mort subite : il est multiplié par 3 chez l’hypertendu.
Complications artérielles liées à l’athérosclérose : artériopathie des membres inférieurs, sténose carotidienne, anévrisme de l’aorte abdominale…
Mortalité cardiovasculaire : elle est accrue chez l’hypertendu, multiplié par 5 chez l’homme et par 3 chez la femme.
Complications rénales
Néphropathie vasculaire : la néphro-angiosclérose peut évoluer vers l’insuffisance rénale par réduction néphronique qui, à son tour, aggrave l’HTA. Un signe précoce est l’apparition d’une albuminurie modérée (> 30 mg/24 h).
L’HTA est associée à la majorité des néphropathies (glomérulaires, tubulaires) et fréquente au cours de la polykystose rénale.
Sténose de l’artère rénale (uni- ou bilatérale) : c’est une cause d’HTA secondaire dont la recherche est systématique dans l’HTA de début brutal chez le sujet jeune (sténose par fibrodysplasie) et chez le sujet avec athérome (fumeur, dyslipidémique, diabétique).
Au cours du suivi de l’HTA traitée par antihypertenseurs, le suivi de la fonction rénale est indispensable, par le dosage de la créatininémie de façon annuelle chez les sujets sous inhibiteur de l’enzyme de conversion (IEC), antagoniste des récepteurs de l’angiotensine 2 (ARA II), diurétique, et chez le sujet diabétique, chez l’athéromateux et chez le sujet âgé de plus de 70 ans.
Une dégradation de la fonction rénale peut s’observer :
- chez l’hypertendu avec insuffisance cardiaque (hypoperfusion rénale par bas débit, majoration du traitement diurétique, introduction d’un IEC ou d’un ARA II) ;
- en cas de déshydratation (diarrhée, vomissements, forte chaleur) ;
- après prescription d’un IEC ou d’un ARA II en cas de sténose bilatérale des artères rénales ou de sténose de l’artère d’un rein unique ;
- après prescription d’un anti-inflammatoire non stéroïdien (AINS), en particulier chez le sujet âgé ;
- en cas de baisse de la PA chez l’hypertendu sévère (baisse de la filtration glomérulaire) et celle-ci devra être respectée si l’élévation de la créatinine reste inférieure à 20-25 %.
Urgences hypertensives
L’urgence hypertensive est différente de la « poussée hypertensive », qui se définit par une HTA de grade III (HTA > 180-110 mmHg) sans signe de complication cardiaque, neurologique ou rénale.
L’urgence hypertensive (dont fait partie l’HTA maligne ; cf. infra) se caractérise par une HTA sévère (ou installée rapidement chez un patient normotendu) qui est associée à une complication aiguë d’un « organe cible » (cœur, cerveau, œil, rein, aorte).
Les principales urgences hypertensives sont :
- l’AVC d’origine ischémique (80 %) ou hémorragique (20 %) ; l’HTA sévère ne doit pas être traitée avant la réalisation du bilan d’imagerie cérébrale ;
- l’insuffisance ventriculaire gauche (OAP) secondaire à une poussée d’HTA, qui impose une baisse rapide de la PA ;
- la dissection aortique, qui impose une baisse de la PA rapide ;
- l’encéphalopathie hypertensive (PRES syndrome), qui impose baisse rapide de la PA ;
- l’insuffisance cardiaque aiguë (maladie deTako-Tsubo) du phéochromocytome, qui impose une assistance circulaire en urgence ;
- l’éclampsie, qui impose l’extraction fœtale en urgence ;
- l’HTA maligne avec insuffisance rénale aiguë et syndrome hémolytique et urémique, qui impose une prise en charge spécialisée en réanimation.
L’urgence hypertensive est rare, mais le pronostic vital est engagé et impose une prise en charge hospitalière en unité de soins intensifs.
Le traitement de l’urgence hypertensive impose le plus souvent une baisse rapide de la PA à l’aide d’antihypertenseurs administrés par voie injectable. Un monitoring de la PA est indispensable afin de surveiller et d’éviter une chute trop rapide de la PA.
En cas de complications neurologiques (accident vasculaire cérébral), l’usage des antihypertenseurs d’action rapide est contre-indiqué avant la réalisation d’un bilan radiologique spécialisé (imagerie par résonance magnétique ou tomodensitométrie) qui guidera la stratégie du traitement selon la nature de la complication. Le risque est celui d’une hypoperfusion cérébrale avec aggravation de l’ischémie du fait de la perte de l’autorégulation du débit cérébral.
HTA maligne
Elle est devenue plus rare aujourd’hui grâce à la prise en charge des HTA à un stade débutant. Elle doit être suspectée chez les sujets ayant un accès limité à la médecine de prévention (population immigrée).
Les causes déclenchantes sont mal connues. L’HTA maligne s’accompagne toujours d’une hypovolémie et d’un hyperaldostéronisme secondaire avec hypokaliémie. Les diurétiques sont contre-indiqués, mais les IEC et les ARA II sont d’une grande efficacité.
L’HTA maligne se définit par une PA très élevée (PAD >130 mmHg, PAS > 220 mmHg) et une rétinopathie hypertensive de stade IV (œdème papillaire, hémorragie rétinienne).
La recherche des complications cardiaques (insuffisance ventriculaire gauche), rénales (insuffisance rénale aiguë avec protéinurie abondante et hématurie) et neurologiques (PRES syndrome, avec cécité centrale et lésions IRM occipitales) doit être systématique.
Parfois, le tableau clinique est trompeur :
- céphalée banale mais rapidement évolutive ;
- asthénie, amaigrissement, avec altération de l’état général ;
- troubles digestifs (douleurs abdominales, nausées, vomissements), soif, signes de déshydratation ;
- cécité brutale, comitialité, vomissements (PRES syndrome) ;
- anémie et troubles de l’hémostase (CIVD)
Le traitement de l’HTA maligne utilise les antihypertenseurs, à l’exclusion des diurétiques, qui sont tous très efficaces, en particulier les IEC ou les ARA II. La bonne efficacité des médicaments permet la résolution rapide des symptômes et des atteintes viscérales. Une altération de la fonction rénale séquellaire est fréquente si le traitement antihypertenseur a été mis en route tardivement. La récupération neurologique est en revanche complète et sans séquelles.
Bilan initial
La prise en charge initiale lors de la découverte d’une HTA doit : 1) confirmer l’HTA par une automesure ; 2) entreprendre un bilan biologique minimal ; 3) débuter les mesures non médicamenteuses pour en évaluer l’efficacité sur le contrôle de la PA ; 4) débuter un traitement médicamenteux par une monothérapie après la réalisation du bilan initial.
Mesure de la pression artérielle
Pression artérielle de consultation
La méthode traditionnelle est la méthode auscultatoire, mais il est aujourd’hui recommandé de se servir de tensiomètres automatiques qui utilisent la méthode oscillométrique (PAS détectée et PAD calculée par un algorithme).
Pour toutes les mesures de la PA réalisées au cabinet médical ou à domicile par le patient lui-même (automesure), les recommandations sont les suivantes :
- sujet assis (recommandé), mais la position allongée est possible, au repos physique et psychique depuis > 5 minutes, à distance de plus de 30 minutes d’un effort physique ou de l’exposition au tabac ;
- réalisation d’au moins trois mesures espacées chacune de 1 minute ;
- utilisation d’un brassard adapté à la circonférence du bras. Brassard de taille 42 cm est nécessaire chez le patient en surpoids ou obèse ;
- utilisation d’un tensiomètre automatique (recommandé) avec brassard positionné sur le bras ;
- si le tensiomètre se positionne sur le poignet, la main doit être à la « hauteur du cœur » (position bras croisés pendant la mesure) ;
- réaliser la moyenne des deux dernières mesures.
Mesurer la PA aux deux bras à la première consultation pour rechercher une asymétrie tensionnelle (différence pour la PAS de plus de 30 mmHg, une sténose de l’artère sous-clavière doit être alors suspectée et recherchée par la réalisation d’un écho-Doppler).
Mesurer la PA à 1 minute après le passage en position debout permet de dépister une hypotension orthostatique, notamment chez le sujet âgé et chez le diabétique.
Si la pression artérielle est variable, un effet blouse blanche est suspecté, et la réalisation d’une automesure ou d’une MAPA est indispensable.
La comparaison des mesures faites par le médecin à celles faites par le patient permet d’éviter les erreurs de diagnostic :
- l’effet blouse blanche : PA de consultation élevée alors que l’automesure ou la MAPA donnent des valeurs plus basses (20-35 % ; plus fréquente après 55 ans).
- l’HTA masquée : PA normale en consultation, alors que l’automesure ou MAPA donne des valeurs plus élevées (10-15 % ; plus fréquente avant 55 ans).
La différence des valeurs entre la PAS et la PAD (PAS - PAD) est appelée pression pulsée (PP), qui est un reflet de la rigidité des artères, on parle d’élévation de la PP au-delà de 60 mmHg.
Automesure à domicile
L’automesure tensionnelle à domicile (mesure de la PA par le sujet lui-même) est, en France, l’examen recommandé pour confirmer le diagnostic d’une HTA.
La moyenne des PA sur au moins 3 jours d’automesure apporte une prédiction du risque cardiovasculaire supérieure à celle des PA mesurées par un professionnel de santé au cours d’une visite unique.
La PA moyenne en automesure est corrélée à l’atteinte cardiaque (HVG).
Il est recommandé d’utiliser des appareils automatiques avec brassard positionné sur le bras.
Les appareils avec mesure sur le poignet sont validés, mais les risques d’erreur lors de leur usage par les patients sont plus nombreux, et leur usage n’est donc pas recommandé.
Une éducation du patient est nécessaire pour le bon usage de l’automesure. Des applications pour smartphone apportent une aide pour réaliser l’automesure et pour mémoriser les données (ex : depist-Tension).
Les recommandations pour la réalisation du « relevé d’automesure » sont :
- calme, position assise, pas de tabac 30 minutes avant, ne pas parler pendant les mesures ;
- le matin 15 minutes après le lever, réalisation de 3 mesures consécutives à 2 minutes d’intervalle ;
- le soir avant le coucher, 3 mesures le soir ;
- 3 jours de suite (règle des 3).
L’interprétation est faite sur la moyenne des 18 mesures.
Une HTA est définie si la moyenne est : PAS > 135 mmHg ou PAD > 85 mmHg :
- chez le sujet âgé de 80 ans et plus, une HTA est définie par : PAS > 140 mmHg ;
- l’objectif optimal est d’obtenir une PAS entre 110 et 130 mmHg et une PAD entre 70 et 80 mmHg.
Le
Mesure ambulatoire de la pression artérielle (MAPA)
La MAPA est un examen qui permet la mesure automatique de la PA indépendamment du patient et du médecin. La mesure de la PA pendant le sommeil est possible, ce qui procure une information très pertinente pour évaluer le risque cardiovasculaire du patient (la PA nocturne est plus précise que la PA de jour pour évaluer le risque CV d’un sujet).
La MAPA doit être faite sur 24 heures et correspondre à une période d’activité habituelle. Le brassard doit être adapté à la taille du bras. Le déroulement de l’examen est expliqué au patient. Celui-ci doit recevoir un journal d’activité servant à consigner les heures réelles de coucher et de lever, éventuellement les heures de prise de médicaments ou l’horaire d’apparition d’un symptôme.
Il est recommandé de procéder à des mesures suffisamment rapprochées, soit une mesure toutes les 15 minutes ou encore une mesure toutes les 15 minutes pendant la période diurne et toutes les 30 minutes pendant la période nocturne.
Avec la MAPA, une HTA est définie si la moyenne des PA est > 135/85 mmHg en période de jour ou > 120-70 mmHg en période de nuit, ou 130/80 mmHg sur 24 heures.
Le
Évaluation initiale du patient hypertendu
Ce bilan comporte deux aspects : le bilan étiologique et le bilan de gravité (reposant sur le degré d’élévation des chiffres tensionnels, la présence de signes cliniques d’atteinte viscérale et/ou de manifestations infracliniques d’atteinte d’un organe cible et la présence de facteurs de risque).
Interrogatoire
Il précise :
- l’ancienneté de l’HTA et les valeurs antérieures, le traitement antihypertenseur antérieur (efficacité, effets secondaires éventuels) ;
- les facteurs de risque associés : dyslipidémie, diabète, tabagisme, antécédents familiaux cardiovasculaires précoces, habitudes alimentaires (graisses animales, aliments riches en sel, alcool), activité physique, obésité ou prise de poids, ronflements et apnées du sommeil ;
- les antécédents et symptômes évocateurs d’une atteinte des organes cibles ;
- les antécédents de maladie coronaire, d’insuffisance cardiaque, d’accident vasculaire cérébral, d’atteinte vasculaire périphérique, de néphropathie.
Il examine :
- le cerveau et les yeux : céphalées, vertiges, troubles visuels, accident ischémique transitoire (AIT), déficit sensitif ou moteur ;
- le cœur : palpitations, douleur thoracique, dyspnée, œdèmes des membres inférieurs ;
- le rein : soif, polyurie, nycturie, hématurie ;
- les périphériques : extrémités froides, claudication intermittente ;
- les symptômes évocateurs d’une HTA secondaire.
Il note :
- l’histoire familiale de néphropathie (polykystose familiale) ou de polyendocrinopathie ;
- les maladies rénales, infections urinaires, hématurie, consommation d’antalgiques (néphropathie parenchymateuse) ;
- les médicaments contraceptifs oraux, réglisse et boissons anisées, carbénoxolone, gouttes nasales vasoconstrictrices, cocaïne, amphétamines, corticoïdes, AINS, érythropoïétine, ciclosporine, dérivés de l’ergot de seigle ;
- les céphalées, sueurs, palpitations (triade de Ménard du phéochromocytome) ;
- la faiblesse musculaire, la tétanie (hyperaldostéronisme primaire).
Examen clinique du bilan initial
Il recherche :
- signes évocateurs d’une atteinte des organes cibles :
. cerveau : souffles carotidiens, déficit moteur ou sensitif,
. cœur : tachycardie, troubles du rythme, galop, râles pulmonaires, œdèmes des membres inférieurs,
. artères périphériques, absence, diminution ou asymétrie des pouls, extrémités froides, lésions cutanées d’allure ischémique ;
- signes évocateurs d’une HTA secondaire :
. souffle précordial, diminution ou abolition des pouls fémoraux (coarctation),
. souffle aortique abdominal (HTA rénovasculaire),
. gros reins palpables (polykystose),
. signes cutanés de neurofibromatose (phéochromocytome),
. éléments du syndrome de Cushing ;
- une obésité viscérale :
. poids, indice de masse corporelle : surpoids ≥ 25 kg/m2 ; obésité ≥ 30 kg/m2,
. tour de taille en position debout : homme > 102 cm ; femme > 88 cm.
Examens complémentaires du bilan initial
Le but de ces examens est de rechercher une HTA secondaire, d’autres facteurs de risque pour évaluer le niveau de risque cardiovasculaire, une atteinte infraclinique des organes cibles :
- kaliémie ;
- créatinine, estimation de la clairance de la créatinine (formule de Cockcroft et Gault) ou de la filtration glomérulaire (formule MDRD) ;
- bandelette réactive urinaire pour recherche de protéinurie et d’hématurie, quantification si bandelette positive sur échantillon d’urine ;
- glycémie à jeun, test de tolérance au glucose si glycémie à jeun ≥ 5,6 mmol/L (≥ 1 g/L) ;
- cholestérol total, HDL-cholestérol, triglycérides, calcul du LDL ;
- ECG de repos.
Le calcul du risque cardiovasculaire sera effectué soit par l’utilisation de calculateurs, soit par l’usage de la grille de risque SCORE*.
Atteinte infraclinique et cœur
ECG de repos :
- HVG (la présence de signes électriques d’HVG traduit une HVG déjà importante, car l’ECG est un examen relativement peu sensible) ;
- séquelles d’un infarctus du myocarde passé inaperçu (éventualité non exceptionnelle) ;
- anomalies de la repolarisation, d’interprétation plus difficile car les conséquences électriques de l’HVG (surcharge ventriculaire gauche) ou d’une ischémie associée ont des expressions assez voisines ;
- troubles de la repolarisation en relation avec le traitement (par exemple, un traitement diurétique abaissant la kaliémie) ;
- hypertrophie atriale gauche ;
- troubles du rythme, notamment fibrillation atriale ;
- ECG de départ normal qui peut ultérieurement servir de repère en cas d’accident évolutif.
Échocardiographie (pas de réalisation dans le bilan initial chez le sujet asymptomatique) :
- plus sensible que l’ECG pour dépister une HVG et prédire le risque cardiovasculaire. Elle améliore la stratification du risque (géométrie, HVG concentrique de plus mauvais pronostic, taille de l’oreillette gauche) et aide du choix de la thérapeutique ;
- HVG définie par une masse VG >125 g/m² chez l’homme et 110 g/m² chez la femme ;
- étude de la fonction VG, d’abord anomalies du remplissage (doppler transmitral) puis diminution des indices de fonction systolique. La dysfonction diastolique est fréquente chez l’hypertendu (même en l’absence d’HVG) et explique une grande partie des insuffisances cardiaques chez le sujet âgé.
Atteinte infraclinique et vaisseaux (pas de réalisation dans le bilan initial chez le sujet asymptomatique)
L’échographie des carotides avec mesure de l’épaisseur intima-média (> 0,9 mm au niveau de la carotide primitive) et recherche de plaques athéromateuses (bifurcations, carotides internes) affine la stratification du risque.
Un indice de pression systolique cheville-bras < 0,9 est le signe d’une artériopathie des membres inférieurs.
La mesure de la vitesse de l’onde de pouls carotido-fémorale (disponibilité encore limitée en dehors des centres de recherche), reflet de la rigidité artérielle des grosses artères, a une valeur prédictive indépendante pour la mortalité, la morbidité cardiovasculaire, les événements coronariens et les AVC.
Atteinte infraclinique et rein
Une augmentation de la créatinine ou une baisse de la clairance de la créatinine sont le reflet d’une baisse de la filtration glomérulaire, alors que la présence d’une protéinurie traduit une altération de la surface filtrante.
On parle de micro-albuminurie de 30 à 300 mg/24 h et de protéinurie au-delà de 500 mg/24 h.
La recherche de micro-albuminurie n’est systématique que chez le diabétique.
Fond d’œil (pas de réalisation dans le bilan initial chez le sujet asymptomatique)
Les stades 1 (rétrécissement artériolaire focal ou diffus) et 2 (signe du croisement) correspondent à des altérations artériolaires peu spécifiques, sauf chez les sujets jeunes.
Au contraire, les stades 3 (hémorragies ou exsudats) et 4 (œdème papillaire) sont associés à un risque accru d’événements cardiovasculaires.
Hypertensions artérielles secondaires
Quand en faire le dépistage ?
Sur point d’appel obtenu lors de l’interrogatoire précis, de l’examen clinique et des examens biologiques simples du bilan initial :
- en cas d’HTA de grade III ;
- en cas d’âge < 30 ans ;
- en cas d’HTA résistante.
Néphropathies parenchymateuses
Glomérulopathies chroniques et polykystose rénale représentent les causes les plus fréquentes d’HTA secondaire d'origine rénale.
En cas de palpation de masses abdominales bilatérales (polykystose rénale), on réalise une échographie abdominale : taille des reins, contour, épaisseur corticale, obstacle sur les voies excrétrices, ou tumeurs.
Créatinine, protéinurie, examen du sédiment urinaire (hématies et leucocytes).
HTA rénovasculaire
Elle doit être suspectée d’autant plus qu’une artériopathie des membres inférieurs ou des facteurs de risque d’athérosclérose sont présents.
Cause la plus fréquente : sténose par athérosclérose et/ou thrombose touchant le tiers proximal de l’artère.
La dysplasie fibromusculaire, plus rare, touche la femme jeune, et les deux tiers distaux de l’artère.
Diagnostic clinique devant un souffle abdominal latéralisé ou un OAP récidivant sans explication évidente d’ordre cardiaque.
Diagnostic biologique en cas d’hypokaliémie associée à un hyperaldostéronisme secondaire (augmentation de la rénine et de l’aldostérone plasmatique) ou devant une insuffisance rénale.
Diagnostic échographique par mesure de la taille des reins, une différence de plus de 1,5 cm entre les deux reins est retrouvée dans 60-70 % des cas. Le Doppler couleur permet le diagnostic de sténose de l’artère rénale, surtout dans les formes ostiales, et détermine un indice de résistance utile dans la discussion d’une éventuelle angioplastie.
Confirmation du diagnostic par l’angioscanner abdominal qui permet la visualisation de l’aorte, des artères rénales principales et secondaires, une évaluation du pourcentage de sténose par analyse automatisée. La visualisation des surrénales est possible au cours du même examen, ce qui en fait aujourd’hui l’examen de première intention dans le bilan d’une HTA secondaire.
L’artériographie rénale, examen de référence, n’est réalisée que dans l’idée de pratiquer une angioplastie.
Traitement : la revascularisation par angioplastie doit faire l’objet d’une discussion préalable pluridisciplinaire. L’angioplastie avec pose d’une endoprothèse est proposée dans la sténose athéromateuse en cas de lésion bilatérale ou d’HTA récente. Le taux de resténose est de 10 à 20 %. Le taux de guérison de l’HTA de 20 à 30 %. La poursuite d’un traitement par IEC ou ARA II n’est pas indiquée dans les formes avec sténoses bilatérales.
L’angioplastie sans stent seule est le traitement pour les sténoses par fibrodysplasie, mais le taux de guérison de l’HTA est de 50 à 70 %.
Phéochromocytome
Cause très rare, associée à une HTA dans seulement 70 % des cas.
HTA permanente ou paroxystique et alors accompagnée de la triade de Ménard associant céphalées, sueurs, palpitations.
Troubles du rythme possibles, polyglobulie, hyperleucocytose.
Plusieurs affections familiales sont associées au phéochromocytome devant faire proposer aux patients et à leur famille des tests génétiques :
- néoplasie endocrinienne multiple de type 2 (NEM 2) ;
- maladie de von Hippel-Lindau ;
- neurofibromatose de type 1 ;
- paragangliomes familiaux.
Diagnostic sur le dosage urinaire des métanéphrines et catécholamines.
Localisation de la tumeur par scanner et surtout IRM des surrénales (hypersignal en T2). Scintigraphie à la méta-iodobenzylguanidine (MIBG) pour localiser un phéochromocytome extrasurrénalien ou des métastases, TEP scanner.
Traitement par alphabloquants débuté à petites doses, puis augmenté progressivement et associé aux bêtaloquants. Exérèse chirurgicale de la tumeur par laparoscopie à risque de poussée hypertensive, déplétion volémique avec hypotension sévère.
Hyperaldostéronisme primaire ou syndrome de Conn
Il est dû à un adénome surrénal (30 %) ou à une hyperplasie bilatérale des surrénales (70 %), exceptionnellement à un corticosurrénalome malin.
Le dépistage, par le dosage de la kaliémie, de l’hypokaliémie (< 3,7 mmol/L) doit faire rechercher une HTA par hyperaldosétronisme.
L’augmentation de l’aldostéronémie est associée à une baisse de la rénine plasmatique. Le rapport aldostérone/rénine est élevé (> 23). Ces différents dosages doivent être réalisés après arrêt des antialdostérone depuis 6 semaines, des IEC, ARA II, diurétiques et bêtabloquants depuis 2 semaines.
La description des lésions surrénales se fait par scanner des surrénales, qui est plus précis que l’IRM. Cependant, les formes de transition entre adénome et hyperplasie imposent un avis spécialisé et une discussion multidisciplinaire pour définir le choix du traitement. Le cathétérisme des veines surrénales est parfois nécessaire pour fixer le choix du traitement (chirurgie ou traitement médical).
Le traitement chirurgical se fait aujourd’hui par laparoscopie (résection de la surrénale).
Le traitement par la spironolactone a un effet spectaculaire dans les HTA avec hyperaldostéronisme primaire. Il est toujours préalable à la chirurgie et indispensable en cas d’hyperplasie. Il provoque, pour les dosages de plus de 0,5 mg/kg, des effets indésirables spécifiques (gynécomastie, troubles des règles). Le traitement par Modamide ou par éplérénone sont alors l’alternative.
Autres causes endocrines
Syndrome de Cushing avec pseudo-hyperaldostéronisme et rénine et aldostérone basses.
Acromégalie.
Coarctation aortique
Elle est observée chez l’enfant et l’adulte jeune.
Le diagnostic clinique révèle :
- souffle mésosystolique ou parfois continu, parasternal gauche et dans le dos ;
- pouls fémoraux absents ;
- HTA aux membres supérieurs associée à une PA basse aux membres inférieurs.
Le diagnostic est confirmé par l’échocardiographie ou surtout l’IRM, la radio de thorax peut montrer des érosions des arcs costaux postérieurs (3e-6e côtes).
Le traitement est soit chirurgical, soit endoluminal (dilatation avec pose d’une endoprothèse).
Syndrome d’apnées du sommeil (SAS)
Il est évoqué :
- chez les patients obèses ; surtout si l’HTA est résistante, ainsi que chez les patients classés non dippers (absence de baisse nocturne de la PA) en MAPA ;
- en cas de diagnostic par polysomnographie, appareillage par masque de pression positive (CPAP) si l’indice d’apnées- hypopnées est > 30/h ;
- lorsque le contrôle de la PA impose toujours l’adaptation des antihypertenseurs en plus de l’appareillage par continuous positive airway pressure (CPAP).
Médicaments et produits augmentant la pression artérielle
Ce sont :
- cocaïne et amphétamines ;
- anti-inflammatoires non stéroïdiens (AINS) ;
- corticoïdes ;
- ciclosporine ;
- contraceptifs oraux ;
- anti-VEGF.
HTA gravidique
Elle est liée à une anomalie de développement du trophoblaste entre 16 et 22 semaines d’aménorrhée, avec atteinte du myomètre et de la circulation utérine, hypotrophie fœtale.
Primipares, souvent après 35 ans, chez les patientes noires ou obèses, éventuellement gémellarité. On trouve fréquemment un terrain avec des facteurs de risque de l’athérome.
On oppose :
- l’HTA gestationnelle au-delà de 20 semaines qui réapparaît à chaque grossesse avec hypotrophie fœtale ;
- la grossesse chez la femme hypertendue dont l’HTA s’aggrave pendant la grossesse ;
- la prééclampsie, ou toxémie gravidique, en cas de protéinurie > 300 mg/24 h, grave si > 1 g/24 h.
Les complications sont dominées par l’éclampsie : crises convulsives, céphalées, confusion, coma (encéphalopathie hypertensive).
Les autres complications sont : rénales, cardiaques, retard de croissance ou mort fœtale, hématome rétroplacentaire, HELLP syndrome (hémolyse, cytolyse hépatique, thrombopénie).
L’hospitalisation est requise si la diastolique est > 110 mmHg ou en cas de protéinurie. IEC, ARA II et diurétiques sont contre-indiqués, l’aspirine est d’emploi proposé en prévention au cours du premier et deuxième trimestre de la grossesse suivant une toxémie gravidique. Le régime sans sel est néfaste. Le traitement médicamenteux peut comporter des inhibiteurs calciques (nicardipine), la méthylldopa et les bêtabloquants (aténolol non recommandé).
L’extraction du fœtus est parfois nécessaire en cas d’éclampsie ou de souffrance fœtale.
Traitement (recommandation de la HAS, 2016)
Quand débuter un traitement antihypertenseur ?
On débute le traitement médicamenteux, seulement :
- après avoir confirmé l’HTA par une automesure (tableau 2) ;
- après avoir débuté des mesures hygiéno-diététiques selon la situation de chaque patient. Les mesures efficaces sur la baisse de la PA sont : réduction d’une consommation excessive de sel, réduction pondérale chez les sujets en surpoids, activité physique régulière. Les mesures efficaces sur le risque cardiovasculaire sont : arrêt du tabac, diminution des apports lipidiques.
Plan de soins initial de 0 à 6 mois
Consultation d’information et d’annonce
La prise en charge d’un patient hypertendu nécessite une information et un temps éducatif qui se font au mieux dans le cadre d’une consultation dédiée. Cette consultation permet d’informer le patient des risques liés à l’HTA, des bénéfices démontrés du traitement antihypertenseur, de fixer les objectifs du traitement, et d’établir un plan de soins. La décision médicale partagée entre le médecin et son patient favorise l’adhésion du patient à sa prise en charge. Il est recommandé que des mesures hygiéno-diététiques soient initiées dès cette consultation. En fonction du profil du patient, de la sévérité de l’HTA, de ses préférences et de son adhésion à ces mesures, le délai de mise en route du traitement médicamenteux sera adapté, pour atteindre l’objectif d’une PA contrôlée à 6 mois. Au cours des 6 premiers mois, des consultations médicales mensuelles sont recommandées jusqu’à obtention du contrôle tensionnel, pour évaluer la tolérance et l’efficacité du traitement, renforcer l’éducation et parfaire l’information du patient.
Place des mesures hygiéno-diététiques
Il est recommandé de proposer des mesures hygiéno-diététiques à tous les patients hypertendus. Elles contribuent à la réduction des chiffres tensionnels et font partie intégrante de la prise en charge.
Elles comprennent :
- la pratique d’une activité physique régulière et adaptée aux possibilités du patient (par exemple 30 min/j au moins 3 fois par semaine en endurance) ;
- la réduction du poids en cas de surcharge pondérale ;
- la suppression ou la réduction de la consommation d’alcool : une consommation journalière supérieure à 3 verres chez l’homme et 2 verres chez la femme doit entraîner une prise en charge adaptée ;
- une normalisation de l’apport sodé (6-8 g/j de sel au maximum, soit une natriurèse d’environ 100 à 150 mmol/j) ;
- l’arrêt d’une intoxication tabagique. Cette mesure n’entraîne habituellement pas directement une réduction de la PA mais est essentielle pour réduire la morbimortalité ;
- une alimentation privilégiant la consommation de fruits, légumes et d’aliments peu riches en graisses saturées.
Cible tensionnelle à atteindre
L’objectif est d’obtenir une PA systolique comprise entre 130 et 139 mmHg et une PA diastolique < 90 mmHg à 6 mois au cabinet médical, confirmées par des mesures au domicile (PA < 135/85 mmHg).
Chez le sujet âgé de 80 ans ou plus, il est recommandé d’obtenir une PA systolique < 150 mmHg, sans hypotension orthostatique (PAS diurne en AMT ou en MAPA < 145 mmHg). Chez ces patients, la lutte contre une iatrogénie est impérative. Le fait de ne pas dépasser dans la plupart des cas 3 molécules antihypertensives après 80 ans entre dans ce cadre.
Des données récentes indiquent que le risque de complications cardiovasculaires est le plus bas si la PAS est entre 120 et 130 mmHg (mesures effectuées au cabinet médical avec un tensiomètre automatique avec moyenne des 2 dernières mesures). Le traitement antihypertenseur ne doit pas provoquer d’effet indésirable.
Éléments à prendre en compte dans le choix initial des médicaments
Globalement, 70 % des patients hypertendus vus en ville n’ont pas de complications. Néanmoins, il est recommandé d’adapter le choix thérapeutique en fonction des comorbidités associées (
Les diurétiques de l’anse (à la place des diurétiques thiazidiques) peuvent être prescrits chez un patient hypertendu, en cas d’insuffisance rénale sévère (DFG estimé < 30 ml/min/1,73 m²), ou de syndrome néphrotique ou chez l’insuffisant cardiaque. L’utilisation des IEC et des ARA II nécessite un contrôle du sodium et du potassium plasmatiques et de la créatininémie dans un délai de 1 à 4 semaines après l’initiation du traitement puis lors des modifications posologiques ou en cas d’événement intercurrent. Il convient, lors de la prescription d’un antihypertenseur, de préférer la molécule (et la posologie) la plus efficiente.
Adaptation du traitement au cours des 6 premiers mois
Une monothérapie peut suffire à contrôler la PA lorsque l’HTA est de découverte récente et les chiffres de la PA peu élevés. Cependant, la plupart des HTA nécessitent sur le long terme une plurithérapie.
Il est recommandé d’évaluer le contrôle tensionnel tous les mois jusqu’à obtention de l’objectif tensionnel.
En pratique, à 1 mois, si l’objectif tensionnel n’est pas atteint (inefficacité, efficacité insuffisante ou mauvaise tolérance), il est préférable de passer à une bithérapie, car elle améliore l’efficacité et réduit le risque d’effet indésirable, plutôt que de changer de monothérapie ou d’augmenter la posologie de la monothérapie.
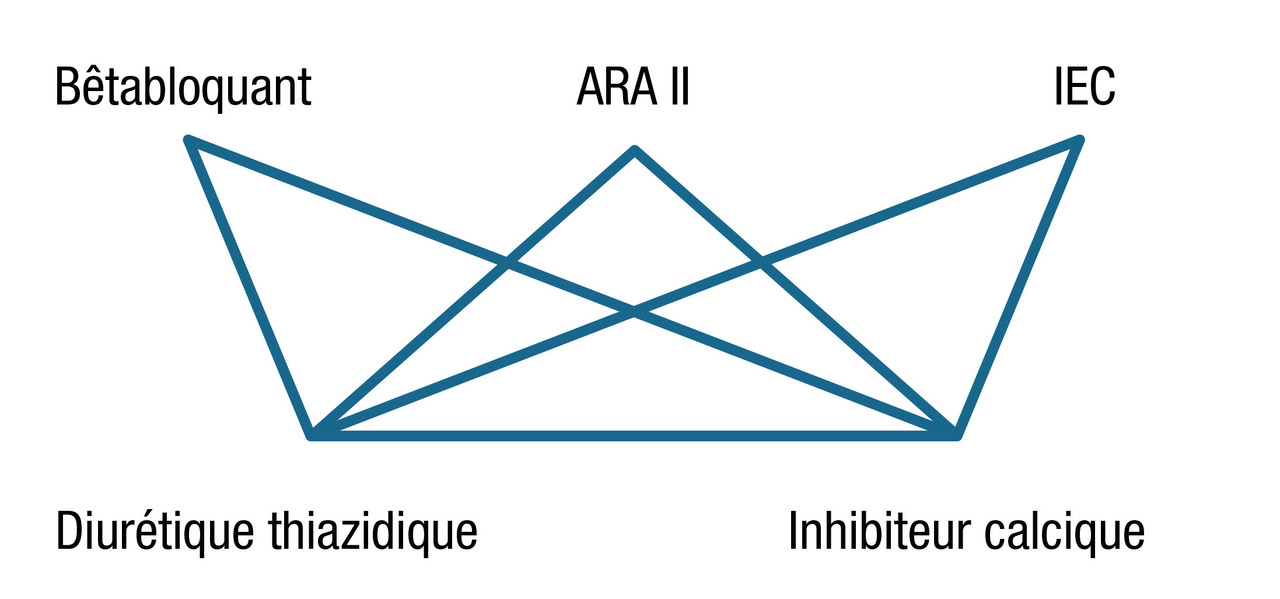
Cette bithérapie comportera de façon préférentielle l’association de deux des trois classes suivantes : inhibiteur du système rénine-angiotensine (IEC ou ARA II ou bêtabloquant), inhibiteur calcique, diurétique thiazidique, et en cas d’inefficacité, d’autres bithérapies (doses, principes actifs) peuvent être proposées (
Si l’objectif tensionnel n’est toujours pas atteint, on peut recourir à une trithérapie, qui comportera idéalement l’association d’un inhibiteur du système rénine-angiotensine (IEC ou ARA II), d’un inhibiteur calcique et d’un diurétique thiazidique, sauf indication préférentielle d'une autre classe thérapeutique et/ou mauvaise tolérance.
Dans tous les cas, il est recommandé d’évaluer régulièrement l’adhésion aux mesures hygiéno-diététiques et au traitement médicamenteux. L’adhésion est favorisée par l’utilisation d’associations fixes. Le plus souvent, une mesure tensionnelle à domicile est nécessaire pour évaluer l’efficacité du traitement. Elle est recommandée avant chaque modification thérapeutique.
Par quelle classe médicamenteuse débuter ?
Il est recommandé de débuter un traitement pharmacologique : diurétique thiazidique, inhibiteur calcique, inhibiteur de l’enzyme de conversion (IEC) ou antagoniste des récepteurs de l’angiotensine 2 (ARA II), par une monothérapie, au mieux en monoprise.
Les bêtabloquants peuvent être utilisés comme antihypertenseurs, mais ils semblent moins protecteurs que les autres classes thérapeutiques vis-à-vis du risque d’accident vasculaire cérébral. Au sein d’une même classe, il existe des différences pharmacologiques (durée d’action notamment) entre les médicaments, pouvant avoir des conséquences sur l’efficacité et la tolérance. Ces éléments doivent être pris en considération dans le choix du médicament. Comme pour tout traitement, la prescription des antihypertenseurs doit être établie en DCI.
La persistance (action de continuer le traitement sur une certaine durée selon la prescription initiale) du traitement est plus élevée avec les ARA II ou les IEC, moindre avec les inhibiteurs calciques et plus faible encore avec les diurétiques thiazidiques et les bêtabloquants.
En cas d’HTA sévère confirmée (PAS > 180mmHg et/ou PAD > 110mmHg), il est recommandé d’instaurer sans délai un traitement pharmacologique.
Organisation du suivi après 6 mois de prise en charge
Une consultation de suivi est proposée tous les 3 à 6 mois.
Cette consultation a pour objectif de rechercher les symptômes, de surveiller le niveau tensionnel, et d’évaluer la tolérance et l’adhésion au traitement médicamenteux et aux mesures hygiéno-diététiques.
La surveillance tensionnelle comprend la mesure de la PA au cabinet médical, et l’analyse de mesures tensionnelles récentes faites par automesure. Des applications pour smartphone apporte une aide pour réaliser l’automesure et pour mémoriser les données (ex : Depist-Tension).
La recherche d’une hypotension orthostatique est recommandée chez tous les patients hypertendus, plus fréquemment chez les patients diabétiques, parkinsoniens ou âgés.
Un contrôle biologique (Na, K, créatininémie) est souhaitable tous les 1 à 2 ans, ou plus fréquemment en cas de diabète, d’insuffisance rénale, d'HTA mal contrôlée, ou d’autres événements intercurrents (pathologies aiguës). Cette surveillance doit être plus fréquente chez le sujet âgé.
En l’absence de diabète ou de dyslipidémie, un contrôle biologique (glycémie à jeun et exploration d’une anomalie lipidique [EAL]) est souhaitable tous les 3 ans.
Un suivi cardiologique est justifié tous les 3 à 5 ans, ou plus fréquemment en cas de symptômes cardiaques ou de cardiopathie sous-jacente.
Le traitement antihypertenseur peut être allégé chez les patients ayant une hypotension orthostatique persistante, en cas de perte de poids par dénutrition ou chez les patients polypathologiques ayant d’autres médicaments pouvant avoir des effets sur la tension (AINS, corticoïdes, antidépresseurs IMAO et IRSNA, neuroleptiques, antiparkinsoniens, médicaments utilisés pour l’adénome de la prostate).
Adaptation des traitements en cas de non-contrôle tensionnel
En cas de non-contrôle de la tension au cours d’une visite médicale, une automesure ou une MAPA doivent être obtenues afin d’éliminer un effet blouse blanche.
Si la PA n’est pas contrôlée en ambulatoire, une adaptation de nombre et/ou des dosages des médicaments antihypertenseurs est à effectuer.
La trithérapie doit être prescrite après la bithérapie et comporter : inhibiteur du SRA (ARA II, IEC, bêtabloquant) + diurétique + inhibiteur calcique. Les doses doivent être maximales, en particulier chez le sujet en surpoids ou obèse pour le diurétique thiazidique (hydrochlorothiazide 25 mg/j ou indapamide 1,5 mg/j) et pour les ARA II (irbésartan 300 mg/j, valsartan 160 mg/j, candésartan 16 mg/j, telmisartan 80 mg/j, losartan 100 mg/j).
Il est recommandé d’évaluer si les médicaments prescrits sont réellement pris par le patient, et l’observance peut être évaluée :
- en utilisant des questionnaires dédiés qui précisent les causes de difficulté de suivi du traitement (questionnaire de Girerd) ;
- en réalisant des dosages des médicaments antihypertenseurs (réalisables dans certains laboratoires hospitaliers) ;
- d’après les informations recueillies auprès de la famille, du pharmacien, des infirmiers avec visite à domicile.
Après vérification de tous ces éléments, la recherche d’une HTA secondaire est justifiée. Le recours à un avis spécialisé est recommandé. La prescription d’une quadrithérapie comportant de la spironolactone 25 mg/j pourra être proposée, qui nécessite une surveillance trimestrielle du bilan biologique (créatinine, kaliémie).
POINTS FORTS À RETENIR
L’hypertension artérielle (HTA) est la maladie chronique la plus fréquente dans le monde, elle affecte plus de 1,5 milliard de sujets. En France, 11,5 millions de patients sont traités en 2017.
La prévalence de l’HTA augmente avec l’âge, et 80 % des hypertendus sont âgés de plus de 55 ans. Avant 55 ans, l’HTA systolo-diastolique prédomine, et après 70 ans, c’est l’HTA systolique qui est la plus fréquente.
L’HTA est un facteur de risque cardiovasculaire majeur de maladie cardiovasculaire. La complication la plus fréquente, si l’HTA est non traitée, est l’accident vasculaire cérébral, et ce sont les complications cardiaques (cardiopathie ischémique, insuffisance cardiaque) dans l’HTA traitée.
Elle est suspectée en consultation si la PA ≥140/90 mmHg et est confirmée en ambulatoire (automesure ou MAPA) si la PA ≥135/85 mmHg.
Dans 95 % des cas, l’HTA est essentielle et la conséquence du vieillissement artériel, du surpoids ou de l’hérédité. Les HTA secondaires sont de cause rénale ou surrénale.
Le plus souvent, l’HTA est asymptomatique. Son dépistage doit être annuel après l’âge de 30 ans mais effectué de manière plus précoce en cas d’hérédité d’HTA ou de prise de poids récente.
La recherche d’atteinte des organes cibles de l’HTA (rein, cœur, artères) est indispensable lors du diagnostic et dans le suivi. L’urgence hypertensive associe une PA > 180/110 avec des complications cardiaques, cérébrales ou rénales et impose une prise en charge hospitalière adaptée à la complication viscérale.
Hypertension artérielle – Révision flash – Mots-clés
• Facteur de risque et maladie
• PA normale si < 130/85 mmHg en consultation
• HTA : suspectée si PA > 140/90 mmHg consultation et confirmée si PA > 135/90 mmHg en automesure
• Rôle de l’âge sur la PAS ++
• Risque d’AVC +++
• 90 % d’HTA essentielle = vieillissement vasculaire, poids, familial
•10 % d’HTA secondaire = reins, surrénales, artères
• Système sympathique et baroréflexe = régulation à court terme
• SRA-aldostérone = régulation à moyen terme (sel et système vasculaire)
• HTA endocrine : hyperplasie bilatérale (fréquent), adénome de Conn (rare), phéochromocytome (très rare)
• HTA gravidique : conséquence de la dysfonction placentaire, 3e trimestre
• HTA asymptomatique : dépistage ++
• Tensiomètre automatique ++, position assise, 3 mesures et moyenne des 2 dernières
• HTA asymptomatique : dépistage ++
• Effet blouse blanche (35 %), HTA masquée (15 %) : importance automesure ou MAPA pour diagnostic et suivi
• Bilan initial = étiologie et retentissement viscéral
Signes cliniques d’atteinte viscérale et/ou infracliniques d’organe cible (HVG, microalbuminurie)
• Glycémie à jeun, bilan lipidique, K+ sans garrot, créatinine, recherche de protéinurie et d’hématurie, ECG
• Anomalies ECG : HVG, HAG, séquelles infarctus, FA, troubles de repolarisation
• Créatinine
• Microalbuminurie de 30 à 300 mg/24 h et protéinurie au-delà de 500 mg/24 h
• Évaluation risque cardiovasculaire global = grille SCORE
• Fond d’œil = pas systématique, sauf HTA maligne (œdème papillaire)
Traitement non médicamenteux avant les médicaments ++ :
• Réduction d’une consommation excessive de sel, réduction pondérale chez les sujets en surpoids, activité physique régulière
Cinq classes antihypertenseurs avec preuves : ARA II, bêtabloquants, calcium, diurétiques, IEC
• Début par une monothérapie pour 4 semaines
• Choix de la classe pharmacologique dépend du profil patient
• Évaluation de l’efficacité/tolérance avant 1 mois (automesure si possible)
• Passage à la bithérapie si la monothérapie ne suffit pas (combinaison fixe si possible)
• Objectif : PA < 130-139/90 mmHg en consultation et < 135/85 mmHg avec tensiomètre automatique
• Trithérapie après la bithérapie : inhibiteur du SRA (ARA II, IEC, BB) + diurétique + inhibiteur calcique
• Recherche d’une HTA secondaire = non-résistance à la trithérapie
Suivi
• Automesure tous les 3 mois, chercher les causes de mauvaise observance
• Recherche retentissement viscéral et complications
• Hypotension orthostatique : sujet âgé, diabétique
• Visite tous les 3 ou 6 mois (selon le risque cardiovasculaire)
Lexique
AMM. Autorisation de mise sur le marché.
ARA II. Antagoniste des récepteurs de l’angiotensine II.
AVC. Accident vasculaire cérébral.
BB. Bêtabloquant.
ECG. Électrocardiogramme.
FA. Fibrillation atriale.
FDR. Facteurs de risque.
HAG. Hypertrophie atriale gauche.
HTA. Hypertension artérielle.
HVG. Hypertrophie ventriculaire gauche.
IEC. Inhibiteurs de l’enzyme de conversion.
K. Potassium.
MAPA. Mesure ambulatoire de la pression artérielle.
PA. Pression artérielle.
PAD. Pression artérielle diastolique.
PAS. Pression artérielle systolique.
SRA. Système rénine-angiotensine.

 Encadrés
Encadrés