Diagnostiquer une hyperthyroïdie.
Argumenter l'attitude thérapeutique et planifier le suivi du patient.
L’hyperthyroïdie affecte 1 à 2 % de la population adulte féminine, mais n’épargne pas l’enfant, le sexe masculin et le sujet âgé. On peut être amené à évoquer cette situation dans une variété très considérable de circonstances, et la confirmation en est aisément obtenue par les dosages hormonaux.
Diagnostic clinique
État de thyrotoxicose
Dans les formes typiques, on observe habituellement les symptômes suivants :
- un éréthisme cardiovasculaire : tachycardie permanente, augmentation de la pression artérielle systolique ;
- une asthénie musculaire avec amyotrophie, notamment des ceintures ;
- une thermophobie avec hypersudation (ce qu’exprime la « main basedowienne », chaude et moite), une élévation thermique discrète, une polydipsie ;
- des troubles du sommeil ;
- un amaigrissement rapide avec polyphagie ;
- une diarrhée ou la disparition d’une constipation ancienne ;
- un tremblement d’attitude des extrémités, fin, rapide, régulier ;
- une nervosité, une agitation, une instabilité de l’humeur.
Certaines formes trompeuses n’orientent pas en premier vers un emballement de la production thyroïdienne. L’hyperthyroïdie se manifeste alors par des signes :
- paradoxaux : prise de poids souvent avec aménorrhée chez la femme jeune, anorexie chez le sujet âgé ;
- cardiaques (cardiothyréose) : extrasystoles, crises de tachycardie paroxystique, flutter ou fibrillation auriculaire paroxystique ou permanente (notamment chez le sujet âgé), asystolie ;
- cutanés : prurit ;
- digestifs : diarrhée et amaigrissement ;
- musculaires : myopathie pseudo-paralytique ou pseudo-myasthénique, troubles paresthésiques ou paralytiques ;
- osseux : fractures et tassements vertébraux liés à l'ostéopénie ou ostéoporose ;
- neuropsychiatriques : modifications du comportement et difficultés scolaires chez l’enfant, états anxiodépressifs, délirants ou confusionnels ;
- mimant une infection sévère : crise aiguë thyrotoxique avec hyperthermie et déshydratation.
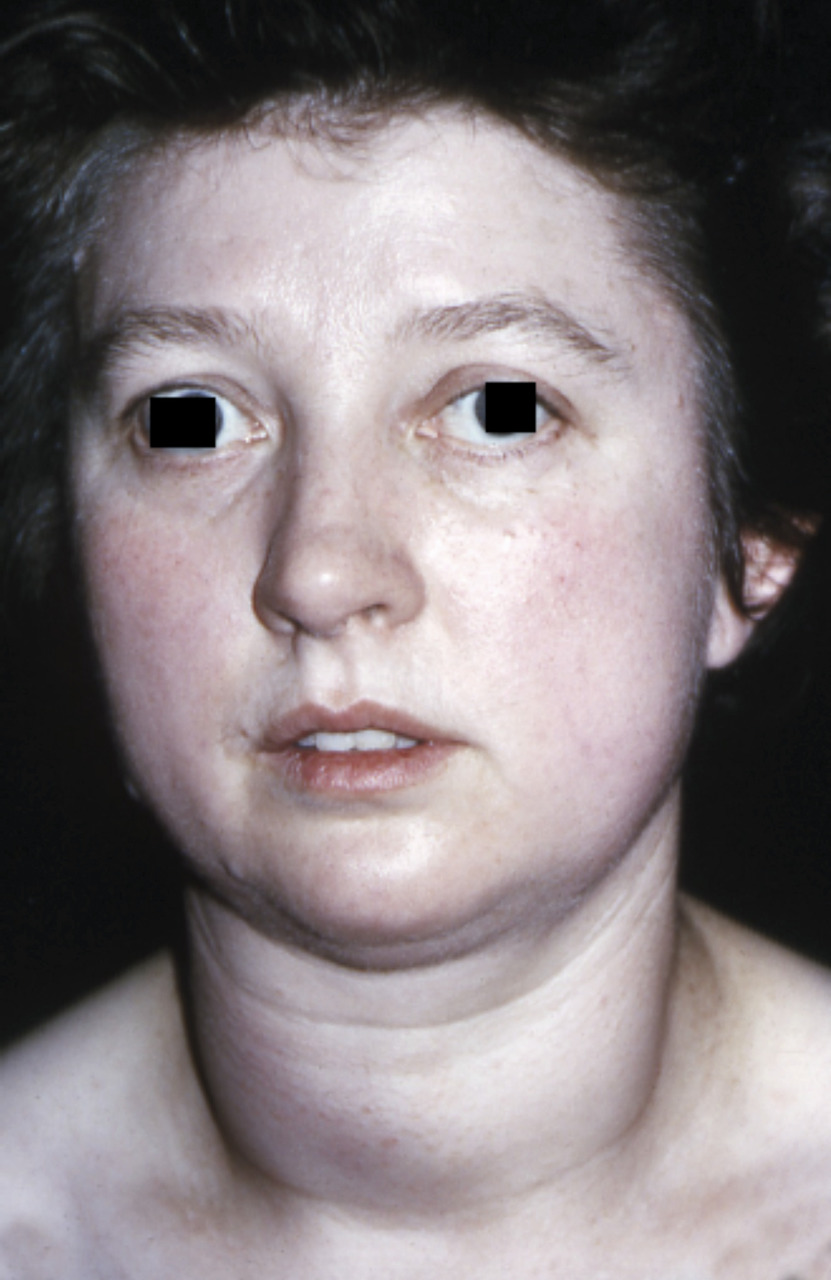
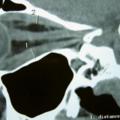
Hypertrophie thyroïdienne
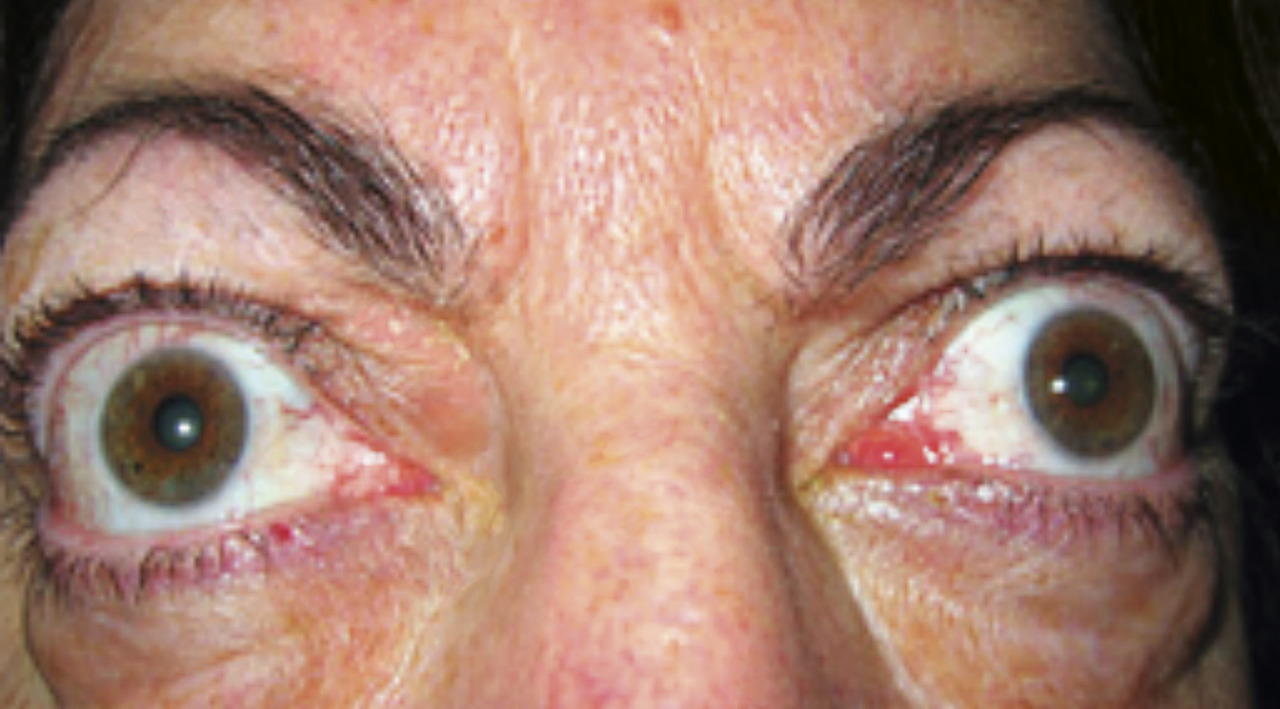
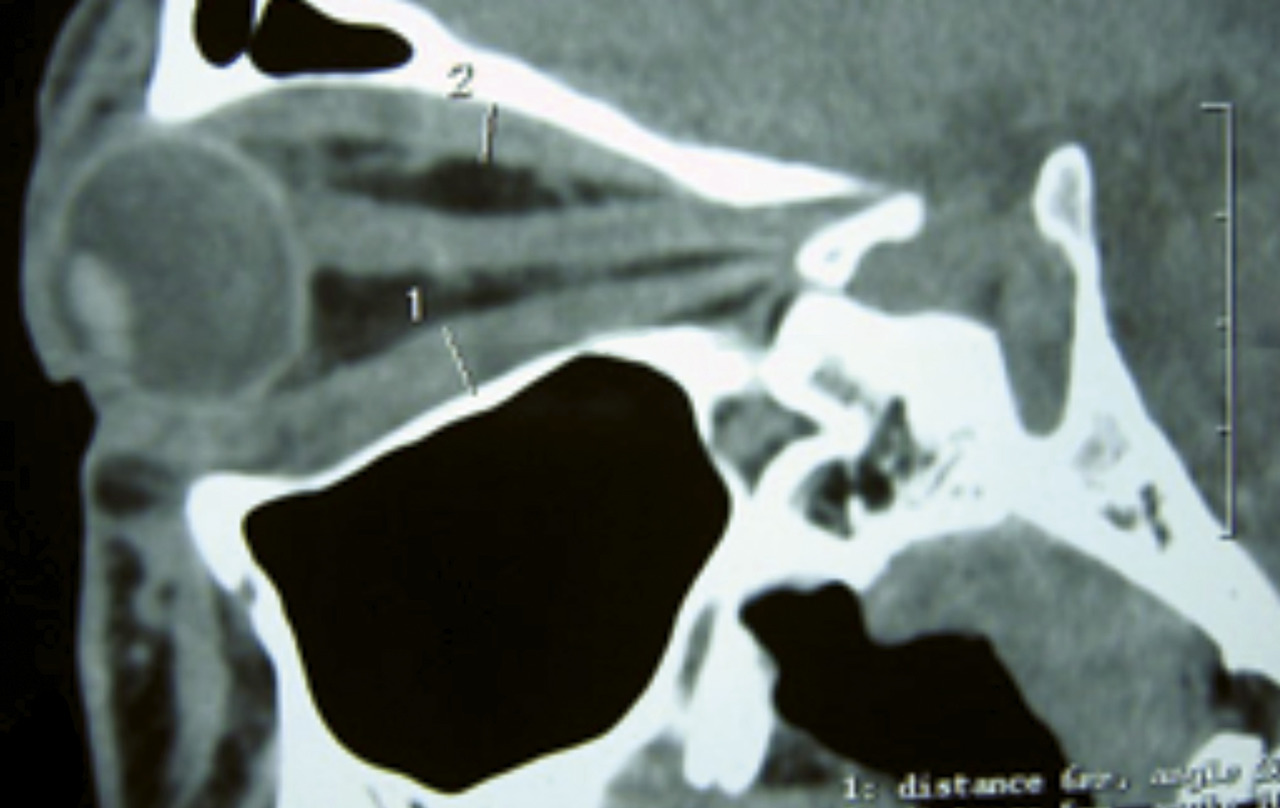
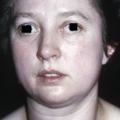
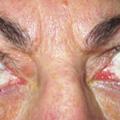
Anomalie oculaire
Diagnostic biologique
“Thyroid stimulating hormone” (TSH) sérique
Malgré tout, le dosage de la TSH méconnaît les hyperthyroïdies d’origine centrale beaucoup plus rares (adénome thyrotrope, résistance aux hormones thyroïdiennes) qui se caractérisent par un taux de TSH normal ou légèrement augmenté, inapproprié à l’hyperhormonémie thyroïdienne.
De plus, la baisse de la TSH est non spécifique, constatée lors des 1er et 2e trimestres de la grossesse, en raison de l’activité thyrostimulante de l’hormone chorionique placentaire (hCG). Chez les patients hospitalisés, en mauvais état général, récemment soumis aux corticoïdes, aux dopaminergiques, aux analogues de la somatostatine, à la bromocriptine, les taux de TSH peuvent être abaissés, indépendamment de toute maladie thyroïdienne. La TSH peut être également basse en cas de pathologies hypothalamo-hypophysaires.
T3 et T4 libres
Dans les formes frustes, dites subcliniques, de thyrotoxicose, on observe un abaissement isolé du taux de TSH, alors que les taux d’hormones thyroïdiennes sont normaux.
Autres dosages
- diminution du cholestérol total (< 1,5 g/L) et LDL (low density lipoprotein) ;
- microcytose sanguine (VGM < 82 mm3) ;
- augmentation des phosphatases alcalines et de l’ostéocalcine sérique, liée à l’accroissement du remodelage osseux ;
- tendance à l’hypercalcémie ;
- élévation sérique de la ferritine, de la SHBG (sex hormone binding globulin), marqueur sensible de l’imprégnation par les hormones thyroïdiennes.
Diagnostic étiologique
Causes évidentes
- la présence d’un goitre diffus, d’apparition récente, de signes oculaires œdémateux chez un patient souffrant de thyrotoxicose, caractérise à coup sûr la maladie de Basedow ;
- en présence d’un nodule palpable et de signes thyrotoxiques, on évoque en premier lieu un nodule toxique ;
- une hypertrophie irrégulière et bosselée oriente vers un goitre multinodulaire toxique ;
- une thyrotoxicose iatrogène est évoquée chez un malade soumis à l’amiodarone, au lithium, à une thérapie immunomodulatrice (cytokines, inhibiteurs de tyrosine kinase, immunothérapies anticancéreuses…), dans les suites d’une imagerie avec injection de produits de contraste iodés…
Enquête paraclinique
Biologie
Les anticorps antirécepteur de la TSH (Ac anti-RTSH) ont une sensibilité de près de 99 % pour la maladie de Basedow. L’importance du taux initial est assez corrélée avec le risque d’orbitopathie et le pronostic de l’hyperthyroïdie. Leur recherche est particulièrement indispensable chez les femmes enceintes pour prédire le risque de dysthyroïdie fœtale et néonatale car ces anticorps traversent la barrière placentaire. Enfin, leur présence à des titres très élevés avant toute thérapeutique et leur permanence à l’issue du traitement prolongé par antithyroïdiens de synthèse (ATS) constituent des marqueurs prédictifs du risque de rechute. Leur dosage est indispensable lorsque l’arrêt du traitement est envisagé, afin d’évaluer le risque de récidive. Il n’y a pas de réel intérêt au dosage des anticorps antithyroglobuline et antithyroperoxydase dans la maladie de Basedow, même si leurs titres en sont aussi ordinairement accrus.La thyroglobuline circulante est accrue dans toutes les variétés d’hyperfonctionnement thyroïdien. Son dosage se révèle donc inutile, sauf dans la détection des états de thyrotoxicose factice dans lesquels sa concentration est basse.
La mesure de l’iodurie peut être utilisée lorsque la responsabilité d’une surcharge iodée actuelle est suspectée. Ce dosage n’est pas remboursé et n’est pas recommandé en routine.
Imagerie
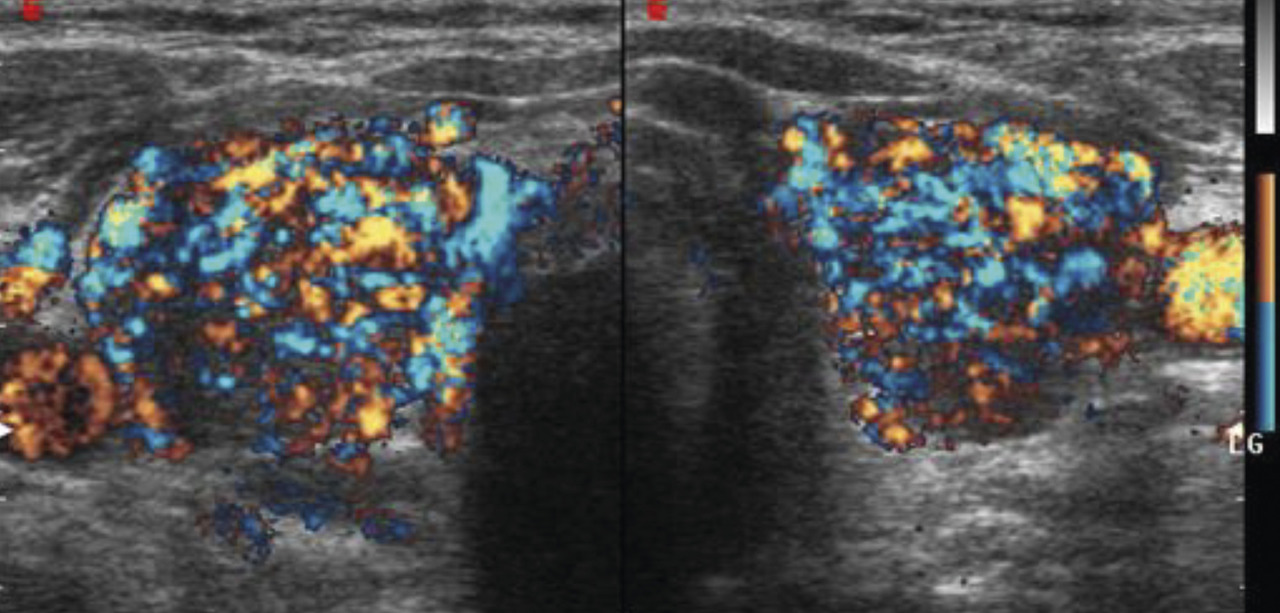
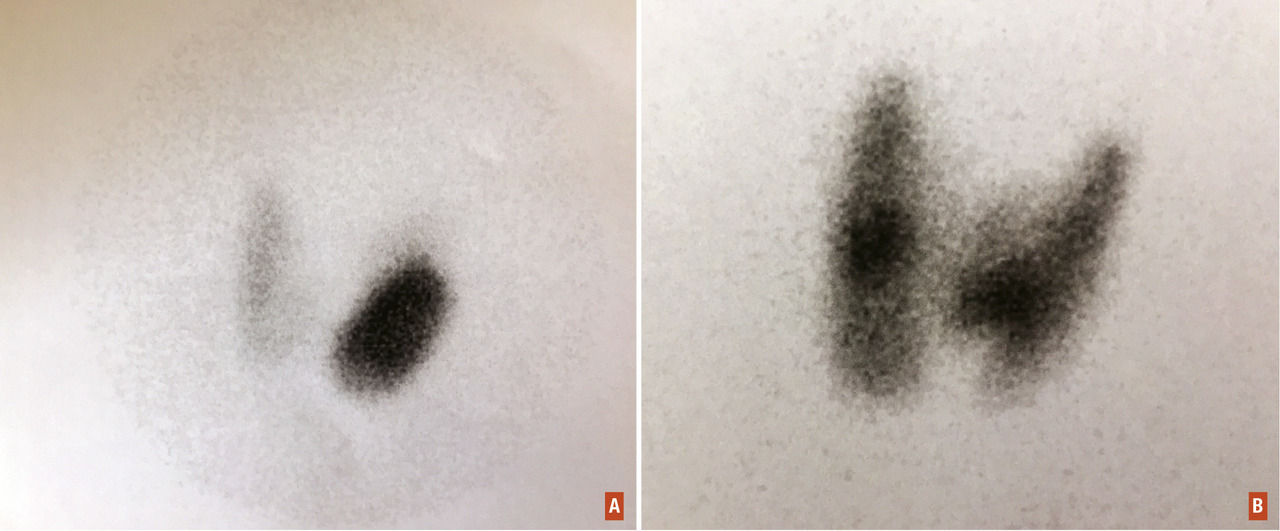
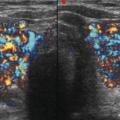
La scintigraphie thyroïdienne (à l’iode 123 ou au technétium) est inutile dans les formes typiques de maladie de Basedow. Cependant, elle reste l’examen le plus informatif pour déterminer le mécanisme de certaines formes d’hyperthyroïdie de diagnostic difficile, et est indispensable avant un éventuel traitement radio-isotopique. Sa seule contre-indication est la grossesse. Elle est pleinement réalisable au cours des prétendues allergies à l’iode, les phénomènes allergiques concernant non pas l’iode mais essentiellement les agents radiologiques de contraste iodés.L’échographie-Doppler de la glande thyroïde n’est pas ordinairement indispensable. Toutefois, cet examen non invasif et peu coûteux peut apporter rapidement des informations sur :
- l’étiologie : dans la maladie de Basedow, le parenchyme est globalement hypo-échogène, hypervasculaire. Le nodule toxique se présente comme une formation hypo-échogène, hypervasculaire. Il est parfois associé à d’autres formations nodulaires au sein d’une thyroïde dystrophique. Dans les thyroïdites subaiguës, des plages hypo-échogènes mal limitées sont fréquemment observées ;
- l’orientation thérapeutique : les données échographiques sont précieuses pour distinguer les différentes formes de thyropathies iatrogènes (notamment liées à l’amiodarone) et déterminer rapidement la thérapeutique la plus adaptée.
Causes de thyrotoxicose de l’adulte
Maladie de Basedow
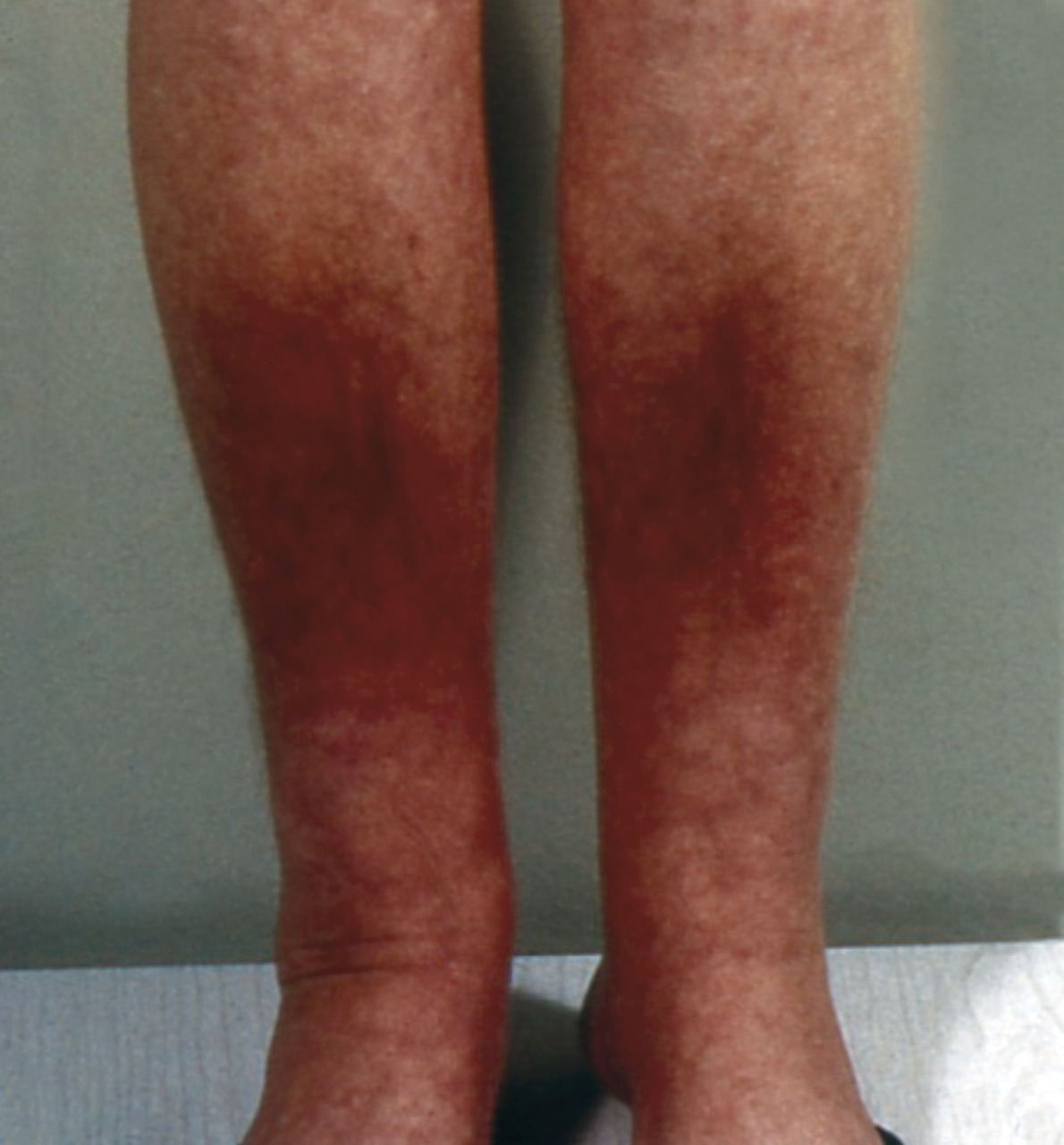
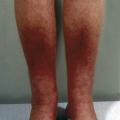
S’associent parfois d’autres manifestations extra-thyroïdiennes : capsulite rétractile de l’épaule, hippocratisme digital, dermopathie (« myxœdème prétibial »,
La présence d’anticorps anti-RTSH constitue un argument fort en faveur de l’origine basedowienne de l’hyperthyroïdie. En échographie, le parenchyme est globalement hypo-échogène et hypervasculaire (
Nodule toxique
Goitres multinodulaires secondairement toxiques
Thyrotoxicoses d’origine iatrogène
Lithium, interféron, interleukine 2, inhibiteurs de tyrosine kinase, nouvelles immunothérapies utilisées dans les cancers (anti-CTLA4, anti-PD1/PD-L1) : ils déterminent des thyrotoxicoses dont le mécanisme immunologique (maladie de Basedow, thyroïdite silencieuse) ou toxique, est à préciser.
Thyroïdite subaiguë de De Quervain
Thyroïdites silencieuses ou indolores
Dans ces situations, il n’y a guère de désordres inflammatoires, mais on relève habituellement l’accroissement des titres d’anticorps anti-thyroperoxydase, et des modifications hormonales.
La thyroïdite silencieuse est typiquement responsable d’une phase initiale de thyrotoxicose de 3 à 8 semaines, spontanément résolutive. Elle passe souvent inaperçue, car la symptomatologie est peu bruyante, contribuant à la perte de poids, à l’accélération du rythme cardiaque… S’il ne préexistait pas, on découvre souvent un petit goitre ferme et indolore. À ce stade, la fixation du technétium ou de l’iode 123 serait blanche. Après 3 à 6 mois lui succède une phase d’hypothyroïdie souvent discrète (fatigue, prise de poids, troubles menstruels, hypercholestérolémie…). L’évolution se fait en règle générale vers le retour à l’euthyroïdie, mais des hypothyroïdies définitives ou des récidives, notamment à l’issue de nouvelles grossesses, sont possibles.
Thyrotoxicose factice
Hyperthyroïdies liées à l’hormone chorionique placentaire
Môles hydatiformes et choriocarcinomes producteurs d’hCG : le pronostic de ces tumeurs placentaires est actuellement assez favorable.
Hyperthyroïdies par production excessive de TSH
- adénome thyrotrope de l’antéhypophyse, typiquement responsable de signes thyrotoxiques ;
- état de résistance tissulaire à l’action des hormones thyroïdiennes par mutation du gène codant pour le récepteur bêta. Cette situation ordinairement familiale ne détermine guère de signes thyrotoxiques, et le taux de la SHBG est normal.
Autres causes rares
- les métastases fonctionnelles diffuses de cancer thyroïdien différencié ;
- le goitre ovarien toxique (tératome) ;
- l'hyperthyroïdie d’origine génétique par mutation constitutionnelle activatrice du récepteur de TSH, responsable d’un goitre diffus toxique familial sans signe d’auto-immunité.
Traitement et surveillance
Thérapeutiques symptomatiques
Thérapeutiques spécifiques
Traitement médical : antithyroïdiens de synthèse (ATS)
Les ATS actuellement disponibles en France sont les mercapto-imidazolines (carbimazole et son dérivé métabolique actif, le thiamazole), les dérivés du thio-uracile (benzylthio-uracile et propylthio-uracile) [La dose d’attaque d’ATS (15-30 mg de thiamazole ou 20-40 mg de carbimazole, adaptée à l’intensité de l’hyperthyroïdie) est maintenue pendant 4 à 6 semaines, jusqu’à réduction de l’hyperhormonémie thyroïdienne. La phase d’entretien peut être envisagée de deux manières. On peut diminuer progressivement la posologie de l’ATS, qu’il faut alors adapter à l’état hormonal. Une autre attitude est de maintenir la dose d’attaque et d’y associer la prescription de lévothyroxine, d’emblée à posologie substitutive (1,6-1,7 µg/kg/j), selon le schéma qualifié de « block and replace ».
Les dosages de T4 et de T3 libres sont contrôlés vers la 4e semaine, et jusqu’à la fin de la phase d’attaque. La normalisation de la TSH est retardée. Une fois l’euthyroïdie obtenue, la normalité de la TSH peut être vérifiée tous les 2 à 4 mois, il devient alors inutile de contrôler les taux de T4 et de T3 libres.
Certains effets indésirables graves sont exceptionnels mais nécessitent une vigilance particulière.
La pratique de l’hémogramme avant traitement, puis tous les 10 jours durant les 2 premiers mois du traitement, ou immédiatement en cas de fièvre ou d’angine, est recommandée. La surveillance des hémogrammes peut détecter une leuconeutropénie progressive qui conduit à réduire ou interrompre le traitement en cas de baisse des neutrophiles < 1 000/mm3 ; la modification de la classe de l’ATS peut être discutée. La surveillance des hémogrammes n’empêche pas le risque d’agranulocytose aiguë toxo-allergique : l’interruption immédiate du traitement par ATS est indispensable en cas de fièvre ou d’angine, parallèlement à la vérification de l’hémogramme. L’agranulocytose (< 300/mm3) constitue une contre-indication définitive à tout ATS. Une leuconeutropénie préexistante, souvent associée à la maladie de Basedow, ne contre-indique pas la mise en route prudente du traitement. Le risque hématologique persiste lors de la reprise du traitement par ATS, même si celui-ci avait été antérieurement bien toléré.
La surveillance systématique des fonctions hépatiques n’est pas de pratique habituelle du fait de la rareté des atteintes hépatiques. En revanche, l’apparition d’un ictère, de selles colorées, d’urines foncées, de nausées doit conduire le patient à consulter en urgence. Un taux de transaminases à plus de trois fois la normale ou un franc syndrome de cholestase imposent l’arrêt du traitement, ou le changement prudent de la classe de l’ATS.
On insiste actuellement sur le risque de pancréatite liée aux ATS, à détecter sur des bases cliniques, à évaluer sur la lipasémie et la tomodensométrie abdominale.
Il est conseillé d’informer les patients, idéalement par écrit, des principaux effets indésirables des ATS (
Traitement chirurgical
Il s’agit d’une thérapeutique radicale, capable d’assurer la guérison. En fonction de l’étiologie, on choisit la thyroïdectomie ordinairement quasi totale (maladie de Basedow, goitre secondairement toxique) ou la lobectomie (nodule toxique).Elle doit être précédée d’une préparation médicale par ATS pour obtenir l’euthyroïdie. La thyroïdectomie totale est suivie d’une hypothyroïdie définitive, nécessitant une substitution à vie par lévothyroxine. Une altération peropératoire des glandes parathyroïdes ou des nerfs récurrents est possible, mais les hypoparathyroïdies et les paralysies récurrentielles définitives sont rares lorsque l’intervention est confiée à un chirurgien spécialisé.
Traitement par radio-iode (iode 131)
Il s’agit également d’un traitement radical. L’administration d’iode 131 par voie orale a lieu en service de médecine nucléaire, et est soumise à des règles précises de radioprotection. Elle est précédée de l’échographie et parfois de l’évaluation du taux de fixation, pour la détermination dosimétrique. La grossesse (ou un projet de grossesse dans les 6 mois), l’allaitement, un nodule thyroïdien suspect et l’ophtalmopathie basedowienne évolutive en sont les principales contre-indications. Les mesures de radioprotection sont explicitées au patient (information orale et écrite) par le médecin nucléaire.En cas d’hyperthyroïdie symptomatique, notamment chez des patients à risque (sujet âgé, cardiopathie…), le traitement radio-métabolique est précédé par la prise d’antithyroïdiens de synthèse, interrompus quelques jours avant le traitement. De plus en plus couramment, dans la maladie de Basedow sont délivrées des doses ablatives visant à obtenir l’hypothyroïdie définitive, rapidement substituée. Toutefois, certains cas d’hyperthyroïdie persistante nécessitent une deuxième dose de radio-iode, 6 mois après le premier traitement. Ainsi, la surveillance attentive de l’équilibre hormonal est indispensable dans les mois suivant le traitement radiométabolique.
Indications
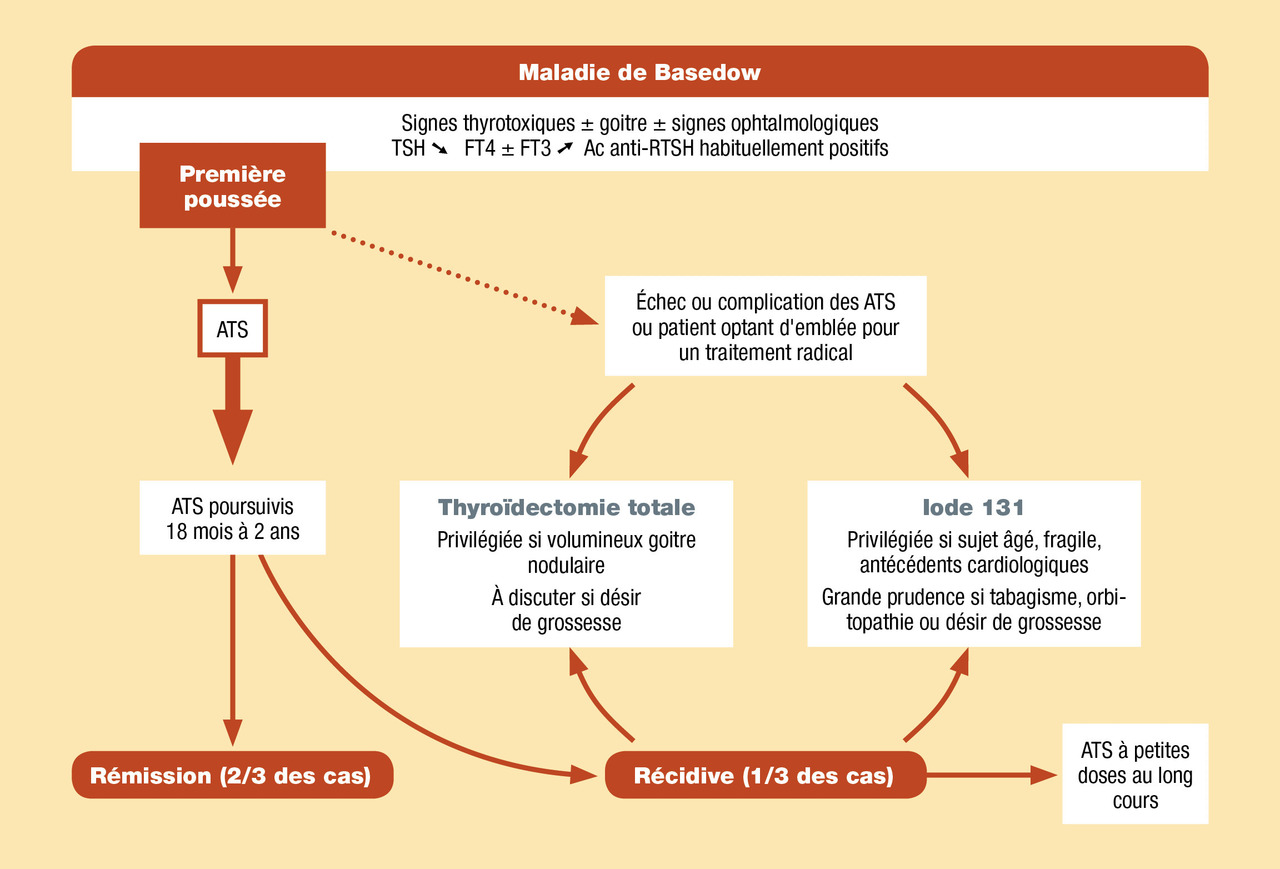
Plusieurs alternatives sont envisageables en fonction de l’étiologie de l’hyperthyroïdie et doivent être adaptées au cas particulier de chaque patient. Un avis spécialisé est préférable, particulièrement pour la définition du choix thérapeutique et la définition de la surveillance.Maladie de Basedow (fig. 7 )
En première intention, un traitement médical par ATS est habituellement prescrit, pour une durée de 18 mois. Toutefois, un traitement radical peut être également discuté d’emblée avec le patient. La thyroïdectomie est parfois indiquée d’emblée en raison des caractéristiques du goitre. L’iode 131 peut également être utilisé en premier lieu ; cette thérapeutique expose à une majoration importante des titres d’anticorps anti-RTSH, susceptible de perdurer plusieurs années, ce qui n’est pas sans incidence sur l’état du fœtus en cas de grossesse. L’arrêt du tabac est impératif car il accentue le risque orbitaire, réduit les chances de rémission, majore le risque de récidive à l’arrêt du traitement par ATS, et globalement aggrave le pronostic de la maladie. Une aide au sevrage peut être proposée.En cas de récidive : même si le taux de rémission avoisine 60 % en Europe, ce risque est fréquent. Les récidives surviennent en particulier durant la première année suivant l’arrêt des ATS. Une thérapeutique radicale est souvent proposée, et discutée avec le patient. La chirurgie est préférée en cas de goitre volumineux, ou chez la femme jeune en âge de procréer. L’iode 131 apparaît adapté à la personne âgée, à la femme jeune ne désirant plus de grossesse ou en cas de récidive après thyroïdectomie partielle, et peut se discuter aussi chez l’adolescent. L’éventualité d’un traitement médical au long cours par une faible dose d’un dérivé d’une mercapto-imidazoline n’est pas nécessairement récusée.
Nodule toxique
Il ne relève pas d’un traitement médical qui n’en permet pas la guérison, contribue à la majoration du volume thyroïdien. La chirurgie consiste, en cas de nodule unique, en une lobectomie voire une isthmectomie, en fonction de la taille et de l’emplacement du nodule. L’iode 131 est préféré chez la personne âgée, et constitue en réalité une alternative possible à tout âge, en l’absence de projet immédiat de grossesse.Goitre multinodulaire secondairement toxique
Le traitement médical ne permet pas la guérison, et s’avère seulement utile en préparation au traitement radical : thyroïdectomie ordinairement totale ou radio-iode chez la personne âgée.Thyrotoxicose d'origine iatrogène
Elle requiert un avis spécialisé. En cas de surcharge iodée, en particulier liée à l’amiodarone, l’opportunité d’arrêter le produit responsable est à discuter, en accord avec le cardiologue. La thyrotoxicose liée à la prise d’amiodarone touche 6 à 10 % des patients traités. Dans les formes rebelles à l’arrêt de l’amiodarone, se justifie un traitement spécifique. Une hyperthyroïdie fonctionnelle se constituant sur une dystrophie nodulaire ou un mécanisme auto-immun (de type 1) est traitée par ATS, souvent à fortes doses et de façon prolongée. Un mécanisme lésionnel, responsable d’hyperthyroïdie rebelle à la seule interruption de l’antiarythmique, nécessite la prescription de corticoïdes (de type 2).Thyroïdite subaiguë
Le traitement symptomatique (b-bloqueurs) est ici indiqué durant la phase thyrotoxique. Le recours au paracétamol, à l’aspirine, aux traitements anti-inflammatoires non stéroïdiens est susceptible d’atténuer les désordres inflammatoires locaux et généraux. La corticothérapie n’a plus guère d’indication en dehors des formes sévères résistantes.Thyrotoxicose factice
L’arrêt de la prise du traitement hormonal est à obtenir, dans l’immédiat sous couvert d’un β-bloqueur, parfois de colestyramine qui contribue à l’élimination fécale des iodothyronines.Conclusion
POINTS FORTS À RETENIR
L’état de thyrotoxicose est souvent cliniquement évident, même s’il existe des formes frustes, à ne pas négliger du fait de leurs potentielles complications cardiaques et osseuses.
Il est primordial d’en déterminer l’étiologie. Chez le sujet jeune, notamment chez la femme, on soupçonnera en premier lieu une maladie de Basedow, moins souvent un nodule toxique. Chez le sujet plus âgé, on évoquera plus volontiers un goitre multinodulaire hyperfonctionnel, ou une étiologie iatrogène avec ou sans thyropathie sous-jacente (amiodarone, produits de contraste iodés, lithium, immunothérapies…).
La maladie de Basedow requiert ordinairement la prescription d’un antithyroïdien de synthèse en première intention. Un traitement radio-métabolique ou une chirurgie peuvent également être discutés ; ils sont privilégiés en cas de récidive de la pathologie. La survenue d’une orbitopathie ou d’une grossesse nécessitent une prise en charge régulière attentive, spécialisée, et multidisciplinaire.
Les nodules toxiques et les goitres multinodulaires hyperfonctionnels seront traités radicalement, soit par chirurgie, soit par radio-iode, en fonction de l’âge, du contexte, et du choix du patient.

 Encadrés
Encadrés