Diagnostiquer une hypothyroïdie chez le nouveau-né, l’enfant et l’adulte.
Argumenter l'attitude thérapeutique et planifier le suivi du patient.
Hypothyroïdie de l’adulte
Diagnostic clinique : la forme typique
Le syndrome d’hypométabolisme est la conséquence de la réduction de la production énergétique et des activités tissulaires. Il se caractérise par des signes généraux : asthénie physique et psychique, ralentissement psychomoteur, frilosité, bradycardie. La pression artérielle est peu modifiée, parfois accrue par élévation des résistances périphériques. Le ralentissement du transit intestinal entraîne une constipation.
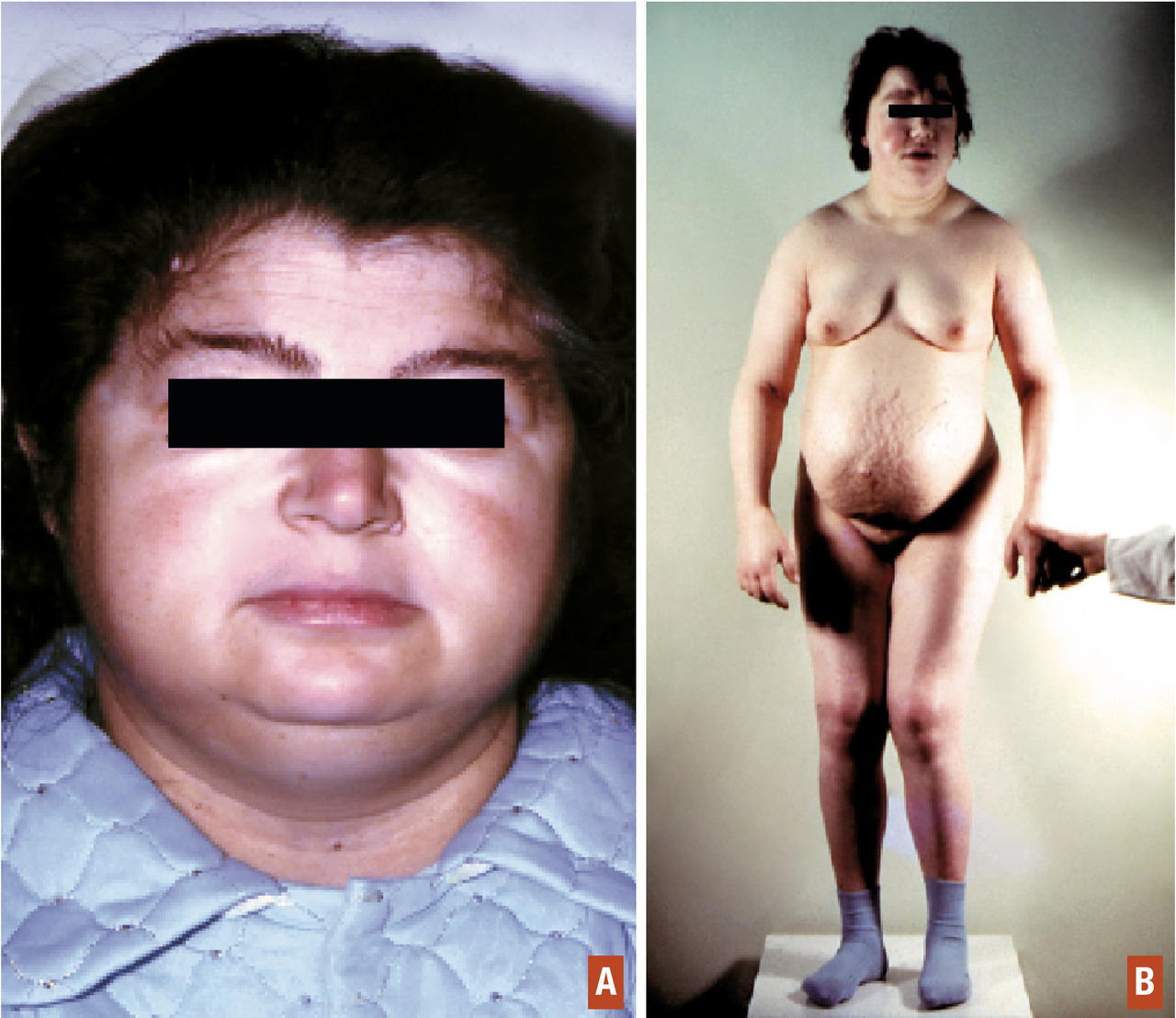
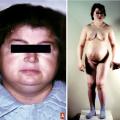
Le myxœdème résulte de l’infiltration de la peau et des tissus sous-cutanés par une substance mucoïde, riche en polysaccharides acides (figure A et B). Il s’agit d’un faux œdème ferme, ne prenant pas le godet. Il affecte le visage qui s’arrondit, les traits sont épaissis, les lèvres soufflées, les paupières bouffies. Le tronc est infiltré avec un comblement des creux sus-claviculaires, les jambes sont élargies en « poteaux », les extrémités (mains et pieds) sont boudinées. La peau est froide et sèche, d’une pâleur cireuse hormis au niveau des lèvres et des pommettes volontiers érythrocyanosiques. L’infiltration muqueuse et musculaire est à l’origine de la macroglossie, de la voix rauque et grave, de l’hypoacousie, du ronflement et des apnées lors du sommeil. Les phanères sont touchés : les cheveux sont secs et cassants, se raréfient, de même que la pilosité axillaire, pubienne et la queue des sourcils. Les ongles sont striés et fragiles. Le myxœdème est à l’origine d’une prise de poids modérée qui contraste avec la réduction de l’appétit (l’hypothyroïdie n’est pas cause d’obésité).
Formes cliniques
Formes cardiaques
L’hypothyroïdie chronique sévère favorise l’athéromatose, la cardiomégalie, l’insuffisance cardiaque ou coronarienne. La cardiomégalie résulte de l’infiltration myocardique et de la présence d’un épanchement péricardique, habituellement de faible abondance, déterminant radiographiquement un aspect en « cœur de bœuf ». Les manifestations cliniques d’insuffisance cardiaque sont rares, liées à la tamponnade ou la diminution du débit cardiaque que favorisent la bradycardie, la diminution de la force contractile myocardique et l’altération de la fonction diastolique. L’électrocardiogramme révèle des altérations diffuses : bradycardie sinusale, bas voltage, aplatissement ou inversion de l’onde T dans toutes les dérivations. C’est surtout lors de l’instauration de la substitution hormonale que des signes d’ischémie myocardique peuvent se démasquer.Formes neuromusculaires et psychiatriques
Les crampes et la diminution de la force musculaire peuvent coïncider avec une hypertrophie musculaire pseudo-athlétique. L’atteinte neurologique est responsable d’une neuropathie sensitivomotrice à prédominance sensitive, qui se manifeste par des paresthésies des extrémités, une fréquence accrue du syndrome du canal carpien (favorisé par l’infiltration périnerveuse de la gaine), une lenteur à la décontraction musculaire lors de la recherche des réflexes ostéotendineux notamment achilléens. On peut observer des troubles de l’humeur, un état dépressif ou mélancolique, un état confusionnel voire une pseudodémence, réversibles sous traitement.Formes digestives
Un ralentissement prononcé du transit peut déterminer des manifestations occlusives avec iléus paralytique et mégacôlon, notamment chez le sujet âgé.Formes endocriniennes
La fonction gonadotrope est affectée par la carence en hormones thyroïdiennes, ce qui peut entraÎner une infertilité aussi bien chez l’homme que chez la femme, des troubles du cycle et de la libido, des dysfonctions érectiles. Les hypothyroïdies profondes modifient le tonus dopaminergique, entraînant chez la femme jeune une hyperprolactinémie avec syndrome aménorrhée- galactorrhée. L’hypertrophie hypophysaire résultant de l’hypertrophie des secteurs thyréotrope et prolactinique ne doit pas conduire à évoquer à tort un prolactinome.Des formes hydropisiques avec anasarque (épanchements pleuraux, ascite, hydarthroses), hyponatrémie dilutionnelle sévère sont traditionnelles.
Coma myxœdémateux
Le coma myxœdémateux est devenu rare en raison de l’efficacité du diagnostic biologique et du traitement de l’hypothyroïdie. Il s’agit d’un coma calme associé à une hypothermie, une bradycardie, une bradypnée, une hypoxémie, une hypotension artérielle avec risque de collapsus et, sur le plan biologique, une hyponatrémie de dilution. Il correspond à l’évolution ultime d’une hypothyroïdie profonde négligée. Des facteurs déclenchants sont souvent identifiés : exposition au froid (survenue hivernale dans 95 % des cas), infection, stress médical ou chirurgical, médicaments (sédatifs, opiacés, diurétiques, digitaliques…), hyperhydratation. Le pronostic reste sombre.Diagnostic biologique
Diagnostic positif
Le dosage de TSH est l’examen à prescrire en première intention. Le taux de TSH s’accroît précocement dans les hypothyroïdies discrètes, débutantes. Lorsque la TSH est élevée, le dosage de T4 libre permet de confirmer le diagnostic d’atteinte primitivement thyroïdienne et d’en évaluer la profondeur. L’hypothyroïdie est qualifiée de patente si la T4 libre est abaissée, et de fruste ou subclinique si la T4 libre est normale. De façon générale, la mise en évidence d’une valeur de TSH faiblement augmentée doit systématiquement être contrôlée par un nouveau dosage 2 à 3 mois plus tard. Le dosage de T3 libre n’a pas d’intérêt dans l’évaluation d’une hypothyroïdie.Dans les rares situations où l’on suspecte un déficit thyréotrope, cette hypothyroïdie d’origine hypothalamo-hypophysaire se marque par l’abaissement de la T4 libre, en regard d’une TSH normale, rarement basse, voire modérément augmentée (en raison de la réduction de sa bioactivité), mais toujours inadaptée à la valeur basse de T4 libre.
En l’absence de contexte clinique de déficit thyréotrope, le dosage de T4 libre ne doit pas être prescrit en première intention. Sa moindre spécificité et l’extrême rareté de l’hypothyroïdie centrale risquent en effet de conduire à des erreurs diagnostiques coûteuses et dangereuses (tableau 1).
Signes biologiques associés
Des modifications biologiques conduisent parfois à évoquer le diagnostic d’hypothyroïdie :- hypercholestérolémie avec élévation préférentielle des LDL, parfois hypertriglycéridémie ;
- anémie souvent macrocytaire, voire mégalocytaire en cas de maladie de Biermer associée dans un contexte auto-immun. Elle est parfois microcytaire liée à une carence martiale favorisée par l’achlorhydrie gastrique ou les ménorragies, ou normocytaire ;
- élévation des enzymes musculaires (CPK, ASAT, LDH) et, dans les formes sévères, de la myoglobine, de la créatinine ;
- troubles électrolytiques : hyponatrémie de dilution (par réduction de la filtration glomérulaire) ;
- hyperuricémie, en particulier chez les hommes ;
- tendance à l’hypoglycémie, surtout marquée dans les formes centrales avec déficits antéhypophysaires associés ;
- hyperprolactinémie seulement avant la ménopause.
Diagnostic étiologique
La recherche d’une auto-immunité antithyroïdienne consiste en la détection d’un accroissement des anticorps antithyroperoxydase (anti-TPO), plus rarement les anticorps antithyroglobuline (anti-Tg) [présents isolément en l’absence d’anticorps anti-TPO dans 3 % des cas]. Le dosage de thyroglobuline est seulement utile dans l’évaluation des hypothyroïdies congénitales : sa valeur est indétectable en cas d’athyréose, accrue dans les autres causes (ectopie, anomalie de la biosynthèse hormonale). Le dosage de l’iodurie (souvent déterminée en concentration sur un simple recueil urinaire) permettrait de confirmer une surcharge iodée non identifiée à l’interrogatoire. Ce dosage n’est pas remboursé par l’Assurance maladie.
L’échographie thyroïdienne est justifiée en présence d’un goitre ou de nodules palpables, ou dans le cadre des hypothyroïdies congénitales, à la recherche d’une ectopie thyroïdienne cervicale. Elle a moins d’intérêt pour confirmer le caractère atrophique d’une thyroïde ou la vacuité de la loge thyroïdienne.
Enfin, la scintigraphie thyroïdienne est rarement utile dans l’exploration d’une hypothyroïdie acquise de l’adulte. Elle permet d’évaluer le mécanisme de certaines hypothyroïdies congénitales ou acquises, notamment iatrogènes, de détecter en particulier un trouble de l’organification de l’iode par le test au perchlorate.
Causes de l’hypothyroïdie de l’adulte (tableau 2)
Hypothyroïdie primitivement thyroïdienne
Hypothyroïdie d’origine auto-immune. L’auto-immunité représente le principal facteur étiologique d’hypothyroïdie spontanée, notamment chez la femme, et s’exprime sous diverses présentations. L’atteinte thyroïdienne peut être isolée, ou s’associer à d’autres atteintes auto-immunes : diabète de type 1, insuffisance surrénale, insuffisance ovarienne primitive par ovarite auto-immune, vitiligo, maladie de Biermer, syndrome de Gougerot-Sjögren… Ces atteintes multiples peuvent entrer dans le cadre de polyendocrinopathies auto-immunes. La polyendocrinopathie auto-immune de type 2 est plus fréquente. Elle associe une hyper- ou une hypothyroïdie auto-immune, un diabète de type 1, une maladie d’Addison, une ménopause précoce, éventuellement d’autres atteintes auto- immunes. Le syndrome de Schmidt associe thyroïdite auto- immune et maladie d’Addison (la mélanodermie manque habituellement du fait de la carence en hormones thyroïdiennes).Thyroïdite lymphocytaire chronique à forme atrophiante myxœdème idiopathique post-ménopausique). Cause la plus fréquente d’hypothyroïdie, touchant particulièrement la femme après la ménopause, elle est possible aussi chez l’homme et l’enfant. Elle s’accompagne d’une atrophie progressive de la glande thyroïde (involution thyroïdienne spontanée). La thyroïde est atrophique à l’échographie (volume < 7 mL), hypoéchogène et hypovasculaire. Les anticorps anti-TPO sont accrus, moins fréquemment les anticorps antithyroglobuline (anti-Tg). Leur taux diminue progressivement parallèlement à l’involution thyroïdienne et de la masse tissulaire antigénique, parfois jusqu’à la négativation. L’hypothyroïdie est définitive.
Thyroïdite de Hashimoto. Il s’agit de la forme hypertrophique des thyroïdites lymphocytaires chroniques. Elle prédomine nettement chez la femme (9 cas sur 10), avec une incidence maximale entre 30 et 45 ans. Le goitre est constant, diffus, homogène, indolore, de consistance ferme (semblable à celle d’un pneu en caoutchouc), non compressif. L’hypothyroïdie est souvent absente au moment du diagnostic mais s’installe inéluctablement de façon progressive au cours de l’évolution. Les anticorps anti-TPO sont présents à des titres très élevés, et moins constamment les anticorps anti-Tg. En échographie, l’hypertrophie thyroïdienne est diffuse, d’aspect hypoéchogène hétérogène. Le principal risque évolutif de la thyroïdite de Hashimoto est constitué par la transformation lymphomateuse, rare (1 % des cas), mais imposant une surveillance régulière. Une variante de la thyroïdite de Hashimoto est représentée par la thyroïdite lymphocytaire chronique de l’adolescent. Elle apparaît généralement entre 10 et 15 ans, se manifeste par un goitre diffus qui se distingue du goitre simple par sa fermeté. Elle s’accompagne biologiquement d’un taux d’anticorps anti-TPO élevé et parfois d’une élévation de la TSH.
Thyroïdite auto-immune asymptomatique. C’est la plus fréquente des présentations des thyropathies auto-immunes, touchant entre 10 et 20 % de la population adulte féminine. Au sens propre, la thyroïdite asymptomatique s’observe en l’absence de goitre, de dysfonction thyroïdienne. On peut la reconnaître biologiquement par la présence d’anticorps antithyroïdiens, en échographie par l’aspect globalement hypoéchogène de la thyroïde, enfin histologiquement par un infiltrat lymphoplasmocytaire s’associant à des altérations parenchymateuses. La TSH est normale, mais sa surveillance annuelle est recommandée, en raison du risque élevé d’apparition d’une hypothyroïdie, avec une incidence de 5 % par an. Les situations de thyroïdites auto-immunes asymptomatiques constituent un facteur majeur de prédisposition aux hypothyroïdies précoces de la grossesse, aux thyroïdites silencieuses du post-partum, aux hypothyroïdies liées aux surcharges iodées, au lithium…
Thyroïdite du post-partum. Elle touche environ 5 à 10 % des femmes après leur accouchement. Après une phase transitoire de thyrotoxicose, souvent inapparente, survient une hypothyroïdie à partir du 4e ou 5e mois suivant l’accouchement. Les signes cliniques peuvent être rattachés à tort à la fatigue liée à l’accouchement et aux soins apportés au nouveau-né, à un « baby-blues ». La TSH est généralement franchement élevée et les anticorps anti-TPO accrus. L’évolution est marquée dans la plupart des cas (80-90 %) par le retour à l’euthyroïdie, en quelques semaines ou quelques mois. Néanmoins, des hypothyroïdies définitives sont possibles (10-20 % des cas, coïncidant avec une atrophie progressive de la glande thyroïde). La récidive lors des grossesses ultérieures est fréquente (30-40 %).
Thyroïdite subaiguë de De Quervain. L’hypothyroïdie est possible à la phase de récupération des thyroïdites subaiguës. La symptomatologie avait débuté par des douleurs cervicales antérieures, survenant typiquement entre 2 et 6 semaines après un épisode viral rhinopharyngé. En phase aiguë sont constatés une fièvre, une asthénie, un goitre diffus, ferme, très douloureux, et des signes de thyrotoxicose en rapport avec la libération d’hormones thyroïdiennes secondaire au processus de thyroïdite. Ces signes, spontanément régressifs, sont soulagés par un traitement symptomatique comportant des anti-inflammatoires non stéroïdiens (AINS) ou une corticothérapie orale, et font place à une phase transitoire d’hypothyroïdie de quelques semaines ou mois, suivie d’une récupération fonctionnelle complète. Dans moins de 5 % des cas, cette hypothyroïdie peut néanmoins être définitive.
Hypothyroïdie d’origine iatrogène
Post-thyroïdectomie : l’hypothyroïdie est constante après thyroïdectomie totale, nécessitant un traitement substitutif immédiat en hormones thyroïdiennes. Après thyroïdectomie partielle, le risque d’hypothyroïdie dépend de la masse de tissu fonctionnel laissé en place. Il est très faible en cas de lobectomie ou de lobo- isthmectomie, si le parenchyme est sain et préalablement normofonctionnel. Néanmoins, une surveillance régulière et prolongée de la TSH est nécessaire puisque l’hypothyroïdie peut apparaître secondairement, plusieurs mois après la chirurgie, en particulier en cas de thyroïdite auto-immune sous-jacente ;
Traitement radio-isotopique : le traitement des pathologies thyroïdiennes par iode radioactif se complique volontiers d’hypothyroïdie, en particulier au décours du traitement de la maladie de Basedow. L’hypothyroïdie peut apparaître précocement, dans les semaines qui suivent le traitement. Elle est alors souvent transitoire, en rapport avec des phénomènes de thyroïdite radique. Elle peut être retardée, s’observer plusieurs mois ou années après l’administration d’iode radioactif, et dans ce cas définitive, liée à la destruction progressive du parenchyme thyroïdien. Une surveillance systématique prolongée de la TSH est donc indispensable après traitement radio-isotopique. Le risque d’hypothyroïdie est beaucoup plus faible après traitement d’un nodule toxique puisque seul le nodule hyperfonctionnel capte l’iode administré (nodule extinctif) mais pas le parenchyme sain qui est au repos et reste ainsi protégé. La surveillance de la TSH reste néanmoins indispensable.
Radiothérapie externe : toute irradiation de la région cervicale peut entraîner une hypothyroïdie dans un délai de plusieurs mois voire plusieurs années après le traitement. C’est le cas particulièrement des traitements de cancers oto-rhino-laryngés et des lymphomes de Hodgkin qui ont conduit à une irradiation élevée (30-60 Gy). Une surveillance de la TSH est indispensable au décours de ces situations pendant plusieurs années ;
Surcharge iodée : l’hypothyroïdie induite par l’iode est surtout le fait de traitements par l’amiodarone, molécule très riche en iode (un seul comprimé apporte 75 mg d’iode, soit 500 fois plus que les besoins journaliers recommandés) et lipophile, qui s’accumule longtemps dans les tissus (demi-vie d’élimination plasmatique de 30 à 100 jours). Elle est possible mais plus rare dans les surcharges iodées d’autre origine : produits de contraste radiologiques, antiseptiques locaux, préparations laxatives, produits diététiques à base de produits de la mer… L’apparition de l’hypothyroïdie est favorisée par l’auto-immunité antithyroïdienne. Elle est ordinairement transitoire, réversible avec l’élimination de la surcharge iodée, mais peut justifier la supplémentation hormonale.
Autres causes médicamenteuses : les antithyroïdiens de synthèse peuvent induire une hypothyroïdie, ce qui justifie une surveillance biologique régulière et une bonne adaptation du schéma thérapeutique. L’hypothyroïdie est fréquente sous lithium, utilisé en psychiatrie dans les troubles bipolaires. Elle survient chez environ 10 % des patients lors de la première année du traitement, surtout chez les femmes. Une auto-immunité thyroïdienne préexistante favorise la survenue de l’hypothyroïdie. Celle-ci coïncide avec un goitre, est en général réversible à l’arrêt de la lithothérapie lorsque celui-ci est possible. Mais, dans le cas contraire, il n’y pas de gêne à sa poursuite en association avec l’hormonothérapie thyroïdienne. Les cytokines sont aussi d’importants pourvoyeurs de dysthyroïdies. L’interféron a, essentiellement utilisé dans les hépatites chroniques B et C, ainsi que dans certaines hémopathies ou tumeurs solides, induit une dysthyroïdie en moyenne dans 9 % des cas (de 2,5 à 40 % selon les études) dont l’hypothyroïdie, surtout chez la femme et en cas d’auto-immunité thyroïdienne préexistante. Sous interféron b, utilisé dans la sclérose en plaques, une hypothyroïdie par thyroïdite destructrice survient dans 8 % des cas surtout lors de la première année de traitement. L’interleukine 2 peut aussi induire une hypothyroïdie, ou une hyperthyroïdie, ou des dysthyroïdies diphasiques. D’introduction plus récente, les thérapeutiques moléculaires ciblées anticancéreuses se sont révélées potentiellement responsables d’hypothyroïdies. C’est le cas du sunitinib (Sutent), inhibiteur de tyrosine kinase utilisé dans le cancer du rein et les tumeurs stromales gastro-intestinales (GIST) qui justifie aussi la surveillance des taux de TSH. Enfin, l’immunothérapie anticancéreuse anti- CTLA-4 ou anti-PD-1/PD-L1, utilisée notamment en dermatologie contre le mélanome métastatique ou en pneumologie dans le carcinome pulmonaire à petites cellules, peut induire une hypothyroïdie par deux mécanismes : déficit thyréotrope lié à une hypophysite parfois associé à d’autres déficits antéhypophysaires, ou hypothyroïdie périphérique dans le cadre d’une thyroïdite diphasique (phase de thyrotoxicose précédant l’hypothyroïdie).
Hypothyroïdie d’origine infiltrative. La thyroïdite de Riedel, ou thyroïdite fibreuse, est une pathologie thyroïdienne fibrosante rare qui peut aboutir à une hypothyroïdie en cas de destruction complète du parenchyme thyroïdien par le processus fibreux. De façon analogue, les envahissements du parenchyme thyroïdien par un processus néoplasique, une localisation métastatique ou dans le cadre d’une leucémie ou d’un lymphome, peuvent conduire dans leurs formes extrêmes à un déficit de la production hormonale thyroïdienne. Enfin, des hypothyroïdies par infiltration thyroïdienne liée à maladie de surcharge ou à une granulomatose (amylose, sarcoïdose, autres granulomatoses) ont été décrites.
Hypothyroïdie congénitale à révélation tardive. Le diagnostic des hypothyroïdies d’origine congénitale est dans la très grande majorité des cas de reconnaissance pédiatrique, surtout depuis la généralisation du dépistage néonatal de l’hypothyroïdie. Néanmoins, certains tableaux particuliers peuvent échapper au diagnostic ou apparaître de façon retardée dans l’enfance, l’adolescence, voire à l’âge adulte. Il s’agit de troubles de l’hormonogenèse, généralement associés à un goitre, ou d’anomalies de l’ontogenèse, en particulier d’ectopies thyroïdiennes.
Facteurs nutritionnels, environnementaux et généraux. Le principal facteur environnemental à l’origine d’hypothyroïdies était la carence iodée, responsable de goitres endémiques dans certaines régions du globe, parfois de tableaux de crétinisme, compliquant l’hypothyroxinémie fœtale et infantile. Ces tableaux ont presque partout disparu. On observe aussi des hypothyroïdies avec goitre au cours des syndromes néphrotiques qui entraînent une déperdition urinaire en hormones liées à la protéinurie, ou chez les dialysés.
Insuffisance thyroïdienne par déficit thyréotrope
L’hypothyroïdie d’origine centrale est infiniment moins fréquente que l’hypothyroïdie périphérique (rapport de 1/1 000). Elle est exceptionnellement isolée, ordinairement associée à d’autres déficits hypophysaires. C’est le contexte qui permet généralement de l’évoquer : pathologie tumorale de la région hypothalamo-hypophysaire, mais aussi génétique, auto-immune, infectieuse, infiltrative, nécrose ischémique, du syndrome de Sheehan, radiothérapie cérébrale, traumatisme crânien, hémorragie méningée… La présentation clinique est variable, fonction des déficits associés, il n’y a pas de goitre ni de myxœdème. Le diagnostic biologique n’est pas facile : la TSH peut être basse, normale voire augmentée, mais inadaptée à une T4 libre basse. La T4 libre peut toutefois être dans les valeurs basses des normesÉtats de résistance à la TSH
Ils sont liés à des mutations inhibitrices, souvent familiales, du gène codant le récepteur de la TSH, ou du gène GNAS codant la protéine de liaison Gsα (impliquée dans la signalisation du récepteur de la TSH) au cours des pseudo-hypoparathyroïdies de type 1, parfois de type 2.Traitement et surveillance
Moyens thérapeutiques et posologies
Le traitement de l’hypothyroïdie repose sur la correction de l’insuffisance hormonale par l’administration d’hormones thyroïdiennes. On utilise principalement la lévothyroxine, correspondant à la L-T4. Absorbée au niveau du jéjunum et de l’iléon, elle est secondairement métabolisée au niveau des tissus-cible en L-T3, hormone biologiquement active. Le traitement par lévothyroxine est idéal. En effet, il est sûr, structurellement identique à l’hormone endogène, efficace, d’action douce, peu onéreux, finement ajustable sur la valeur de la TSH. Sa longue demi-vie (7 jours) permet une prise unique quotidienne. La lévothyroxine est disponible en France en comprimés sous la forme de plusieurs spécialités (Levothyrox, L-Thyroxin Henning, Thyrofix). La lévothyroxine en solution buvable (L-Thyroxine), administrée sous forme de gouttes, est réservée préférentiellement aux enfants. Sous forme d’ampoules injectables dosées à 200 µg, elle est utilisée dans le coma myxœdémateux ou lorsque la voie orale est impossible. Il existe aussi des préparations à base de L-T3 (lévotriiodothyronine ou liothyronine), commercialisées sous forme de comprimés de Cynomel dosés à 25 µg, et d’Euthyral, composé de l’association de L-T4 (100 µg) et de L-T3 (20 µg). Ces deux présentations conduisent néanmoins à des concentrations supraphysiologiques de L-T3, hormone directement active à demi-vie plus courte (nécessitant plusieurs prises quotidiennes) avec un risque de surdosage et une stabilité moins parfaite des taux plasmatiques.Les besoins en lévothyroxine ne sont guère dépendants de la cause et de l’intensité initiale de l’hypothyroïdie. Ils dépendent essentiellement du volume de distribution, en pratique du poids du patient : les besoins sont en moyenne 1,6 à 1,7 µg/kg/j chez l’adulte, 1,3 µg/kg/j chez le sujet âgé et 2-2,5 µg/kg/j chez l’enfant. L’état d’équilibre est atteint environ 6 semaines après l’introduction du traitement. L’instauration du traitement peut se faire d’emblée à la posologie cible au décours d’une thyroïdectomie totale, ou même dans les hypothyroïdies modérées du sujet une sans antécédent cardiaque. En revanche, l’apport initial est d’autant plus faible et la progression d’autant plus lente que l’hypothyroïdie est ancienne, que le sujet est âgé ou cardiaque. Une optimisation du traitement de la cardiopathie est nécessaire avant d’introduire la substitution hormonale.
Conditions de prise
Expérimentalement, la meilleure absorption digestive de lévothyroxine est obtenue lors d’une administration le matin à jeun, idéalement au moins une heure avant le petit déjeuner, car la prise alimentaire réduit significativement l’absorption. Puisque ces conditions sont difficilement compatibles avec les habitudes de vie de la plupart des patients, on préfère recommander des conditions qui favorisent l’observance : prise tous les jours dans les mêmes conditions, si possible 20-30 minutes avant le petit déjeuner. Dans les situations d’équilibre difficile ou de prises médicamenteuses associées, une prise le soir au coucher plus de 2 heures après le dernier repas peut être favorable.Surveillance
Elle repose sur le dosage de la TSH seule 6-8 semaines après le dernier changement de posologie, c’est-à-dire à l’état d’équilibre. Une TSH élevée témoigne d’une posologie insuffisante de L-T4, qui doit donc être majorée. Une TSH basse témoigne au contraire d’un surdosage, nécessitant une diminution de la posologie. En dehors des situations nécessitant un freinage de la TSH (certains cancers thyroïdiens non guéris de souche vésiculaire), le surdosage doit être évité, en particulier chez les sujets âgés ou cardiopathes, chez lesquelles on vise plutôt une TSH proche de la limite supérieure des normes. Lorsque la posologie optimale a été identifiée, un contrôle de la TSH tous les 6-12 mois est suffisant. On peut rassurer le patient quant à l’absence de retentissement clinique de minimes fluctuations de la TSH qui ne constitue pas un paramètre fixe chez les sujets normaux ou les hypothyroïdiens substitués.Situations particulières
Grossesse. Les besoins en hormones thyroïdiennes augmentent dès le début de la grossesse. Chez les patientes traitées, la posologie de lévothyroxine doit donc être systématiquement d’emblée augmentée de 30 à 50 % dès le diagnostic de grossesse. Un dosage de TSH est recommandé après 4 à 6 semaines, puis tous les 2 mois, avec l’objectif de maintenir la valeur < 2,5 mUI/L. La posologie antérieure à la grossesse peut être reprise dès l’accouchement. En préconceptionnel, il est recommandé de vérifier la normalité de la TSH.Déficit thyréotrope. Les posologies de lévothyroxine utilisées pour traiter l’hypothyroïdie centrale sont similaires à celles utilisées dans l’hypothyroïdie périphérique. La surveillance repose sur le dosage de la FT4, mesurée le matin avant la prise du médicament, avec pour objectif d’obtenir une valeur comprise dans la moitié supérieure des normes. La TSH, si elle a été dosée, s’abaisse généralement bien en dessous des normes lorsque l’objectif thérapeutique est atteint, ce qui ne doit pas conduire à une diminution de posologie.
Hypothyroïdie d’origine médicamenteuse. Lorsqu’il est possible, l’arrêt du médicament à l’origine de l’hypothyroïdie permet la récupération d’une fonction thyroïdienne normale. Le traitement de l’hypothyroïdie par la lévothyroxine étant sûr et efficace, il est possible de maintenir le traitement causal, par exemple lors des traitements par amiodarone ou lithium, ou des traitements anticancéreux.
Autres situations modifiant les besoins en LT4. Les situations suivantes augmentent les besoins en lévothyroxine :
- pathologies digestives diminuant l’absorption de LT4 :
. gastrite atrophique ;
. maladie cœliaque ;
. intolérance au lactose ;
. giardiase intestinale ;
. chirurgie de bypass gastrique : souvent augmentation des besoins ;
- prise de médicaments réduisant l’absorption digestive de LT4 :
. sulfate de fer ;
. inhibiteurs de la pompe à protons en utilisation chronique ;
. antiacides contenant de l’aluminium ;
. chélateurs biliaires (colestyramine, Questran) ;
. chélateurs du phosphore (sévélamer, Renvela) ;
. sucralfate (Ulcar) ;
- médicaments inducteurs enzymatiques ;
- autres médicaments : amiodarone, inhibiteurs de tyrosine kinase ;
- situations augmentant l’espace de diffusion :
. grossesse ;
. prise d’œstrogènes ;
- déperdition hormonale :
. dialysés.
Hypothyroïdie de l’enfant
Dépistage néonatal
Signes cliniques
À la naissance, les signes suivants peuvent être observés :
- petite taille contrastant avec un poids de naissance normal ;
- élargissement des fontanelles antérieure et postérieure ;
- ictère néonatal prolongé (plus de 8 jours) ;
- hernie ombilicale ;
- marbrures cutanées ;
- lanugo ;
- constipation ;
- hypotonie ;
- pleurs rauques ;
- hypothermie ;
- troubles de la succion.
En l’absence de traitement substitutif, situation encore observée dans les pays n’ayant pas instauré de dépistage néonatal, la présentation clinique s’aggrave progressivement : apparition d’un retard statural disharmonieux, avec dysmorphie faciale, d’un retard de développement psychomoteur (« crétinisme » hypothyroïdien), de signes myxœdémateux.
Lorsque l’hypothyroïdie survient plus tardivement, le principal signe d’appel est le retard statural à vitesse de croissance ralentie, classiquement disharmonieux. D’autres signes d’hypothyroïdie tels qu’une frilosité, une constipation, une infiltration discrète, une baisse des performances scolaires peuvent aussi être observés.
Causes des hypothyroïdies congénitales
Lorsque la TSH est retrouvée élevée, les examens suivants sont pratiqués :
- nouveau dosage de TSH, dosages de T3 libre et de T4 libre ;
- dosage de thyroglobuline ;
- parfois dosage d’anticorps antirécepteur de la TSH ;
- dosage de l’iodurie si une carence sévère ou une surcharge iodée est suspectée ;
- radiographies des os longs, à la recherche de signes de retard de maturation osseuse, évoquant un début anténatal de l’hypothyroïdie ;
- échographie thyroïdienne, à la recherche d’une glande thyroïdienne, en place ou ectopique ;
- scintigraphie thyroïdienne : permet de localiser les ectopies et de préciser la fonctionnalité de la glande, parfois grâce à la réalisation d’un test au perchlorate (qui évalue les capacités d’hormonosynthèse).
Hypothyroïdies congénitales permanentes
Primaires. Il s’agit de :- dysgénésies thyroïdiennes (ectopie, agénésie, hypoplasie, hémiagenèse). Elles représentent 85 % des hypothyroïdies congénitales. L’anomalie génétique en cause est le plus souvent non identifiée ;
- troubles de l’hormonosynthèse, qui représentent 10-15 % des causes d’hypothyroïdie congénitale (mutations du gène de la thyroglobuline, du transporteur d’iode/sodium, de la thyroperoxydase, gène PDS impliqué dans le syndrome de Pendred, ThOX2 [pour thyroid oxidase]) ;
- résistance à la TSH (mutations du récepteur de la TSH, pseudo- hypoparathyroïdie).
- syndrome d’interruption de la tige hypophysaire ;
- mutations inactivatrices du récepteur de la TRH, de facteurs de transcription hypophysaires (HESX1, LHX3, LHX4, PIT1, PROP1), de la sous-unité ß de la TSH.
Hypothyroïdies congénitales transitoires
- carence iodée maternelle sévère ou surcharge iodée aiguë (utilisation d’antiseptiques iodés, surtout chez les prématurés) ;
- traitement maternel par antithyroïdiens de synthèse ;
- passage transplacentaire d’anticorps contre le récepteur de TSH ;
- mutations hétérozygotes inactivatrices de ThOX2.
Prise en charge thérapeutique
Le traitement de choix est représenté, comme chez l’adulte, par la lévothyroxine, disponible sous la forme de gouttes dosées à 5 µg/goutte, et sous forme de comprimés pour les enfants plus grands. La posologie est adaptée à l’âge de l’enfant et à la sévérité de la pathologie. Elle est d’environ 8-12 μg/kg/j chez le nouveau-né, puis diminue avec l’âge. La surveillance comporte les dosages de TSH et de T4 libre mais aussi l’évaluation de la croissance, de l’âge osseux et du développement psychomoteur.
L’hypothyroïdie est une pathologie endocrinienne fréquente, qui touche essentiellement les femmes.
Le diagnostic est facile grâce au dosage de la TSH. Il est souvent posé à un stade infraclinique.
Les principales causes sont les thyroïdites auto-immunes et les thyroïdectomies chirurgicales.
Le traitement repose sur la substitution en hormones thyroïdiennes, facile à mettre en œuvre et remarquablement efficace.
L’hypothyroïdie de l’enfant est le plus souvent congénitale. Le dépistage néonatal a transformé son pronostic en permettant une supplémentation précoce en hormones thyroïdiennes.
Message de l'auteur
Questions possibles pour l’examen
➜ Signes cliniques des hypothyroïdies acquises primitives de l’adulte.
➜ Signes biologiques des hypothyroïdies.
➜ Étiologie des hypothyroïdies acquises primitives de l’adulte.
➜ Traitement par la lévothyroxine : modalités, surveillance, critères d’équilibre.
➜ Facteurs susceptibles de majorer ou de réduire les besoins en hormone thyroïdienne.

 Encadrés
Encadrés