L’ictère à bilirubine libre (ou non conjuguée) est fréquemment rencontré durant la période périnatale : il concerne 60 à 80 % des nouveau-nés. Son évolution est le plus souvent favorable sans traitement. -Cependant, il peut être également associé à des manifestations cliniques – regroupées sous le terme de Bilirubin-Induced Neurologic Dysfunction (BIND) –, avec la crainte d’atteintes plus sévères constituant un tableau d’ictère nucléaire lié au dépôt de bilirubine au niveau des noyaux gris centraux ; il s’agit de la première cause d’encéphalopathie évitable.
Ictère physiologique : au-delà du séjour à la maternité
Durant la période néonatale immédiate, il existe un déséquilibre physiologique entre une production importante de bilirubine (hémolyse physiologique) et une élimination réduite (immaturité hépatique et augmentation du cycle entérohépatique). Le métabolisme de la bilirubine s’adapte en une quinzaine de jours (production, conjugaison et excrétion). L’ictère apparaît habituellement entre le 2e et le 3e jour de vie de l’enfant, progresse jusqu’au 7e jour, puis régresse et disparaît spontanément avant le 15e jour. Ainsi, l’ictère persiste au-delà de la période d’observation à la maternité.
Il est donc important que les professionnels de santé de ville soient vigilants vis-à-vis de cet ictère. En effet, les durées de séjour en maternité sont de plus en plus courtes et, même si elles sont encadrées par des règles précises, des études ont mis en évidence un lien entre sorties plus précoces et augmentation des réhospitalisations. L’ictère est la première cause de ces réhospitalisassions dans le premier mois de vie.
Prendre en charge l’hyperbilirubinémie sévère pour éviter l’ictère nucléaire
La définition d’un ictère sévère est bien établie (encadré 1). Le repérage des nouveau-nés à risque, leur traitement et leur suivi après la sortie de maternité doivent suivre une démarche systématique.
Facteurs de risque
Il est important de repérer les enfants à risque d’hyperbilirubinémie sévère afin de redoubler d’attention dans le dépistage et le suivi de l’ictère. Les facteurs de risque sont les suivants :
- âge gestationnel à la naissance inférieur à 38 SA ;
- ictère précoce (survenant moins de 24 heures après la naissance) ;
- situation d’incompatibilité fœto-maternelle érythrocytaire (ABO, Rhésus) ;
- antécédents d’ictère traité par photothérapie dans la fratrie ;
- existence d’une bosse sérosanguine, d’ecchymoses, d’hématomes ;
- antécédents familiaux de maladie hémo-lytique ;
- origine ethnique (Antilles/Afrique pour le déficit en glucose- 6 -phosphate déshydrogénase [G6PD] ; Asie pour l’induction retardée de la glucuronoconjugaison) ;
- allaitement maternel exclusif et inef-ficace ;
- perte de poids supérieure à 10 %.
Quel bilan complémentaire ?
Une hyperbilirubinémie dépassant les seuils de traitement par photothérapie intensive ou se prolongeant au-delà d’une semaine nécessite un bilan. Celui--ci comprend un dosage de la bilirubine totale et de la bilirubine conjuguée – permettant d’éliminer un ictère cholestatique –, un hémogramme avec dosage des réticulocytes, une recherche du groupe sanguin ABO, Rhésus et Kell avec test de Coombs direct, et éventuellement le dosage d’un marqueur de l’inflammation (protéine C-réactive), un examen cytobactériologique des urines (en cas de persistance au-delà de 5 jours) et un dosage de l’activité G6PD pour les populations à risque.
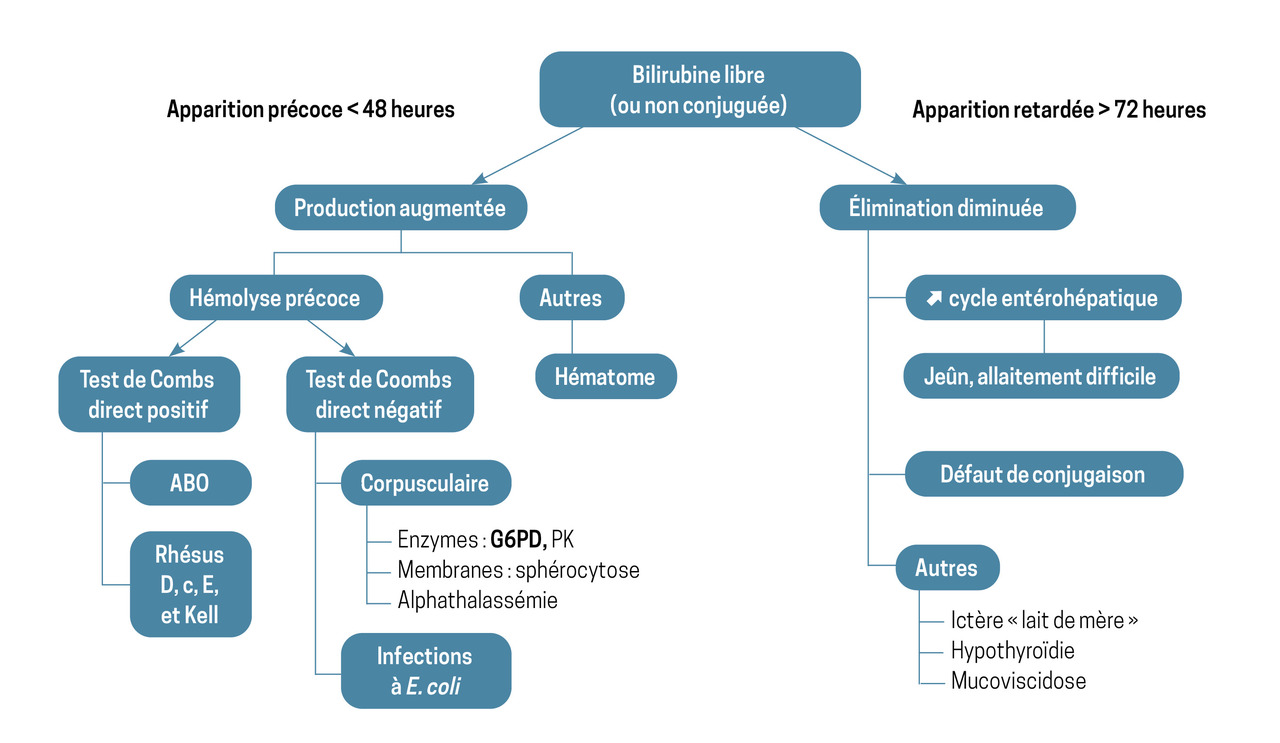
L’ictère précoce à bilirubine libre – survenant moins de quarante-huit heures après la naissance – est principalement dû à une production augmentée de bilirubine (hémolyse), tandis qu’un ictère plus tardif – survenant plus de soixante-douze heures après la naissance – a pour cause une élimination retardée (augmentation du cycle entérohépatique, défaut de glucuronoconjugaison) [fig. 2]. Néanmoins, certains ictères en lien avec une hémolyse peuvent se révéler plus tardivement, après la sortie de maternité, comme pour le déficit en G6PD.
Deux options thérapeutiques
Le traitement curatif de choix est la photothérapie intensive en lumière bleue dépourvue d’ultraviolets ; l’agent actif est l’énergie lumineuse. L’absorption des photons par la bilirubine cutanée ou sous-cutanée induit des photo--dérivés excrétés directement dans les urines ou dans les selles. La surface cutanée exposée doit être la plus importante possible.
L’exsanguinotransfusion est une pratique devenue rare. Elle est utilisée pour le traitement de l’hyperbilirubinémie non conjuguée en cas d’échec ou de retard de la photothérapie intensive afin de prévenir la neurotoxicité de la bilirubine. Il s’agit d’un échange de sang volume à volume correspondant à environ deux masses sanguines, soit 150 à 170 mL/kg. Le sang du nouveau-né est remplacé par du sang reconstitué à partir de globules rouges et de plasma de donneur.
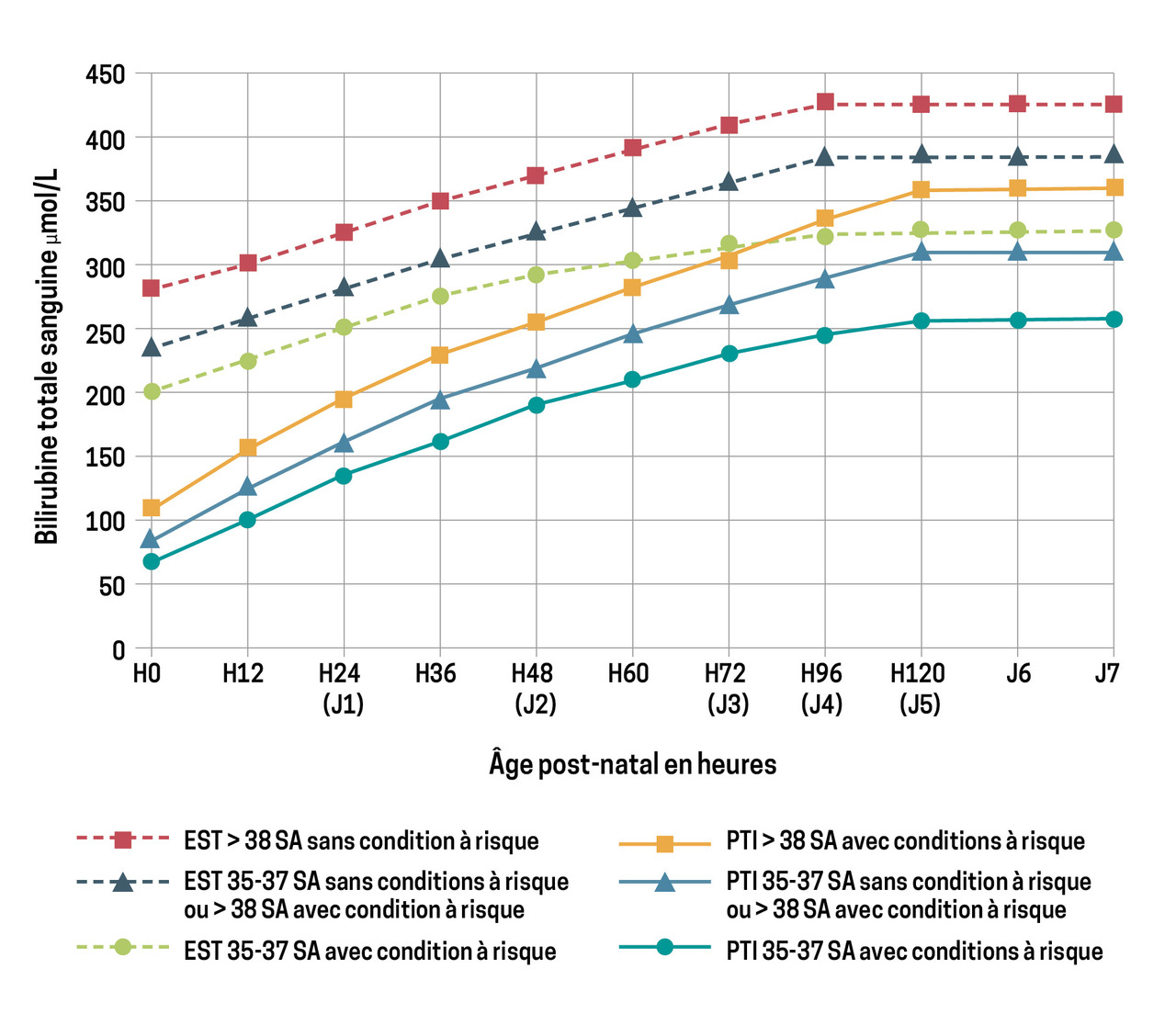
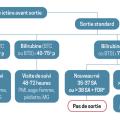
Les courbes de valeurs-seuil de bilirubine totale pour les indications de photothérapie intensive ou d’exsanguinotransfusion intègrent l’âge gestationnel à la naissance et les conditions à risque de vulnérabilité neurologique du nouveau-né (fig. 3).
Face à des signes cliniques d’encéphalopathie aiguë (ictère nucléaire), l’indication d’exsanguinotransfusion est formelle.
Quel suivi à la sortie de maternité ?
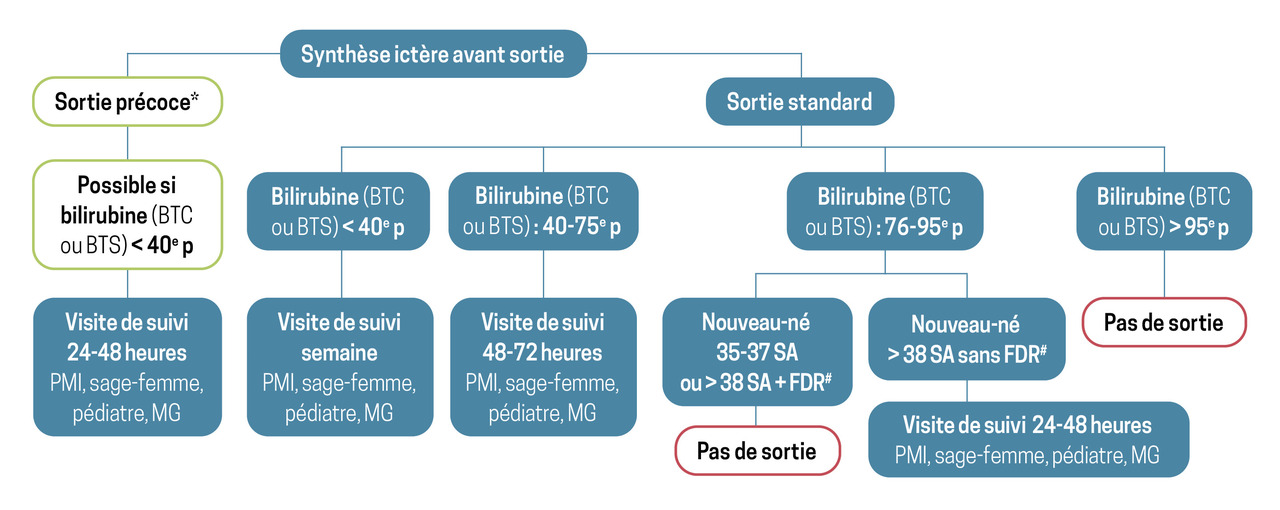
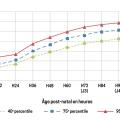
À partir des recommandations de la Haute Autorité de santé de 2014, la Société française de néonatalogie a proposé un algorithme décisionnel de sortie et de suivi en fonction du percentile de bilirubinémie – déterminé à partir des mesures sanguines ou transcutanées par bilirubinomètre – à la date de sortie présumée (fig. 4). L’objectif des visites de suivi est d’évaluer l’état général de l’enfant, les interactions mère-enfant, la qualité de l’alimentation, la reprise du poids de naissance et l’ictère.
En pratique : dépister et évaluer l’ictère après la sortie de maternité
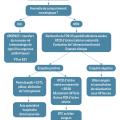
En cas d’ictère chez un nouveau-né après la sortie de maternité, il convient de rechercher des signes neurologiques qui imposent une prise en charge en urgence ; en leur absence, la prise en charge suit un algorithme décisionnel (fig. 5). Son application permet de limiter le recours aux services d’urgences pédiatriques pour prélèvements sanguins ou avis spécialisés non justifiés, d’éviter le retard de prise en charge d’un ictère pathologique ainsi que les complications liées à la neurotoxicité de la bilirubine au-delà d’un certain seuil.
Repérer les nouveau-nés à risque d’ictère pathologique
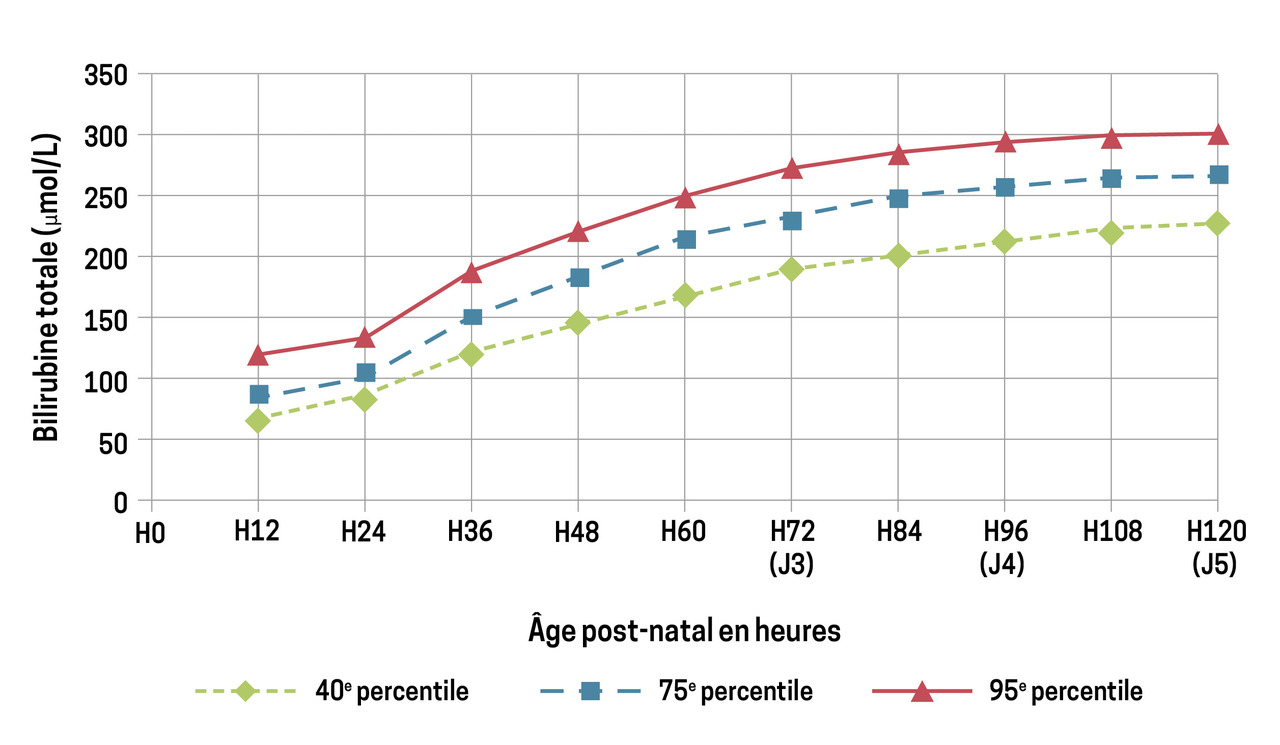
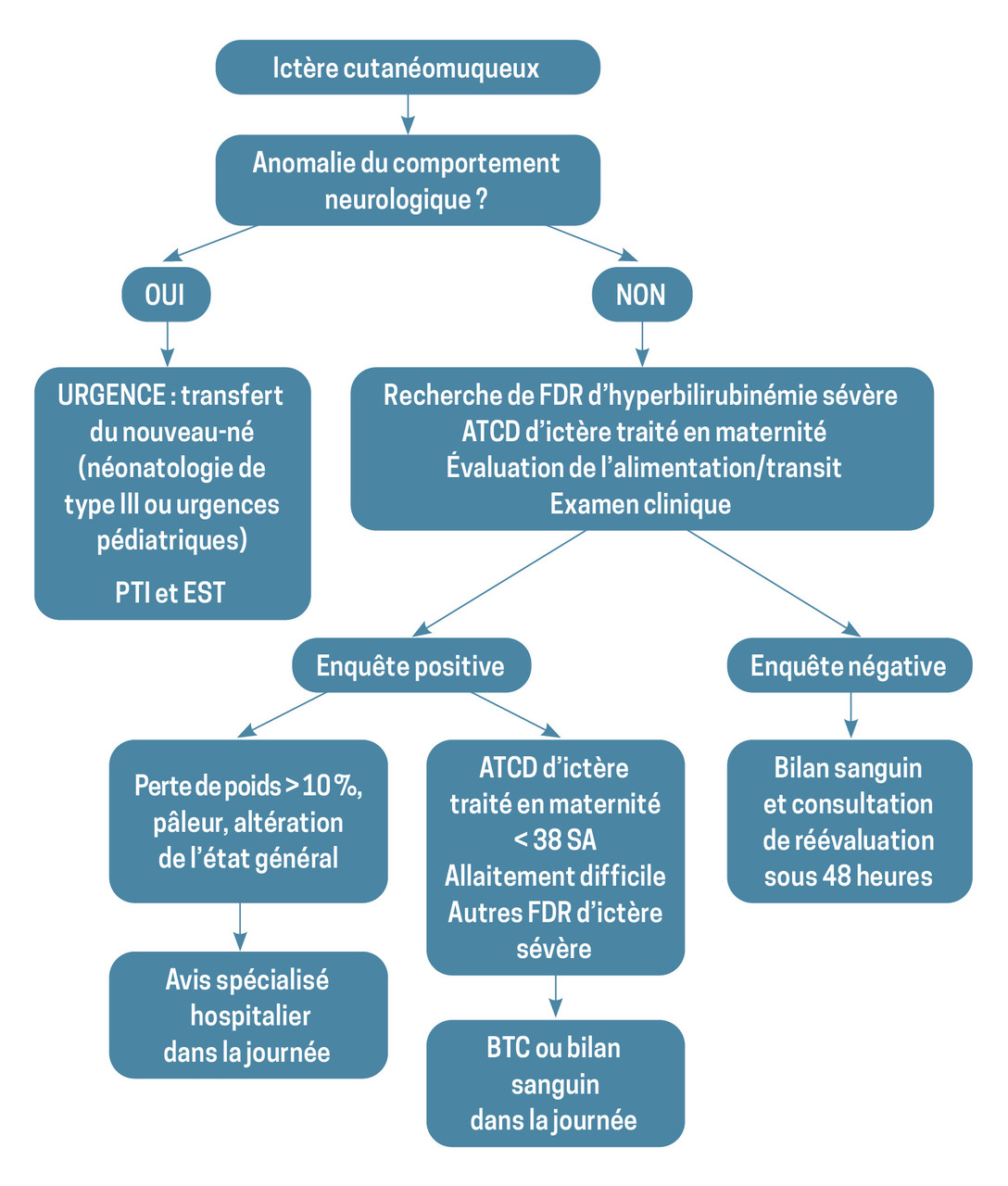
L’interrogatoire permet de renseigner l’âge de début de l’ictère, les traitements éventuels au cours du séjour à la maternité et l’existence de facteurs de risque d’hyperbilirubinémie sévère. Les nouveau-nés ayant eu un ictère (traité ou non) durant leur séjour à la maternité devraient tous avoir, dans leur carnet de santé, le nomogramme de Bhutani imprimé, avec l’ensemble des valeurs de bilirubine transcutanée (ou sanguine) relevées au cours de la surveillance hospitalière.
Évaluer le comportement neurologique de l’enfant
Il est important de repérer les signes précoces de neurotoxicité de la bilirubine (refus de boire, somnolence, hypotonie) ainsi que ses signes plus tardifs (cri aigu et attitude en hyperextension). La présence de ces symptômes est une urgence thérapeutique : l’enfant doit être adressé, sans délai, dans un service de néonatologie ou d’urgences pédiatriques en fonction de l’organisation locale. En effet, le délai de mise en route de thérapeutiques efficaces doit être le plus court possible afin de limiter les séquelles neurologiques.
Examiner l’enfant dans sa globalité
En dehors de l’ictère cutanéomuqueux, des signes peuvent orienter le diagnostic étiologique : pâleur ou hépatosplénomégalie (causes hémolytiques), fièvre (causes infectieuses), perte de poids -supérieure à 10 % et signes cliniques de déshydratation (allaitement insuffisant), etc.
Évaluer la qualité de la prise alimentaire
Après une perte de poids physiologique (< 8 à 10 %) dans les deux à trois premiers jours de vie, l’enfant doit prendre environ 20 à 30 g/j et récupérer son poids de naissance entre le 7e et le 10e jour de vie.
L’ictère d’allaitement insuffisant ou « de jeûne » représente la majorité des ictères des nouveau-nés allaités exclusivement au sein, dans les quinze premiers jours de vie. Il est à différencier de l’ictère au lait maternel, physiologique (encadré 2).
Cet ictère « de jeûne » peut être limité par un soutien actif de l’allaitement et par une évaluation des obstacles rencontrés. L’observation d’une tétée aide au diagnostic ; l’impression d’une incapacité du couple mère-enfant à surmonter les difficultés conduit parfois à une hospitalisation. Néanmoins, la mise en place d’un rythme de huit à douze tétées par jour est le plus souvent suffisante ; mais il est parfois nécessaire d’instaurer transitoirement des compléments de lait artificiel (hydrolysats de protéines de lait de vache). L’allaitement maternel s’évalue par la prise pondérale après la naissance, la qualité du transit et la présence d’urines à chaque change.
Quantifier l’ictère
L’évaluation visuelle de l’ictère n’est pas suffisante pour en apprécier la gravité ; elle peut en effet être faussement rassurante ou difficile à percevoir chez les nouveau-nés à phototype foncé. Par ailleurs, l’évaluation de la coloration des muqueuses (conjonctives) n’est pas toujours faisable chez ces enfants endormis.
Le test de référence (ou gold standard) est le dosage sanguin de la bilirubine totale.
Cependant, l’utilisation du bilirubinomètre transcutané est une méthode non invasive intéressante de quantification de la bilirubine sous-cutanée. Grâce à ce procédé, les prélèvements sanguins peuvent être limités aux valeurs de bilirubine transcutanée supérieures au 75e percentile selon le nomogramme de Bhutani. Néanmoins, peu de professionnels de santé sont équipés de bilirubinomètre transcutané en raison du coût élevé de ces appareils.
1. Classification des hyperbilirubinémies
La valeur de la bilirubine s’interprète en fonction de l’âge post-natal – exprimé en heures de vie – et en utilisant le nomogramme de Bhutani (fig. 1). L’ictère « pathologique » correspond à une hyperbilirubinémie dépassant le 95e percentile des valeurs de bilirubinémie totale pour l’âge. L’hyperbilirubinémie est dite « sévère » et à risque neurologique lorsque les valeurs de bilirubinémie dépassent 340 μmol/L dans les 96 premières heures de vie ou 420 μmol/L au-délà des 96 premières heures de vie, chez l’enfant né à terme.
2. Ictère au lait maternel : un diagnostic d’élimination
- Il apparaît après 4 à 5 jours de vie.
- Il peut durer plusieurs semaines, et son pic de fréquence se situe entre 2 et 4 semaines.
- Au contraire des situations d’allaitement inefficace, l’ictère au lait maternel s’observe chez un nouveau-né qui est suffisamment allaité, avec une courbe de poids normale.
- Sa physiopathologie est mal connue, mais un facteur encore non identifié et présent dans le lait maternel mature augmenterait la réabsorption intestinale de la bilirubine.
- Bénin, il est un diagnostic d’élimination.
Cortey A, Renesme L, Raignoux J, et al. Ictère à bilirubine non conjuguée du nouveau-né de 35 semaines et plus : du dépistage au suivi après sortie de la maternité. Recommandations pour la pratique clinique. Arch Pédiatrie 2017;24(2):192‑203.
Cortey A. Ictère à bilirubine non conjuguée du nouveau-né après sortie de maternité : de la physiopathologie à la pratique. Perfect en Pédiatrie 2018;1(2):127‑34.
Bhutani VK, Johnson L. A proposal to prevent severe neonatal hyperbilirubinemia and kernicterus. J Perinatol 2009;29(S1):S61‑7.
American Academy of Pediatrics, Subcommittee on Hyperbilirubinemia. Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation. Pediatrics 2004;114:297-316
HAS. Sortie de maternité après accouchement : conditions et organisation du retour à domicile des mères et de leurs nouveau-nés. Recommandations pour la pratique clinique. 2014.
Maisels MJ, Bhutani VK, Bogen D, et al. Hyperbilirubinemia in the Newborn Infant ≥ 35 Weeks’ Gestation: An Update With Clarifications. Pediatrics 2009;124(4):1193‑8.
Maisels MJ. Transcutaneous Bilirubin Measurement: Does It Work in the Real World? Pediatrics 2015;135(2):364‑6.

 Encadrés
Encadrés