Les toxidermies sont des effets indésirables fréquents des médicaments. Si elles sont le plus souvent bénignes, les 1 % les plus graves peuvent menacer le pronostic vital et/ou conduire à des séquelles à long terme. Une fois identifié et stoppé le médicament suspect, une prise en charge symptomatique adaptée est mise en place. Une déclaration au système de pharmacovigilance s’impose.
Les réactions cutanées sont parmi les effets indésirables des médicaments les plus fréquents. On distingue les hypersensibilités immédiates, survenant moins d’une heure après la prise du médicament, et les hypersensibilités retardées, ou toxidermies, survenant plus d’une heure après, en pratique souvent plus de six à vingt-quatre heures après.1
La plupart des toxidermies sont bénignes, peu sévères, ne conduisant pas à une hospitalisation et guérissant en quelques jours à l’arrêt du médicament suspect. Il s’agit essentiellement des exanthèmes maculo-papuleux, des urticaires dites « retardées » (survenant plus d’une heure après la prise du médicament, par opposition aux urticaires des hypersensibilités immédiates) et des érythèmes pigmentés fixes non généralisés.
Par opposition, les toxidermies graves sont rares (1 % des cas) mais peuvent menacer le pronostic vital et/ou conduire à des séquelles à long terme. Elles regroupent principalement la nécrolyse épidermique, la drug reaction with eosinophilia and systemic symptoms (DRESS) et la pustulose exanthématique aiguë généralisée (PEAG). La nécrolyse épidermique inclut, en fonction de la surface cutanée décollée-décollable, le syndrome de Stevens-Johnson (SJS) [< 10 %], le syndrome de chevauchement, ou overlap (de 10 à 29 %), et la nécrolyse épidermique toxique (NET), ou syndrome de Lyell (≥ 30 %).
L’incidence de la nécrolyse épidermique est de 2 à 6 cas par million d’habitants et par an ; celles de la PEAG et du DRESS ne sont pas connues, mais chez les patients mis sous antiépileptiques, l’incidence du DRESS est de 1 cas pour 1 000 à 1 cas pour 10 000.2
La physiopathologie des toxidermies fait intervenir des mécanismes d’hypersensibilité de type IV de la classification de Gell et Coombs, avec activation de lymphocytes T CD8+ cytotoxiques spécifiques du médicament et mise en jeu de diverses cellules (polynucléaires neutrophiles, éosinophiles) et molécules (cytokines, granulysine, perforine, granzyme B…) effectrices selon le type de toxidermie.2
La plupart des toxidermies sont bénignes, peu sévères, ne conduisant pas à une hospitalisation et guérissant en quelques jours à l’arrêt du médicament suspect. Il s’agit essentiellement des exanthèmes maculo-papuleux, des urticaires dites « retardées » (survenant plus d’une heure après la prise du médicament, par opposition aux urticaires des hypersensibilités immédiates) et des érythèmes pigmentés fixes non généralisés.
Par opposition, les toxidermies graves sont rares (1 % des cas) mais peuvent menacer le pronostic vital et/ou conduire à des séquelles à long terme. Elles regroupent principalement la nécrolyse épidermique, la drug reaction with eosinophilia and systemic symptoms (DRESS) et la pustulose exanthématique aiguë généralisée (PEAG). La nécrolyse épidermique inclut, en fonction de la surface cutanée décollée-décollable, le syndrome de Stevens-Johnson (SJS) [< 10 %], le syndrome de chevauchement, ou overlap (de 10 à 29 %), et la nécrolyse épidermique toxique (NET), ou syndrome de Lyell (≥ 30 %).
L’incidence de la nécrolyse épidermique est de 2 à 6 cas par million d’habitants et par an ; celles de la PEAG et du DRESS ne sont pas connues, mais chez les patients mis sous antiépileptiques, l’incidence du DRESS est de 1 cas pour 1 000 à 1 cas pour 10 000.2
La physiopathologie des toxidermies fait intervenir des mécanismes d’hypersensibilité de type IV de la classification de Gell et Coombs, avec activation de lymphocytes T CD8+ cytotoxiques spécifiques du médicament et mise en jeu de diverses cellules (polynucléaires neutrophiles, éosinophiles) et molécules (cytokines, granulysine, perforine, granzyme B…) effectrices selon le type de toxidermie.2
Conduite à tenir initiale devant une suspicion de toxidermie
Cinq étapes pour orienter la prise en charge
Le médecin doit, face à une éruption cutanée aiguë suspecte de toxidermie :
– faire le diagnostic nosologique de celle-ci (type de toxidermie) ;
– rechercher des signes de gravité devant conduire à un transfert du patient en urgence en milieu spécialisé ;
– évaluer le terrain du patient, qui doit être pris en compte comme facteur de potentielle gravité supplémentaire (sujet âgé, fragile, avec de nombreuses comorbidités, cancer avancé…) ;
– conduire l’interrogatoire médicamenteux, qui permet la démarche d’imputabilité et donc l’identification du ou des molécules suspectes ;
– débuter une prise en charge symptomatique adaptée. Une hospitalisation en service de dermatologie est toujours nécessaire en cas de toxidermie grave, uniquement en cas de signe de gravité s’il s’agit d’une toxidermie plus bénigne. Pour les patients atteints de nécrolyse épidermique, compte tenu de l’importance pronostique de la qualité des soins symptomatiques de support à prodiguer, le transfert du patient doit se faire sans délai vers un service habitué à la prise en charge des toxidermies graves et proche, dans tous les cas, d’une réanimation médicale ou d’un centre de traitement des brûlés.
– faire le diagnostic nosologique de celle-ci (type de toxidermie) ;
– rechercher des signes de gravité devant conduire à un transfert du patient en urgence en milieu spécialisé ;
– évaluer le terrain du patient, qui doit être pris en compte comme facteur de potentielle gravité supplémentaire (sujet âgé, fragile, avec de nombreuses comorbidités, cancer avancé…) ;
– conduire l’interrogatoire médicamenteux, qui permet la démarche d’imputabilité et donc l’identification du ou des molécules suspectes ;
– débuter une prise en charge symptomatique adaptée. Une hospitalisation en service de dermatologie est toujours nécessaire en cas de toxidermie grave, uniquement en cas de signe de gravité s’il s’agit d’une toxidermie plus bénigne. Pour les patients atteints de nécrolyse épidermique, compte tenu de l’importance pronostique de la qualité des soins symptomatiques de support à prodiguer, le transfert du patient doit se faire sans délai vers un service habitué à la prise en charge des toxidermies graves et proche, dans tous les cas, d’une réanimation médicale ou d’un centre de traitement des brûlés.
En cas de gravité, bilan biologique et biopsie cutanée
Le tableau 1 liste les critères de gravité d’une toxidermie. Devant tout signe de gravité clinique, un bilan biologique doit être demandé, à la recherche d’une hyperéosinophilie, d’une hyperlymphocytose basophile (qui peut remplacer l’éosinophilie dans le DRESS), d’une défaillance hépatique ou rénale.
La biopsie cutanée est envisagée en semi-urgence après avis dermatologique.
Les nécroses kératinocytaires, plus ou moins nombreuses et étagées, et un infiltrat dermique superficiel lymphocytaire et éosinophilique constituent les signes les plus fréquents de toxidermie.
L’histologie de la PEAG, montrant des pustules spongiformes intra-épidermiques, est indissociable du psoriasis pustuleux.
La nécrolyse épidermique est caractérisée par une nécrose complète de l’épiderme.3
Devant toute toxidermie bulleuse, une biopsie pour immunofluorescence directe doit également être pratiquée afin d’éliminer une dermatose bulleuse auto-immune ; en effet, certaines maladies bulleuses peuvent être induites par des médicaments, comme la dermatose à IgA linéaire.
La biopsie cutanée est envisagée en semi-urgence après avis dermatologique.
Les nécroses kératinocytaires, plus ou moins nombreuses et étagées, et un infiltrat dermique superficiel lymphocytaire et éosinophilique constituent les signes les plus fréquents de toxidermie.
L’histologie de la PEAG, montrant des pustules spongiformes intra-épidermiques, est indissociable du psoriasis pustuleux.
La nécrolyse épidermique est caractérisée par une nécrose complète de l’épiderme.3
Devant toute toxidermie bulleuse, une biopsie pour immunofluorescence directe doit également être pratiquée afin d’éliminer une dermatose bulleuse auto-immune ; en effet, certaines maladies bulleuses peuvent être induites par des médicaments, comme la dermatose à IgA linéaire.
Différents types de toxidermies
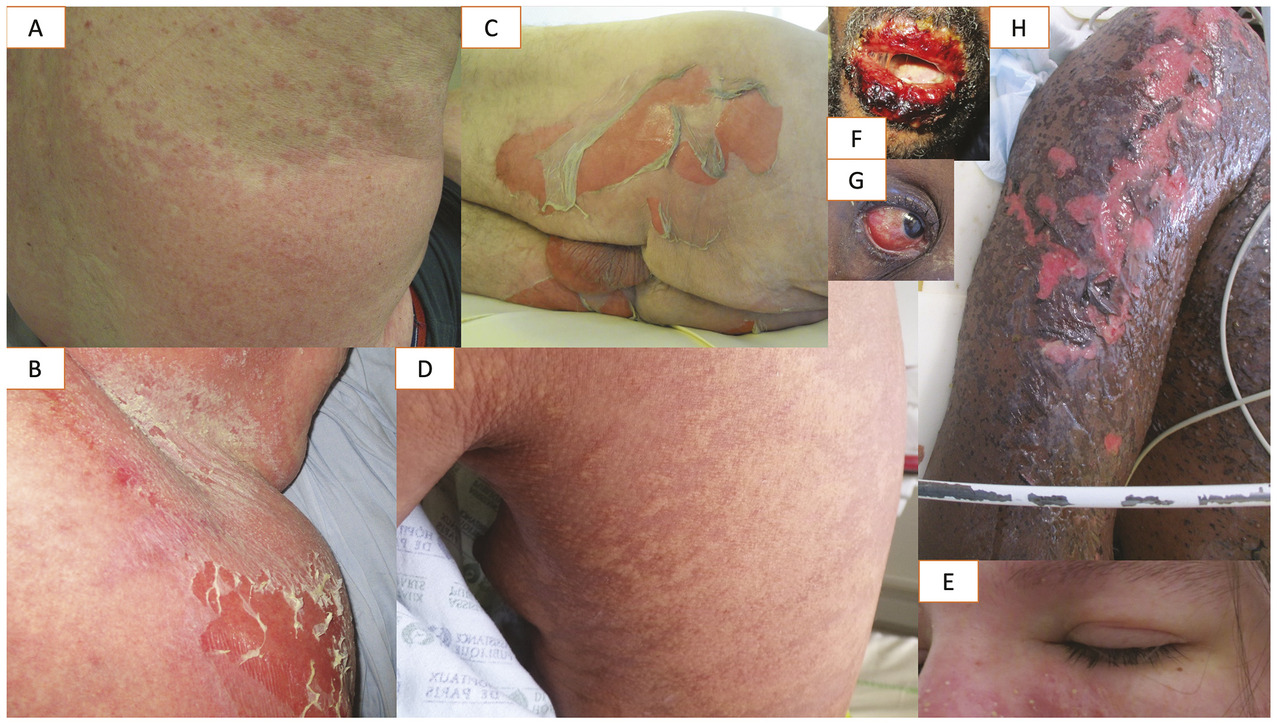
Le tableau 2 décrit les aspects cliniques des différents types de toxidermie : exanthème maculopapuleux, urticaire retardée, érythème pigmenté fixe, y compris dans sa forme bulleuse généralisée, PEAG, DRESS et nécrolyse épidermique. Il indique également le délai habituel de survenue de cette toxidermie (temps écoulé entre le premier jour de la prise du médicament et le premier jour de la toxidermie, ou « date index ») ainsi que les principales données du bilan biologique.
En cas d’antécédent allergique au même médicament (toxidermie dite alors « de réintroduction »), le délai de survenue est très raccourci (quelques heures à 2 jours). Par ailleurs, le délai habituel de survenue d’une toxidermie peut être modifié par l’existence d’une insuffisance rénale chronique ou hépatique, la prise au long cours d’une corticothérapie générale ou d’un immunosuppresseur, une immunodépression profonde.
Lafigure 1 illustre les différents types de toxidermie.
En cas d’antécédent allergique au même médicament (toxidermie dite alors « de réintroduction »), le délai de survenue est très raccourci (quelques heures à 2 jours). Par ailleurs, le délai habituel de survenue d’une toxidermie peut être modifié par l’existence d’une insuffisance rénale chronique ou hépatique, la prise au long cours d’une corticothérapie générale ou d’un immunosuppresseur, une immunodépression profonde.
La
Appliquer rigoureusement la démarche d’imputabilité
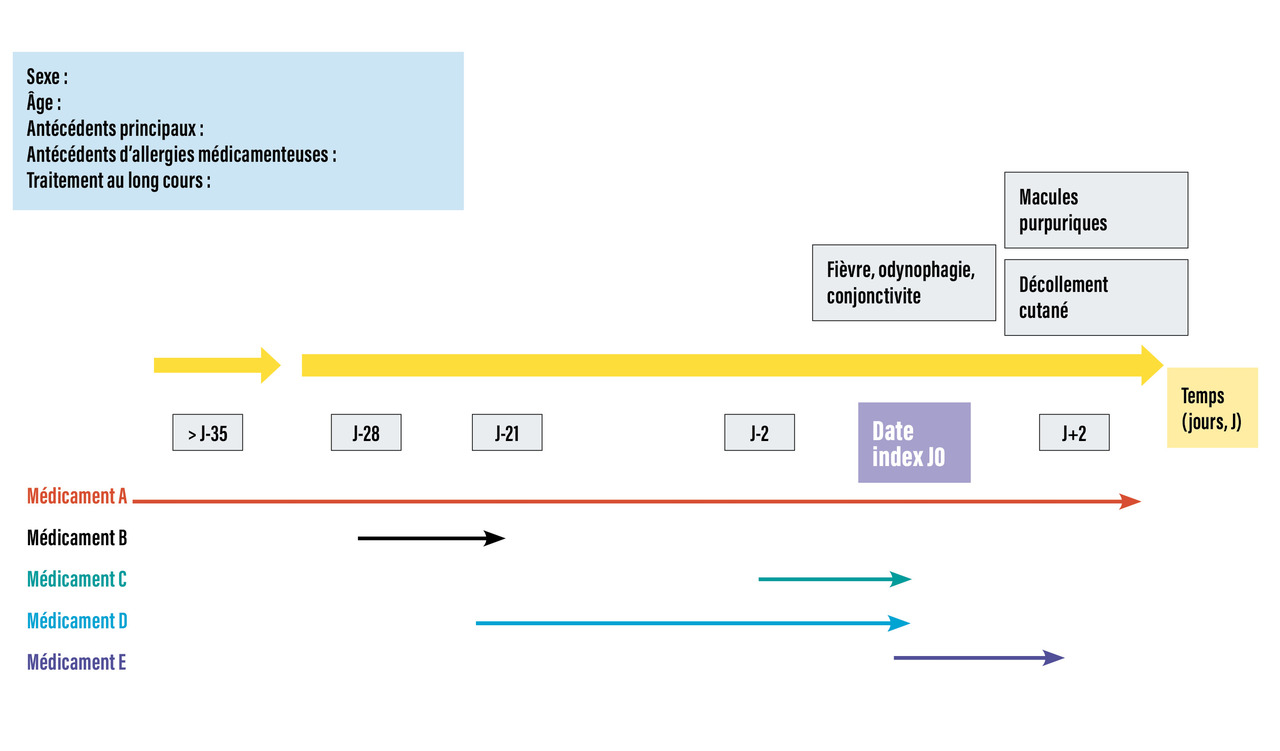
L’interrogatoire médicamenteux (auprès du patient, de sa famille, du médecin traitant, du pharmacien) permet l’élaboration d’une frise médicamenteuse chronologique aidant au raisonnement d’imputabilité (fig. 2 ). Pour être considéré comme potentiellement suspect, un médicament doit être soit en cours de prise depuis une durée compatible avec le type de toxidermie (tableau 2 ), soit arrêté avant le début des signes mais depuis une durée inférieure à cinq demi-vies d’élimination.
Par ailleurs, certaines toxidermies commençant par des manifestations non dermatologiques (fièvre, asthénie, myalgies, douleurs pharyngées...), il ne faut pas imputer à tort un médicament qui aurait été pris pour traiter ces premières manifestations non cutanées qui constituent pourtant la date index de la toxidermie (on parle alors de biais protopathique).
Le soutien du département de pharmacovigilance est précieux pour aider au raisonnement d’imputabilité. Des scores comme celui dit « de Bégaud » (méthode française d’imputabilité), utilisant des critères sémiologiques, chronologiques et de notoriété, peu–vent en effet être utiles pour discerner les responsabilités lorsque plusieurs médicaments sont suspects.4
À distance de la phase aiguë, les tests allergologiques (tests épicutanés avec patch-tests, prick-tests et intradermoréactions), réalisés par un dermato-allergologue entraîné, sont très utiles mais de positivité variable selon le type de toxidermie et la molécule testée. Leur négativité n’élimine pas la responsabilité possible d’un médicament. En France, les tests in vitro (test de transformation lymphocytaire, par exemple) sont très peu développés.5
Par ailleurs, certaines toxidermies commençant par des manifestations non dermatologiques (fièvre, asthénie, myalgies, douleurs pharyngées...), il ne faut pas imputer à tort un médicament qui aurait été pris pour traiter ces premières manifestations non cutanées qui constituent pourtant la date index de la toxidermie (on parle alors de biais protopathique).
Le soutien du département de pharmacovigilance est précieux pour aider au raisonnement d’imputabilité. Des scores comme celui dit « de Bégaud » (méthode française d’imputabilité), utilisant des critères sémiologiques, chronologiques et de notoriété, peu–vent en effet être utiles pour discerner les responsabilités lorsque plusieurs médicaments sont suspects.4
À distance de la phase aiguë, les tests allergologiques (tests épicutanés avec patch-tests, prick-tests et intradermoréactions), réalisés par un dermato-allergologue entraîné, sont très utiles mais de positivité variable selon le type de toxidermie et la molécule testée. Leur négativité n’élimine pas la responsabilité possible d’un médicament. En France, les tests in vitro (test de transformation lymphocytaire, par exemple) sont très peu développés.5
Médicaments suspects selon le type de toxidermie
Même si tous les médicaments, quelle que soit leur voie d’administration, peuvent être pourvoyeurs de toxidermie, certains le sont plus souvent selon les différents types de toxidermie :
– exanthèmes maculopapuleux et urticaires retardées : bêtalactamines, sulfamides antibactériens, antituberculeux, anti-inflammatoires non stéroïdiens, produits de contraste iodés ;
– érythème pigmenté fixe : paracétamol, anti-inflammatoires non stéroïdiens, antibiotiques ;
– DRESS, nécrolyse épidermique :6 allopurinol, sulfamides antibactériens (cotrimoxazole, salazopyrine et dapsone), antiépileptiques (amines aromatiques incluant carbamazépine, oxcarbazépine, phénobarbital, hydantoïne et lamotrigine), anti-inflammatoires non stéroïdiens, oxicams, névirapine, abacavir, inhibiteurs de la pompe à protons, minocycline ;
– PEAG :7 bêtalactamines, macrolides, pristinamycine, clindamycine, terbinafine, hydroxychloroquine, diltiazem.
De nouveaux médicaments inducteurs de toxidermies bénignes ou plus graves émergent, au premier rang desquels les anticancéreux (et notamment les nouvelles immunothérapies comme les inhibiteurs de check-point).8, 9
– exanthèmes maculopapuleux et urticaires retardées : bêtalactamines, sulfamides antibactériens, antituberculeux, anti-inflammatoires non stéroïdiens, produits de contraste iodés ;
– érythème pigmenté fixe : paracétamol, anti-inflammatoires non stéroïdiens, antibiotiques ;
– DRESS, nécrolyse épidermique :6 allopurinol, sulfamides antibactériens (cotrimoxazole, salazopyrine et dapsone), antiépileptiques (amines aromatiques incluant carbamazépine, oxcarbazépine, phénobarbital, hydantoïne et lamotrigine), anti-inflammatoires non stéroïdiens, oxicams, névirapine, abacavir, inhibiteurs de la pompe à protons, minocycline ;
– PEAG :7 bêtalactamines, macrolides, pristinamycine, clindamycine, terbinafine, hydroxychloroquine, diltiazem.
De nouveaux médicaments inducteurs de toxidermies bénignes ou plus graves émergent, au premier rang desquels les anticancéreux (et notamment les nouvelles immunothérapies comme les inhibiteurs de check-point).8, 9
Susceptibilité génétique pour certaines populations
Certaines populations ont une prédisposition génétique à certaines toxidermies, les rendant plus fréquentes et plus graves. Ceci est particulièrement vrai dans la population asiatique d’origine Han, pour laquelle l’association est bien connue entre toxidermie à l’allopurinol et HLA-B*58:01, et entre toxidermie à la carbamazépine ou à la lamotrigine et HLA-B*15:02.10
Dans les pays où elle est bien conduite, la politique de dépistage HLA avant toute prescription du médicament concerné a permis de réduire considérablement le nombre de toxidermies graves. En France, un tel dépistage est également recommandé dans les résumés des caractéristiques du produit de l’allopurinol et de la carbamazépine avant toute prescription chez un sujet d’origine asiatique, mais cette recommandation est à ce jour mal connue et très peu appliquée.
Une étude nationale a montré que près de 25 % des toxidermies graves sont liées à un usage inapproprié des médicaments : indication non conforme (par exemple, allopurinol dans les hyperuricémies asymptomatiques), reprise malgré un antécédent d’allergie…11
Dans les pays où elle est bien conduite, la politique de dépistage HLA avant toute prescription du médicament concerné a permis de réduire considérablement le nombre de toxidermies graves. En France, un tel dépistage est également recommandé dans les résumés des caractéristiques du produit de l’allopurinol et de la carbamazépine avant toute prescription chez un sujet d’origine asiatique, mais cette recommandation est à ce jour mal connue et très peu appliquée.
Une étude nationale a montré que près de 25 % des toxidermies graves sont liées à un usage inapproprié des médicaments : indication non conforme (par exemple, allopurinol dans les hyperuricémies asymptomatiques), reprise malgré un antécédent d’allergie…11
Prise en charge des toxidermies
Arrêt du médicament suspect
Le traitement des toxidermies passe dans un premier temps par l’arrêt du ou des médicament(s) suspect(s).
Dans les toxidermies bénignes néanmoins, après exclusion de tout signe clinique ou biologique de gravité, et seulement si le médicament suspect est indispensable au patient et n’est pas une molécule classiquement associée à un haut risque de toxidermie grave, la poursuite de celui-ci peut être envisagée sous contrôle médical régulier ; cette décision doit être prise par une équipe habituée à la prise en charge des toxidermies.12
Dans les toxidermies graves, l’arrêt est indispensable et urgent. Un retard à l’arrêt peut être préjudiciable au pronostic.13 En parallèle, un traitement symptomatique doit être entrepris.
Dans les toxidermies bénignes néanmoins, après exclusion de tout signe clinique ou biologique de gravité, et seulement si le médicament suspect est indispensable au patient et n’est pas une molécule classiquement associée à un haut risque de toxidermie grave, la poursuite de celui-ci peut être envisagée sous contrôle médical régulier ; cette décision doit être prise par une équipe habituée à la prise en charge des toxidermies.12
Dans les toxidermies graves, l’arrêt est indispensable et urgent. Un retard à l’arrêt peut être préjudiciable au pronostic.13 En parallèle, un traitement symptomatique doit être entrepris.
Corticothérapie et traitement symptomatique
Dans les exanthèmes et les urticaires retardées, une corticothérapie locale forte (classe 3) de quelques jours, associée à des émollients, est efficace (ne pas utiliser de corticothérapie par voie générale dans cette indication car elle est moins efficace et à risque de rebond à l’arrêt). Les antihistaminiques sont peu utiles. L’hospitalisation peut être nécessaire en cas de signe de gravité.14
L’érythème pigmenté fixe est également sensible aux dermocorticoïdes, mais ceux-ci sont peu efficaces, voire dangereux puisqu’ils favorisent un risque infectieux dans les formes bulleuses généralisées de la maladie.
Le traitement de la PEAG repose sur les dermocorticoïdes forts ou très forts (classe 3 ou 4) et les émollients pendant dix à quinze jours.15
Le traitement du DRESS utilise également la corticothérapie soit locale (classe 4), soit générale (0,5 à 1 mg/kg/j) selon la gravité, à pleine dose pendant un mois, puis décroissance progressive pendant trois à six mois selon la gravité (traitement de 6 mois dans les formes les plus graves). En effet, dans le DRESS, l’arrêt trop brutal et trop précoce de la corticothérapie peut engendrer un rebond de la maladie parfois fatal. En cas de réplication virale majeure (notamment à cytomégalovirus [CMV] mais aussi à herpèsvirus humain de types 6 [HHV6]), avec atteinte viscérale grave, un traitement antiviral peut être discuté en association à la corticothérapie, et les anti-IL-5 semblent prometteurs.16, 17
Le traitement de la nécrolyse épidermique est essentiellement symptomatique en centre de référence (tableau 3 ). Les grands principes du traitement font l’objet d’un protocole national de diagnostic et de soins, disponible sur le site de la Haute Autorité de santé.18, 19 À ce jour, les traitements immunomodulateurs (ciclosporine, immunoglobulines intraveineuses, anti-TNF, corticoïdes systémiques) n’ont pas fait la preuve irréfutable de leur efficacité pour accélérer la cicatrisation, réduire la mortalité et les séquelles à distance. La prise en charge prolongée multidisciplinaire est capitale après une nécrolyse épidermique en cas de séquelles (notamment cutanées, oculaires, psychologiques) qui peuvent impacter la vie familiale et professionnelle et altérer durablement la qualité de vie.20
L’érythème pigmenté fixe est également sensible aux dermocorticoïdes, mais ceux-ci sont peu efficaces, voire dangereux puisqu’ils favorisent un risque infectieux dans les formes bulleuses généralisées de la maladie.
Le traitement de la PEAG repose sur les dermocorticoïdes forts ou très forts (classe 3 ou 4) et les émollients pendant dix à quinze jours.15
Le traitement du DRESS utilise également la corticothérapie soit locale (classe 4), soit générale (0,5 à 1 mg/kg/j) selon la gravité, à pleine dose pendant un mois, puis décroissance progressive pendant trois à six mois selon la gravité (traitement de 6 mois dans les formes les plus graves). En effet, dans le DRESS, l’arrêt trop brutal et trop précoce de la corticothérapie peut engendrer un rebond de la maladie parfois fatal. En cas de réplication virale majeure (notamment à cytomégalovirus [CMV] mais aussi à herpèsvirus humain de types 6 [HHV6]), avec atteinte viscérale grave, un traitement antiviral peut être discuté en association à la corticothérapie, et les anti-IL-5 semblent prometteurs.16, 17
Le traitement de la nécrolyse épidermique est essentiellement symptomatique en centre de référence (
Pronostic variable
Le pronostic des toxidermies est variable.
• L’exanthème maculopapuleux guérit en quelques jours, tout comme l’urticaire retardée, sans laisser de séquelles.
• L’érythème pigmenté fixe laisse souvent une cicatrice pigmentée. Le pronostic des formes bulleuses généralisées d’érythème pigmenté fixe est réservé, en raison du terrain (sujets âgés) et du décollement cutané qui expose aux complications de la défaillance cutanée comme dans la nécrolyse épidermique.
• La PEAG est de très bon pronostic malgré de rares atteintes viscérales (foie, rein) qui guérissent en quelques jours.
• Le DRESS a une mortalité de 5 à 10 % en phase aiguë liée aux formes viscérales graves de la maladie (pulmonaire, cardiaque…) et se complique dans 10 % des cas de séquelles auto-immunes à distance.
• Enfin, le pronostic de la nécrolyse épidermique est plus réservé : la mortalité globale en phase aiguë est de 15 à 20 %, très variable selon l’âge du patient, son terrain et la surface décollée (jusqu’à 40 % de mortalité dans les syndromes de Lyell les plus graves). La mortalité en phase aiguë est prédite par le SCORTEN, score en 7 points (4 variables cliniques et 3 biologiques). Le pronostic à long terme dépend aussi des séquelles dont les plus invalidantes pour la reprise d’une vie normale sont oculaires et psychologiques.2
• L’exanthème maculopapuleux guérit en quelques jours, tout comme l’urticaire retardée, sans laisser de séquelles.
• L’érythème pigmenté fixe laisse souvent une cicatrice pigmentée. Le pronostic des formes bulleuses généralisées d’érythème pigmenté fixe est réservé, en raison du terrain (sujets âgés) et du décollement cutané qui expose aux complications de la défaillance cutanée comme dans la nécrolyse épidermique.
• La PEAG est de très bon pronostic malgré de rares atteintes viscérales (foie, rein) qui guérissent en quelques jours.
• Le DRESS a une mortalité de 5 à 10 % en phase aiguë liée aux formes viscérales graves de la maladie (pulmonaire, cardiaque…) et se complique dans 10 % des cas de séquelles auto-immunes à distance.
• Enfin, le pronostic de la nécrolyse épidermique est plus réservé : la mortalité globale en phase aiguë est de 15 à 20 %, très variable selon l’âge du patient, son terrain et la surface décollée (jusqu’à 40 % de mortalité dans les syndromes de Lyell les plus graves). La mortalité en phase aiguë est prédite par le SCORTEN, score en 7 points (4 variables cliniques et 3 biologiques). Le pronostic à long terme dépend aussi des séquelles dont les plus invalidantes pour la reprise d’une vie normale sont oculaires et psychologiques.2
Informer largement pour prévenir les récidives
L’information du patient, de sa famille et de son médecin traitant est capitale pour prévenir la récidive de toxidermie : type de toxidermie, molécule responsable (et molécules apparentées) à contre-indiquer, remise d’une carte d’allergie, inscription de la toxidermie dans le dossier médical du patient.
La déclaration de l’accident médicamenteux doit être faite auprès du système de pharmacovigilance.21
La déclaration de l’accident médicamenteux doit être faite auprès du système de pharmacovigilance.21
Références
1. Brockow K, Ardern-Jones MR, Mockenhaupt M, Aberer W, Barbaud A, Caubet JC, et al. EAACI position paper on how to classify cutaneous manifestations of drug hypersensitivity. Allergy 2019;74(1):14-27.
2. Duong TA, Valeyrie-Allanore L, Wolkenstein P, Chosidow O. Severe cutaneous adverse reactions to drugs. Lancet Lond Engl 2017;390(10106):1996-2011.
3. Ortonne N. Histopathology of cutaneous drug reactions. Ann Pathol 2018;38(1):7-19.
4. Arimone Y, Bidault I, Dutertre JP, Gérardin M, Guy C, Haramburu F, et al. Updating the French method for the causality assessment of adverse drug reactions. Therapie 2013;68(2):69-76.
5. Barbaud A, Collet E, Milpied B, Assier H, Staumont D, Avenel-Audran L, et al. A multicentre study to determine the value and safety of drug patch tests for the three main classes of severe cutaneous adverse drug reactions. Br J Dermatol 2013;168(3):555-62.
6. Mockenhaupt M, Viboud C, Dunant A, Naldi L, Halevy S, Bouwes Bavinck JN, et al. Stevens-Johnson syndrome and toxic epidermal necrolysis: Assessment of medication risks with emphasis on recently marketed drugs. The EuroSCAR-study. J Invest Dermatol 2008;128(1):35-44.
7. Sidoroff A, Dunant A, Viboud C, Halevy S, Bouwes Bavinck JN, Naldi L, et al. Risk factors for acute generalized exanthematous pustulosis (AGEP). Results of a multinational case-control study (EuroSCAR). Br J Dermatol 2007; 157(5):989-96.
8. Bettuzzi T, Ingen-Housz Oro S, Chinchilla Purtillo C, Le Cleach L, Maison P, de Prost N, et al. Changing spectrum of suspected drugs of epidermal necrolysis: An WHO pharmacovigilance database analysis from 1997 to 2020. J Am Acad Dermatol. Published online November 17, 2020:S0190-9622(20)33007-3.
9. Sibaud V. Dermatologic reactions to immune checkpoint inhibitors: Skin toxicities and immunotherapy. Am J Clin Dermatol 2018;19(3):345-61.
10. Cheng CY, Su SC, Chen CH, Chen WL, Deng ST, Chung WH. HLA associations and clinical implications in T-cell mediated drug hypersensitivity reactions: An updated review. J Immunol Res 2014;2014:565320.
11. Chaby G, Valeyrie-Allanore L, Duong TA, Lebrun-Vignes B, Milpied B, Sassolas B, et al. Severe cutaneous adverse reactions due to inappropriate medication use. Br J Dermatol 2018;179(2):329-36.
12. Trubiano JA, Soria A, Torres MJ, Trautmann A. Treating through drug-associated exanthems in drug allergy management: Current evidence and clinical aspects. J Allergy Clin Immunol Pract 2021;9(8):2984-93.
13. Garcia-Doval I, LeCleach L, Bocquet H, Otero XL, Roujeau JC. Toxic epidermal necrolysis and Stevens-Johnson syndrome: Does early withdrawal of causative drugs decrease the risk of death? Arch Dermatol 2000;136(3):323-7.
14. Ingen-Housz-Oro S, Tétart F, Milpied B. Prise en charge d’un exanthème maculo-papuleux. Ann Dermatol Venereol-FMC 2021;1(2):114-7.
15. Ingen-Housz-Oro S, Hotz C, Valeyrie-Allanore L, Sbidian E, Hemery F, Chisidow O, et al. Acute generalized exanthematous pustulosis: A retrospective audit of practice between 1994 and 2011 in a single center. Br J Dermatol. Published online November 15, 2014.
16. Ingen-Housz-Oro S, Duong TA, de Prost N, Colin A, Fardet L, Lebrun-Vignes B, et al. Treatment of severe cutaneous adverse drug reactions. Ann Dermatol Venereol 2018;145(6-7):454-64.
17. Schmid-Grendelmeier P, Steiger P, Naegeli MC, Kolm I, Lang CCV, Maverakis E, et al. Benralizumab for severe DRESS in two COVID-19 patients. J Allergy Clin Immunol Pract 2021;9(1):481-3.
18. Ingen-Housz-Oro S, Duong TA, Bensaid B, Bellon N, de Prost N, Lu D, et al. Epidermal necrolysis french national diagnosis and care protocol (PNDS: protocole national de diagnostic et de soins). Orphanet J Rare Dis 2018;13(1):56.
19. Nécrolyse épidermique - Syndromes de Stevens-Johnson et de Lyell, Guide maladie chronique. Site HAS. 4 avril 2018. https://vu.fr/KLGj20.
20. Ingen-Housz-Oro S, Alves A, Colin A, Ouedraogo R, Layese R, Canoui-Poitrine F, et al. Health-related quality of life and long-term sequelae in epidermal necrolysis survivors: An observational study of 57 patients. Br J Dermatol 2020;182(4):916-26.
21. Lebrun-Vignes B, Sanchez-Pena P. Organisation et intérêt de la pharmacovigilance. Ann Dermatol Venereol-FMC 2022;2(5):427-32.
2. Duong TA, Valeyrie-Allanore L, Wolkenstein P, Chosidow O. Severe cutaneous adverse reactions to drugs. Lancet Lond Engl 2017;390(10106):1996-2011.
3. Ortonne N. Histopathology of cutaneous drug reactions. Ann Pathol 2018;38(1):7-19.
4. Arimone Y, Bidault I, Dutertre JP, Gérardin M, Guy C, Haramburu F, et al. Updating the French method for the causality assessment of adverse drug reactions. Therapie 2013;68(2):69-76.
5. Barbaud A, Collet E, Milpied B, Assier H, Staumont D, Avenel-Audran L, et al. A multicentre study to determine the value and safety of drug patch tests for the three main classes of severe cutaneous adverse drug reactions. Br J Dermatol 2013;168(3):555-62.
6. Mockenhaupt M, Viboud C, Dunant A, Naldi L, Halevy S, Bouwes Bavinck JN, et al. Stevens-Johnson syndrome and toxic epidermal necrolysis: Assessment of medication risks with emphasis on recently marketed drugs. The EuroSCAR-study. J Invest Dermatol 2008;128(1):35-44.
7. Sidoroff A, Dunant A, Viboud C, Halevy S, Bouwes Bavinck JN, Naldi L, et al. Risk factors for acute generalized exanthematous pustulosis (AGEP). Results of a multinational case-control study (EuroSCAR). Br J Dermatol 2007; 157(5):989-96.
8. Bettuzzi T, Ingen-Housz Oro S, Chinchilla Purtillo C, Le Cleach L, Maison P, de Prost N, et al. Changing spectrum of suspected drugs of epidermal necrolysis: An WHO pharmacovigilance database analysis from 1997 to 2020. J Am Acad Dermatol. Published online November 17, 2020:S0190-9622(20)33007-3.
9. Sibaud V. Dermatologic reactions to immune checkpoint inhibitors: Skin toxicities and immunotherapy. Am J Clin Dermatol 2018;19(3):345-61.
10. Cheng CY, Su SC, Chen CH, Chen WL, Deng ST, Chung WH. HLA associations and clinical implications in T-cell mediated drug hypersensitivity reactions: An updated review. J Immunol Res 2014;2014:565320.
11. Chaby G, Valeyrie-Allanore L, Duong TA, Lebrun-Vignes B, Milpied B, Sassolas B, et al. Severe cutaneous adverse reactions due to inappropriate medication use. Br J Dermatol 2018;179(2):329-36.
12. Trubiano JA, Soria A, Torres MJ, Trautmann A. Treating through drug-associated exanthems in drug allergy management: Current evidence and clinical aspects. J Allergy Clin Immunol Pract 2021;9(8):2984-93.
13. Garcia-Doval I, LeCleach L, Bocquet H, Otero XL, Roujeau JC. Toxic epidermal necrolysis and Stevens-Johnson syndrome: Does early withdrawal of causative drugs decrease the risk of death? Arch Dermatol 2000;136(3):323-7.
14. Ingen-Housz-Oro S, Tétart F, Milpied B. Prise en charge d’un exanthème maculo-papuleux. Ann Dermatol Venereol-FMC 2021;1(2):114-7.
15. Ingen-Housz-Oro S, Hotz C, Valeyrie-Allanore L, Sbidian E, Hemery F, Chisidow O, et al. Acute generalized exanthematous pustulosis: A retrospective audit of practice between 1994 and 2011 in a single center. Br J Dermatol. Published online November 15, 2014.
16. Ingen-Housz-Oro S, Duong TA, de Prost N, Colin A, Fardet L, Lebrun-Vignes B, et al. Treatment of severe cutaneous adverse drug reactions. Ann Dermatol Venereol 2018;145(6-7):454-64.
17. Schmid-Grendelmeier P, Steiger P, Naegeli MC, Kolm I, Lang CCV, Maverakis E, et al. Benralizumab for severe DRESS in two COVID-19 patients. J Allergy Clin Immunol Pract 2021;9(1):481-3.
18. Ingen-Housz-Oro S, Duong TA, Bensaid B, Bellon N, de Prost N, Lu D, et al. Epidermal necrolysis french national diagnosis and care protocol (PNDS: protocole national de diagnostic et de soins). Orphanet J Rare Dis 2018;13(1):56.
19. Nécrolyse épidermique - Syndromes de Stevens-Johnson et de Lyell, Guide maladie chronique. Site HAS. 4 avril 2018. https://vu.fr/KLGj20.
20. Ingen-Housz-Oro S, Alves A, Colin A, Ouedraogo R, Layese R, Canoui-Poitrine F, et al. Health-related quality of life and long-term sequelae in epidermal necrolysis survivors: An observational study of 57 patients. Br J Dermatol 2020;182(4):916-26.
21. Lebrun-Vignes B, Sanchez-Pena P. Organisation et intérêt de la pharmacovigilance. Ann Dermatol Venereol-FMC 2022;2(5):427-32.
Dans cet article
- Conduite à tenir initiale devant une suspicion de toxidermie
- Différents types de toxidermies
- Appliquer rigoureusement la démarche d’imputabilité
- Médicaments suspects selon le type de toxidermie
- Susceptibilité génétique pour certaines populations
- Prise en charge des toxidermies
- Pronostic variable
- Informer largement pour prévenir les récidives