Définir et expliquer le mécanisme des principales pathologies induites par les médicaments.
Iatrogénie médicamenteuse : épidémiologie, imputabilité et conséquences en santé publique.
Expliquer les objectifs et les principes du fonctionnement de la pharmacovigilance, de l’addictovigilance (item 75, item 76 et item 78) et de la matériovigilance (voir item 177).
Apprécier les risques liés à la contrefaçon de médicaments.
Identifier et prévenir les erreurs médicamenteuses et celles du circuit du médicament.
Préciser les temps d’une démarche permettant une culture positive de l’erreur : analyse des EIG, Revue de Mortalité Morbidité, information et plan d’action.
Définir la notion de responsabilité sans faute (aléa thérapeutique) et le rôle de l'Office national d'indemnisation des accidents médicaux (ONIAM).
Généralités et définitions
On considère un effet indésirable comme grave dans cinq cas : décès du patient, menace du pronostic vital, prolongation de l’hospitalisation, nécessité de réhospitalisation ou apparition d’un handicap. L’impact de morbi-mortalité de ces effets indésirables graves est majeur, représentant par exemple la 8e cause de décès aux États-Unis. L’OMS estime qu’ils entraînent chaque année dans le monde plusieurs millions de traumatismes invalidants et de décès. Ces événements indésirables graves concentrent la majorité des actions de prévention.
Bien que la prévalence réelle des effets indésirables médicamenteux soit complexe à définir et variable selon le lieu d’étude et la population, on peut estimer qu’ils seraient responsables de 0,5 à 2 % des consultations de médecine de ville, de 10 % des hospitalisations et jusqu’à 20 % chez le sujet âgé de plus de 80 ans. La mortalité liée à un effet indésirable médicamenteux serait de 4 à 7 % des hospitalisations. Cela représenterait en France chaque année 10 000 à 12 000 décès et 130 000 hospitalisations.
Les accidents iatrogènes médicamenteux sont définis par l’OMS comme « toute réaction nocive et non recherchée liée à la prise d’un médicament et survenant de manière fortuite ». On en retire classiquement les causes liées à un usage inhabituel du médicament : les intoxications aiguës (volontaires ou non), les toxicomanies, les accidents liés aux produits de médecine dits « naturels », les accidents par automédication.
Il faut différencier la notion d’accidents médicamenteux de celle d’erreur médicamenteuse. Les trois caractéristiques suivantes permettent de classifier ces accidents médicamenteux.
Certains accidents sont considérés comme « prévisibles » car pouvant être anticipés grâce à la connaissance du mode d’action du produit ou grâce aux études réalisées avant la mise sur le marché (par exemple, saignement sous anticoagulant ou hyponatrémie sous diurétiques thiazidiques) ou après sa mise sur le marché via la pharmacovigilance ou le plan de gestion des risques (v. ci-dessous). À l’opposé, certains sont « imprévisibles », notamment les accidents allergiques que l’on qualifiera d’idiosyncrasiques (c’est-à-dire liés à une prédisposition particulière qu’a l’organisme du patient à réagir au traitement de manière personnelle) ou un effet indésirable jamais rapporté antérieurement.
Certains accidents sont « évitables », c’est-à-dire qu’ils n’auraient pas dû survenir si toutes les précautions nécessaires (respect des contre-indications, des posologies et des précautions d’emploi en fonction du patient et surveillance adaptée) avaient été prises au moment de la prescription et d’autres sont « inévitables » malgré un respect scrupuleux des règles de prescription et de bon usage du ou des médicaments. Par exemple, une hémorragie digestive sous anti-inflammatoire non stéroïdien (AINS) pris au long cours sans prophylaxie par inhibiteur de pompe à protons (IPP) chez un patient ayant un antécédent d’ulcère aurait pu être évitable tandis que la même hémorragie chez un jeune patient sans antécédent et traité durant moins de 4 semaines serait inévitable, puisque dans ce contexte elle ne pouvait être anticipée. Selon certaines études, 40 à 50 % des accidents iatrogènes seraient évitables.
Enfin, certains accidents sont considérés comme « acceptables », soit par l’absence de gravité ou de risque de complication, soit parce que la maladie est grave et qu’il n’y a pas d’alternative thérapeutique. Typiquement, le risque élevé d’effets indésirables graves au cours des chimiothérapies anticancéreuses n’empêche pas leur prescription et leur utilisation incontournable compte tenu du bénéfice attendu chez les patients et de l’absence d’alternative thérapeutique. Inversement, certains accidents sont « inacceptables », par exemple lors d’une prescription hors recommandations. Ainsi, une insuffisance rénale par néphrite interstitielle immuno-allergique aux IPP sera acceptable si ces derniers sont prescrits pour un ulcère hémorragique mais inacceptable dans le cas d’une simple épigastralgie épisodique au cours de laquelle la prescription de cette classe thérapeutique n’est pas indiquée.
La notion d’imputabilité, importante à connaître, constitue l’une des bases de la pharmacovigilance, à savoir l’évaluation du lien de causalité entre un événement indésirable et l’administration d’un médicament et sera détaillée ci-après (v. partie III).
Mécanismes des pathologies induites par les médicaments
Circonstances favorisantes
Circonstances en lien avec le médicament
Il s’agit par exemple de la marge thérapeutique du médicament, définie par le rapport entre son efficacité et sa toxicité. La marge thérapeutique est dite « étroite » lorsque la dose toxique est peu supérieure à la dose efficace, entraînant un risque d’accidents médicamenteux au moindre dépassement de posologie (ex : antivitamine K, digitaliques, aminosides, lithium, colchicine, théophylline). Un médicament ayant une demi-vie longue entraîne un plus grand risque d’accumulation, par exemple chez l’insuffisant rénal en cas d’élimination rénale et/ou l’insuffisant hépatique en cas d’élimination principalement hépatique, risquant ainsi de prolonger la durée d’un effet secondaire. Chez le patient insuffisant rénal sévère avec une clairance de la créatinine inférieure ou égale à 30 mL/min/1,73 m2, de nombreux antibiotiques doivent être administrés à doses plus faibles ou de manière espacée, adaptée à la fonction rénale du patient pour éviter la survenue d’effets secondaires en gardant une efficacité équivalente à celle observée chez les patients à fonction rénale normale. Par exemple, la posologie classique de l’ofloxacine à 400 mg matin et soir doit être réduite à 200 mg matin et soir, voire à une seule prise par jour chez l’insuffisant rénal préterminal. Un traitement par méthotrexate doit être évité chez l’insuffisant rénal pour éviter les effets indésirables hématologiques (cytopénies) et hépatiques qu’il induit, en raison de son élimination principalement rénale. Chez le patient cirrhotique, on privilégie par exemple l’utilisation de benzodiazépines à demi-vie courte (oxazépam) par rapport à des benzodiazépines de demi-vie plus longue comme le diazépam.La mise sur le marché récente d’un nouveau médicament et a fortiori d’une nouvelle classe thérapeutique expose au risque d’effets secondaires non connus car non repérés au cours des étapes du développement clinique, y compris lors de l’essai de phase III réalisé chez plusieurs milliers de patients et précédant son AMM. En effet, plus un effet indésirable est rare, plus la probabilité de le détecter au cours d’un essai clinique de phase III est faible. Par exemple, la survenue d’aplasie médullaire sous chloramphénicol ayant une fréquence estimée à 1/50 000, un essai clinique incluant 4 000 à 6 000 patients aura moins de 4 % de chance de pouvoir détecter cet événement indésirable grave chez un seul des patients inclus et traités. Un effet indésirable cutané (toxicité) survenant sous bêtabloquant à la fréquence de 1/1 000 patients traités aura 86 % de chance d’être observé chez au moins 1 patient parmi 6 000 patients traités lors d’un essai clinique. Pour être sûr d’observer au moins un événement indésirable grave survenant habituellement une fois chez 2 000 patients traités, il faudrait inclure 6 000 patients pour s’attendre à observer un cas, 9 600 patients pour deux cas et 13 000 patients pour trois cas. Autrement dit, le nombre de patients inclus ne cesse d’augmenter dans les essais cliniques réalisés en phases II et III du développement du médicament (c’est-à-dire précédant l’AMM) mais reste systématiquement insuffisant pour détecter un événement indésirable grave, a fortiori lorsqu’il est rare, justifiant les cohortes observationnelles et le plan de gestion des risques mis en place après la mise sur le marché du médicament.
Le plan de gestion des risques est un programme nécessaire depuis 2005 pour tout médicament avec nouveau principe actif, mis en place au cours du développement de ce dernier. Il peut également être mis en place a posteriori, du fait d’un changement de modalité d’administration (nouvelle indication ou nouveau dosage, par exemple) ou si un risque important est détecté. Il permet de mieux caractériser ou prévenir les risques associés à un médicament, de compléter les données disponibles au moment de la mise sur le marché, de surveiller les conditions réelles d’utilisation. Il implique, si besoin, des mesures complémentaires aux activités de routine. Parmi ces mesures, citons une pharmacovigilance renforcée sur certains des risques mis en évidence dans le plan de gestion des risques, des études de sécurité d’emploi post-AMM, des études d’utilisation, des mesures de minimisation du risque (documents d’information pour les professionnels de santé ou les patients).
Circonstances en lien avec le médecin
La connaissance insuffisante, voire la méconnaissance du médicament prescrit, l’appréciation insuffisante des comorbidités, de l’observance en raison d’un interrogatoire insuffisant, une surveillance insuffisante ou non conforme aux recommandations de l’efficacité et de la tolérance, l’absence de prise en compte des prescriptions émanant d’autres prescripteurs (notamment chez les patients ayant plusieurs ordonnances), l’absence de réévaluation thérapeutique et de « déprescription » sont autant d’éléments de pratique courante incombant au médecin prescripteur et majorant le risque d’effet indésirable.Circonstances en lien avec le patient
Ce sont les populations dites « à risque accru d’effets indésirables médicamenteux », parmi lesquelles :Population gériatrique (
Population pédiatrique : cette population est caractérisée par l’immaturité des voies d’élimination (notamment chez le nouveau-né), le retard de croissance généré par certaines molécules (corticoïdes, par exemple), la plus grande perméabilité de la barrière hémato- encéphalique, la nécessité d’adaptation posologique en fonction du poids (parfois source d’erreur), la nécessité d’adapter la galénique au patient tout en respectant certaines contre-indications (le broyage par les parents d’une forme à libération prolongée pour faciliter la prise orale entraînant un risque de surdosage p. ex.) ;
Femmes enceintes : pour le fœtus, notamment en raison du risque de passage transplacentaire de certains médicaments, du risque tératogène entraînant des malformations surtout au premier trimestre de grossesse (ex : méthotrexate, thalidomide, rétinoïdes, acide valproïque...), du risque d’effets indésirables graves pour la grossesse (ex : AINS, inhibiteurs de l’enzyme de conversion [IEC]), à l’accouchement (traitement anticoagulant et risque de saignement) ou lors de l’allaitement en raison du passage dans le lait maternel de certains médicaments (toxicité thyroïdienne et amiodarone, par exemple, lithémie pouvant atteindre 50 % de la valeur de la mère en raison d’une excellente diffusion du lithium dans le lait maternel). Au cours de la grossesse, il y a une augmentation du volume de distribution (système sanguin de la mère et du fœtus), une augmentation de la clairance rénale et hépatique, entraînant à l’inverse un risque de sous-dosage de certains médicaments nécessitant parfois un monitoring, notamment lors des traitements au long cours ;
Insuffisants rénaux : accumulation des médicaments à élimination essentiellement, voire exclusivement rénale (digoxine, antidiabétiques oraux, lithium, aminosides...) et risque accru des médicaments néphrotoxiques de diminuer la fonction rénale résiduelle et d’accélérer l’évolution vers l’insuffisance rénale terminale ;
Insuffisants hépatiques : seul le stade ultime (Child C de la classification de Child-Pugh) d’insuffisance hépatocellulaire expose au risque d’accumulation de certains médicaments à élimination essentiellement hépatique (bêtabloquants, benzodiazépines) majorant le risque iatrogène. Par ailleurs, il existe un risque hémorragique accru sous antivitamine K en raison de la baisse de synthèse hépatique des facteurs de coagulation.
D’autres terrains à risque iatrogène sont soit plus rares (déficit en glucose-6-phosphate déshydrogénase et hémolyse médicamenteuse), soit n’ont pas démontré d’excès de risque iatrogène cliniquement pertinent en dépit d’un mécanisme physiopathologique avéré ou probable (dénutrition protidique ou globale et augmentation de la fraction libre des médicaments habituellement fixés à l’albumine et/ou l’alpha-1-glycoprotéine acide).
Manifestations cliniques et paracliniques fréquentes
Des tableaux classiques plus complexes correspondant à certains médicaments sont à connaître, on parle alors de toxidrome (v. item 332).
Ces manifestations cliniques peuvent survenir sur un ou des organes sains ou préalablement lésés (ex : surdosage en anticoagulants déclenchant une hématurie faisant découvrir une tumeur de vessie). Certaines sont communes à tous les médicaments d’une même classe (on parle alors d’« effet de classe »), d’autres pour un médicament particulier de la classe (p. ex., tous les neuroleptiques atypiques induisent une prise de poids, mais seule la clozapine induit fréquemment des agranulocytoses).
Cette distinction peut être capitale, notamment pour les mécanismes allergiques, par exemple pour la distinction entre une allergie à la pénicilline ou à toutes les bêtalactamines. Ainsi, les manifestations les plus fréquemment rencontrées en pratique clinique quotidienne sont :
- allergiques (le plus fréquemment cutanées bénignes) [v. item 182-184] ;
- digestives (nausées, vomissements, troubles du transit, perturbations du bilan hépatique) ;
- cardiovasculaires (hypotension artérielle) ;
- neuropsychiques (confusion, somnolence).
Les médicaments cités dans le
Pharmacovigilance, matériovigilance, addictovigilance, risques liés à la contrefaçon
Pharmacovigilance
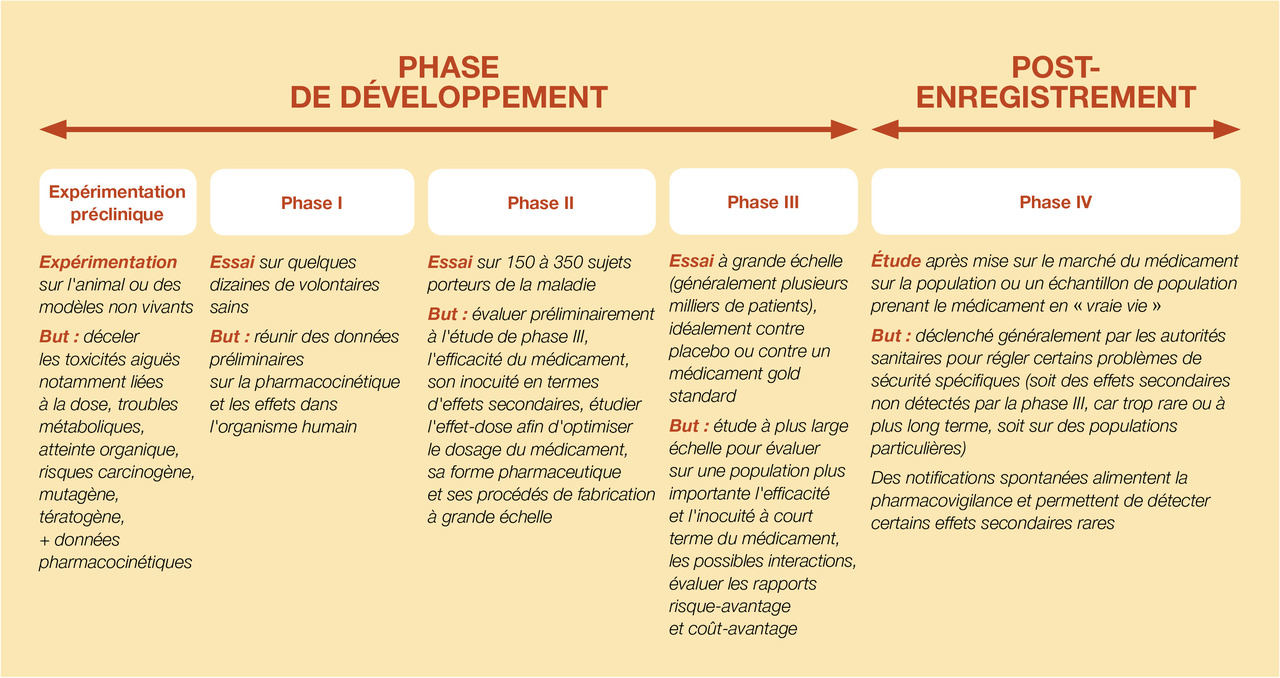
Elle existe à tous les niveaux du développement du médicament à partir des étapes cliniques de celui-ci (
Des événements tels que la tragédie de la thalidomide, administrée à des femmes enceintes entre 1957 et 1965 contre les nausées et vomissements incoercibles et retirée du marché en 1965 en raison d’anomalies congénitales responsables de graves malformations à la naissance, soulignent l’extrême importance de systèmes efficaces de contrôle des médicaments. La pharmacovigilance a donc pour objectif de détecter ces effets et les recenser, en se fondant sur la notification spontanée par les professionnels de santé et constitue une obligation réglementaire. Les patients peuvent eux-mêmes déclarer les effets secondaires, par les mêmes réseaux que les professionnels (notamment via le portail national internet de signalement sous l’égide du ministère de la Santé).
Les organismes gérant la pharmacovigilance sont :
- à l’échelle nationale, l’Agence nationale de sécurité du médicament et des produits de santé, ou ANSM,
- à l’échelle régionale, les 31 centres régionaux de pharmacovigilance (CRPV).
La pharmacovigilance assure :
- le recueil basé sur la notification spontanée des effets indésirables ;
- l’enregistrement et l’évaluation de ces informations ;
- la mise en place d’enquêtes ou d’études pour analyser les risques ;
- la participation à la mise en place et au suivi des plans de gestion des risques ;
- l’appréciation du profil de sécurité d’emploi du médicament en fonction des données recueillies ;
- la prise de mesures correctives (précautions ou restriction d’emploi, contre-indications, voire retrait du produit) et la communication vers les professionnels de santé et le public ;
- la communication et la diffusion de toute information relative à la sécurité d’emploi du médicament ;
- la participation à la politique de santé publique de lutte contre l’iatrogénie médicamenteuse.
La notion fondamentale de la pharmacovigilance est l’imputabilité consistant à déterminer la responsabilité d’un médicament dans la survenue d’un effet indésirable, après avoir écarté les causes non médicamenteuses. C’est ainsi que les agences de pharmacovigilance rendent leur « verdict » lorsqu’une cause médicamenteuse est suspectée, en fonction de critères « intrinsèques », c’est-à-dire chronologiques (délai entre la prise et l’apparition, délai entre l’arrêt et la disparition, survenue si réintroduction) et sémiologiques (explication pharmacodynamique possible, diagnostic différentiel existant, possibilité d’examen complémentaire pour prouver par exemple un surdosage) et « extrinsèques », correspondant à une étude de la bibliographie scientifique existante permettant de définir des effets notoires, rarement décrits ou non décrits. L’imputabilité d’un médicament dans un effet indésirable dépend aussi de l’évolution clinique de cet effet indésirable, notamment à l’arrêt du traitement suspecté mais aussi de la réapparition du symptôme lors de la réintroduction du médicament. Par exemple, un patient traité par une association de sulfaméthoxazole-triméthoprime et ciprofloxacine présente une bicytopénie. Le médicament initialement suspecté est l’association sulfaméthoxazole-triméthoprime sur des arguments « extrinsèques » (les cytopénies étant bien connues et plus fréquemment décrites avec cet antibiotique qu’avec la ciprofloxacine). Mais si la bicytopénie persiste à l’arrêt et qu’elle se corrige après arrêt de la ciprofloxacine malgré la réintroduction du sulfaméthoxazole-triméthoprime, alors le médicament imputable sera la ciprofloxacine.
Addictovigilance, matériovigilance
L’addictovigilance est la surveillance des cas d’abus et de dépendance liés à la prise d’une substance ayant un effet psychoactif, qu’elle soit médicamenteuse ou non, à l’exclusion de l’alcool éthylique et du tabac. Elle a pour objectif d’évaluer le potentiel d’abus et de dépendance à un produit, d’évaluer ses risques sur la santé, d’encadrer leur disponibilité, de les classer sur la liste des stupéfiants et des psychotropes et de diffuser des alertes. Le zolpidem, par exemple, médicament hypnotique, a récemment rejoint cette liste, et sa prescription est par conséquent plus encadrée. Il existe à ce jour 13 centres d’évaluation et d’information sur la pharmacodépendance (CEIP) qui agissent en coordination avec la mission interministérielle de lutte contre la drogue et la toxicomanie (MILDT). La déclaration de cas d’abus grave ou de pharmacodépendances est également obligatoire.
La matériovigilance a pour objet le signalement et l’évaluation des effets indésirables pouvant survenir sur les dispositifs médicaux après leur mise sur le marché, qu’ils soient marqués CE (c’est-à-dire dont la production est conforme aux normes européennes) ou non, en dehors de ceux faisant l’objet d’investigations cliniques. Il n’y a pas d’agence spécifique à l’échelle régionale. L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) agit en collaboration avec les correspondants locaux de matériovigilance des établissements de santé, les fabricants et également directement avec les prescripteurs et les utilisateurs. Sont évalués notamment les modalités de prescription, la formation de ceux qui les utilisent, et également le fonctionnement, l’approvisionnement ou le stockage.
Risques liés à la contrefaçon
Erreurs médicamenteuses : prévention, culture positive et responsabilité sans faute
Erreurs médicamenteuses : définition et prévention
- phase de prescription (médecin) ;
- phase de dispensation (pharmacien) ;
- phase d’administration (infirmière, aidant, ou patient lui-même) ;
- phase de suivi et réévaluation (médecin).
- avérée : si le médicament a effectivement été administré à la mauvaise posologie, à un mauvais patient, par une mauvaise voie... Si un effet indésirable découle de cette erreur médicamenteuse, elle doit faire l’objet d’une déclaration au centre de pharmacovigilance ;
- potentielle : si l’erreur est interceptée avant l’administration (par exemple appel du pharmacien qui se rend compte qu’un anticoagulant est prescrit à un patient qui en a déjà un sur l’ordonnance établie par un autre médecin spécialiste) ;
- latente : s’il existe un danger potentiel pour le patient (p. ex : deux produits ayant exactement le même emballage, une phrase à risque de confusion sur une notice...).
- la participation du patient et son information, voire l’éducation thérapeutique (p. ex. si le patient connaît le rôle et la raison pour laquelle le médicament est introduit dans son cas) ;
- la personnalisation de la décision thérapeutique (par exemple : faut-il introduire un antidépresseur au cours d’un trouble de l’humeur uniquement transitoire ?) ;
- la déprescription et la réévaluation des médicaments que le patient reçoit permettant un respect des recommandations de durée, une moindre toxicité et un moindre risque d’interactions médicamenteuses.
Culture positive de l’erreur et gestion des risques
Une RMM est une méthode d’apprentissage collectif, dont le but est de mettre en œuvre et de suivre des actions améliorant la prise en charge et la sécurité des patients. L’organisation d’une RMM est habituellement confiée à un médecin expérimenté qui met en jeu tout professionnel impliqué dans la procédure de soin et qui doit analyser de manière collective et rétrospective tous les éléments (organisationnels, techniques et humains) ayant été mis en jeu dans le processus. Il s’agit de décrire les faits et d’analyser des situations réelles, pour apprendre et comprendre afin d’agir collectivement pour renforcer la qualité et la sécurité des soins, sans porter de jugement sur les personnes ni rechercher un coupable ou un responsable. Ces RMM, initiées par la Haute Autorité de santé (HAS) dans une démarche constante d’amélioration de la qualité et de la sécurité des soins, ne sont pas limitées au médicament ni aux effets indésirables graves, peuvent concerner n’importe quel service et sont obligatoires dans trois secteurs : la chirurgie, l’anesthésie-réanimation et la cancérologie. Elles peuvent être organisées de manière régulière selon des fréquences et des durées de réunion à la discrétion des services pour traiter de plusieurs points rencontrés durant l’intervalle, ou être organisées de manière exceptionnelle en réponse à une situation unique (par exemple l’impossibilité d’avoir un outil de chirurgie spécifique stérilisé lors d’une opération urgente).
Toutes ces opérations entrent dans le cadre de la gestion des risques, souvent organisée à l’hôpital par un comité de gestion des risques et pouvant donner lieu à des plans d’action locaux mais parfois plus diffus au sein des hôpitaux français.
Notion d’aléa thérapeutique et processus d’indemnisation
Depuis la loi du 4 mars 2002, il est possible que le patient soit dédommagé, dans le cadre d’une « responsabilité sans faute » de la part du système de soins, généralement selon des procédures à l’amiable. C’est le rôle de l’Office national d’indemnisation des accidents médicaux (ONIAM) et à l’échelle régionale des commissions régionales de conciliation et d’indemnisation des accidents médicaux (CRCI).
Si le taux de dommage infligé au patient est inférieur à un seuil fixé par la loi, la CRCI propose une indemnisation rapide. En revanche, si ce taux est supérieur au seuil, l’ONIAM expertise le cas et statue sur l’aléa médical. Après expertise, si l’événement indésirable grave est attribué à une faute, le CRCI proposera une conciliation avec l’assureur du médecin ou de l’établissement de soins, qui assurera l’indemnisation.
Les rôles de l’ONIAM ont par ailleurs été élargis aux dédommagements des infections nosocomiales graves, des accidents médicaux liés à des procédures de soins d’urgence ou des vaccinations, des contaminations virales par acte transfusionnel (VIH, VHB, VHC, HTLV) ainsi que des victimes du benfluorex (Mediator).
Conclusion
Les protocoles de pharmacovigilance mis en place, leur réévaluation, la vigilance des prescripteurs et le signalement des effets secondaires doivent néanmoins permettre de minimiser ces risques, afin d’assurer une politique de santé la plus sûre possible.
Les aspects juridiques et réglementaires des événements indésirables graves doivent également être pris en compte et aboutir, si nécessaire, à une reconnaissance et à une indemnisation au titre du préjudice engendré par l’événement indésirable grave.•
Identification et gestion des risques liés aux médicaments
Savoir repérer les situations (populations) à risque et évoquer l’iatrogénie devant l’apparition d’un symptôme inattendu ou une évolution défavorable, non conforme à celle attendue devant la maladie initiale et lorsque cette dernière est traitée.
Connaître la liste des classes médicamenteuses à risque (tableau) sur des données pharmacologiques (marge thérapeutique faible, demi-vie longue, interactions médicamenteuses pharmacocinétiques et/ou pharmacodynamiques) mais également compte tenu de la fréquence de leur utilisation en pratique médicale courante.
Savoir adapter la prescription aux spécificités du patient (sujet âgé, pédiatrie, femme enceinte, terrain atopique, insuffisants rénaux et hépatiques).
Connaître les circuits réglementaires de pharmacovigilance, les modalités de déclaration et le devoir du prescripteur de signaler au centre de pharmacovigilance dont il dépend, tout événement indésirable grave et/ou inattendu qu’il constate.
Message de l'auteur
Cet item est transversal comme tous les items de thérapeutique présents au programme de l’ECNi. Tout dossier progressif et même de lecture critique d’article peut donc comporter au moins une question à choix simple ou multiple relative au risque médicamenteux. Cet item peut faire l’objet de questions isolées de connaissance générale ou physiopathologique (sur les mécanismes de l’hypersensibilité d’origine médicamenteuse par exemple).
Il s’agit donc majoritairement de questions de cours, de définitions, d’identification des commissions réglementaires, de la notion de pharmacovigilance et la définition d’un événement indésirable grave qui est réglementaire et importante à connaître.
Des questions spécifiques à certaines thérapeutiques ou au cours de certaines pathologies peuvent également être posées

 Encadrés
Encadrés