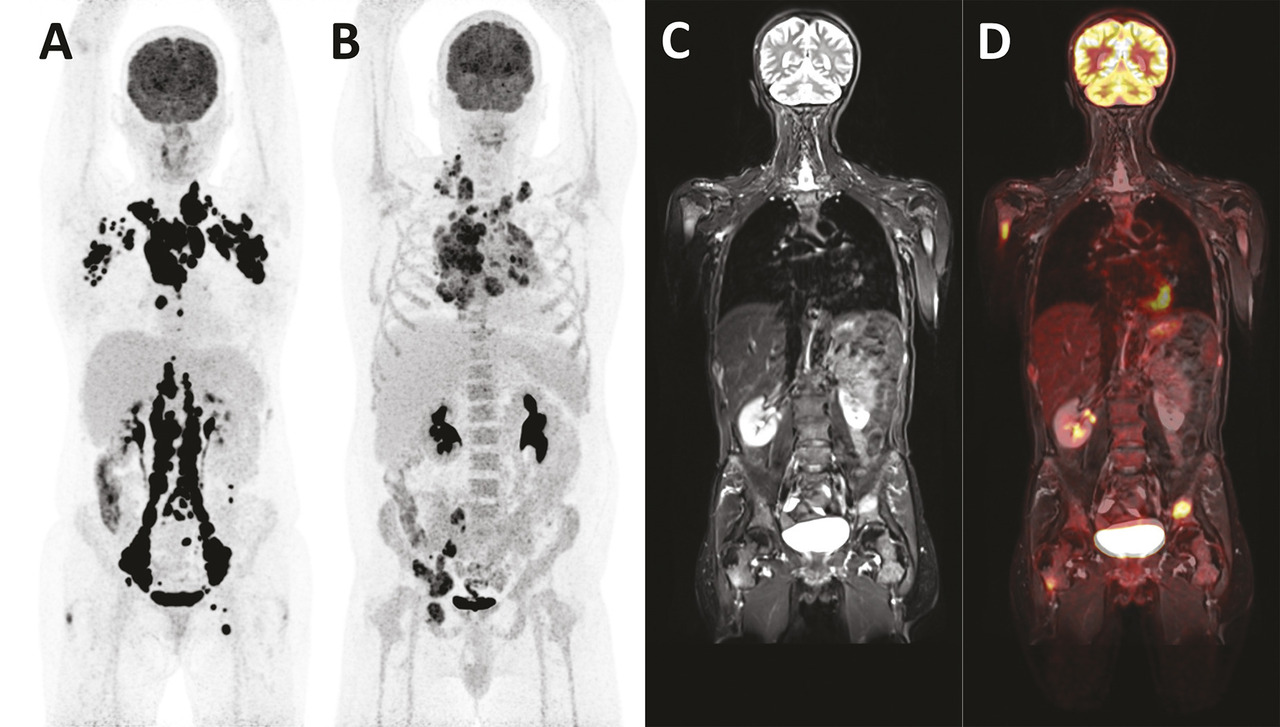
La TEP au 18F-FDG, qui évalue le métabolisme glucidique des tumeurs et donc leur activité de prolifération, est devenue indispensable pour le bilan d’extension et l’évaluation thérapeutique des lymphomes et a une valeur pronostique dans le myélome. Son interprétation est désormais standardisée.
L’imagerie métabolique par tomographie par émission de positons (ou TEP-scan) est aujourd’hui indispensable pour la prise en charge des hémopathies lymphoïdes en routine et plus particulièrement des lymphomes.1 Elle repose sur l’administration d’un médicament radiopharmaceutique (ou radiotraceur faiblement radioactif, le 18F-fluorodésoxyglucose (18F-FDG), qui est métabolisé par la voie de la glycolyse, et permet donc d’évaluer la consommation énergétique des tumeurs, c’est-à-dire leur activité de prolifération.
Un peu de technique
La biodistribution du 18F-FDG est détectée par une caméra dédiée grâce à la désintégration β+ de l’atome de 18F (émission d’un positon) qui aboutit, après annihilation, à la production de deux photons de 511 keV émis à 180° l’un de l’autre. Les caméras de TEP ont une forme en anneau pour pouvoir détecter ces deux photons en coïncidence. Elles sont dans la majorité des cas couplées à une tomodensitométrie (on parle de tomodensitométrie couplée à la tomographie à émission de positons [TEP-TDM]), permettant un repérage anatomique précis des foyers hypermétaboliques et une correction des phénomènes physiques d’atténuation des rayonnements lors de la traversée du patient, rendant possible une semi-quantification du métabolisme glucidique. Plus récemment, des systèmes hybrides permettant l’acquisition simultanée d’une TEP et d’une imagerie par résonance magnétique (IRM) ont été développés, et les premiers résultats ont montré les avantages de la TEP-IRM pour la caractérisation des ganglions, des atteintes spléniques, hépatiques ou osseuses, fréquentes dans les hémopathies lymphoïdes.
Précautions et limites de l’examen
L’imagerie est réalisée à 60 ± 10 minutes après l’injection du produit radiopharmaceutique et couvre un champ d’exploration allant du haut du crâne à mi-cuisse, parfois jusqu’aux pieds. Le respect strict de certaines précautions telles que le jeûne préalable d’au moins 4 heures, le contrôle de la glycémie, qui doit être inférieure ou égale à 7 mmol/L (ou ≤ 11 mmol/L en cas de diabète), le repos strict sans stimulation musculaire pendant l’heure de captation, assure la possibilité d’interpréter correctement l’examen et une reproductibilité de l’analyse quantitative du métabolisme. L’enregistrement des images dure 15 à 20 minutes. Les tissus normaux captent très peu le 18F-FDG, à l’exception du cerveau (consommateur de glucose), du myocarde (switch métabolique vers les acides gras en cas de jeûne) et des voies urinaires (élimination du radiotraceur). En conséquence, les lésions tumorales sont visibles, avec un très fort rapport signal/bruit (v. figure ). La consommation de glucose des tumeurs peut être mesurée par le calcul de la standardized uptake value (SUV), un indice semi-quantitatif qui reflète l’activité de la prolifération tumorale par rapport à une distribution homogène du traceur dans l’organisme.
Des faux positifs…
Les causes de faux positifs sont multiples car certains processus inflammatoires, infectieux ou tout simplement de cicatrisation tissulaire peuvent entraîner un hypermétabolisme parfois supérieur à celui des cellules cancéreuses. Dans le cadre des hémopathies lymphoïdes, un rebond thymique, une activation de la moelle hématopoïétique après chimiothérapie, une pseudo-progression sous immunothérapie ou une infection intercurrente sont des causes courantes de faux positifs. Pour l’évaluation thérapeutique, il est souhaitable de respecter un délai de 2 semaines après une chimiothérapie, 4 semaines après une chirurgie, et 2 à 3 mois après une radiothérapie.
… et des faux négatifs
Les causes de faux négatifs sont essentiellement dues au caractère indolent et/ou paucicellulaire des hémopathies (certains lymphomes de la zone marginale, du MALT, ou lymphocytiques, ainsi que certains myélomes).
Quelle dose reçue ?
L’irradiation équivaut à une dose efficace de 10 à 15 mSv, soit 4 à 6 fois l’irradiation naturelle annuelle en France. La grossesse est une contre-indication relative (il faut évaluer le rapport bénéfice/risque), et l’allaitement doit être suspendu temporairement pendant 24 heures. À la suite d’une TEP, aucune mesure d’éviction des sujets contacts (y compris femmes enceintes, jeunes enfants, personnel soignant) n’est nécessaire.
Quelles indications ?
Les indications cliniques de la TEP ont été classées par niveau de preuve scientifique dans le Guide du bon usage des examens d’imagerie*, actualisé en 2012 sous l’égide de la Haute Autorité de santé.
Dans les lymphomes
Dans les lymphomes, la TEP-TDM au 18F-FDG est recommandée lors du bilan d’extension initial des lymphomes de Hodgkin et des lymphomes non hodgkiniens, habituellement avides (v . figure ). Elle permet de réaliser un inventaire des lésions ganglionnaires et extraganglionnaires pour la stadification (et dans certains cas de se passer de la biopsie ostéomédullaire systématique), de mesurer le volume métabolique tumoral, d’identifier les éventuelles composantes de bas grade (SUV < 10) et de haut grade (SUV > 10) pour guider la biopsie, et enfin de disposer d’un examen de référence pour évaluer ensuite la réponse au traitement. L’évaluation thérapeutique s’appuie sur l’utilisation consensuelle de l’échelle de Deauville 2009 (tableau 1 ), qui compare visuellement l’intensité d’un foyer résiduel avec des organes de référence, comme le médiastin et le foie. La réponse au traitement est ensuite exprimée selon la classification de Lugano 2014 (tableau 2 ) en quatre catégories : réponse métabolique complète (RMC), réponse partielle (RMP), maladie métaboliquement stable (MMS) ou maladie métaboliquement progressive (MMP).2 Dans le lymphome diffus à grandes cellules B, l’évaluation précoce de la réponse après les deux premières cures de chimiothérapie a une forte valeur pronostique et peut s’appuyer sur le calcul du pourcentage de réduction du SUV entre l’imagerie préthérapeutique et l’imagerie précoce (ΔSUV), rendant plus objective l’interprétation. Le seuil au-delà duquel un patient est considéré en bonne réponse après deux cures est fixé à ΔSUV > 66 %.
Dans les myélomes
Dans les myélomes, l’IRM et la TEP permettent de caractériser la prolifération ostéomédullaire (lésions focales, infiltration diffuse) bien mieux que les radiographies standard et font partie intégrante de la nouvelle stadification de Salmon et Durie « plus ».3 Ces modalités d’imagerie peuvent également mettre en évidence des atteintes extramédullaires de la maladie, et peuvent être réalisées simultanément sur les machines hybrides TEP-IRM (v . figure ). L’IRM est beaucoup plus sensible pour détecter l’infiltration diffuse, corrélée au pourcentage de plasmocytes présents dans la moelle osseuse, et la TEP permet de caractériser l’agressivité des lésions focales. Ainsi, le véritable intérêt de l’imagerie métabolique dans l’évaluation initiale des myélomes est pronostique, en particulier avant autogreffe de cellules souches : la présence d’au moins trois lésions hypermétaboliques et/ou d’une atteinte extramédullaire sont des facteurs de mauvais pronostic. Un SUV > 4,2 a également été décrit comme étant un facteur péjoratif, mais son utilisation est plus controversée. Enfin, les deux modalités sont indiquées pour l’évaluation de la réponse thérapeutique, la TEP étant plus précoce que l’IRM : la disparition de tout hypermétabolisme lésionnel après traitement permet d’identifier les patients sans maladie résiduelle minime qui auront une meilleure survie sans progression.
Vers une thérapie personnalisée
En conclusion, l’imagerie métabolique TEP au 18F-FDG est incontournable dans la prise en charge des lymphomes et montre certains avantages diagnostiques et pronostiques par rapport à l’IRM dans les myélomes. L’évaluation précoce de la réponse métabolique a permis récemment de proposer des stratégies thérapeutiques personnalisées. Ainsi, dans le lymphome de Hodgkin de stade avancé, une TEP négative après deux cures du protocole BEACOPP** témoigne d’une réponse rapide et permet de désescalader le traitement avec une chimiothérapie moins toxique comme le protocole ABVD*** sans compromettre le contrôle de la maladie ;4 à l’inverse, dans le lymphome diffus à grandes cellules B, une TEP positive après deux cures d’immunochimiothérapie témoigne d’une mauvaise réponse et permet de poser l’indication d’une escalade thérapeutique par autogreffe de cellules souches, conférant aux patients la même survie sans progression que s’ils avaient été bons répondeurs.5 Ces stratégies guidées par la TEP ont été rendues possibles grâce à la standardisation des critères de réponse conduite ces 10 dernières années.
* http://gbu.radiologie.fr/ ** BEACOPP : bléomycine, étoposide, doxorubicine, cyclophosphamide, vincristine, procarbazine, prednisone. *** ABVD : doxorubicine, bléomycine, vinblastine, dacarbazine.
Références
1. Mulé S, Reizine E, Piekarski E, et al. Tomographie par émission de positons dans les hémopathies lymphoïdes. EMC (Elsevier Masson SAS, Paris), Hématologie 13-000-L-15, pp. 1-15, 2019.
2. Cheson BD, Fisher RI, Barrington SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol 2014;32:3059-68.
3. Cavo M, Terpos E, Nanni C, et al. Role of 18F-FDG PET/CT in the diagnosis and management of multiple myeloma and other plasma cell disorders: a consensus statement by the International Myeloma Working Group. Lancet Oncol 2017;18:e206-e217.
4. Casasnovas RO, Bouabdallah R, Brice P, et al. PET-adapted treatment for newly diagnosed advanced Hodgkin lymphoma (AHL2011): a randomised, multicentre, non-inferiority, phase 3 study. Lancet Oncol 2019;20:202-15.
5. Le Gouill S, Ghesquieres H, Obéric L, et al. Obinutuzumab versus rituximab in young patients with advanced DLBCL, a PET-guided and randomized phase 3 study by LYSA. Blood 2020 Nov 19;blood.2020008750. Online ahead of print.
2. Cheson BD, Fisher RI, Barrington SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol 2014;32:3059-68.
3. Cavo M, Terpos E, Nanni C, et al. Role of 18F-FDG PET/CT in the diagnosis and management of multiple myeloma and other plasma cell disorders: a consensus statement by the International Myeloma Working Group. Lancet Oncol 2017;18:e206-e217.
4. Casasnovas RO, Bouabdallah R, Brice P, et al. PET-adapted treatment for newly diagnosed advanced Hodgkin lymphoma (AHL2011): a randomised, multicentre, non-inferiority, phase 3 study. Lancet Oncol 2019;20:202-15.
5. Le Gouill S, Ghesquieres H, Obéric L, et al. Obinutuzumab versus rituximab in young patients with advanced DLBCL, a PET-guided and randomized phase 3 study by LYSA. Blood 2020 Nov 19;blood.2020008750. Online ahead of print.