À long terme, les résultats des greffes rénales avec donneurs vivants sont meilleurs que ceux obtenus à partir de donneurs décédés. Parmi les raisons, il peut y avoir une meilleure compatibilité donneur- receveur dans le système HLA, des donneurs (presque) parfaits en termes de fonction rénale, une ischémie froide beaucoup plus courte et, de fait, beaucoup moins de risques de reprise retardée de la fonction du greffon. Quel est le rôle joué par l’immunosuppression ? Après une greffe rénale, il n’y a pas de tolérance et, de fait, il y a une nécessité de prendre à vie un traitement antirejet. Ce traitement repose sur un traitement d’induction et un traitement de maintenance.
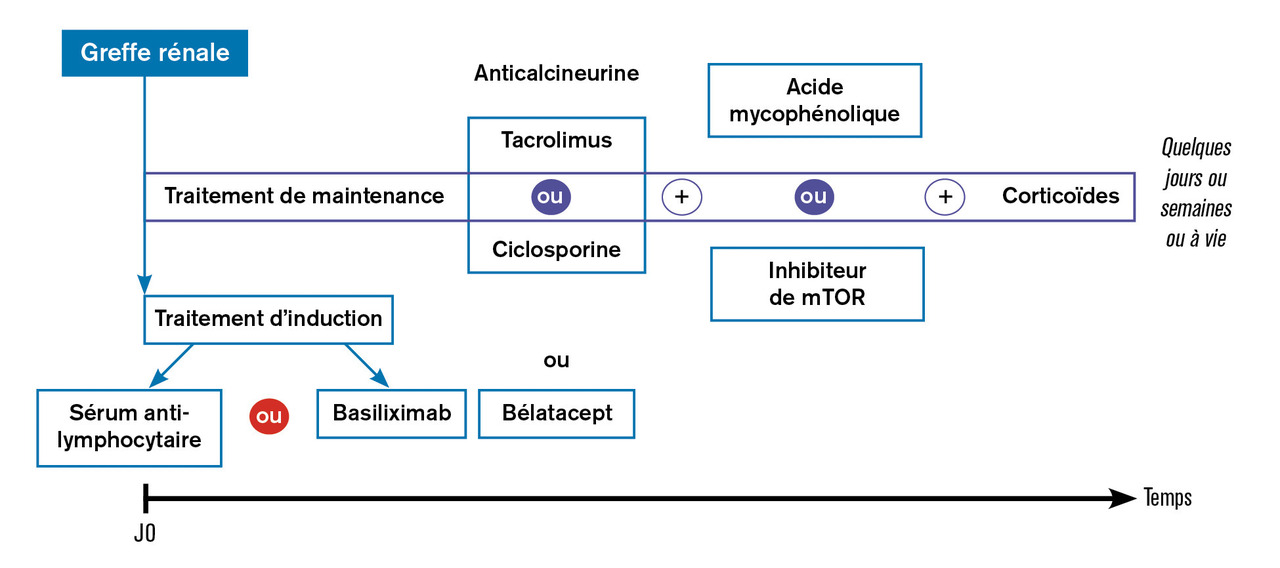
Le traitement d’induction est transitoire et puissant, il a pour vocation d’éviter un rejet pendant la période postopératoire précoce. Il fait appel soit au sérum antilymphocytaire (Thymoglobuline ou Grafalon) qui induit pendant quelques mois une lymphopénie profonde, soit au basiliximab (Simulect), anticorps monoclonal ciblant à la surface des lymphocytes activés la molécule CD25, qui est le récepteur de l’interleukine 2.1
Le traitement de maintenance doit être efficace (prévenir le rejet aigu mais aussi le rejet chronique, en particulier celui médié par des anticorps anti-HLA ciblant les antigènes HLA du greffon) et le moins toxique possible. En effet, il fait appel à des molécules dont l’index thérapeutique est très étroit. Ainsi, afin de minimiser les effets indésirables des médicaments immunosuppresseurs, on associe plusieurs médicaments de différentes classes thérapeutiques (v. figure ).
La pierre angulaire du traitement de maintenance repose sur un médicament de la classe des anticalcineurines : la ciclosporine (Neoral) ou le tacrolimus (Prograf, Adoport, Advagraf, Envarsus).2, 3 Dans l’immense majorité des cas, il s’agit du tacrolimus. Ces médicaments sont puissants mais, parmi leurs effets indésirables, la néphrotoxicité tant aiguë que chronique est au premier plan.4 La posologie est adaptée en fonction des taux sanguins résiduels. On associe à l’anticalcineurine soit de l’acide mycophénolique (CellCept ou Myfortic) ciblant les lymphocytes en interagissant au niveau de la phase S, soit un inhibiteur de mTOR (Certican ou Rapamune). Enfin, les corticoïdes sont encore très utilisés soit sur un schéma très court (bolus préopératoire et phase postopératoire immédiate, c’est-à-dire arrêt vers J5), soit sur un schéma court (arrêt entre le 1er et le 3e mois postopératoires), soit maintenus à vie mais à très faibles doses (moins de 5 mg/j de prednisone/prednisolone).
Depuis quelques années, on peut chez certains patients s’affranchir des anticalcineurines et les remplacer par le bélatacept (Nulojix), protéine de fusion bloquant la costimulation des lymphocytes T médiée par le CD28 et non néphrotoxique.5 De plus, le bélatacept permet de limiter la formation d’anticorps anti-HLA spécifiques du greffon.6 Par ailleurs, chez des patients greffés rénaux recevant depuis la greffe et au long cours soit du bélatacept, soit de la ciclosporine, il a été montré que ceux recevant le bélatacept avaient une fonction rénale qui s’améliorait avec le temps, traduisant probablement une hypertrophie compensatrice, comme cela est observé après néphrectomie unilatérale.7 Une telle hypertrophie n’est jamais observée chez des patients sous anticalcineurines, possiblement parce que ces médicaments sont associés à une vasoconstriction chronique rénale. Enfin, chez des transplantés rénaux chez qui, à distance de la greffe rénale, la ciclosporine ou le tacrolimus sont remplacés par le bélatacept, on voit leur fonction rénale significativement s’améliorer, et ce de façon durable.8
Le traitement d’induction est transitoire et puissant, il a pour vocation d’éviter un rejet pendant la période postopératoire précoce. Il fait appel soit au sérum antilymphocytaire (Thymoglobuline ou Grafalon) qui induit pendant quelques mois une lymphopénie profonde, soit au basiliximab (Simulect), anticorps monoclonal ciblant à la surface des lymphocytes activés la molécule CD25, qui est le récepteur de l’interleukine 2.1
Le traitement de maintenance doit être efficace (prévenir le rejet aigu mais aussi le rejet chronique, en particulier celui médié par des anticorps anti-HLA ciblant les antigènes HLA du greffon) et le moins toxique possible. En effet, il fait appel à des molécules dont l’index thérapeutique est très étroit. Ainsi, afin de minimiser les effets indésirables des médicaments immunosuppresseurs, on associe plusieurs médicaments de différentes classes thérapeutiques (
La pierre angulaire du traitement de maintenance repose sur un médicament de la classe des anticalcineurines : la ciclosporine (Neoral) ou le tacrolimus (Prograf, Adoport, Advagraf, Envarsus).2, 3 Dans l’immense majorité des cas, il s’agit du tacrolimus. Ces médicaments sont puissants mais, parmi leurs effets indésirables, la néphrotoxicité tant aiguë que chronique est au premier plan.4 La posologie est adaptée en fonction des taux sanguins résiduels. On associe à l’anticalcineurine soit de l’acide mycophénolique (CellCept ou Myfortic) ciblant les lymphocytes en interagissant au niveau de la phase S, soit un inhibiteur de mTOR (Certican ou Rapamune). Enfin, les corticoïdes sont encore très utilisés soit sur un schéma très court (bolus préopératoire et phase postopératoire immédiate, c’est-à-dire arrêt vers J5), soit sur un schéma court (arrêt entre le 1er et le 3e mois postopératoires), soit maintenus à vie mais à très faibles doses (moins de 5 mg/j de prednisone/prednisolone).
Depuis quelques années, on peut chez certains patients s’affranchir des anticalcineurines et les remplacer par le bélatacept (Nulojix), protéine de fusion bloquant la costimulation des lymphocytes T médiée par le CD28 et non néphrotoxique.5 De plus, le bélatacept permet de limiter la formation d’anticorps anti-HLA spécifiques du greffon.6 Par ailleurs, chez des patients greffés rénaux recevant depuis la greffe et au long cours soit du bélatacept, soit de la ciclosporine, il a été montré que ceux recevant le bélatacept avaient une fonction rénale qui s’améliorait avec le temps, traduisant probablement une hypertrophie compensatrice, comme cela est observé après néphrectomie unilatérale.7 Une telle hypertrophie n’est jamais observée chez des patients sous anticalcineurines, possiblement parce que ces médicaments sont associés à une vasoconstriction chronique rénale. Enfin, chez des transplantés rénaux chez qui, à distance de la greffe rénale, la ciclosporine ou le tacrolimus sont remplacés par le bélatacept, on voit leur fonction rénale significativement s’améliorer, et ce de façon durable.8
Le schéma immunosuppresseur est-il différent en cas de donneur vivant ?
Il y a tout d’abord les cas exceptionnels où le donneur est jumeau monozygote. Dans ce cas, il faut prendre en considération la néphropathie initiale : en effet, si elle est à médiation immunitaire, il est possible qu’elle récidive sur le greffon (maladie auto-immune, maladie de Berger, hyalinose segmentaire et focale, par exemple). Dans ces cas-là, un traitement immunosuppresseur à vie est requis.10 Ailleurs (maladie génétique, uropathie malformative par exemple), le traitement immunosuppresseur est uniquement prescrit au cours des premiers mois postgreffe, puis progressivement arrêté. En cas de greffe rénale entre jumeaux monozygotes, le traitement d’induction n’est pas nécessaire ; le traitement de maintenance repose les trois premiers mois sur une association tacrolimus-acide mycophénolique. Après ce stade, dans les cas favorables (v. supra), le tacrolimus peut être arrêté, puis, trois mois plus tard, l’arrêt de l’acide mycophénolique peut être envisagé. Quant aux corticoïdes, ils sont indispensables, au moins au début pour bénéficier de leur propriété anti-inflammatoire. Les résultats de la greffe rénale entre jumeaux monozygotes sont excellents.11
En dehors des greffes rénales entre jumeaux monozygotes, l’immunosuppression peut être adaptée en fonction des compatibilités HLA : en effet, en cas de greffe rénale HLA-identique aux loci A, B, Cw, DR, DP et DQ, l’immunosuppression peut être minimisée au-delà de la première année (faible exposition au tacrolimus sous couvert de doses standard d’acide mycophénolique). En dehors de cette situation, l’immunosuppression de maintenance est similaire à celles des patients recevant un greffon d’un donneur décédé. Pour ce qui est du traitement d’induction, le fait d’avoir un donneur vivant permet de programmer la greffe. Ainsi, l’immunosuppression standard peut et doit être débutée entre 10 et 15 jours avant la greffe (tacrolimus, acide mycophénolique et corticoïdes). Cette imprégnation prégreffe permet ainsi de s’affranchir du traitement d’induction sauf chez les receveurs pour lesquels la greffe rénale serait incompatible (soit pour les groupes sanguins ABO, soit pour les antigènes HLA avec anticorps anti-HLA préformés contre le greffon).
Les données semi-récentes concernant des patients transplantés rénaux pour lesquels l’immunosuppression de maintenance est à base de bélatacept en lieu et place d’une anticalcineurine plaident pour utiliser chez le receveur de greffon issu de donneur vivant le bélatacept au long cours afin d’éviter toute néphrotoxicité, de permettre une hypertrophie du greffon, et d’avoir une demi-vie du greffon plus longue que sous anticalcineurines.
Pour les greffes rénales ABO-incompatibles (ABOi) et HLA-incompatibles (HLAi) avec donneur vivant, il faut, avant la greffe, mettre en place un traitement de désimmunisation, dont l’objectif est de réduire le taux d’isoagglutinines (greffe ABOi) ou des anticorps anti-HLA spécifiques dirigés contre le greffon (greffe HLAi) afin d’éviter tout rejet aigu en per-transplantation ou postgreffe précoce.12, 13 Cette désimmunisation est mise en place environ 30 jours avant la greffe et fait appel à une immunosuppression conventionnelle (tacrolimus-acide mycophénolique-corticoïdes) à laquelle on ajoute, avant la greffe, du rituximab pour cibler les lymphocytes B et des séances d’aphérèse afin de retirer les anticorps potentiellement néfastes. Grâce à ces procédures, les résultats obtenus pour ces greffes incompatibles sont excellents.
En dehors des greffes rénales entre jumeaux monozygotes, l’immunosuppression peut être adaptée en fonction des compatibilités HLA : en effet, en cas de greffe rénale HLA-identique aux loci A, B, Cw, DR, DP et DQ, l’immunosuppression peut être minimisée au-delà de la première année (faible exposition au tacrolimus sous couvert de doses standard d’acide mycophénolique). En dehors de cette situation, l’immunosuppression de maintenance est similaire à celles des patients recevant un greffon d’un donneur décédé. Pour ce qui est du traitement d’induction, le fait d’avoir un donneur vivant permet de programmer la greffe. Ainsi, l’immunosuppression standard peut et doit être débutée entre 10 et 15 jours avant la greffe (tacrolimus, acide mycophénolique et corticoïdes). Cette imprégnation prégreffe permet ainsi de s’affranchir du traitement d’induction sauf chez les receveurs pour lesquels la greffe rénale serait incompatible (soit pour les groupes sanguins ABO, soit pour les antigènes HLA avec anticorps anti-HLA préformés contre le greffon).
Les données semi-récentes concernant des patients transplantés rénaux pour lesquels l’immunosuppression de maintenance est à base de bélatacept en lieu et place d’une anticalcineurine plaident pour utiliser chez le receveur de greffon issu de donneur vivant le bélatacept au long cours afin d’éviter toute néphrotoxicité, de permettre une hypertrophie du greffon, et d’avoir une demi-vie du greffon plus longue que sous anticalcineurines.
Pour les greffes rénales ABO-incompatibles (ABOi) et HLA-incompatibles (HLAi) avec donneur vivant, il faut, avant la greffe, mettre en place un traitement de désimmunisation, dont l’objectif est de réduire le taux d’isoagglutinines (greffe ABOi) ou des anticorps anti-HLA spécifiques dirigés contre le greffon (greffe HLAi) afin d’éviter tout rejet aigu en per-transplantation ou postgreffe précoce.12, 13 Cette désimmunisation est mise en place environ 30 jours avant la greffe et fait appel à une immunosuppression conventionnelle (tacrolimus-acide mycophénolique-corticoïdes) à laquelle on ajoute, avant la greffe, du rituximab pour cibler les lymphocytes B et des séances d’aphérèse afin de retirer les anticorps potentiellement néfastes. Grâce à ces procédures, les résultats obtenus pour ces greffes incompatibles sont excellents.
Une immunosuppression indispensable
En résumé, après greffe rénale par donneur vivant, en dehors de situations exceptionnelles (jumeaux monozygotes), une immunosuppression est indispensable. Le bélatacept est une alternative aux anticalcineurines car ces dernières sont néphrotoxiques ; il pourrait ainsi augmenter la demi-vie des greffons. Enfin, les greffes incompatibles, particulièrement celles dans le système ABO, sont associées à de très bons résultats à long terme. V
Références
1. Rostaing L, Malvezzi P. Where do we stand in 2020 regarding induction therapy after kidney transplantation? Transpl Int 2020;33:858-62.
2. Vincenti F, Friman S, Scheuermann E, Rostaing L, Jenssen T et al.; DIRECT (Diabetes Incidence after REnal transplantation: Neoral C Monitoring Versus Tacrolimus) investigators. Results of an international, randomized trial comparing glucose metabolism disorders and outcome with cyclosporine versus tacrolimus. Am J Transplant 2007;7:1506-14.
3. Oberbauer R, Bestard O, Furian L, Maggiore U, Pascual JB et al. Optimization of tacrolimus in kidney transplantation: New pharmacokinetic perspectives. Transplant Rev (Orlando) 2020;34:100531.
4. Jouve T, Noble J, Rostaing L, Malvezzi P. An update on the safety of tacrolimus in kidney transplant recipients, with a focus on tacrolimus minimization. Expert Opin Drug Saf 2019;18:285-94.
5. Noble J, Jouve T, Janbon B, Rostaing L, Malvezzi P. Belatacept in kidney transplantation and its limitations. Expert Rev Clin Immunol 2019;15:359-67.
6. Bray RA, Gebel HM, Townsend R, Roberts ME, Polinsky M et al. De novo donor-specific antibodies in belatacept-treated vs cyclosporine-treated kidney-transplant recipients: Post hoc analyses of the randomized phase III BENEFIT and BENEFIT-EXT studies. Am J Transplant 2018;18:1783-9.
7. Vincenti F, Rostaing L, Grinyo J, Rice K, Steinberg S et al. Belatacept and long-term outcomes in kidney transplantation. N Engl J Med 2016;374:333-43.
8. Rostaing L, Massari P, Garcia VD, Mancilla-Urrea E, Nainan G et al. Switching from calcineurin inhibitor-based regimens to a belatacept-based regimen in renal transplant recipients: a randomized phase II study. Clin J Am Soc Nephrol 2011;6:430-9.
9. Day E, Kearns PK, Taylor CJ, Bradley JA. Transplantation between monozygotic twins: how identical are they? Transplantation 2014;98:485-9.
10. Rao Z, Huang Z, Song T, Lin T. A lesson from kidney transplantation among identical twins: Case report and literature review. Transpl Immunol 2015;33:27-9.
11. Jorgensen DR, Wu CM, Hariharan S. Epidemiology of end-stage renal failure among twins and diagnosis, management, and current outcomes of kidney transplantation between identical twins. Am J Transplant 2020;20:761-8.
12. Morath C, Zeier M, Döhler B, Opelz G, Süsal C. ABO-Incompatible Kidney Transplantation. Front Immunol 2017;8:234.
13. Malvezzi P, Jouve T, Noble J, Rostaing L. Desensitization in the Setting of HLA-Incompatible Kidney Transplant. Exp Clin Transplant 2018;16:367-75.
2. Vincenti F, Friman S, Scheuermann E, Rostaing L, Jenssen T et al.; DIRECT (Diabetes Incidence after REnal transplantation: Neoral C Monitoring Versus Tacrolimus) investigators. Results of an international, randomized trial comparing glucose metabolism disorders and outcome with cyclosporine versus tacrolimus. Am J Transplant 2007;7:1506-14.
3. Oberbauer R, Bestard O, Furian L, Maggiore U, Pascual JB et al. Optimization of tacrolimus in kidney transplantation: New pharmacokinetic perspectives. Transplant Rev (Orlando) 2020;34:100531.
4. Jouve T, Noble J, Rostaing L, Malvezzi P. An update on the safety of tacrolimus in kidney transplant recipients, with a focus on tacrolimus minimization. Expert Opin Drug Saf 2019;18:285-94.
5. Noble J, Jouve T, Janbon B, Rostaing L, Malvezzi P. Belatacept in kidney transplantation and its limitations. Expert Rev Clin Immunol 2019;15:359-67.
6. Bray RA, Gebel HM, Townsend R, Roberts ME, Polinsky M et al. De novo donor-specific antibodies in belatacept-treated vs cyclosporine-treated kidney-transplant recipients: Post hoc analyses of the randomized phase III BENEFIT and BENEFIT-EXT studies. Am J Transplant 2018;18:1783-9.
7. Vincenti F, Rostaing L, Grinyo J, Rice K, Steinberg S et al. Belatacept and long-term outcomes in kidney transplantation. N Engl J Med 2016;374:333-43.
8. Rostaing L, Massari P, Garcia VD, Mancilla-Urrea E, Nainan G et al. Switching from calcineurin inhibitor-based regimens to a belatacept-based regimen in renal transplant recipients: a randomized phase II study. Clin J Am Soc Nephrol 2011;6:430-9.
9. Day E, Kearns PK, Taylor CJ, Bradley JA. Transplantation between monozygotic twins: how identical are they? Transplantation 2014;98:485-9.
10. Rao Z, Huang Z, Song T, Lin T. A lesson from kidney transplantation among identical twins: Case report and literature review. Transpl Immunol 2015;33:27-9.
11. Jorgensen DR, Wu CM, Hariharan S. Epidemiology of end-stage renal failure among twins and diagnosis, management, and current outcomes of kidney transplantation between identical twins. Am J Transplant 2020;20:761-8.
12. Morath C, Zeier M, Döhler B, Opelz G, Süsal C. ABO-Incompatible Kidney Transplantation. Front Immunol 2017;8:234.
13. Malvezzi P, Jouve T, Noble J, Rostaing L. Desensitization in the Setting of HLA-Incompatible Kidney Transplant. Exp Clin Transplant 2018;16:367-75.