Désormais prescrite en première intention dans les mélanomes au stade avancé en situation métastatique ou adjuvante, elle a profondément modifié l’histoire naturelle de la maladie.
La stratégie actuelle de traitement du mélanome par immunothérapie consiste à bloquer les points de contrôle du système immunitaire par des anticorps monoclonaux appelés inhibiteurs de check-points immunitaires. Ces anticorps ciblent des récepteurs inhibiteurs présents à la surface des lymphocytes (CTLA-4 ou PD-1) et exercent leur action initiale dans les organes lymphoïdes (anti- CTLA-4) et/ou directement dans le micro-environnement tumoral (anti-PD-1). Ils permettent de lever les freins du système immunitaire en réactivant une réponse immunitaire antitumorale inhibée par les cellules tumorales. Les inhibiteurs de check-points immunitaires ont considérablement modifié la prise en charge du mélanome, permettant d’obtenir des réponses thérapeutiques durables même après l’arrêt du traitement.
Inhibiteurs de check-points immunitaires dans le mélanome métastatique ou inopérable
L’anticorps anti-CTLA-4 (ipilimumab) a été le premier à démontrer un bénéfice sur la survie globale des patients atteints de mélanome métastatique par rapport à la chimiothérapie, avec un allongement de la médiane de survie (11,2 vs 9,1 mois) et des meilleurs taux de survie à 1 an (47,3 vs 36,3 %),1 confirmés à 5 ans (18,2 vs 8,8 %).2
Les anticorps anti-PD-1 (pembrolizumab, nivolumab) ont rapidement supplanté les anti-CTLA-4 grâce à de meilleurs taux de réponse et à un profil de tolérance plus favorable. Les taux de survie à 5 ans étaient comparables pour le pembrolizumab et le nivolumab (38,7 et 40 % respectivement).3
L’association anti-CTLA-4 et anti- PD-1 semble aujourd’hui l’option la plus efficace dans le traitement du mélanome métastatique ou inopérable, mais au prix d’une toxicité bien plus importante (v. infra). Les taux de réponse objective étaient de 57,6 % pour l’association vs 43,7 % pour la monothérapie anti-PD-1 et 19 % pour la monothérapie anti-CTLA-4.4 La médiane de survie après 5 ans n’était pas atteinte avec la combinaison (vs 36,9 mois avec les anti-PD-1 seuls et 19,9 mois avec les anti-CTLA-4 seuls).5
Chez les patients ayant des métastases cérébrales, l’association nivolumab-ipilimumab semble donner de très bons résultats, avec un taux de réponse dans le cerveau de 55 % et un taux de survie de 81,5 % à 1 an, mais ces données sont issues d’une cohorte de faible effectif avec des patients atteints au maximum de 3 métastases cérébrales asymptomatiques.6
L’association ipilimumab-nivolumab est prescrite en 4 injections par voie intraveineuse à 3 semaines d’intervalle suivies d’un traitement par nivolumab seul en entretien.
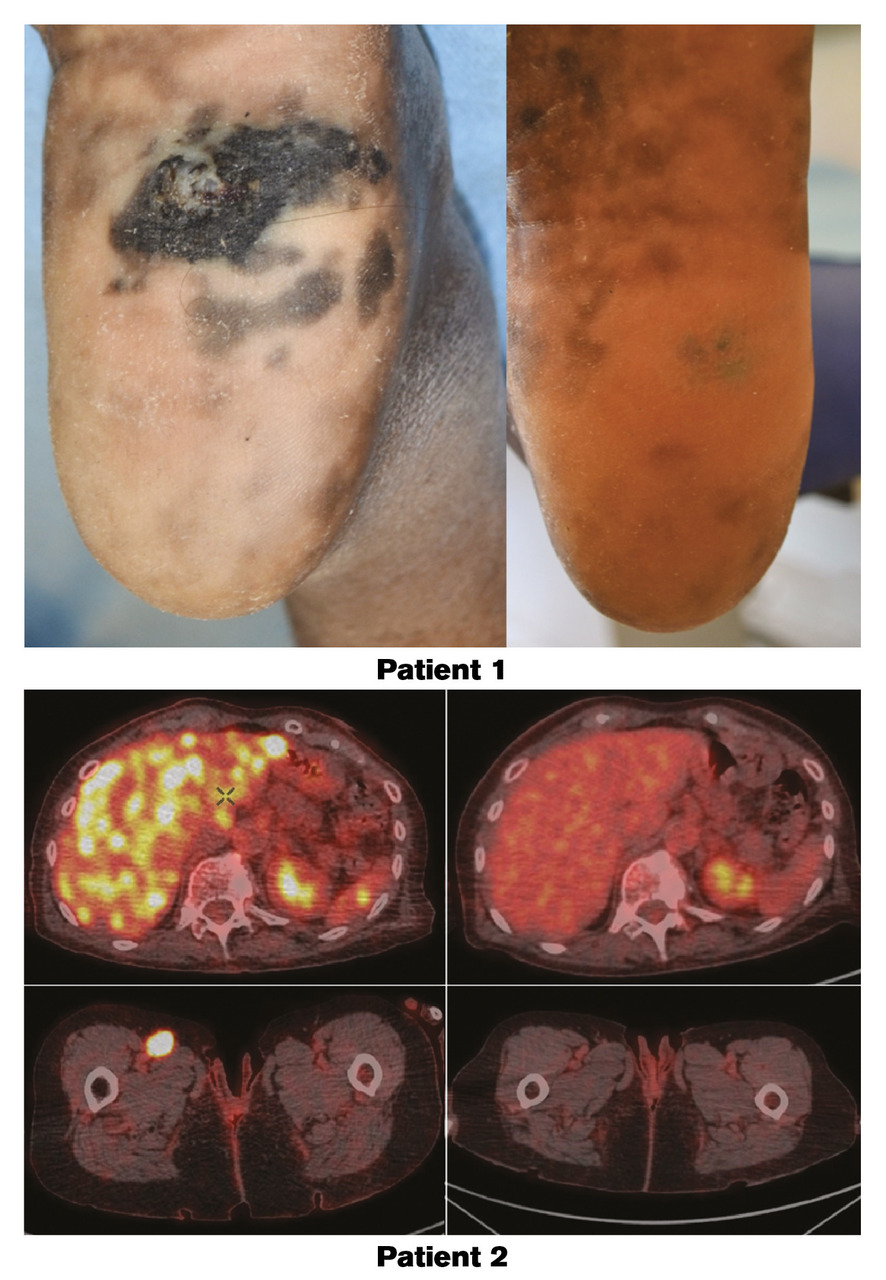
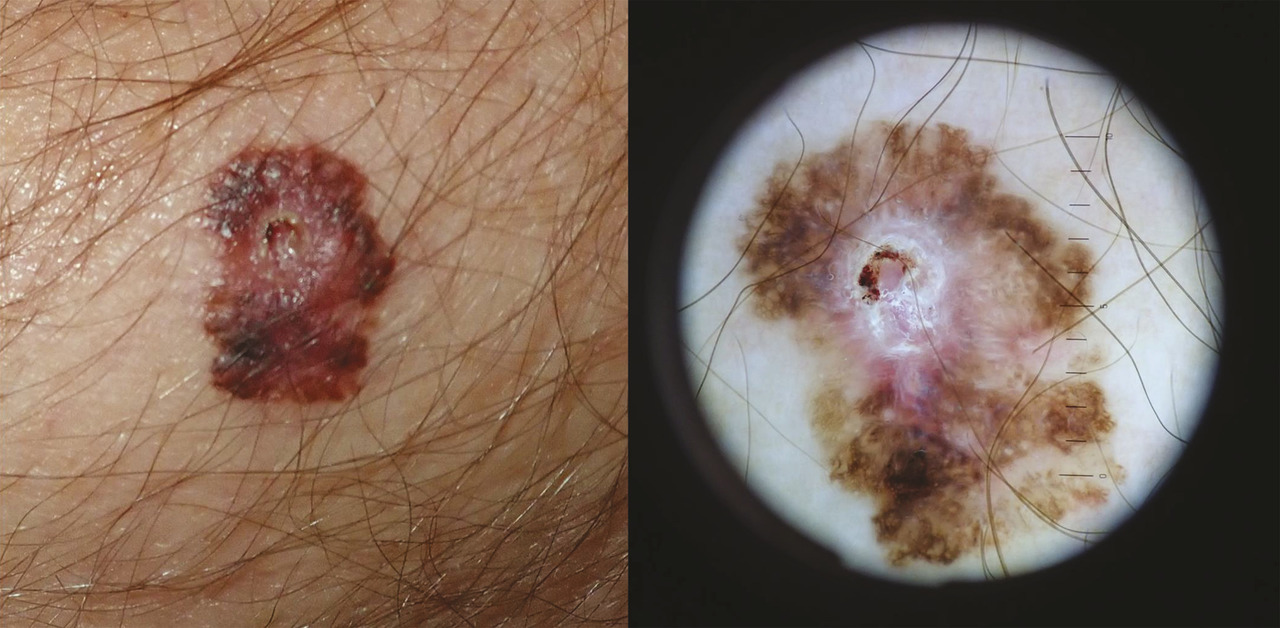
Lafigure 1 illustre les réponses obtenues grâce à l’immunothérapie en monothérapie (anti-PD-1) ou en combinaison (anti-PD1 associé à un anti-CTLA-4).
Les anticorps anti-PD-1 (pembrolizumab, nivolumab) ont rapidement supplanté les anti-CTLA-4 grâce à de meilleurs taux de réponse et à un profil de tolérance plus favorable. Les taux de survie à 5 ans étaient comparables pour le pembrolizumab et le nivolumab (38,7 et 40 % respectivement).3
L’association anti-CTLA-4 et anti- PD-1 semble aujourd’hui l’option la plus efficace dans le traitement du mélanome métastatique ou inopérable, mais au prix d’une toxicité bien plus importante (v. infra). Les taux de réponse objective étaient de 57,6 % pour l’association vs 43,7 % pour la monothérapie anti-PD-1 et 19 % pour la monothérapie anti-CTLA-4.4 La médiane de survie après 5 ans n’était pas atteinte avec la combinaison (vs 36,9 mois avec les anti-PD-1 seuls et 19,9 mois avec les anti-CTLA-4 seuls).5
Chez les patients ayant des métastases cérébrales, l’association nivolumab-ipilimumab semble donner de très bons résultats, avec un taux de réponse dans le cerveau de 55 % et un taux de survie de 81,5 % à 1 an, mais ces données sont issues d’une cohorte de faible effectif avec des patients atteints au maximum de 3 métastases cérébrales asymptomatiques.6
L’association ipilimumab-nivolumab est prescrite en 4 injections par voie intraveineuse à 3 semaines d’intervalle suivies d’un traitement par nivolumab seul en entretien.
La
Thérapies ciblées dans le mélanome métastatique ou inopérable
En cas de présence d’une mutation du gène BRAF, retrouvée dans environ 50 % des mélanomes, un traitement oral par thérapies ciblées visant à bloquer l’activité de la protéine BRAF peut aussi être proposé. Pour plus d’efficacité et une meilleure tolérance, les thérapies ciblées associent systématiquement un inhibiteur de BRAF (dabrafénib, vémurafénib ou encorafénib) à un inhibiteur de la protéine MEK (tramétinib, cobimétinib ou binimétinib).
Cette thérapie ciblée a une bonne efficacité initiale, mais les durées de réponse sont en moyenne moins longues que celles obtenues avec les immunothérapies.7
Cette thérapie ciblée a une bonne efficacité initiale, mais les durées de réponse sont en moyenne moins longues que celles obtenues avec les immunothérapies.7
Stratégie thérapeutique en situation adjuvante
La présence de métastases ganglionnaires ou en transit (métastase cutanée ou sous-cutanée située entre la tumeur primitive et l’aire ganglionnaire de drainage) définit le stade III selon la nouvelle classification de l’American Joint Committee on Cancer (AJCC) 2017, 8e édition.
La prise en charge à ce stade a été récemment modifiée :
– le curage ganglionnaire n’est plus recommandé en cas de positivité du ganglion sentinelle. Effectivement, un large essai randomisé de phase III a démontré l’absence de bénéfice de survie conférée par le curage ganglionnaire par rapport à la surveillance en cas de ganglion sentinelle positif.8 Il est cependant toujours proposé en cas de métastase ganglionnaire visible soit cliniquement, soit à l’imagerie ;
– le traitement adjuvant est maintenant indiqué après un geste ganglionnaire (curage ou ganglion sentinelle positif) ou après exérèse d’une métastase en transit. Il consiste en l’administration d’une immunothérapie par anti-PD-1 pendant 1 an ;9, 10
– en cas de mutation du gène BRAF, un traitement oral par thérapies ciblées en adjuvant peut également être proposé, après une chirurgie ganglionnaire ou l’exérèse d’une métastase en transit, pour une durée de 1 an ;11
Rappelons que la technique du ganglion sentinelle est proposée pour les mélanomes à partir de 0,8 mm d’épaisseur selon l’indice de Breslow ou en cas d’ulcération quelle que soit l’épaisseur du mélanome.12
La prise en charge à ce stade a été récemment modifiée :
– le curage ganglionnaire n’est plus recommandé en cas de positivité du ganglion sentinelle. Effectivement, un large essai randomisé de phase III a démontré l’absence de bénéfice de survie conférée par le curage ganglionnaire par rapport à la surveillance en cas de ganglion sentinelle positif.8 Il est cependant toujours proposé en cas de métastase ganglionnaire visible soit cliniquement, soit à l’imagerie ;
– le traitement adjuvant est maintenant indiqué après un geste ganglionnaire (curage ou ganglion sentinelle positif) ou après exérèse d’une métastase en transit. Il consiste en l’administration d’une immunothérapie par anti-PD-1 pendant 1 an ;9, 10
– en cas de mutation du gène BRAF, un traitement oral par thérapies ciblées en adjuvant peut également être proposé, après une chirurgie ganglionnaire ou l’exérèse d’une métastase en transit, pour une durée de 1 an ;11
Rappelons que la technique du ganglion sentinelle est proposée pour les mélanomes à partir de 0,8 mm d’épaisseur selon l’indice de Breslow ou en cas d’ulcération quelle que soit l’épaisseur du mélanome.12
Tolérance des inhibiteurs de check-point immunitaire
L’immunothérapie peut entraîner des effets indésirables, immunomédiés, reproduisant parfois les symptômes des maladies auto-immunes ou auto-inflammatoires, correspondant à une dérégulation de la réponse immune. Ceux-ci peuvent toucher tous les organes ou tissus. Ils sont plus fréquents et plus graves avec la double immunothérapie.
Certains effets indésirables sont fréquents :13
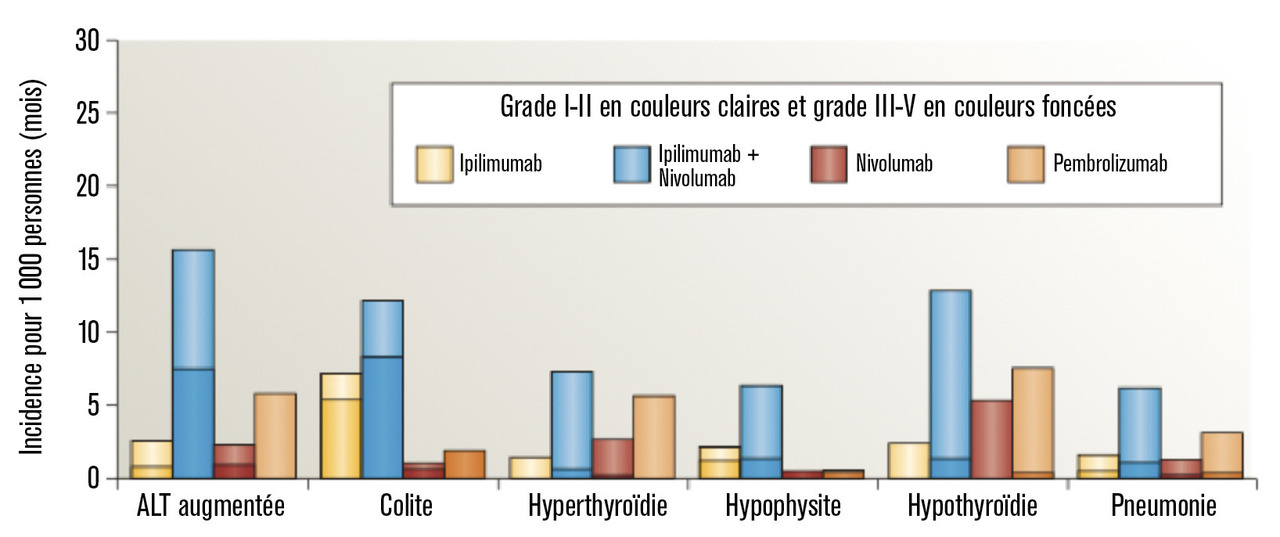
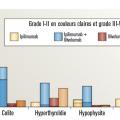
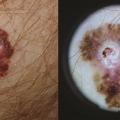
– colites immunomédiées ; elles sont plus fréquentes avec la double immunothérapie, de l’ordre de 13 % vs 2 % sous anti-PD-1 seuls. Un traitement par corticostéroïdes est habituellement suffisant, mais le recours aux anti-tumor necrosis factor alpha (anti-TNFα) peut être nécessaire dans les formes sévères. C’est la principale toxicité responsable d’arrêt de traitement ;
– toxicité cutanée ; les effets indésirables cutanés sont fréquemment retrouvés (15-25 %) sous anti-PD-1, anti-CTLA-4 ou avec l’association. Les plus fréquents sont les éruptions (psoriasiforme ou eczématiforme), le prurit et le vitiligo. La présence de vitiligo est associée à une bonne réponse au traitement ;14
– toxicité endocrinienne ; l’atteinte thyroïdienne est fréquente, de l’ordre de 15 %, (hyper- ou hypothyroïdie), et plutôt associée aux anti-PD-1 qu’aux anti-CTLA-4. L’atteinte hypophysaire est quant à elle plus rare (< 5 %), et l’atteinte du pancréas endocrine responsable de diabète insulinodépendant est exceptionnelle. Ces toxicités nécessitent une surveillance attentive du bilan endocrinien pendant le traitement (bilan thyroïdien, cortisol et glycémie à jeun). Ces effets secondaires sont irréversibles et justifient d’une hormonothérapie substitutive à vie. Ils ne contre-indiquent habituellement pas la poursuite du traitement ;
– autres ; l’asthénie est fréquente et probablement plurifactorielle. Des toxicités neurologiques, pulmonaires, hématologiques, ophtalmologique, oto-rhino-laryngées, musculaires et cardiaques ont été rapportées.
Le lien entre la présence d’effets indésirables et une bonne réponse au traitement est parfois noté,15 mais cela est controversé, car la plupart des études ne prennent pas en compte le biais lié au temps de suivi : plus un patient répond et survit longtemps, plus il a de risque de développer un effet secondaire par rapport à un patient qui ne répond pas au traitement et chez qui on interrompt l’immunothérapie rapidement.16 Ce qui est très encourageant, c’est que chez les patients ayant arrêté l’immunothérapie pour cause de toxicité, la réponse est habituellement persistante.5
Lafigure 2 illustre l’incidence et l’intensité des effets secondaires immunomédiés.
Certains effets indésirables sont fréquents :13
– colites immunomédiées ; elles sont plus fréquentes avec la double immunothérapie, de l’ordre de 13 % vs 2 % sous anti-PD-1 seuls. Un traitement par corticostéroïdes est habituellement suffisant, mais le recours aux anti-tumor necrosis factor alpha (anti-TNFα) peut être nécessaire dans les formes sévères. C’est la principale toxicité responsable d’arrêt de traitement ;
– toxicité cutanée ; les effets indésirables cutanés sont fréquemment retrouvés (15-25 %) sous anti-PD-1, anti-CTLA-4 ou avec l’association. Les plus fréquents sont les éruptions (psoriasiforme ou eczématiforme), le prurit et le vitiligo. La présence de vitiligo est associée à une bonne réponse au traitement ;14
– toxicité endocrinienne ; l’atteinte thyroïdienne est fréquente, de l’ordre de 15 %, (hyper- ou hypothyroïdie), et plutôt associée aux anti-PD-1 qu’aux anti-CTLA-4. L’atteinte hypophysaire est quant à elle plus rare (< 5 %), et l’atteinte du pancréas endocrine responsable de diabète insulinodépendant est exceptionnelle. Ces toxicités nécessitent une surveillance attentive du bilan endocrinien pendant le traitement (bilan thyroïdien, cortisol et glycémie à jeun). Ces effets secondaires sont irréversibles et justifient d’une hormonothérapie substitutive à vie. Ils ne contre-indiquent habituellement pas la poursuite du traitement ;
– autres ; l’asthénie est fréquente et probablement plurifactorielle. Des toxicités neurologiques, pulmonaires, hématologiques, ophtalmologique, oto-rhino-laryngées, musculaires et cardiaques ont été rapportées.
Le lien entre la présence d’effets indésirables et une bonne réponse au traitement est parfois noté,15 mais cela est controversé, car la plupart des études ne prennent pas en compte le biais lié au temps de suivi : plus un patient répond et survit longtemps, plus il a de risque de développer un effet secondaire par rapport à un patient qui ne répond pas au traitement et chez qui on interrompt l’immunothérapie rapidement.16 Ce qui est très encourageant, c’est que chez les patients ayant arrêté l’immunothérapie pour cause de toxicité, la réponse est habituellement persistante.5
La
Marqueurs prédictifs
À l’heure actuelle, il n’y a pas de marqueurs prédictifs pratiques et fiables de réponse au traitement par immunothérapie. Nous aurions besoin, en particulier, de tests permettant de savoir quels patients nécessitent une double immunothérapie, au risque d’effets indésirables plus élevé et quels patients pourraient répondre à une monothérapie par anti-PD-1, moins toxique. De nombreux biomarqueurs ont été proposés, comme l’expression de PDL-1 sur les cellules tumorales, sur les cellules immunes du microenvironnement, la charge mutationnelle tumorale ou encore des signatures inflammatoires, mais la valeur prédictive de ces examens n’est pas suffisante pour orienter le traitement.
Perspectives
L’avènement des inhibiteurs de points de contrôle (check-points) immunitaires a considérablement modifié l’histoire naturelle du mélanome. Ces traitements sont très différents des chimiothérapies précédemment utilisées en termes d’efficacité et de profil de tolérance. Ils sont désormais utilisés en première intention dans les mélanomes au stade avancé en situation métastatique ou adjuvante (v. tableau ). Les inhibiteurs de check-point sont actuellement en cours d’étude dans les stades plus précoces et en situation néo-adjuvante.
Les effets indésirables immunomédiés sont fréquents, imprévisibles, et leur prise en charge est pluridisciplinaire. L’identification de biomarqueurs prédictifs de la réponse au traitement constitue le prochain défi à relever pour améliorer encore la prise en charge des patients.
Les effets indésirables immunomédiés sont fréquents, imprévisibles, et leur prise en charge est pluridisciplinaire. L’identification de biomarqueurs prédictifs de la réponse au traitement constitue le prochain défi à relever pour améliorer encore la prise en charge des patients.
Références
1. Robert C, Thomas L, Bondarenko I, O’Day S, Weber J, Garbe C, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011;364:2517‑26.
2. Maio M, Grob JJ, Aamdal S, et al. Five-year survival rates for treatment-naive patients with advanced melanoma who received ipilimumab plus dacarbazine in a phase III trial. J Clin Oncol 2015;33:1191‑6.
3. Robert C, Ribas A, Schachter J, et al. Pembrolizumab versus ipilimumab in advanced melanoma (KEYNOTE-006): post-hoc 5-year results from an open-label, multicentre, randomised, controlled, phase 3 study. Lancet Oncol 2019;20:1239‑51.
4. Wolchok JD, Chiarion-Sileni V, Gonzalez R, et al. Overall survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2017;377:1345‑56.
5. Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2019;381:1535‑46.
6. Tawbi HA, Forsyth PA, Algazi A, et al. combined nivolumab and ipilimumab in melanoma metastatic to the brain. N Engl J Med 2018;379:722‑30.
7. Robert C, Grob JJ, Stroyakovskiy D, et al. Five-year outcomes with dabrafenib plus trametinib in metastatic melanoma. N Engl J Med 2019;381:626‑36.
8. Faries MB, Thompson JF, Cochran AJ, et al. Completion dissection or observation for sentinel-node metastasis in melanoma. N Engl J Med 2017;376:2211‑22.
9. Eggermont AMM, Blank CU, Mandala M, et al. Adjuvant pembrolizumab versus placebo in resected stage III melanoma. N Engl J Med 2018;378:1789‑801.
10. Weber J, Mandala M, Del Vecchio M, et al. Adjuvant nivolumab versus ipilimumab in resected stage III or IV melanoma. N Engl J Med 2017;377:1824‑35.
11. Long GV, Hauschild A, Santinami M, et al. Adjuvant dabrafenib plus trametinib in stage III BRAF - Mutated melanoma. N Engl J Med 2017;377(19):1813‑23.
12. Guillot B, Dupuy A, Pracht M, Jeudy G, Hindie E, Desmedt E, et al. Actualisation des données concernant le mélanome stade III : nouvelles recommandations du Groupe français de cancérologie cutanée. Ann Dermatol Venereol 2019;146:204‑14.
13. Boutros C, Tarhini A, Routier E, et al. Safety profiles of anti-CTLA-4 and anti-PD-1 antibodies alone and in combination. Nat Rev Clin Oncol 2016;13:473‑86.
14. Hua C, Boussemart L, Mateus C, et al. Association of vitiligo with tumor response in patients with metastatic melanoma treated with pembrolizumab. JAMA Dermatol 2016;152:45.
15. Suo A, Chan Y, Beaulieu C, et al. Anti-PD1-induced immune-related adverse events and survival outcomes in advanced melanoma. Oncologist 2020. doi: 10.1634/theoncologist.2019-0674.
16. Giobbie-Hurder A, Gelber RD, Regan MM. Challenges of guarantee-time bias. J Clin Oncol 2013;31:2963‑9.
2. Maio M, Grob JJ, Aamdal S, et al. Five-year survival rates for treatment-naive patients with advanced melanoma who received ipilimumab plus dacarbazine in a phase III trial. J Clin Oncol 2015;33:1191‑6.
3. Robert C, Ribas A, Schachter J, et al. Pembrolizumab versus ipilimumab in advanced melanoma (KEYNOTE-006): post-hoc 5-year results from an open-label, multicentre, randomised, controlled, phase 3 study. Lancet Oncol 2019;20:1239‑51.
4. Wolchok JD, Chiarion-Sileni V, Gonzalez R, et al. Overall survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2017;377:1345‑56.
5. Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2019;381:1535‑46.
6. Tawbi HA, Forsyth PA, Algazi A, et al. combined nivolumab and ipilimumab in melanoma metastatic to the brain. N Engl J Med 2018;379:722‑30.
7. Robert C, Grob JJ, Stroyakovskiy D, et al. Five-year outcomes with dabrafenib plus trametinib in metastatic melanoma. N Engl J Med 2019;381:626‑36.
8. Faries MB, Thompson JF, Cochran AJ, et al. Completion dissection or observation for sentinel-node metastasis in melanoma. N Engl J Med 2017;376:2211‑22.
9. Eggermont AMM, Blank CU, Mandala M, et al. Adjuvant pembrolizumab versus placebo in resected stage III melanoma. N Engl J Med 2018;378:1789‑801.
10. Weber J, Mandala M, Del Vecchio M, et al. Adjuvant nivolumab versus ipilimumab in resected stage III or IV melanoma. N Engl J Med 2017;377:1824‑35.
11. Long GV, Hauschild A, Santinami M, et al. Adjuvant dabrafenib plus trametinib in stage III BRAF - Mutated melanoma. N Engl J Med 2017;377(19):1813‑23.
12. Guillot B, Dupuy A, Pracht M, Jeudy G, Hindie E, Desmedt E, et al. Actualisation des données concernant le mélanome stade III : nouvelles recommandations du Groupe français de cancérologie cutanée. Ann Dermatol Venereol 2019;146:204‑14.
13. Boutros C, Tarhini A, Routier E, et al. Safety profiles of anti-CTLA-4 and anti-PD-1 antibodies alone and in combination. Nat Rev Clin Oncol 2016;13:473‑86.
14. Hua C, Boussemart L, Mateus C, et al. Association of vitiligo with tumor response in patients with metastatic melanoma treated with pembrolizumab. JAMA Dermatol 2016;152:45.
15. Suo A, Chan Y, Beaulieu C, et al. Anti-PD1-induced immune-related adverse events and survival outcomes in advanced melanoma. Oncologist 2020. doi: 10.1634/theoncologist.2019-0674.
16. Giobbie-Hurder A, Gelber RD, Regan MM. Challenges of guarantee-time bias. J Clin Oncol 2013;31:2963‑9.