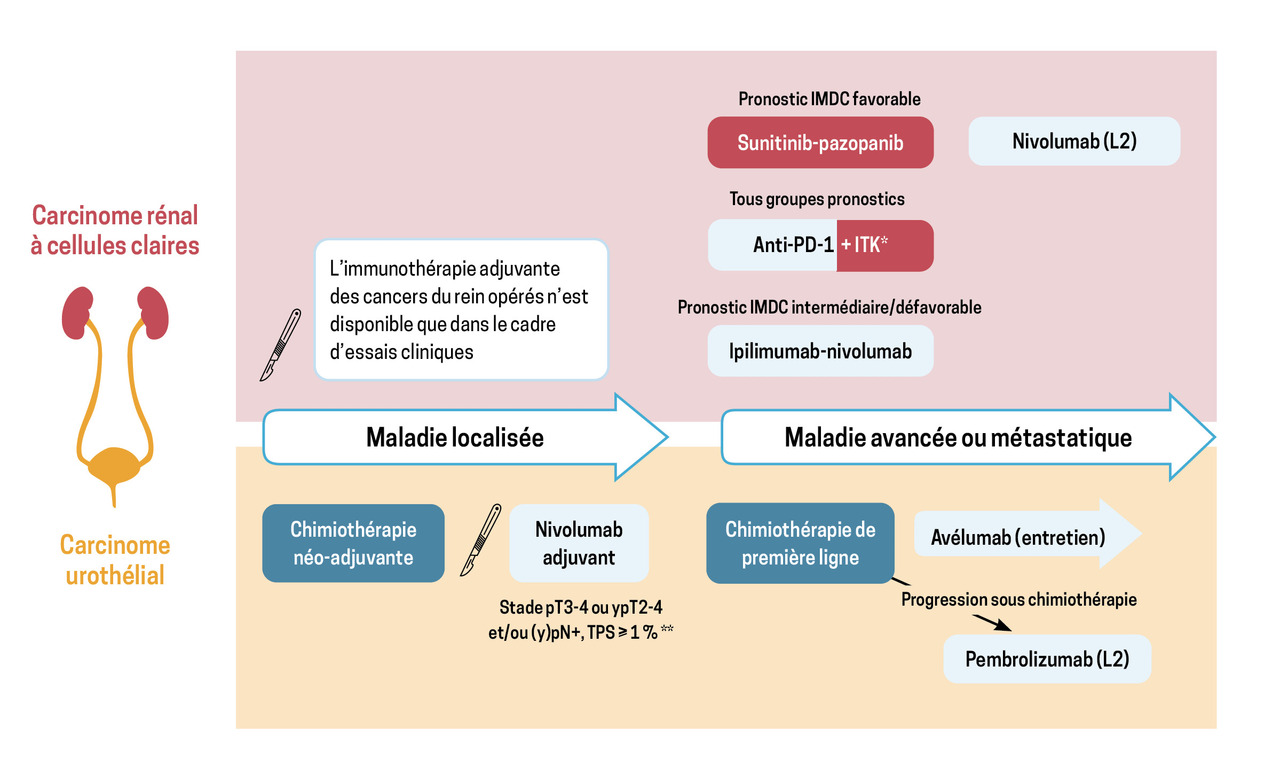
L’immunothérapie par inhibiteurs de points de contrôle immunitaires (immune checkpoint inhibitors : ICI) est aujourd’hui incontournable dans la prise en charge des principales formes de cancers avancés du rein et des voies urinaires. Elle est proposée de plus en plus précocement (figure) et à un nombre croissant de patients.
Les ICI actuellement disponibles en France dans ces pathologies sont le nivolumab et le pembrolizumab, ciblant le récepteur inhibiteur lymphocytaire PD-1 (Programmed cell Death protein 1), ainsi que l’avélumab, qui cible son ligand PD-L1 (Programmed Death-Ligand 1) exprimé par les cellules tumorales et/ou les cellules régulatrices du micro-environnement ; l’ipilimumab cible un autre récepteur inhibiteur, le CTLA-4 (Cytotoxic T-Lymphocyte Associated protein 4). Tous ces anticorps monoclonaux sont administrés par perfusions intraveineuses courtes, en veine périphérique ou sur cathéter central, à des intervalles de deux à six semaines en fonction des situations. En l’absence de progression du cancer ou de toxicité justifiant son interruption, un traitement par anti-PD-(L)1 peut être poursuivi pour une durée prolongée, voire indéfiniment ; des études évaluent actuellement des stratégies de pause ou de désescalade thérapeutique après une réponse initiale. Le traitement par ipilimumab comprend, en revanche, quatre administrations seulement, en association au nivolumab.
Indications des immunothérapies dans les cancers du rein
Les cancers du rein dans lesquels la place des ICI est clairement établie sont les carcinomes rénaux à cellules claires métastatiques (CRCCm). Auparavant, ces cancers étaient traités en première ligne par des traitements antiangiogéniques oraux (sunitinib, pazopanib). Après échec de ces traitements, le nivolumab était depuis 2015 un standard en deuxième ligne ; le taux de réponse était alors de 25 %, avec des réponses souvent prolongées (12 mois en médiane).1
Traitement de première ligneen situation métastatique
Aujourd’hui, l’association ipilimumab-nivolumab a supplanté le sunitinib en première ligne chez les patients de pronostic intermédiaire ou défavorable, selon les critères du Consortium international de la base de données sur le carcinome rénal métastatique (International Metastatic renal cell carcinoma Database Consortium, IMDC) [tableau 1]. Dans cette situation, le taux de réponse est de 42 % et, après cinq ans de suivi, plus de la moitié des patients ayant initialement répondu au traitement n’ont pas eu de nouvelle progression du cancer.2
Également en première ligne, plusieurs combinaisons d’un traitement antiangiogénique oral avec un anticorps anti-PD-1 ont été évaluées : axitinib-pembrolizumab,3 cabozantinib-nivolumab4 et lenvatinib-pembrolizumab.5 Ces trois combinaisons sont supérieures au sunitinib en survie globale dans des populations de patients de tous groupes pronostiques et sont aujourd’hui recommandées en première ligne pour tous les patients atteints de CRCCm. Avec le recul actuel, le bénéfice chez les patients de pronostic intermédiaire ou défavorable semble comparable à celui obtenu avec l’association ipilimumab-nivolumab ; le choix de l’une ou l’autre stratégie est laissé à l’appréciation du clinicien, en tenant compte des caractéristiques et des préférences du patient. En revanche, aucun essai n’a encore montré de bénéfice clair en matière de survie globale dans le sous-groupe de pronostic favorable, raison pour laquelle certains de ces patients se voient encore proposer un traitement antiangiogénique oral seul.
Pas de place encore pour l’immunothérapie adjuvante
Dans les stades localisés, la néphrectomie partielle ou totale est le traitement local de référence. Une étude randomisée a montré que le pembrolizumab administré après néphrectomie améliore significativement la survie sans récidive de la maladie.6 Toutefois, le recul manque encore pour estimer l’impact de ce traitement sur la survie globale, et d’autres études ont rapporté des résultats discordants.
L’immunothérapie adjuvante des cancers du rein reste donc encore un domaine de recherche.
Indications des immunothérapies dans les carcinomes urothéliaux
Une chimiothérapie contenant du platine (cis- ou carboplatine) reste le traitement standard de première ligne des carcinomes urothéliaux métastatiques. Aujourd’hui, l’immunothérapie fait suite à la chimiothérapie.
Après chimiothérapie en situation métastatique
Depuis 2017, le pembrolizumab est un standard en deuxième ligne en cas de progression sous/après chimiothérapie,7 avec un taux de réponse de 21 %, réponse le plus souvent prolongée au-delà de deux ans.
En absence de progression, un traitement d’entretien par avélumab est proposé immédiatement après chimiothérapie ;8 cette stratégie laisse un patient sur cinq indemne de nouvelle progression du cancer après trente mois et améliore la survie globale. Le pembrolizumab et l’avélumab sont actuellement disponibles en France dans leurs indications respectives. Les études randomisées évaluant en première ligne l’immunothérapie seule ou en association concomitante à la chimiothérapie sont en revanche négatives.
Promesses de l’immunothérapie adjuvante ou néo-adjuvante
Pour les stades localisés, le traitement de référence des carcinomes urothéliaux de vessie infiltrant le muscle reste la cystectomie, si possible précédée d’une chimiothérapie néo-adjuvante ; la néphro-urétérectomie est le traitement de référence des carcinomes urothéliaux des voies excrétrices supérieures.
Une étude randomisée a évalué l’intérêt du nivolumab adjuvant pour des carcinomes urothéliaux opérés avec des critères de mauvais pronostic : stade pT3-4 selon la classification TNM (Tumor Node Metastasis) – ou ypT2-4 après chimiothérapie néo-adjuvante – et/ou atteinte ganglionnaire.9 Cette étude est positive en survie sans maladie et, même si davantage de recul semble nécessaire pour évaluer le bénéfice en survie globale, le nivolumab fait actuellement l’objet d’un accès précoce dans cette indication, sous condition d’expression de PD-L1 par au moins 1 % des cellules tumorales en immunohistochimie.
La place de l’immunothérapie néo-adjuvante fait l’objet de nombreuses études, avec des résultats intéressants mais sans données de phase III rapportées à ce jour.
Actuellement, plusieurs études évaluent l’intérêt de l’immunothérapie dans les carcinomes urothéliaux n’infiltrant pasle muscle vésical, en particulier après ou en association avec le BCG intravésical pour les tumeurs à haut risque.
Toxicités et surveillance
Les anti-PD-(L)1 peuvent être responsables de nombreux effets indésirables, qui doivent être dépistés et traités en fonction de leur sévérité (tableau 2).10 Ils surviennent le plus souvent durant les six premiers mois de traitement mais parfois plus tardivement.
Les effets indésirables les plus fréquents sont cutanés, articulaires et thyroïdiens. Ils sont souvent peu sévères et n’imposent pas une interruption de l’immunothérapie ; une substitution par hormones thyroïdiennes – en général à vie – est toutefois nécessaire dans les cas d’hypothyroïdie lésionnelle. La toxicité digestive, généralement révélée par des diarrhées, est également fréquente et ne doit pas être négligée.
Le dépistage clinique – et biologique si nécessaire – des effets indésirables plus rares mais potentiellement graves (pulmonaires, cardiaques, endocriniens, neurologiques, musculaires) est systématique avant chaque administration, et les examens complémentaires nécessaires sont à prescrire sans délai. Ces effets sont plus fréquents et plus précoces avec l’association ipilimumab-nivolumab mais également possibles avec les anti-PD-(L)1 en monothérapie.
Avec les combinaisons d’anti-PD-1 aux antiangiogéniques oraux, certains effets indésirables sont communs aux deux classes thérapeutiques, avec des physiopathologies différentes : troubles cutanés, hypothyroïdie, diarrhées, cytolyse hépatique. L’imputabilité de ces effets indésirables est parfois difficile à établir, et l’interruption du traitement antiangiogénique peut être nécessaire pour les voir régresser, à l’inverse de ceux de l’immunothérapie, qui sont souvent non réversibles sans traitement spécifique. Des explorations précoces (coloscopie, biopsie hépatique) doivent parfois être envisagées pour porter rapidement le diagnostic d’imputabilité en cas de forme sévère.
Le patient doit donc être sensibilisé à signaler tout symptôme nouveau au vu du spectre très étendu des effets indésirables et de leur survenue aléatoire. Un réseau de spécialistes compétents doit être développé par les prescripteurs d’immunothérapie afin de les prendre en charge.
Que dire à vos patients ?
L’immunothérapie est administrée par perfusion intraveineuse courte, une fois toutes les deux à six semaines en fonction des protocoles. Il n’existe pas de durée de traitement consensuelle.
Les effets indésirables immunologiques fréquents incluent des troubles cutanés et articulaires ainsi que des dysthyroïdies. Une surveillance biologique est indispensable. Tout symptôme inhabituel doit faire consulter afin de dépister d’autres toxicités potentiellement sévères.
L’immunothérapie peut permettre des réponses souvent prolongées, parfois complètes.
Que dire à vos patients ?
L’immunothérapie est administrée par perfusion intraveineuse courte, une fois toutes les deux à six semaines en fonction des protocoles. Il n’existe pas de durée de traitement consensuelle.
Les effets indésirables immunologiques fréquents incluent des troubles cutanés et articulaires ainsi que des dysthyroïdies. Une surveillance biologique est indispensable. Tout symptôme inhabituel doit faire consulter afin de dépister d’autres toxicités potentiellement sévères.
L’immunothérapie peut permettre des réponses souvent prolongées, parfois complètes.
2. Motzer RJ, McDermott DF, Escudier B, et al. Conditional survival and long-term efficacy with nivolumab plus ipilimumab versus sunitinib in patients with advanced renal cell carcinoma. Cancer 2022;128(11):2085-97.
3. Rini BI, Plimack ER, Stus V, et al. Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med 2019;380(12):1116-27.
4. Choueiri TK, Powles T, Burotto M, et al. Nivolumab plus Cabozantinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med 2021;384(9):829-41.
5. Motzer R, Alekseev B, Rha SY, et al. Lenvatinib plus Pembrolizumab or Everolimus for Advanced Renal Cell Carcinoma. N Engl J Med 2021;384(14):1289-300.
6. Choueiri TK, Tomczak P, Park SH, et al. Adjuvant Pembrolizumab after Nephrectomy in Renal-Cell Carcinoma. N Engl J Med 2021;385(8):683-94.
7. Bellmunt J, de Wit R, Vaughn DJ, et al. Pembrolizumab as Second-Line Therapy for Advanced Urothelial Carcinoma. N Engl J Med 2017;376(11):1015-26.
8. Powles T, Park SH, Voog E, et al. Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma. N Engl J Med 2020;383(13):1218-30.
9. Bajorin DF, Witjes JA, Gschwend JE, et al. Adjuvant Nivolumab versus Placebo in Muscle-Invasive Urothelial Carcinoma. N Engl J Med 2021;384(22):2102-14.
10. Haanen J, Obeid M, Spain L, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2022;33(12):1217-38.

 Encadrés
Encadrés