Dans les cancers bronchiques non à petites cellules, l’immunothérapie apporte des bénéfices, notamment en termes de survie. Entre indications et limites, la prise en charge des patients a pris un virage décisif.
Le cancer du poumon est l’un des cancers les plus fréquents en France : il s’agit du deuxième cancer chez l’homme (31 231 nouveaux cas en 2018), et du troisième chez la femme (15 132 nouveaux cas en 2018).1 Avec plus de 33 000 décès par an, il arrive en tête des causes de décès par cancer. Quatre-vingts pour cent sont des carcinomes bronchiques non à petites cellules (CBNPC), qui regroupent les adénocarcinomes, les carcinomes épidermoïdes et les carcinomes à grandes cellules. Le CBNPC est considéré comme l’un des cancers les plus sensibles à l’immunothérapie. L’émergence de ces nouveaux traitements, principalement les inhibiteurs de PD-1 et PD-L1, a profondément modifié sa prise en charge, au stade localement avancé comme au stade métastatique.
Des traitements développés à l’origine pour le stade métastatique
Les bloqueurs de point de contrôle immunitaire (immune checkpoint inhibitor, ICI) PD-1/PD-L1 ont d’abord été développés pour les carcinomes bronchiques non à petites cellules métastatiques, après progression sous une première ligne de chimiothérapie. Dans cette indication, l’efficacité de trois ICI a été démontrée : 2 anti PD-1, le nivolumab et le pembrolizumab, et un anti PD-L1 : l’atézolizumab.2 Dans quatre études randomisées, l’immunothérapie a été comparée à la chimiothérapie standard de deuxième ligne, le docétaxel, avec un bénéfice significatif en survie globale (médiane de 9,2 à 13,8 mois avec les ICI contre 6 à 9,6 mois avec le docétaxel). L’immunothérapie était également associée à un meilleur taux de réponse, incluant notamment des réponses prolongées, ainsi qu’à une meilleure tolérance que la chimiothérapie. Dans l’étude évaluant le pembrolizumab, seuls les patients dont les cancers étaient « PD-L1 positifs », c’est-à- dire une expression de PD-L1 par au moins 1 % des cellules tumorales en immunohistochimie sur biopsie, étaient inclus. Les études du nivolumab et de l’atézolizumab incluaient des patients dont les cancers étaient PD-L1 négatifs.
La place du pembrolizumab
Le pembrolizumab a ensuite été validé en première ligne métastatique, en l’absence d’altération moléculaire ciblable. Chez les patients dont le cancer exprime fortement PD-L1 (au moins 50 % des cellules tumorales positives en immunohistochimie), le pembrolizumab en monothérapie apporte un bénéfice en termes de survie sans progression (SSP) par rapport à un traitement standard, un doublet de chimiothérapie à base de sels de platine (SSP médiane de 10,3 contre 6 mois). Ce bénéfice concerne aussi la survie globale médiane, soit 30 mois contre 14,2 mois pour la chimiothérapie.3 L’immunothérapie était également mieux tolérée, avec moins de toxicités de haut grade, soit 27 % de toxicité de grade 3 et plus contre 53 % avec la chimiothérapie. Par la suite, l’association du pembrolizumab à une chimiothérapie à base de sels de platine a été évaluée. Sa supériorité a été démontrée par rapport à un doublet de chimiothérapie seul, que PD-L1 soit exprimé ou non par les cellules tumorales.4,5 Dans le CBNPC non épidermoïde, l’association platine-pémétrexed-pembrolizumab suivie d’un traitement d’entretien de 2 ans par pémétrexed-pembrolizumab était associée à une augmentation significative de la survie sans progression médiane (8,8 contre 4,9 mois) et de la survie globale médiane (22 mois contre 10,7 mois).4
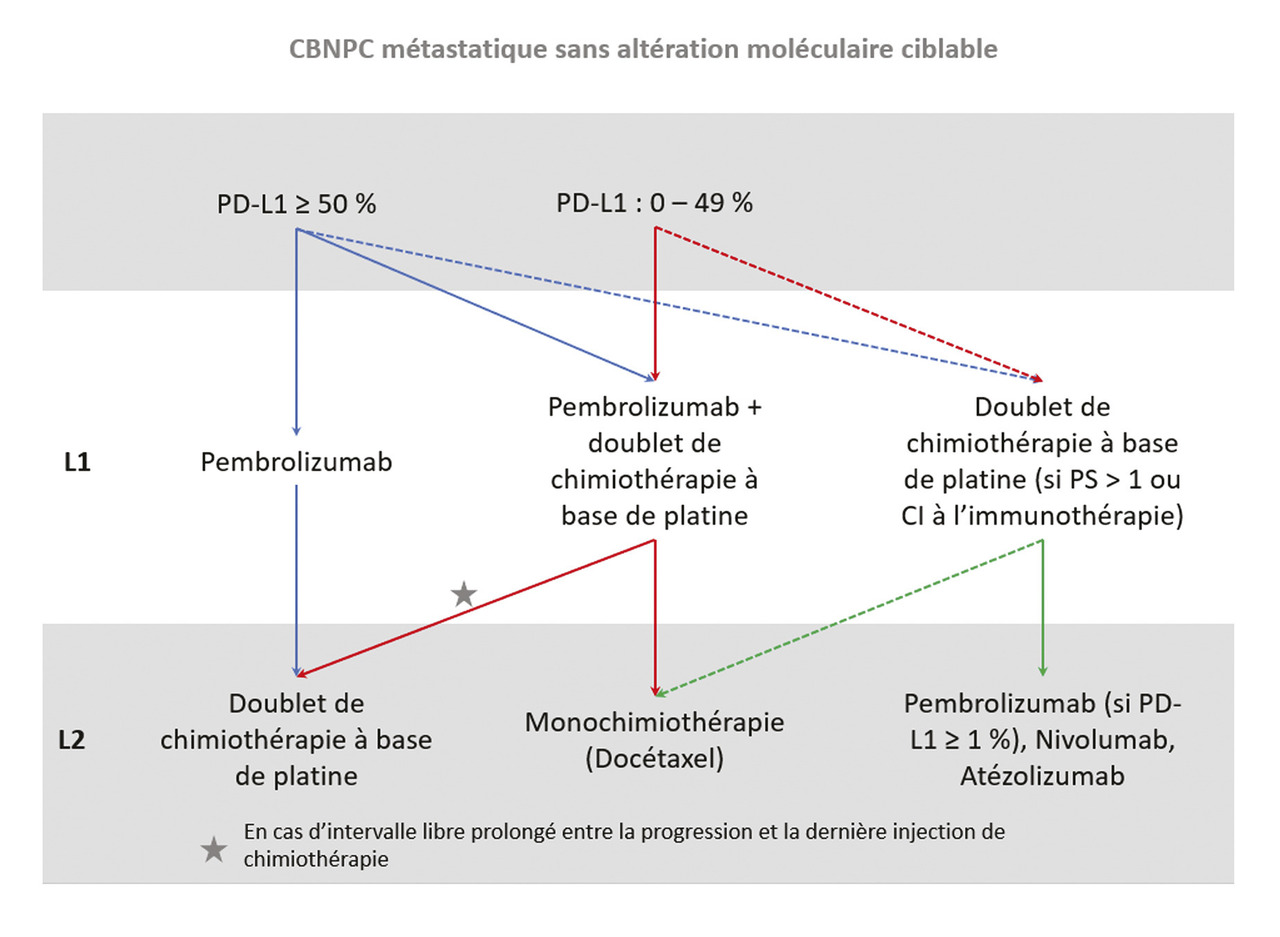
En cas de carcinome épidermoïde, dont le pronostic est plus défavorable, la combinaison carboplatine-taxane-embrolizumab suivie de pembrolizumab en entretien pour, également, une durée totale de 2 ans a, là encore, démontré un bénéfice significatif en SSP (médiane 6,4 contre 4,8 mois) et en survie globale (médiane 15,3 contre 11,9 mois).5 Dans les deux cas, l’ajout de l’immunothérapie à la chimiothérapie n’augmentait pas significativement le nombre de toxicités sévères, qui restaient néanmoins fréquentes (65 % à 70 % de toxicités de grade 3 ou plus). Si l’immunothérapie est désormais toujours proposée, une question persiste pour le sous-groupe des CBNPC exprimant fortement PD-L1 (50 % ou plus) : doit-on utiliser le pembrolizumab seul ou associé à la chimiothérapie, puisque les 2 modalités sont remboursées ? Lafigure résume la prise en charge des CBNPC métastatiques sans altération moléculaire ciblable.
En cas de carcinome épidermoïde, dont le pronostic est plus défavorable, la combinaison carboplatine-taxane-embrolizumab suivie de pembrolizumab en entretien pour, également, une durée totale de 2 ans a, là encore, démontré un bénéfice significatif en SSP (médiane 6,4 contre 4,8 mois) et en survie globale (médiane 15,3 contre 11,9 mois).5 Dans les deux cas, l’ajout de l’immunothérapie à la chimiothérapie n’augmentait pas significativement le nombre de toxicités sévères, qui restaient néanmoins fréquentes (65 % à 70 % de toxicités de grade 3 ou plus). Si l’immunothérapie est désormais toujours proposée, une question persiste pour le sous-groupe des CBNPC exprimant fortement PD-L1 (50 % ou plus) : doit-on utiliser le pembrolizumab seul ou associé à la chimiothérapie, puisque les 2 modalités sont remboursées ? La
Stade localement avancé : quel impact sur la survie ?
En situation de CBNPC localement avancé non résécable chirurgicalement (certains stades IIIA et l’essentiel des stades IIIB), le traitement standard reposait sur une association de radio-chimiothérapie à base de sels de platine. Chez les patients dont la tumeur n’avait pas progressé après la radio-chimiothérapie, un traitement de consolidation par durvalumab pendant un an a été comparé à un placebo, permettant d’améliorer la survie sans progression (16,8 vs 5,6 mois en médiane).6 Le bénéfice en survie globale persiste à long terme : 49,6 % à 4 ans avec le durvalumab contre 36,3 % avec le placebo.7 Avec le durvalumab, une toxicité de haut grade a été observée chez 30 % des patients, versus 26 % avec le placebo après la radio-chimiothérapie.
Stade localisé en péri-opératoire : l’atézolizumab pourrait obtenir une AMM
Le principal traitement des CBNPC de stades I et II, et parfois IIIa, reste la chirurgie, plus ou moins associée à une chimiothérapie adjuvante. Récemment des essais de phase III ont interrogé sur la place d’un traitement par inhibiteur de point de contrôle immunitaire en péri-opératoire. L’association du nivolumab à une chimiothérapie néoadjuvante a induit une augmentation du taux de réponse pathologique complète, ou majeure, lors de la chirurgie, mais ces résultats doivent être nuancés par le pourcentage important de patients non opérés au décours de ce traitement néo-adjuvant.8 En situation adjuvante, un traitement d’entretien par atézolizumab pendant un an après la chimiothérapie adjuvante a apporté un bénéfice en survie sans rechute chez les patients souffrant d’un cancer de stade II à IIIa avec un score PD-L1 ≥ 1 %.9 Ce résultat est issu d’une analyse intermédiaire et les données de survie ne sont pas encore connues. Il pourrait mener prochainement vers une AMM.
Le pronostic global reste réservé
Avec ces différentes indications, l’immunothérapie a radicalement modifié la prise en charge des cancers du poumon, notamment à la phase métastatique en l’absence d’altération moléculaire ciblable. Cependant, hormis pour les patients dont les tumeurs expriment fortement PD-L1, le pronostic de cette maladie reste réservé, avec des survies médianes en première ligne de traitement inférieures à deux ans.
Références
1. SPF. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018 - Tumeurs solides : Étude à partir des registres des cancers du réseau Francim [en ligne]. 2018 [cité le 5 avril 2021]. Disponible sur : https://www.santepubliquefrance.fr
2. ESMO. Clinical Practice Living Guidelines – Metastatic Non-Small-Cell Lung Cancer [en ligne]. 2020 [cité le 17 janvier 2021]. Disponible sur : https://www.esmo.org/guidelines/lung-and-chest-tumours/clinical-practice-living-guidelines-metastatic-non-small-cell-lung-cancer
3. Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csőszi T, Fülöp A, et al. Pembrolizumab versus Chemotherapy for PD-L1–Positive Non–Small-Cell Lung Cancer. N Engl J Med 2016;375:1823-33.
4. Gandhi L, Rodríguez-Abreu D, Gadgeel S, Esteban E, Felip E, De Angelis F, et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med 2018;378:2078–92.
5. Paz-Ares L, Luft A, Vicente D, Tafreshi A, Gümüş M, Mazières J, et al. Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer. N Engl J Med 2018;379:2040-51.
6. Antonia SJ, Villegas A, Daniel D, Vicente D, Murakami S, Hui R, et al. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med 2017;377:1919–29.
7. Faivre-Finn C, Vicente D, Kurata T, Planchard D, Paz-Ares L, Vansteenkiste JF, et al. Four-Year Survival With Durvalumab After Chemoradiotherapy in Stage III NSCLC-an Update From the PACIFIC Trial. J Thorac Oncol 2021;16:860–7.
8. Goodman A. The ASCO Post. Neoadjuvant Nivolumab Plus Chemotherapy Boosts Pathologic Complete Response in Resectable NSCLC [en ligne]. 2021 [cité le 9 octobre 2021]. Disponible sur : https://ascopost.com/issues/may-10-2021/neoadjuvant-nivolumab-plus-chemotherapy-boosts-pathologic-complete-response-in-resectable-nsclc
9. Felip E, Altorki N, Zhou C, Csőszi T, Vynnychenko I, Goloborodko O, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet 2021;398:1344-57.
2. ESMO. Clinical Practice Living Guidelines – Metastatic Non-Small-Cell Lung Cancer [en ligne]. 2020 [cité le 17 janvier 2021]. Disponible sur : https://www.esmo.org/guidelines/lung-and-chest-tumours/clinical-practice-living-guidelines-metastatic-non-small-cell-lung-cancer
3. Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csőszi T, Fülöp A, et al. Pembrolizumab versus Chemotherapy for PD-L1–Positive Non–Small-Cell Lung Cancer. N Engl J Med 2016;375:1823-33.
4. Gandhi L, Rodríguez-Abreu D, Gadgeel S, Esteban E, Felip E, De Angelis F, et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med 2018;378:2078–92.
5. Paz-Ares L, Luft A, Vicente D, Tafreshi A, Gümüş M, Mazières J, et al. Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer. N Engl J Med 2018;379:2040-51.
6. Antonia SJ, Villegas A, Daniel D, Vicente D, Murakami S, Hui R, et al. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med 2017;377:1919–29.
7. Faivre-Finn C, Vicente D, Kurata T, Planchard D, Paz-Ares L, Vansteenkiste JF, et al. Four-Year Survival With Durvalumab After Chemoradiotherapy in Stage III NSCLC-an Update From the PACIFIC Trial. J Thorac Oncol 2021;16:860–7.
8. Goodman A. The ASCO Post. Neoadjuvant Nivolumab Plus Chemotherapy Boosts Pathologic Complete Response in Resectable NSCLC [en ligne]. 2021 [cité le 9 octobre 2021]. Disponible sur : https://ascopost.com/issues/may-10-2021/neoadjuvant-nivolumab-plus-chemotherapy-boosts-pathologic-complete-response-in-resectable-nsclc
9. Felip E, Altorki N, Zhou C, Csőszi T, Vynnychenko I, Goloborodko O, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet 2021;398:1344-57.