Le mode de vie de l’homme a profondément modifié l’environnement. Chaque jour, nous sommes responsables de la production, de l’utilisation et du relargage de nombreuses molécules dans notre environnement proche. Si ces produits du quotidien nous paraissent pour la plupart essentiels, ils peuvent aussi renfermer un certain nombre de composants plus ou moins toxiques… pour nous-mêmes d’abord, mais aussi pour l’environnement au sens large et les écosystèmes qui nous entourent.
Le terme « perturbateurs endocriniens » (PE) désigne des molécules exogènes à l’organisme pouvant mimer ou bloquer l’action des hormones endogènes naturelles. Ils sont maintenant bien connus du grand public, souvent même plus que des professionnels de santé, qui n’ont pas abordé cette notion dans le cadre de leur formation initiale. Pourtant, les premiers effets néfastes de la contamination chimique industrielle sur l’appareil reproducteur, et plus particulièrement sur la fertilité, ont été rapportés dans de nombreuses espèces animales (oiseaux, visons, panthères, alligators, ours polaires…) il y a près de soixante ans par Rachel Carson. Certains auteurs et scientifiques ont d’abord considéré ces observations comme « isolées », ou plus souvent limitées aux animaux, sans corrélation possible avec l’espèce humaine. Or, force est de constater que l’incidence de l’infertilité, et donc le recours à l’assistance médicale à la procréation (AMP), ont augmenté. Phénomène de mode, diront certains ! Ce n’est pas si sûr…
Comment évolue la fertilité masculine ?
La qualité et la quantité spermatiques ne cessent de diminuer depuis la Seconde Guerre mondiale. Plusieurs travaux épidémiologiques ont bien illustré ce déclin séculaire, qui concerne toutes les populations, mais particulièrement celles des pays industrialisés.
Risque chimique : les perturbateurs endocriniens, premiers incriminés
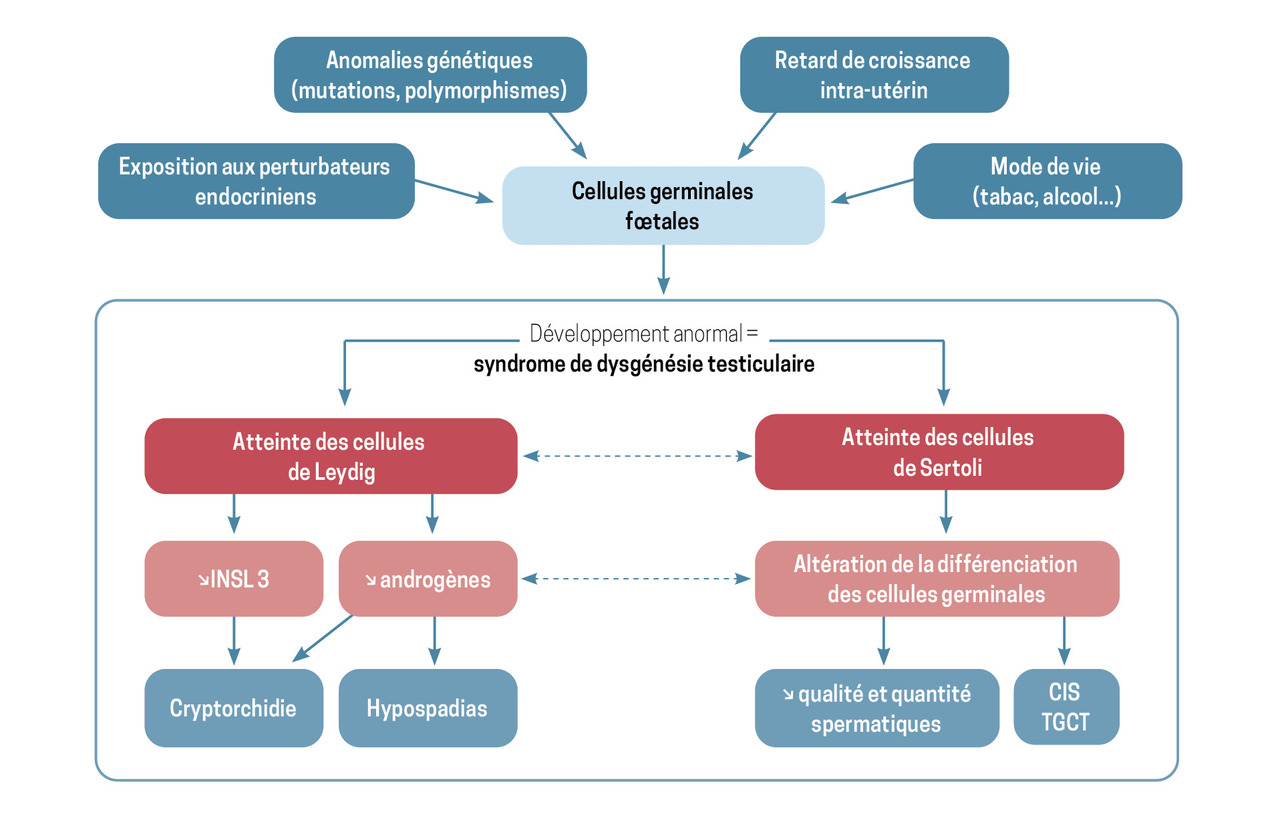
Très tôt, Niels Skakkebæk a émis l’hypothèse du syndrome de dysgénésie testiculaire (SDT), selon laquelle les anomalies observées (hypofertilité et malformations du tractus génital mâle, comme la cryptorchidie et l’hypospadias) seraient liées à une déprogrammation des cellules souches fœtales.1 L’exposition, pendant la grossesse, à des molécules à activité antiandrogénique ou estrogénique issues de notre environnement pourrait en être la cause (
D’une manière générale, même si l’existence du SDT ne fait quasiment plus aucun doute comme entité clinique, les mécanismes physiopathologiques impliqués dans sa survenue sont encore imparfaitement compris. Le rôle des facteurs de l’environnement, parmi lesquels les PE arrivent au premier rang, paraît majeur : notamment ceux à activité estrogénomimétique (bisphénol A, dérivés du dichlorodiphényltrichloroéthane [DDT]) ou antiandrogéniques (phtalates).1
À ce jour – en dehors des pays scandinaves, qui tiennent des registres de santé détaillés depuis plusieurs décennies –, la prévalence exacte du SDT à travers le monde est difficile à établir (2 à 9 % pour la cryptorchidie ; 0,2 à 1 % pour l’hypospadias). En Europe, la prévalence suit un gradient centrifuge, dont l’épicentre est situé au Danemark. La France n’échappe pas à cette évolution, puisque le nombre moyen de spermatozoïdes diminue de 1,9 % chaque année ;3 cette tendance est souvent associée à l’augmentation du recours à l’AMP pour cette indication (qu’elle soit isolée ou associée à une infertilité féminine).4
Des causes environnementales et individuelles probablement associées
Au-delà du risque chimique majoritairement représenté par les PE (compte tenu de l’homologie structurale de certaines de ces molécules avec notre système hormonal endogène), de nouvelles données mettent en jeu d’autres acteurs environnementaux potentiels.
Parmi eux, la pollution atmosphérique (par inhalation de certains produits chimiques), la pollution sonore (en périodes nocturnes et dont le mécanisme physiopathologique reste à déterminer), les nanoparticules (se retrouvant dans le tissu testiculaire, susceptibles éventuellement d’altérer plus ou moins profondément la spermatogenèse), les ondes électromagnétiques (de possibles effets, directs par le stress oxydant et/ou indirects par l’augmentation de la température scrotale, ont été évoqués) sont autant de facteurs pouvant potentiellement expliquer cette baisse de fertilité masculine. La liste ne cesse de s’allonger.
Il faut également prendre en compte les effets de l’environnement propre au patient : l’obésité peut notamment être à l’origine d’un hypogonadisme (en raison de l’aromatisation des androgènes en estrogènes dans le tissu adipeux) et d’une hypofertilité (secondaire à cet hypogonadisme et par augmentation de température scrotale) ; ces phénomènes sont réversibles après la perte pondérale.5
Fertilité féminine : à l’épreuve de l’environnement
Si les données chez l’homme sont illustratives et ont rapidement inquiété la sphère scientifique, ce n’est pas forcément le cas pour les femmes, en dehors du cas tragique du Distilbène, responsable de malformations utérines, d’infertilité et d’adénocarcinome du vagin.2
Déclin de la fertilité féminine : rôle des PE d’abord négligé
Les PE ayant essentiellement une activité estrogénomimétique, les premières observations ont fait état d’une élévation manifeste de la fréquence de pubertés précoces ou avancées (notamment dans des régions géographiques particulièrement exposées : autour d’exploitations agricoles et viticoles utilisatrices de PE)6 et surtout d’une augmentation des conséquences d’une hyperestrogénie prolongée (cancers hormonodépendants, dont celui du sein).
Dans la même période, la fertilité féminine a subi un déclin plus important que celui rapporté pour le sexe masculin, mais souvent attribué à la « révolution » féminine (études plus longues, postes professionnels à responsabilité, contrôle volontaire du nombre de naissances). L’hypothèse d’un rôle associé de l’environnement (et donc des PE) n’a été que secondairement évoquée, même si des données épidémiologiques anciennes montraient déjà que les patientes avec les taux sanguins les plus élevés en PE (notamment d’insecticides et pesticides organochlorés) mettaient plus de temps à concevoir que les autres et/ou avaient une surincidence de fausses couches spontanées.7,8
Environnement : cause première ?
Parmi les causes d’infertilité féminine, les centres d’AMP se sont surtout intéressés au syndrome des ovaires polykystiques (SOPK). Néanmoins, certains auteurs ont rapporté – exclusivement dans des études cas-témoins (souvent critiquées pour leur méthodologie) – que les patientes atteintes de SOPK avaient des taux plasmatiques et/ou urinaires plus élevés de PE, notamment de bisphénol A (et plus récemment de phtalates). L’imprégnation majorée en PE apparaît corrélée, chez ces patientes, à la survenue de troubles métaboliques (syndrome métabolique, diabète de type 2, hypertension artérielle) et à l’intensité de l’hyperandrogénie clinique.9
Une des explications possibles, et plausibles, du déclin de la fertilité féminine est l’altération du pool d’ovocytes, qui n’est pas renouvelable, contrairement aux gamètes masculins. Cela a d’ailleurs été montré pour un certain nombre de substances bien connues comme le tabac, responsable d’un risque doublé d’infertilité et d’une diminution accélérée du capital folliculaire ovarien,10 notamment par les composants retrouvés dans la fumée (benzopyrènes et certains métaux lourds, par exemple le cadmium), ou comme le toluène et les nonylphénols, utilisés de manière professionnelle.8 Les mécanismes impliqués ne sont pas clairement déterminés à ce jour, mais il est possible que des modifications de méthylation de l’ADN (et donc de l’épigénome) soient en cause, comme cela a été récemment rapporté dans une étude sur des souris pour le chlordécone – PE malheureusement bien connu dans les Antilles françaises.11
Plus récemment, une autre pathologie pouvant être reliée à l’environnement a été évoquée : l’endométriose. Des modèles murins ont été développés, permettant de reproduire cette pathologie par imprégnation durant la vie in utero de dioxines, de certains polychlorobiphényls [PCB] de phtalates et de bisphénol A (
Comment lutter efficacement contre les effets des PE ?
À ce jour, s’il est probablement illusoire d’espérer éliminer tous les PE de notre environnement, il paraît essentiel d’en limiter l’exposition, en particulier dans des périodes à risque (dites « critiques ») : en préconceptionnel, durant la grossesse (en raison du passage placentaire et de la programmation fœtale) et le très jeune âge (avant 3 ans), où les mécanismes de détoxification hépatique ne sont pas totalement matures. Cette période de plus grande vulnérabilité correspond à celle dite « des mille premiers jours ».
Modifier son mode de vie et de consommation
Parmi les mesures pouvant limiter l’exposition aux PE (
– bannir le tabagisme (actif et passif) ;
– éviter au maximum de consommer des aliments en boîtes de conserve et récipients recouverts de plastique contenant du bisphénol A ou un de ses substituts ;
– ne pas chauffer les éléments en plastique pour éviter le relargage de molécules libres directement dans les aliments ;
– avoir une alimentation équilibrée, si possible issue de l’agriculture biologique, qui permet de limiter la charge globale en polluants, et bien laver les fruits et légumes avant consommation ;
– limiter au minimum l’utilisation de produits cosmétiques ;
– bannir l’utilisation des pesticides et des insecticides ;
– éviter de repeindre la chambre du futur bébé pendant la grossesse ;
– éviter les contacts avec les zones les plus fortement exposées aux PE, notamment les zones agricoles et viticoles.
Rôle du professionnel de santé : prévenir et orienter
Ces messages, finalement simples et généralistes, doivent être délivrés dans un climat d’apaisement et de réassurance. Le professionnel de santé peut orienter son patient vers des sites d’information spécialisés, dont certains émanent d’autorités de tutelle (https://www.1000-premiers-jours.fr/fr) ou de certaines unions régionales des professionnels de santé (https://www.urps-ml-paca.org/dispositif-paerpa-territoire-var-2/). Des plateformes régionales proposent par ailleurs des ateliers pédagogiques d’information et d’éducation à la santé, ainsi que des consultations préconceptionnelles dédiées pour limiter l’exposition aux PE du couple et de la famille en devenir.
Dans un futur proche, la loi AGEC (anti-gaspillage pour une économie circulaire) prévoit en outre l’étiquetage d’un certain nombre de produits d’usage quotidien (denrées alimentaires, cosmétiques) pour alerter le grand public de leur teneur en PE avérés et suspectés, le but étant d’améliorer l’état de santé de la population et des générations futures.
L’idéal pour un clinicien serait de pouvoir disposer également de biomarqueurs d’exposition faciles à doser afin de quantifier à la fois la durée et l’intensité de l’exposition, et pouvoir ainsi personnaliser les conseils et éventuellement la prise en charge de chaque patient. L’histoire n’est donc pas terminée…
Que dire à vos patients ?
L’élimination de tous les perturbateurs endocriniens n’est pas possible, mais des gestes simples permettent d’en diminuer fortement l’exposition quotidienne : ne pas utiliser de plastique, limiter l’utilisation de cosmétiques, privilégier une alimentation biologique…
Les mesures doivent s’étendre de la période préconceptionnelle à la petite enfance (3 ans au moins) et concerner toute la famille.
Des sites d’information dédiés validés contiennent des conseils accessibles au grand public : https://www.1000-premiers-jours.fr/fr ; https://www.urps-ml-paca.org/dispositif-paerpa-territoire-var-2/
Certaines plateformes régionales ont mis en place des documents de support, des ateliers pédagogiques et des consultations préconceptionnelles dédiées.
1. Skakkebaek NE, Lindahl-Jacobsen R, Levine H, et al. Environmental factors in declining human fertility. Nat Rev Endocrinol 2022;18(3):139-57.
2. Fenichel P, Brucker-Davis F, Chevalier N. The history of Distilbene (diethylstilbestrol) told to grandchildren the transgenerational effect. Ann Endocrinol (Paris) 2015;76(3):253-9.
3. Rolland M, Le Moal J, Wagner V, et al. Decline in semen concentration and morphology in a sample of 26,609 men close to general population between 1989 and 2005 in France. Hum Reprod 2013;28(2):462-70.
4. Choy JT, Eisenberg ML. Male infertility as a window to health. Fertil Steril 2018;110(5):810-4.
5. Leisegang K, Sengupta P, Agarwal A, et al. Obesity and male infertility: Mechanisms and management. Andrologia 2021;53(1):e13617.
6. Lopez-Rodriguez D, Franssen D, Heger S, et al. Endocrine-disrupting chemicals and their effects on puberty. Best Pract Res Clin Endocrinol Metab 2021;35(5):101579.
7. Cohn BA, Cirillo PM, Wolff MS, et al. DDT and DDE exposure in mothers and time to pregnancy in daughters. Lancet 2003;361(9376):2205-6.
8. Rattan S, Zhou C, Chiang C, et al. Exposure to endocrine disruptors during adulthood: consequences for female fertility. J Endocrinol 2017;233(3):R109-129.
9. Palioura E, Diamanti-Kandarakis E. Polycystic ovary syndrome (PCOS) and endocrine disrupting chemicals (EDCs). Rev Endocr Metab Disord 2015;16(4):365-71.
10. Sadeu JC, Hughes CL, Agarwal S, et al. Alcohol, drugs, caffeine, tobacco, and environmental contaminant exposure: reproductive health consequences and clinical implications. Crit Rev Toxicol 2010;40(7):633-52.
11. Legoff L, Dali O, D’Cruz SC, et al. Ovarian dysfunction following prenatal exposure to an insecticide, chlordecone, associates with altered epigenetic features. Epigenetics & Chromatin 2019;12(1):29.
12. Rumph JT, Stephens VR, Archibong AE, et al. Environmental Endocrine Disruptors and Endometriosis. Adv Anat Embryol Cell Biol 2020;232:57-78.

 Encadrés
Encadrés