Malgré son impact significatif sur la qualité de vie, c’est un handicap jugé honteux par les malades et ignoré des médecins.1 Le coût socio-économique n’est pas négligeable, surtout si une chirurgie est envisagée ; l’IA serait même un facteur de risque d’entrée en institution.
On distingue l’IA fonctionnelle, répondant aux critères de Rome (encadré 1) de celle organique secondaire à une cause identifiable. Principaux facteurs de risque : âge, sexe féminin, tabagisme, diabète, diarrhée chronique (ou ≥ 3 selles molles/j), sédentarité, obésité, alitement, incontinence urinaire associée, comorbidités chroniques notamment neurologiques, antécédents de cholécystectomie, d’accouchement traumatique et de chirurgie ano-rectale.2
à cela s’ajoutent de multiples situations pathologiques ou iatrogènes dont l’IA peut être une complication (encadré 2) ; les deux causes principales sont les traumatismes obstétricaux (rupture sphinctérienne et/ou neuropathie d’étirement après accouchement par voie basse) et les séquelles de chirurgie ano-rectale (atteinte du sphincter [fistulotomie], de l’innervation ou du réservoir rectal [proctectomie]).
En cas d’IA secondaire, l’idéal est de traiter la cause mais cela n’est pas toujours possible...
Un diagnostic clinique
L’examen proctologique est réalisé en position genu-pectorale, en décubitus latéral ou dorsal, voire accroupi (pour rechercher un prolapsus rectal) : inspection de la marge anale (cicatrice, déformation, prolapsus hémorroïdaire interne irréductible ou rectal), toucher ano-rectal (évaluation du tonus sphinctérien, présence de selles), anuscopie et/ou rectoscopie rigide. Un examen neurologique est parfois utile (anesthésie en selle).
Explorations : pas en 1re intention
La manométrie ano-rectale apprécie le tonus sphinctérien (repos et contraction volontaire), la compliance et la sensibilité du rectum. Enfin, l’imagerie pelvienne dynamique – colpocystodéfécographie et déféco-IRM – recherche un trouble de la statique pelvienne (prolapsus rectal interne, rectocèle).
Aucune de ces explorations n’est indiquée d’emblée.3 En effet, les résultats ne modifient pas ou peu la prise en charge initiale. Seule une coloscopie de dépistage doit être proposée en cas de signes d’alerte (antécédents personnels ou familiaux de polype ou de tumeur colique, rectorragies, troubles du transit récents), afin de ne pas méconnaître une pathologie sous-jacente : cancer colorectal, maladie inflammatoire…
Prise en charge : d’abord médicale
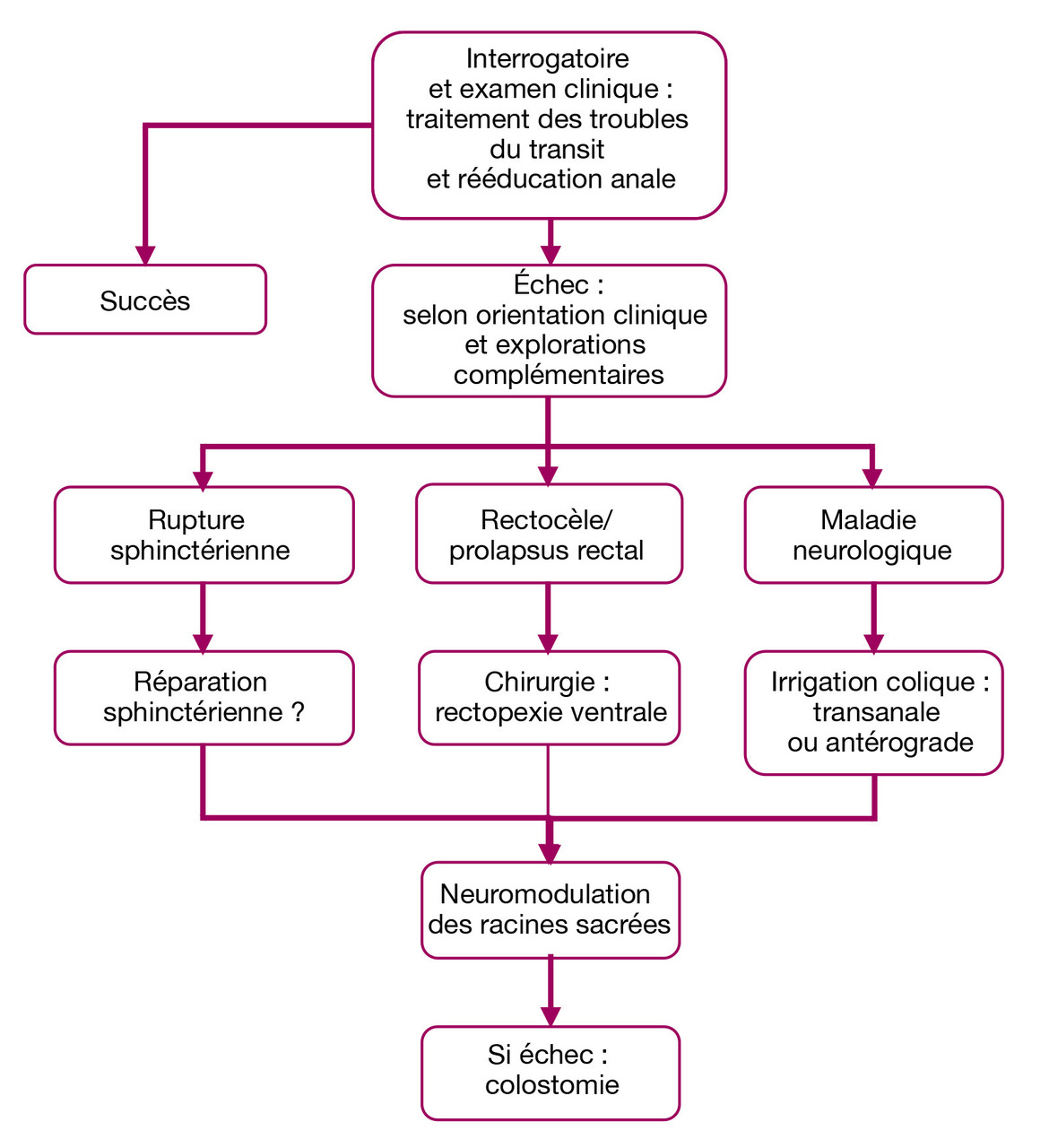
Si les symptômes persistent, une rééducation anale est proposée,5 le plus souvent par biofeedback (au moins 10 séances avant d’en évaluer l’efficacité). Le bénéfice de sa poursuite à long terme (entretien) est à préciser. En cas d’échec, les examens complémentaires guident le traitement de deuxième ligne (fig. 1).
Une rupture sphinctérienne récente et significative à l’échographie endo-anale, par exemple après un accouchement compliqué d’une déchirure périnéale, peut être réparée par sphinctérorraphie.5 Toutefois, les résultats se dégradent avec le temps. Les autres techniques visant à renforcer l’appareil sphinctérien (graciloplastie dynamisée, sphincter anal artificiel ou magnétique) sont abandonnées.
En cas de trouble de la statique rectale (rectocèle, prolapsus rectal), la rectopexie ventrale par voie cœlioscopique consiste à fixer 1 ou 2 bandelettes (synthétiques le plus souvent ou biologiques) sur la face antérieure du bas rectum et à en attacher la partie supérieure sur le ligament prévertébral, devant le promontoire.
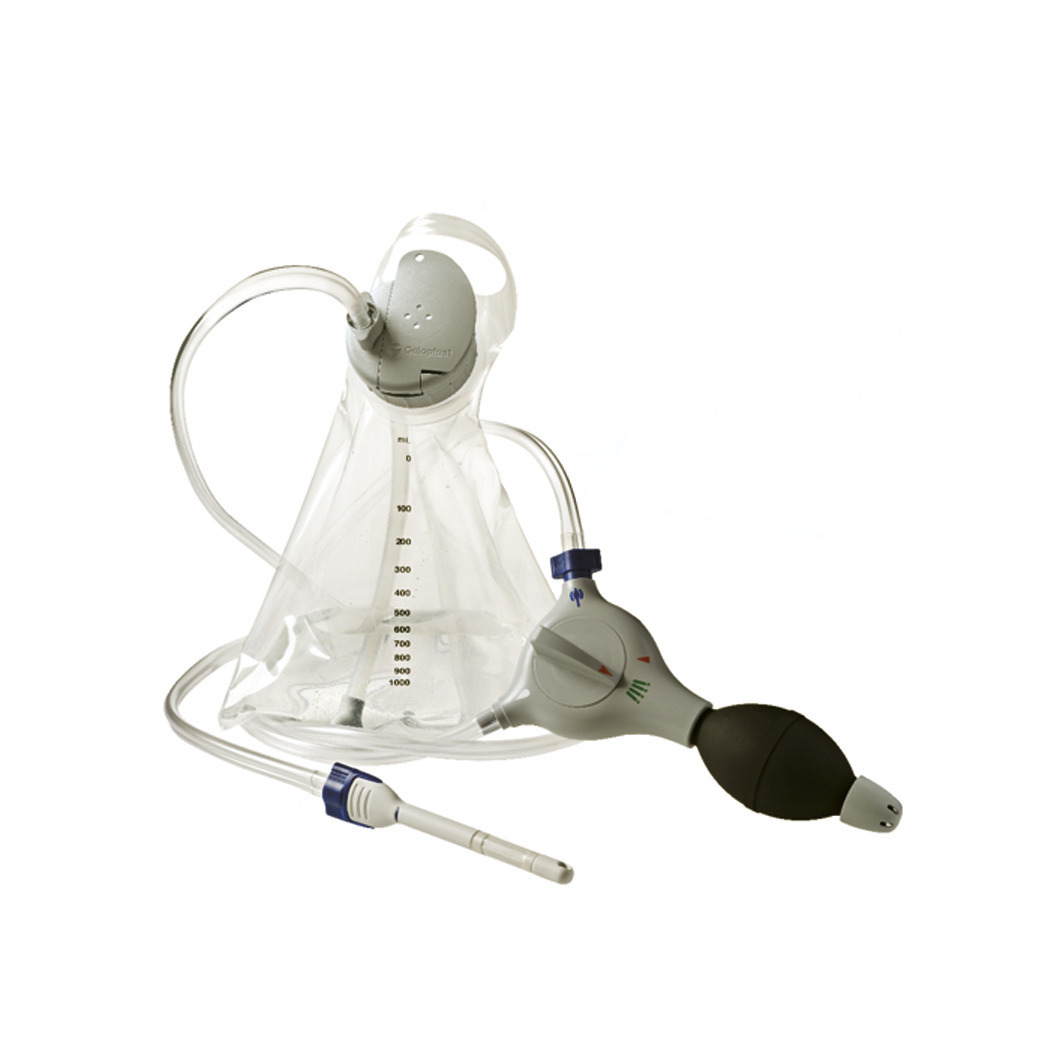
Enfin, dans l’IA d’origine neurologique avec constipation associée, les techniques d’irrigation colique, par exemple avec le Peristeen, sont proposées en deuxième intention :5 les lavements rétrogrades, à raison de 2 à 3 fois par semaine, assurent la vacuité du côlon gauche réduisant la fuite de selles ; après apprentissage (par une infirmière), le patient peut les réaliser lui-même à l’aide d’un appareillage spécifique (fig. 2).
Elles sont contre-indiquées en cas de maladie inflammatoire chronique de l’intestin, de sténose ou de diverticulite.
Dans des indications particulières, les techniques antérogrades permettant de vidanger l’ensemble du côlon (intervention de Malone : mini-stomie trans-appendiculaire ou trans-iléale ; cæcostomie endoscopique) sont discutées avant d’envisager une colo-stomie définitive.
Neuromodulation des racines sacrées
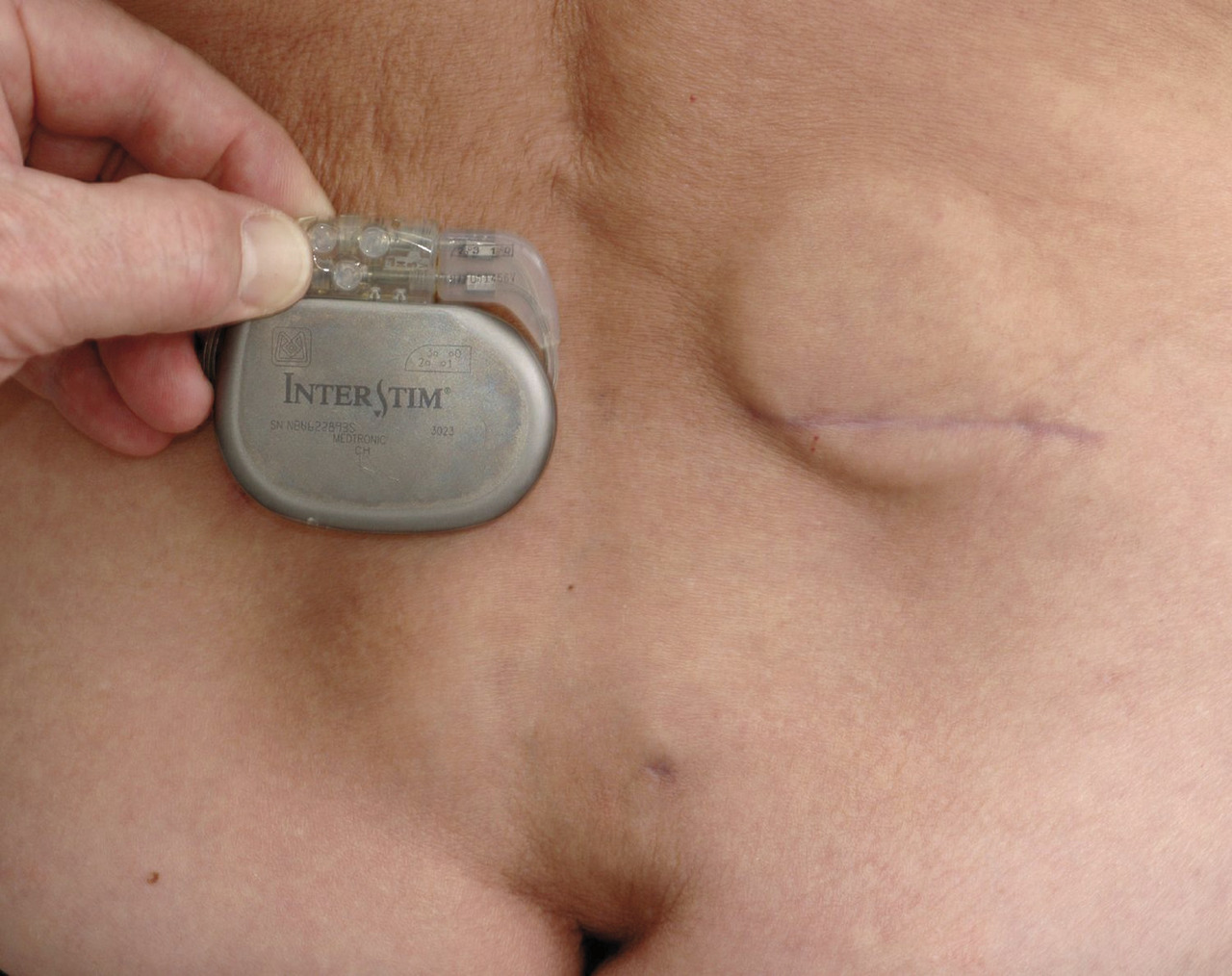
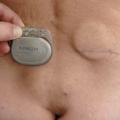
Après une phase de test avec un dispositif temporaire,6 en cas de réponse positive (réduction d’au moins 50 % du nombre de fuites) l’électrode est implantée de façon définitive en sous-cutané dans le quadrant supéro-externe de la fesse (fig. 3). Son mode d’action n’est pas complètement compris : la neuromodulation agirait sur la contraction sphinctérienne mais aussi sur la motricité colique, la sensibilité du rectum et sur la réponse corticale à la sensation de besoin. On obtient une amélioration durable chez 8 patients sur 10 implantés définitivement, soit environ 1 sujet sur 2 initialement éligible (en tenant compte des échecs de la phase test).6 Que proposer à l’autre moitié des malades ? à ce jour, seule la colostomie est une option validée. Bien que son impact psychologique soit important, elle peut améliorer la qualité de vie de certains malades.3
De nouveaux traitements sont en cours d’étude, tels que la radiofréquence anale et les agents de comblement.
La radiofréquence anale consiste à délivrer via une sonde une énergie tissulaire au niveau de la muqueuse du canal anal afin de créer une fibrose rétractile.
Les agents de comblements (silicone, microspores, acide hyaluronique…) sont injectés sous la muqueuse anale ou dans l’espace inter-sphinctérien. Ils visent à augmenter la pression de repos du canal anal.
Cependant, les preuves de leur efficacité manquent encore et ils ne sont à ce jour pas recommandés en pratique courante.
1. IA fonctionnelle : critères de Rome III
• Un fonctionnement anormal de muscles normalement innervés et structurellement intacts.
• Et/ou l’absence d’anomalies du sphincter anal et de son innervation ou la présence d’anomalies mineures ne pouvant à elles seules expliquer l’incontinence.
• Et/ou un transit normal ou, au contraire, des diarrhées ou une constipation.
• Et/ou des causes psychologiques.
2. de nombreuses étiologies
Gastro-entérologiques
Troubles du transit : diarrhée et/ou constipation chronique, fécalome ; syndrome de l’intestin irritable ; MICI ; rectite radique ; tumeur rectale ou du canal anal.
Diabète ; sclérose en plaques ; lésions de la moelle épinière ; AVC ; démence ; collagénoses (sclérodermie, dermatomyosite, amylose).
Cholécystectomie ; chirurgie anorectale (sphinctérotomie, fistulo- tomie, hémorroïdectomie, proctectomie, etc.) ; colectomie avec anastomose iléo-anale ou iléorectale, résection iléocæcale.
Accouchement par voie basse surtout en cas de multiparité, ou traumatique (extraction instrumentale, déchirure périnéale, épisiotomie médiane, durée d’expulsion > 60 min, poids du bébé > 4 kg, dystocie des épaules, présentation occipito-postérieure).
Rectocèle ; prolapsus rectal.
Metformine, colchicine, psychotrope, opiacés, cocaïne, etc.
2. Bharucha AE, Dunivan G, Goode PS, et al. Epidemiology, pathophysiology, and classification of fecal incontinence: State of the Science Summary for the NIDDK Workshop. Am J Gastroenterol 2015;110:127-36.
3. Wald A, Bharucha AE, Cosman BC, Whitehead WE. ACG clinical guideline: management of benign anorectal disorders. Am J Gastroenterol 2014;109: 1141-57.
4. Bharucha A, Wald A, Enck P, Rao S. Functional anorectal disorders. Gastroenterology 2006;130: 1510-8.
5. Vitton V, Soudan D, Siproudhis L, et al. Treatments of faecal incontinence: recommendations from the French national society of coloprocto-logy. Colorectal Dis 2014;16:159-66.
6. Fathallah N, Loriau J, Pillant-Le Moult H, et al. La neuromodulation sacrée dans l’incontinence fécale : le changement, c’est maintenant... Hépato- Gastro & Oncol Digest 2016;23:861-8.

 Encadrés
Encadrés