objectifs
Diagnostiquer et traiter une infection aiguë des parties molles (abcès, panaris, phlegmon des gaines).
Identifier les situations d’urgence et celles nécessitant une hospitalisation, initier la prise en charge.
Diagnostiquer et traiter une infection aiguë des parties molles (abcès, panaris, phlegmon des gaines).
Identifier les situations d’urgence et celles nécessitant une hospitalisation, initier la prise en charge.
Par leur fréquence et leur gravité, les infections des parties molles relèvent le plus souvent d’un traitement chirurgical en urgence. Malgré leur apparente bénignité, elles ne doivent pas être sous-estimées car elles sont parfois à l’origine de séquelles importantes si la prise en charge n’est pas adéquate et rapide. Un suivi régulier et précoce du patient est indispensable pour vérifier l’évolution vers la guérison et dépister la survenue de complications.
Physiopathologie
Le revêtement cutané a une double fonction bactériologique :
L’infection cutanée fait suite à une inoculation septique directe après brèche cutanée dans la plupart des cas. Son développement obéit à un cycle évolutif constant :
Le tabagisme diminue massivement l’afflux sanguin au niveau de la main, réduit l’apport des antibiotiques et prédispose à la nécrose tissulaire.
- une fonction mécanique de barrière étanche s’opposant à la pénétration des agents infectieux se multipliant à sa surface ;
- l’autre symbiotique, accueillant à sa surface des agents infectieux nombreux et variés. Les agents infectieux saprophytes, résidents de la peau, sont tous de type Gram positif, tels que Staphylococcus à coagulase négative (dit « staphylocoque blanc ») et du genre Corynebacterium.
L’infection cutanée fait suite à une inoculation septique directe après brèche cutanée dans la plupart des cas. Son développement obéit à un cycle évolutif constant :
- une phase d’invasion qui sélectionnera, parmi la population microbienne introduite sous la peau, des germes pathogènes privilégiant en général Staphylococcus aureus ou Streptococcus pyogenes ;
- un stade phlegmasique, s’accompagnant de signes inflammatoires locaux (rougeur, chaleur, œdème) sans fièvre, et marqué par une douleur intense non insomniante. Cette phase est encore spontanément réversible et accessible au traitement médical ;
- un stade de collection qui correspond à la limitation dans l’espace du processus infectieux par la réaction de l’hôte conduisant à l’abcédation. La douleur pulsatile et insomniante pouvant s’accompagner de signes régionaux (lymphangite, adénopathie) et généraux (fièvre) signe la collection, qui impose une mise à plat chirurgicale ;
- un stade de complication avec évacuation spontanée du pus soit à la peau (fistulisation), soit en profondeur (articulation, gaine synoviale, ligament, aponévrose).
- une immunodépression (traitements immunosuppresseurs, infection VIH, déficit immunitaire, cancer) ;
- le diabète déséquilibré ;
- l’usage d’anti-inflammatoires non stéroïdiens ou de corticoïdes ;
- la toxicomanie intraveineuse.
Le tabagisme diminue massivement l’afflux sanguin au niveau de la main, réduit l’apport des antibiotiques et prédispose à la nécrose tissulaire.
Bactéries
Trois fois sur quatre, il s’agit d’infections monobactériennes, mais dans un quart des cas plusieurs germes sont impliqués.
Staphylococcus aureus, 50 % des cas
Quel que soit le tableau clinique, c’est la bactérie la plus souvent isolée, que ce soit dans des prélèvements locaux ou des hémocultures. Il existe des souches particulières responsables de petites épidémies (interindividus, parfois familiales) et d’infections cutanées graves, qui sont liées à la production de toxines telles que la leucocidine de Panton-Valentine. Elles sont associées à la formation de nécrose purulente sur la peau et plus rarement dans le poumon (pneumopathie nécrosante).
Les deux mécanismes de résistance acquis de Staphylococcus aureus sont la sécrétion de pénicillinase, qui la rend résistante à l’amoxicilline, et la production d’une protéine liant la pénicilline de faible affinité pour les bêtalactamines (PLP2a), qui la rend résistante à toutes les bêtalactamines. La prévalence des souches résistantes à l’amoxicilline est > 90 %, tandis que la prévalence de la résistance à la méticilline (SARM) est < 5 % en France en communauté.
Les deux mécanismes de résistance acquis de Staphylococcus aureus sont la sécrétion de pénicillinase, qui la rend résistante à l’amoxicilline, et la production d’une protéine liant la pénicilline de faible affinité pour les bêtalactamines (PLP2a), qui la rend résistante à toutes les bêtalactamines. La prévalence des souches résistantes à l’amoxicilline est > 90 %, tandis que la prévalence de la résistance à la méticilline (SARM) est < 5 % en France en communauté.
Streptocoques (environ 10 % des cas)
Il s’agit en particulier de Streptococcus pyogenes (ou streptocoque bêta-hémolytique du groupe A).
Contrairement à Staphylococcus aureus, les streptocoques bêta- hémolytiques n’ont pas développé de mécanisme de résistance à l’amoxicilline, à laquelle ils sont systématiquement sensibles. Certaines souches sont responsables d’une diffusion tissulaire rapide et nécrotique de l’infection secondaire à la production d’enzymes (hyaluronidase, streptokinase, hémolysine).
Contrairement à Staphylococcus aureus, les streptocoques bêta- hémolytiques n’ont pas développé de mécanisme de résistance à l’amoxicilline, à laquelle ils sont systématiquement sensibles. Certaines souches sont responsables d’une diffusion tissulaire rapide et nécrotique de l’infection secondaire à la production d’enzymes (hyaluronidase, streptokinase, hémolysine).
Autres
Les autres bactéries incriminées sont :
- les bacilles à Gram négatif ;
- Pasteurella multocida (agent de la pasteurellose) et Capnocytophaga spp. sont également des bacilles à Gram négatif, mais rencontrées exclusivement après morsure animale ;
- les mycobactéries, qui imposent des cultures prolongées sur milieu spécifique tels que Mycobacterium tuberculosis et Mycobacterium marinum (responsable de surinfection de plaie par eau d’aquarium contaminée).
Différentes formes cliniques
Panaris
C'est l’infection de la main la plus fréquente. Il désigne une infection aiguë, primitive, cutanée ou sous-cutanée d’une quelconque partie constitutive du doigt. Le panaris survient après inoculation à la suite d’un traumatisme local. La difficulté est de différencier la forme précoce pouvant être guérie par une antibiothérapie d’une forme plus évoluée nécessitant une prise en charge chirurgicale.
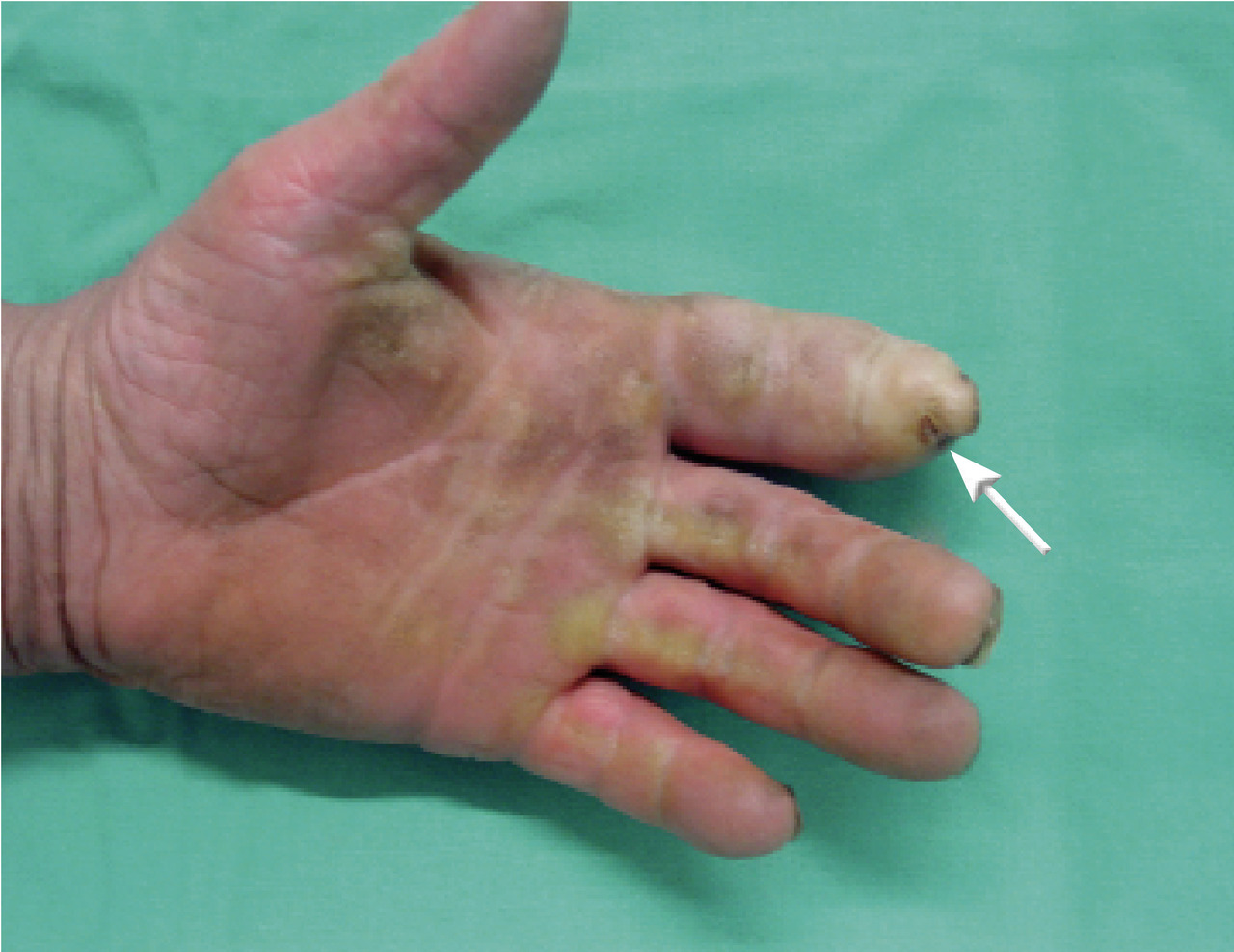
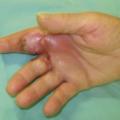
Panaris pulpaire (fig. 1) : c’est parce que l’infection est localisée dans un espace confiné que l’analogie à une collection peut être faite. En effet, il pourra exister une pulsatilité, comme dans un abcès, mais souvent absente dans les formes précoces.
Relativement fréquent, il devient rapidement très douloureux par la mise en tension de la pulpe, faisant disparaître sa pseudo-fluctuation physiologique. Au stade de collection, devant une pulpe hyperalgique, lancinante, augmentant de volume, chaude, rouge et sous tension, l’excision chirurgicale doit être large. La localisation au pouce reste la plus grave car la diffusion y est plus rapide qu’aux doigts longs.
Panaris en « bouton de chemise » : il est particulièrement redouté, conséquence de la propagation à la pulpe d’un panaris péri-unguéal par un pertuis qu’il ne faut pas méconnaître lors de l’excision chirurgicale initiale. Il nécessite alors une mise à plat bipolaire, à la fois péri-unguéale et pulpaire.
Panaris anthracoïde : c’est un panaris superficiel, réalisant un furoncle centré sur l’appareil pileux, respectant l’appareil extenseur sous-jacent et siégeant en règle générale au dos de la première phalange. L’excision est obligatoire pour évacuer les tissus nécrotiques.
Panaris de la face dorsale du doigt : il est grave car correspondant à une véritable cellulite dorsale dont le point de départ est le plus souvent la deuxième phalange. Le tissu sous-cutané y est très mince, favorisant la diffusion de l’infection, qui décolle la peau en lui donnant un aspect nécrotique impressionnant. Il est le plus souvent la conséquence d’une petite lésion initiale non ou insuffisamment traitée, dont le risque est, d’une part, la diffusion de l’infection à la face dorsale de la main et, d’autre part, l’atteinte de voisinage du tendon extenseur et surtout de l’articulation interphalangienne avec arthrite par contiguïté. Elle impose une excision chirurgicale radicale jusqu’en tissu sain.
Cas particulier du « faux panaris » d’Osler : il s’agit de nodosités bleuâtres ou rosées, toujours douloureuses, siégeant à la pulpe des doigts ou des orteils. Ces lésions sont évocatrices d’une endocardite infectieuse. Leur caractère fugace impose de les chercher absolument à l’interrogatoire. Aucune prise en charge spécifique n’est nécessaire puisqu’elles disparaissent spontanément. En revanche, la recherche d’une endocardite infectieuse doit être systématique.
Cas particulier du panaris herpétique : il survient entre 2 et 14 jours après un contact ou une exposition et touche préférentiellement la phalange distale. Le diagnostic est évoqué sur le caractère récidivant toujours au même endroit des lésions et une possible origine professionnelle de la contamination (dentiste, médecin, infirmière...). Les agents infectieux responsables sont les virus herpétiques de types 1 et 2.
Cliniquement, il s’agit d’une infection douloureuse de la phalange distale, les vésicules apparaissent après le 14e jour, puis s’ulcèrent, avec possibilité de signes généraux. La résolution spontanée est observée en 7 à 10 jours.
Cas particulier du panaris après morsure animale : la prise en charge d’une morsure animale est une urgence médico-chirurgicale. Il s’agit le plus souvent d’une plaie profonde et infectée. Les circonstances de survenue (l’heure +++), le statut vaccinal, le terrain ainsi que le type de morsure sont des éléments indispensables. Attention au piège des plaies punctiformes, d’aspect anodin, elles sont toujours la porte d’entrée d’une vaste zone de décollement profonde infectée par le croc.
L’excision de la porte d’entrée et des tissus avoisinants doit être chirurgicale.
Trois risques infectieux sont à prévenir et/ou traiter :
. morsure à haut risque septique (plaie profonde, délabrée),
. lésion articulaire et/ou osseuse,
. parage non satisfaisant (plaie punctiforme), morsure de chat,
. morsures de la main,
. morsures suturées de la face.
L’association amoxicilline-acide clavulanique est efficace, y compris en cas de suspicion de pasteurellose. En cas d’allergie aux pénicillines, un traitement par doxycycline est indiqué.
Cas particulier du « donneur de coup de poing » : il existe un équivalent de morsure dans la pathologie du « donneur de coup de poing ». Un coup de poing donné sur une surface dure (mur, visage, vitre…) peut entraîner une plaie de la face dorsale des articulations métacarpo-phalangiennes. Dans un contexte de rixe, cette lésion passe inaperçue et ne pousse pas le donneur de coup de poing à consulter pour une plaie punctiforme du dos de la main. Une arthrite par inoculation directe survient dans les jours suivant le traumatisme.
Dans le pseudo-panaris herpétique, il faut absolument éviter l’intervention, qui peut être à l’origine d’une extension. Le traitement repose sur le valaciclovir (Zelitrex) à préférer à l’aciclovir per os du fait d’une meilleure biodisponibilité.
Différentes formes de panaris
Panaris péri- et sous-unguéal : forme la plus courante, il est localisé sur le pourtour de l’ongle ou sous celui-ci. Il est secondaire à une brèche cutanée (soin inadapté de manucure, pénétration d’un corps étranger, contusion unguéale responsable d’un hématome secondairement infecté). L’infection débute par une tuméfaction inflammatoire, érythémateuse et douloureuse de la région péri-unguéale, c’est le stade phlegmasique. En l’absence de guérison, il évolue vers le stade collecté (douleur insomniante et lancinante) et impose une excision chirurgicale. Ce stade est irréversible et aboutit, en l’absence de traitement, à des complications : c’est le stade de diffusion. Les complications possibles sont locales, à la peau (fistulisation), à l’os et aux articulations (arthrite et ostéite) et aux gaines synoviales (phlegmons). Les complications générales avec bactériémie peuvent également survenir.Panaris pulpaire (fig. 1) : c’est parce que l’infection est localisée dans un espace confiné que l’analogie à une collection peut être faite. En effet, il pourra exister une pulsatilité, comme dans un abcès, mais souvent absente dans les formes précoces.
Relativement fréquent, il devient rapidement très douloureux par la mise en tension de la pulpe, faisant disparaître sa pseudo-fluctuation physiologique. Au stade de collection, devant une pulpe hyperalgique, lancinante, augmentant de volume, chaude, rouge et sous tension, l’excision chirurgicale doit être large. La localisation au pouce reste la plus grave car la diffusion y est plus rapide qu’aux doigts longs.
Panaris en « bouton de chemise » : il est particulièrement redouté, conséquence de la propagation à la pulpe d’un panaris péri-unguéal par un pertuis qu’il ne faut pas méconnaître lors de l’excision chirurgicale initiale. Il nécessite alors une mise à plat bipolaire, à la fois péri-unguéale et pulpaire.
Panaris anthracoïde : c’est un panaris superficiel, réalisant un furoncle centré sur l’appareil pileux, respectant l’appareil extenseur sous-jacent et siégeant en règle générale au dos de la première phalange. L’excision est obligatoire pour évacuer les tissus nécrotiques.
Panaris de la face dorsale du doigt : il est grave car correspondant à une véritable cellulite dorsale dont le point de départ est le plus souvent la deuxième phalange. Le tissu sous-cutané y est très mince, favorisant la diffusion de l’infection, qui décolle la peau en lui donnant un aspect nécrotique impressionnant. Il est le plus souvent la conséquence d’une petite lésion initiale non ou insuffisamment traitée, dont le risque est, d’une part, la diffusion de l’infection à la face dorsale de la main et, d’autre part, l’atteinte de voisinage du tendon extenseur et surtout de l’articulation interphalangienne avec arthrite par contiguïté. Elle impose une excision chirurgicale radicale jusqu’en tissu sain.
Cas particulier du « faux panaris » d’Osler : il s’agit de nodosités bleuâtres ou rosées, toujours douloureuses, siégeant à la pulpe des doigts ou des orteils. Ces lésions sont évocatrices d’une endocardite infectieuse. Leur caractère fugace impose de les chercher absolument à l’interrogatoire. Aucune prise en charge spécifique n’est nécessaire puisqu’elles disparaissent spontanément. En revanche, la recherche d’une endocardite infectieuse doit être systématique.
Cas particulier du panaris herpétique : il survient entre 2 et 14 jours après un contact ou une exposition et touche préférentiellement la phalange distale. Le diagnostic est évoqué sur le caractère récidivant toujours au même endroit des lésions et une possible origine professionnelle de la contamination (dentiste, médecin, infirmière...). Les agents infectieux responsables sont les virus herpétiques de types 1 et 2.
Cliniquement, il s’agit d’une infection douloureuse de la phalange distale, les vésicules apparaissent après le 14e jour, puis s’ulcèrent, avec possibilité de signes généraux. La résolution spontanée est observée en 7 à 10 jours.
Cas particulier du panaris après morsure animale : la prise en charge d’une morsure animale est une urgence médico-chirurgicale. Il s’agit le plus souvent d’une plaie profonde et infectée. Les circonstances de survenue (l’heure +++), le statut vaccinal, le terrain ainsi que le type de morsure sont des éléments indispensables. Attention au piège des plaies punctiformes, d’aspect anodin, elles sont toujours la porte d’entrée d’une vaste zone de décollement profonde infectée par le croc.
L’excision de la porte d’entrée et des tissus avoisinants doit être chirurgicale.
Trois risques infectieux sont à prévenir et/ou traiter :
- le risque rabique : la France métropolitaine est reconnue indemne de rage des animaux terrestres. Un risque exceptionnel persiste en cas de morsure d’un animal illégalement importé. Actuellement, aucune prophylaxie post-exposition (vaccination) n’est recommandée après morsure d’animal terrestre sur le territoire français. En revanche, toute morsure de chauve-souris, souillure de plaie ou d’une muqueuse par sa salive (y compris sur le territoire français) et toute morsure animale terrestre à l’étranger sont des indications absolues à un traitement antirabique immédiat associant immunoglobulines spécifiques et vaccination ;
- le risque tétanique : si la personne est non à jour, vaccination antitétanique dans un bras et immunoglobulines tétaniques humaines dans l’autre bras. Il faut systématiquement proposer un programme de mise à jour du calendrier vaccinal et préciser la date du prochain rappel ;
- l’infection par les germes aérobies et anaérobies : ces germes sont constamment présents dans la bouche de l’animal. Une antibiothérapie systématique est indiquée dans les cas suivants :
. morsure à haut risque septique (plaie profonde, délabrée),
. lésion articulaire et/ou osseuse,
. parage non satisfaisant (plaie punctiforme), morsure de chat,
. morsures de la main,
. morsures suturées de la face.
L’association amoxicilline-acide clavulanique est efficace, y compris en cas de suspicion de pasteurellose. En cas d’allergie aux pénicillines, un traitement par doxycycline est indiqué.
Cas particulier du « donneur de coup de poing » : il existe un équivalent de morsure dans la pathologie du « donneur de coup de poing ». Un coup de poing donné sur une surface dure (mur, visage, vitre…) peut entraîner une plaie de la face dorsale des articulations métacarpo-phalangiennes. Dans un contexte de rixe, cette lésion passe inaperçue et ne pousse pas le donneur de coup de poing à consulter pour une plaie punctiforme du dos de la main. Une arthrite par inoculation directe survient dans les jours suivant le traumatisme.
Complications du panaris
Les complications sont rares (< 2 %) mais elles sont fonctionnellement très graves lorsque l’infection atteint les structures de voisinage : fistulisation à la peau, ostéite, ostéo-arthrite voire gangrène digitale en cas de diabète. Les panaris palmaires peuvent se compliquer d’un phlegmon de la gaine. Une radiographie du doigt concerné est recommandée avant tout geste chirurgical, notamment à la recherche d’une ostéite.Traitement du panaris
Il se décrit en deux phases :- au stade phlegmasique, il est purement médical et se réduit à des soins antiseptiques locaux (bain de Dakin ou Hexomedine diluée) et un pansement. Le traitement médical a pour but de prévenir l’extension de la suppuration en profondeur. Les anti- inflammatoires non stéroïdiens sont à proscrire absolument malgré leur efficacité sur la douleur. Le traitement antiseptique permet souvent de résoudre à lui seul la maladie. La surveillance rapprochée est nécessaire ;
- si le panaris se collecte, le traitement chirurgical seul est recommandé. Un parage de l’ensemble du tissu infecté et nécrosé doit être réalisé, associé à une évacuation de la collection, qui sera prélevée pour culture. La plaie est abondamment lavée et non refermée, laissée en cicatrisation dirigée. Une antibiothérapie ne sera mise en route qu’en cas d’évolution défavorable (c’est-à-dire en présence d’une diffusion régionale de l’infection ou de signes infectieux systémiques) et adaptée aux prélèvements. Une antibiothérapie probabiliste locale ou générale précoce (en préopératoire) n’est pas recommandée, car elle stérilise les prélèvements en cas de complication.
Dans le pseudo-panaris herpétique, il faut absolument éviter l’intervention, qui peut être à l’origine d’une extension. Le traitement repose sur le valaciclovir (Zelitrex) à préférer à l’aciclovir per os du fait d’une meilleure biodisponibilité.
Abcès
La survenue d’un abcès est la conséquence d’une extension d’une infection de voisinage avec cloisonnement. Les circonstances de survenue sont multiples : complication d’un furoncle, toxicomanie intraveineuse, plaie traumatique…
Le tableau clinique correspond à celui d’une cellulite, avec un placard érythémateux très inflammatoire et douloureux, de taille variable. La palpation met en évidence en son centre une zone fluctuante. Les signes associés peuvent être la fièvre, une lymphangite, des adénopathies satellites.
Staphylococcus aureus est, de très loin, l’agent infectieux le plus souvent responsable d’abcès cutané. Des souches sécrétrices de toxine de Panton-Valentine sont souvent impliquées. En cas d’abcès post-chirurgical ou faisant suite à une injection sous-cutanée, des streptocoques (surtout du groupe milleri) ou des bacilles à Gram négatif peuvent également être impliqués.
L’analyse bactériologique du pus est indispensable pour isoler la bactérie en cause et adapter le traitement antibiotique.
L’abcès sous-cutané peut être ponctionné, mais le traitement est surtout chirurgical et consiste à réaliser une incision et un drainage de l’abcès, avec des prélèvements peropératoires. Une antibiothérapie systémique adaptée à la (ou aux) bactérie(s) sera proposée en cas de zone inflammatoire périlésionnelle supérieure à 5 cm, de lésions secondaires à distance, chez l’immunodéprimé, ou en cas d’atteinte du visage ou de la main.
Au niveau de la main, deux tableaux cliniques sont particuliers du fait de l’anatomie. Il s’agit de l’abcès des espaces profonds et du panaris pulpaire (v. supra). En cas d’abcès de la main, à la face dorsale en sous-aponévrotique, dans les éminences thénar, hypothénar, médio-palmaires et interdigitales, on parlera d’infection des espaces profonds. Il s’agit dans tous les cas d’une extension d’une infection de voisinage avec abcès. Il est extrêmement difficile de faire la différence avec un abcès sous-cutané. L’échographie permet de confirmer le diagnostic et la localisation. Le traitement est chirurgical, avec abord de la zone abcédée et excision de l’abcès. Une antibiothérapie de couverture est mise en place après les prélèvements peropératoires.
Le tableau clinique correspond à celui d’une cellulite, avec un placard érythémateux très inflammatoire et douloureux, de taille variable. La palpation met en évidence en son centre une zone fluctuante. Les signes associés peuvent être la fièvre, une lymphangite, des adénopathies satellites.
Staphylococcus aureus est, de très loin, l’agent infectieux le plus souvent responsable d’abcès cutané. Des souches sécrétrices de toxine de Panton-Valentine sont souvent impliquées. En cas d’abcès post-chirurgical ou faisant suite à une injection sous-cutanée, des streptocoques (surtout du groupe milleri) ou des bacilles à Gram négatif peuvent également être impliqués.
L’analyse bactériologique du pus est indispensable pour isoler la bactérie en cause et adapter le traitement antibiotique.
L’abcès sous-cutané peut être ponctionné, mais le traitement est surtout chirurgical et consiste à réaliser une incision et un drainage de l’abcès, avec des prélèvements peropératoires. Une antibiothérapie systémique adaptée à la (ou aux) bactérie(s) sera proposée en cas de zone inflammatoire périlésionnelle supérieure à 5 cm, de lésions secondaires à distance, chez l’immunodéprimé, ou en cas d’atteinte du visage ou de la main.
Au niveau de la main, deux tableaux cliniques sont particuliers du fait de l’anatomie. Il s’agit de l’abcès des espaces profonds et du panaris pulpaire (v. supra). En cas d’abcès de la main, à la face dorsale en sous-aponévrotique, dans les éminences thénar, hypothénar, médio-palmaires et interdigitales, on parlera d’infection des espaces profonds. Il s’agit dans tous les cas d’une extension d’une infection de voisinage avec abcès. Il est extrêmement difficile de faire la différence avec un abcès sous-cutané. L’échographie permet de confirmer le diagnostic et la localisation. Le traitement est chirurgical, avec abord de la zone abcédée et excision de l’abcès. Une antibiothérapie de couverture est mise en place après les prélèvements peropératoires.
Phlegmons des parties molles
Un phlegmon est une infection sans collection, à l’inverse de l’abcès qui est collecté. On appelle le phlegmon de la gaine des tendons fléchisseurs l’infection du tissu conjonctif.
Le phlegmon des gaines des fléchisseurs est une urgence chirurgicale absolue. Le pronostic fonctionnel du doigt est engagé car une prise en charge tardive conduit à des séquelles majeures pouvant aller jusqu’à l’amputation. Le tableau clinique peut avoir été abâtardi par une antibiothérapie aveugle retardant le diagnostic et la prise en charge chirurgicale.
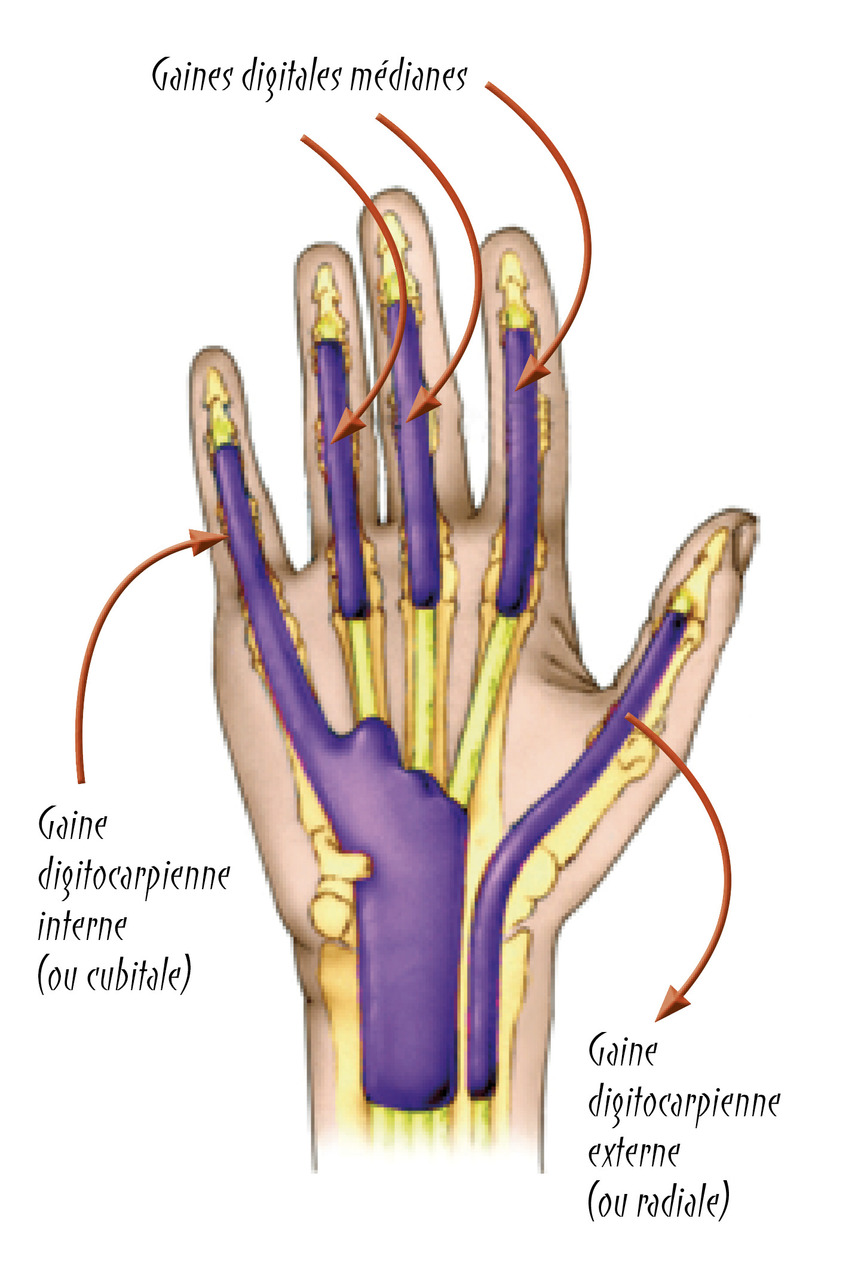
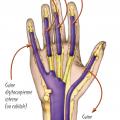
L’anatomie (fig. 2) des gaines synoviales explique la diffusion du phlegmon et ses manifestations cliniques.
La gaine radiale ou digitocarpienne externe est celle du long fléchisseur du pouce.
Les gaines digitales correspondent aux trois doigts médians.
La gaine cubitale ou digitocarpienne interne offre trois dispositions anatomiques possibles :
. attitude en crochet : le doigt est en position demi-fléchie. C’est le signe le plus commun, mais inconstant, surtout dans les formes débutantes. C’est en flexion que la gaine autorise le plus grand volume de remplissage.
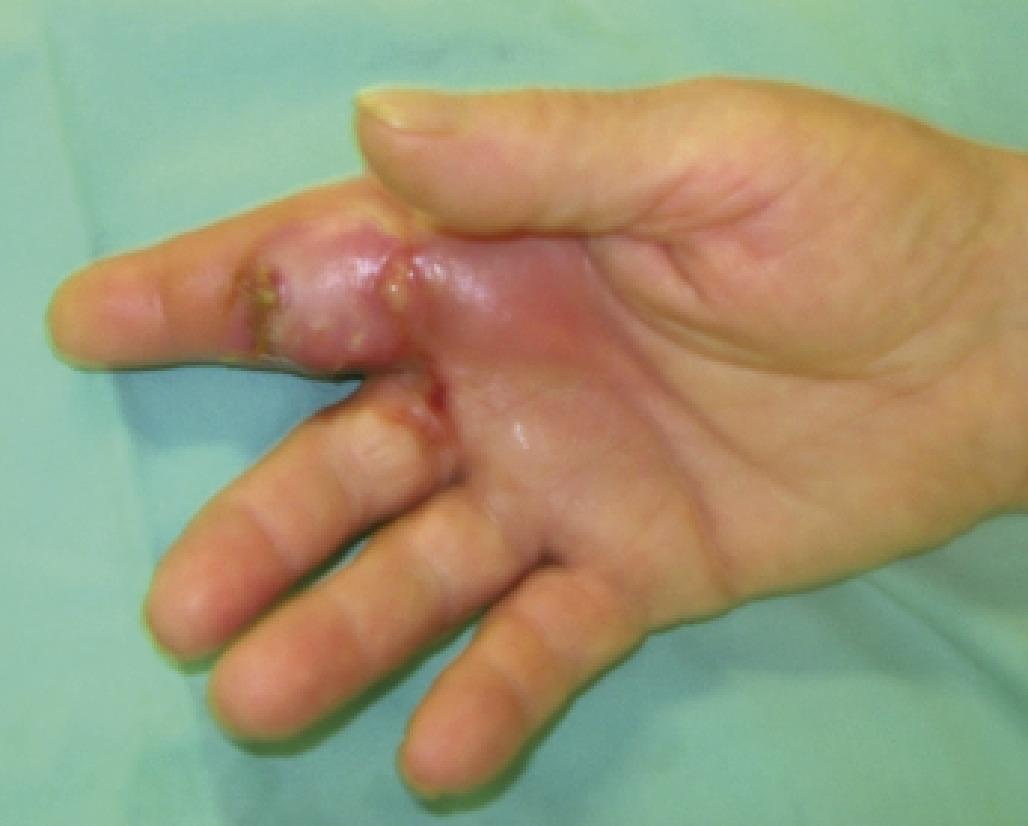
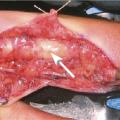
Par l’examen physique (fig. 3). Les signes cliniques typiques du phlegmon ont été décrits par Allen Kanavel en 1905. Il faut rechercher des :
. douleur à l’extension passive : l’extension passive du doigt provoque une intense douleur ;
. douleur à la palpation du cul-de-sac de la gaine des fléchisseurs du doigt intéressé. Ce cul-de-sac se situe en regard des têtes métacarpiennes pour les 2e, 3e et 4e rayons et à la face antérieure du poignet pour les 1er et 5e rayons.
. asthénie.
Ces signes généraux sont inconstants mais graves.
Dans tous les cas, ces examens doivent être réalisés en urgence.
En cas de diagnostic clinique évident, une radiographie de la main de face ou du doigt de face et de profil reste un examen indispensable pour rechercher un corps étranger radio-opaque ou des arguments pour une ostéo-arthrite associée. L’échographie de la main et du poignet réalisée par un examinateur entraîné est un complément utile et performant. Elle offre une analyse précise des gaines tendineuses, des tendons et des différents espaces articulaires, permettant même une détection précoce avant l’apparition de l’ensemble des signes cliniques.
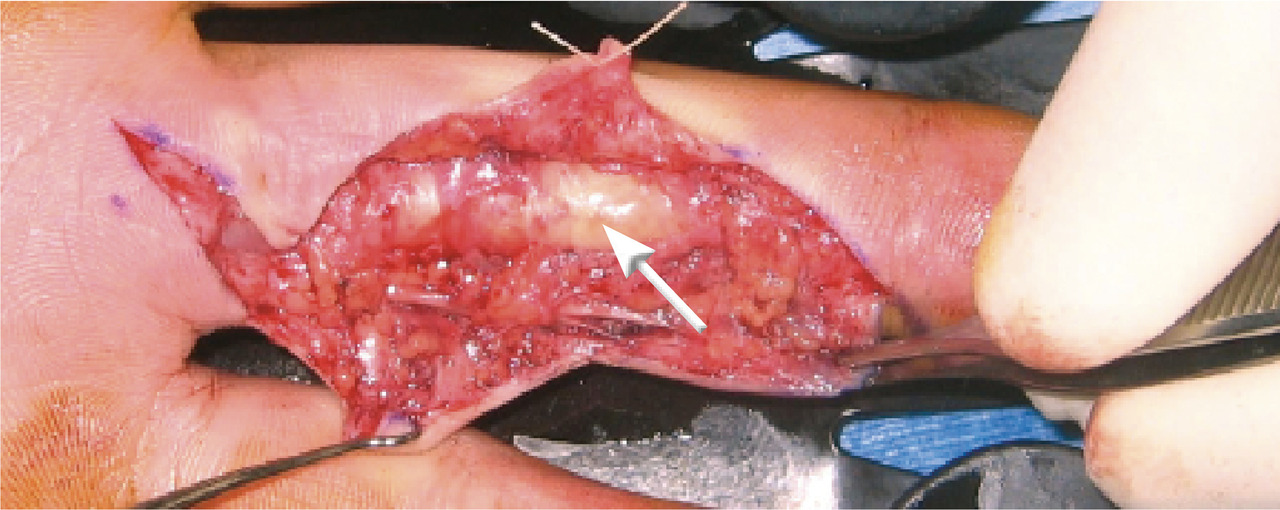
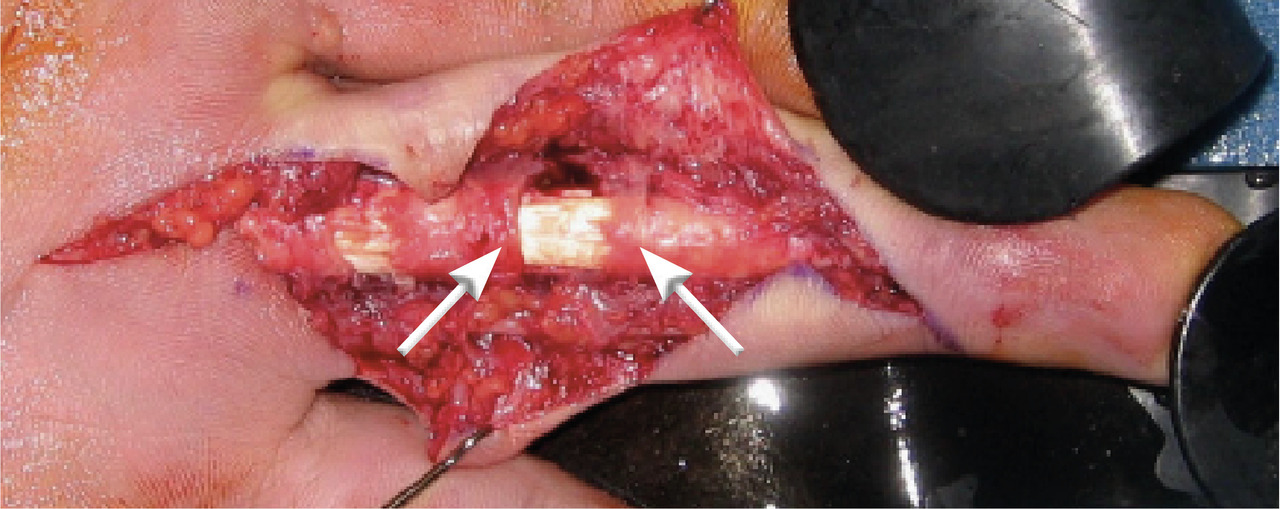
. stade IIb : la synoviale est pathologique (turgescente, hypertrophique, lie-de-vin) tout le long du canal digital ; le tissu sous-cutané peut être également infiltré et présenter des zones septiques ; il est justifié, dans ces cas, de pratiquer une synovectomie complète (fig. 4 et 5) ;
. stade III : nécrose, plus ou moins étendue des tendons. Le traitement consiste en une excision de tous les tissus nécrotiques. Les séquelles sont constantes puisque le fléchisseur a été excisé.
Le phlegmon des gaines des fléchisseurs est une urgence chirurgicale absolue. Le pronostic fonctionnel du doigt est engagé car une prise en charge tardive conduit à des séquelles majeures pouvant aller jusqu’à l’amputation. Le tableau clinique peut avoir été abâtardi par une antibiothérapie aveugle retardant le diagnostic et la prise en charge chirurgicale.
L’anatomie (fig. 2) des gaines synoviales explique la diffusion du phlegmon et ses manifestations cliniques.
La gaine radiale ou digitocarpienne externe est celle du long fléchisseur du pouce.
Les gaines digitales correspondent aux trois doigts médians.
La gaine cubitale ou digitocarpienne interne offre trois dispositions anatomiques possibles :
- dans le type 1, le plus classique, il existe deux gaines digitocarpiennes bien individualisées de part et d’autre du nerf médian dans le canal carpien, l’une externe, la gaine radiale, l’autre interne, la gaine cubitale ;
- dans le type 2, une gaine synoviale carpienne moyenne de l’index vient s’interposer dans le canal carpien entre les deux gaines digitocarpiennes interne et externe ;
- dans le type 3, les gaines digitocarpiennes interne et externe sont réunies dans le canal carpien, disposition anatomique rare mais qui explique la possibilité de phlegmon à bascule intéressant successivement pouce et auriculaire.
- les phlegmons par inoculation directe : un objet pénétrant (clou, épine, verre...) introduit directement le germe à l’intérieur de la gaine synoviale. Le deuxième facteur étiologique est constitué par les morsures d’animaux domestiques (chat et chien) dont le risque particulier est aussi de transmettre la pasteurellose au sujet mordu ;
- les phlegmons par diffusion : les germes traversent la gaine synoviale à partir d’un foyer infectieux de voisinage (panaris, le plus souvent) ;
- les phlegmons par contamination hématogène : ils surviennent à la suite d’une diffusion septique à partir d’un foyer à distance (infections génitales à gonocoque, certaines infections à mycobactéries dont Mycobacterium tuberculosis).
Examen clinique
Par l’interrogatoire, il faut rechercher des éléments sur :- les circonstances de l’accident : plaie, exposition à risque (eau contaminée, sexuelle) ;
- le terrain favorisant : diabète, déficit immunitaire (VIH, immunosuppresseur, traitement corticoïde, cancer), éthylisme chronique, toxicomanie, tabagisme ;
- l’état de la vaccination antitétanique ;
- les signes fonctionnels :
. attitude en crochet : le doigt est en position demi-fléchie. C’est le signe le plus commun, mais inconstant, surtout dans les formes débutantes. C’est en flexion que la gaine autorise le plus grand volume de remplissage.
Par l’examen physique (fig. 3). Les signes cliniques typiques du phlegmon ont été décrits par Allen Kanavel en 1905. Il faut rechercher des :
- signes locaux :
. douleur à l’extension passive : l’extension passive du doigt provoque une intense douleur ;
. douleur à la palpation du cul-de-sac de la gaine des fléchisseurs du doigt intéressé. Ce cul-de-sac se situe en regard des têtes métacarpiennes pour les 2e, 3e et 4e rayons et à la face antérieure du poignet pour les 1er et 5e rayons.
- signes régionaux :
- signes généraux :
. asthénie.
Ces signes généraux sont inconstants mais graves.
Examen paraclinique
Le diagnostic de phlegmon des gaines est un diagnostic clinique. Aucun examen complémentaire n’est indispensable pour poser ce diagnostic. Cependant, certains examens pourront être réalisés s’il existe un doute diagnostique, pour le bilan préopératoire et pour l’identification des agents infectieux.Dans tous les cas, ces examens doivent être réalisés en urgence.
En cas de diagnostic clinique évident, une radiographie de la main de face ou du doigt de face et de profil reste un examen indispensable pour rechercher un corps étranger radio-opaque ou des arguments pour une ostéo-arthrite associée. L’échographie de la main et du poignet réalisée par un examinateur entraîné est un complément utile et performant. Elle offre une analyse précise des gaines tendineuses, des tendons et des différents espaces articulaires, permettant même une détection précoce avant l’apparition de l’ensemble des signes cliniques.
Traitement
Le traitement est chirurgical quel que soit le stade. Le principe comporte :- l’excision de la porte d’entrée (panaris ou piqûre souillante) ;
- des prélèvements bactériologiques multiples ;
- un traitement chirurgical en fonction du stade (v. infra) ;
- une antibiothérapie probabiliste en postopératoire, en attendant les résultats des prélèvements bactériologiques. L’amoxicilline-acide clavulanique intraveineux est à utiliser en première intention. En cas de signes de gravité ou de suspicion d’infection polymicrobienne à germes pyogènes, on peut y ajouter de la clindamycine ou de la gentamicine. La durée de l’antibiothérapie est fonction de la gravité, de l’évolution et du terrain. Elle doit être d’au moins 10 jours et peut aller jusqu’à 4 à 6 semaines si une ostéo-arthrite est associée.
Traitement chirurgical selon le stade
Les phlegmons évoluent en 3 phases distinctes, qui sont à la base de la classification. Elles sont fondées sur des constatations opératoires et ont un rôle pronostique et thérapeutique :- stade I : sérite exsudative qui distend la gaine ; le liquide est clair ou louche, la synoviale est simplement hyperhémiée. À ce stade, un lavage de la gaine par ses extrémités est le traitement de choix ;
- stade II : le liquide est trouble ou purulent. Le tendon est intact. L’aspect de la synoviale permet de définir deux stades différents :
. stade IIb : la synoviale est pathologique (turgescente, hypertrophique, lie-de-vin) tout le long du canal digital ; le tissu sous-cutané peut être également infiltré et présenter des zones septiques ; il est justifié, dans ces cas, de pratiquer une synovectomie complète (fig. 4 et 5) ;
. stade III : nécrose, plus ou moins étendue des tendons. Le traitement consiste en une excision de tous les tissus nécrotiques. Les séquelles sont constantes puisque le fléchisseur a été excisé.
Dermohypodermites et fasciites nécrosantes
Elles sont classées selon la profondeur de l’atteinte et la notion de nécrose. Les dermohypodermites bactériennes nécrosantes (DHBN) provoquent une nécrose du derme et de l’hypoderme. Dans la fasciite nécrosante (FN), l’atteinte s’étend jusqu’à l’aponévrose superficielle sous-jacente.
Deux localisations préférentielles avec des germes et des circonstances de survenue différents sont décrits :
La dermohypodermite bactérienne nécrosante-fasciite nécrosante survient le plus souvent chez des patients fragiles, âgés de plus de 50 ans, diabétiques, immunodéprimés, alcooliques ou toxicomanes, ou traités de façon intempestive par anti-inflammatoires non stéroïdiens pour une dermohypodermite simple non nécrosante.
La létalité est de 30 % environ. Le patient doit être orienté en milieu spécialisé où il relève d’une prise en charge par une équipe médico-chirurgicale.
Les hémocultures sont positives dans plus de 10 % des cas. Des prélèvements locaux (lésions bulleuses, phlyctènes) peuvent être également utiles.
Le dosage de la créatinine-phosphokinase (CPK) est systématique. Son élévation traduit une nécrose musculaire associée et représente un signe de gravité.
Les radiographies peuvent montrer des zones aériques sous- cutanées, en faveur d’une infection à germes anaérobies. Une échographie des parties molles peut être indiquée. L’imagerie par résonance magnétique (IRM) permettrait de mieux évaluer la gravité et de guider le geste, mais cet examen ne doit pas retarder le geste chirurgical. Des prélèvements bactériologues peropératoires sont obligatoires.
Le traitement symptomatique du sepsis voire de l’état de choc est bien sûr recommandé.
L’antibiothérapie est probabiliste et doit tenir compte de la localisation et des germes les plus fréquemment responsables :
La durée du traitement est généralement de 15 à 21 jours.
La clindamycine utilisée dans ce cas pour son rôle antitoxinique peut être arrêtée au bout de 5 jours.
Traitement chirurgical : la précocité de l’intervention est un facteur déterminant du pronostic. Elle consiste à :
›››
Deux localisations préférentielles avec des germes et des circonstances de survenue différents sont décrits :
- les fasciites des membres et cervico-faciales : Streptococcus pyogenes est le plus souvent impliqué, mais également les streptocoques non groupables, les anaérobies de la flore bucco-dentaire et Staphylococcus aureus ;
- les fasciites du périnée pour lesquelles les entérobactéries et les anaérobies des genres Bacteroides et Clostridium sont souvent impliquées (gangrène de Fournier).
La dermohypodermite bactérienne nécrosante-fasciite nécrosante survient le plus souvent chez des patients fragiles, âgés de plus de 50 ans, diabétiques, immunodéprimés, alcooliques ou toxicomanes, ou traités de façon intempestive par anti-inflammatoires non stéroïdiens pour une dermohypodermite simple non nécrosante.
Présentation clinique
Le diagnostic est clinique. Les signes de sepsis sont souvent au premier plan. Au stade précoce, les signes locaux sont plus difficiles à différencier d’une simple dermohypodermite. Les signes locaux de gravité qui doivent inquiéter sont les suivants : douleur intense, anesthésie locale, lividités cutanées puis taches cyaniques et enfin nécrotiques, extension de l’œdème, qui devient majeur, extension de l’érythème, à limites déchiquetées en carte de géographie (dont il faut surligner les contours+++) sous antibiothérapie adaptée, crépitations à la palpation.La létalité est de 30 % environ. Le patient doit être orienté en milieu spécialisé où il relève d’une prise en charge par une équipe médico-chirurgicale.
Examens complémentaires
On peut noter la présence d’un syndrome inflammatoire biologique. Des signes indirects de sepsis peuvent également être présents : insuffisance rénale aiguë fonctionnelle, acidose métabolique...Les hémocultures sont positives dans plus de 10 % des cas. Des prélèvements locaux (lésions bulleuses, phlyctènes) peuvent être également utiles.
Le dosage de la créatinine-phosphokinase (CPK) est systématique. Son élévation traduit une nécrose musculaire associée et représente un signe de gravité.
Les radiographies peuvent montrer des zones aériques sous- cutanées, en faveur d’une infection à germes anaérobies. Une échographie des parties molles peut être indiquée. L’imagerie par résonance magnétique (IRM) permettrait de mieux évaluer la gravité et de guider le geste, mais cet examen ne doit pas retarder le geste chirurgical. Des prélèvements bactériologues peropératoires sont obligatoires.
Traitement
Le traitement de la dermohypodermite bactérienne nécrosante- fasciite nécrosante est une urgence médico-chirurgicale car mortelle dans près de 30 % des cas.Le traitement symptomatique du sepsis voire de l’état de choc est bien sûr recommandé.
L’antibiothérapie est probabiliste et doit tenir compte de la localisation et des germes les plus fréquemment responsables :
- amoxicilline-acide clavulanique + clindamycine ± vancomycine (si suspicion de Staphylococcus aureus résistant à la méticilline) quand le tableau oriente vers un streptocoque bêtahémolytique sans pouvoir exclure d’autres pathogènes, notamment bacilles à Gram négatif (fasciite des membres ou cervico-faciale) ;
- tazobactam-pipéracilline + métronidazole + clindamycine quand le tableau oriente vers des cocci à Gram positif associés à des bacilles à Gram négatif aérobies et anaérobies (cellulites périnéales = gangrène de Fournier).
La durée du traitement est généralement de 15 à 21 jours.
La clindamycine utilisée dans ce cas pour son rôle antitoxinique peut être arrêtée au bout de 5 jours.
Traitement chirurgical : la précocité de l’intervention est un facteur déterminant du pronostic. Elle consiste à :
- effectuer des incisions de drainage longitudinales à un stade précoce en cas de syndrome de loge ;
- exciser l’ensemble des tissus atteints jusqu’aux tissus sains. Une exérèse complémentaire dans un second temps est souvent nécessaire. La chirurgie de reconstruction sera envisagée secondairement.
›››
Points forts
Infection aiguë des parties molles (abcès, panaris, phlegmon des gaines)
Trois stades de l’infection : stade phlegmasique (inflammatoire), stade de collection et stade de diffusion (complications).
Au stade de collection, le traitement est chirurgical.
Les gaines des premiers et cinquièmes doigts remontent au poignet et peuvent communiquer.
Quel que soit le stade, le traitement du phlegmon est chirurgical.
L’antibiothérapie n’est pas systématique après un panaris ou un abcès, sauf en cas de morsure animale.
Une dermohypodermite compliquée d’un sepsis est une fasciite nécrosante jusqu’à preuve du contraire, et nécessite une prise en charge chirurgicale.
CMIT. Infections cutanées à pyogènes. In Pilly E. 26e éd. : Alinea Plus Ed; 2018: pp274.
CMIT. Dermohypodermites aigues bactériennes.In Pilly E. 26e éd. : Alinea Plus Ed; 2018: pp279.
Société de pathologie infectieuse de langue française. Conférence de consensus.
Érisypèle et fasciite nécrosante. Med Mal Infect 2000;30:241-5.
Singer et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016.
Ebelin M , Beccari R, Maiez A. Infections de la main. EMC, Appareil locomoteur, 14-070, 2006.
Rossi B. Mise au point sur l'antibiothérapie des infections bactériennes de la peau et des tissus mous en France. Journal des anti-infectieux. 2017.
Singer A, Talan D. Management of Skin Abscesses in the Era of Methicillin-Resistant Staphylococcus aureus. New Engl J of Med, 2014.
CMIT. Dermohypodermites aigues bactériennes.In Pilly E. 26e éd. : Alinea Plus Ed; 2018: pp279.
Société de pathologie infectieuse de langue française. Conférence de consensus.
Érisypèle et fasciite nécrosante. Med Mal Infect 2000;30:241-5.
Singer et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016.
Ebelin M , Beccari R, Maiez A. Infections de la main. EMC, Appareil locomoteur, 14-070, 2006.
Rossi B. Mise au point sur l'antibiothérapie des infections bactériennes de la peau et des tissus mous en France. Journal des anti-infectieux. 2017.
Singer A, Talan D. Management of Skin Abscesses in the Era of Methicillin-Resistant Staphylococcus aureus. New Engl J of Med, 2014.

 Encadrés
Encadrés