Helicobacter pylori, bactérie à Gram négatif très commune de l’intestin humain, est la seule capable de résister à un environnement acide. De forme hélicoïdale, mesurant environ 3 μm de long et munie de 4 à 6 flagelles, elle se fixe sur les cellules de la paroi gastrique grâce à des protéines (adhésines) et sécrète une uréase qui transforme l’urée en ammoniaque, ce qui neutralise l’acidité gastrique mais altère aussi les cellules épithéliales de l’estomac.2 Elle est responsable de 80 % des ulcères gastroduodénaux.
Une bactérie très fréquente dans la population
Bien que décelée dans des estomacs humains dès 1875, elle n’y fut isolée qu’en 1982 grâce à Warren et Marshall, deux Australiens qui suspectèrent la nature bactérienne de l’ulcère de l’estomac, contre la théorie admise à l’époque d’une cause liée au stress ou une nourriture trop épicée. Marshall avait expérimenté sur lui-même son hypothèse en avalant le contenu d’un tube à essai contenant une culture d’Helicobacter pylori, ce qui avait provoqué une gastrite conséquente qu’il avait guérie en prenant des antibiotiques. Pour cette découverte majeure, les deux auteurs reçurent le prix Nobel de médecine en 2005.
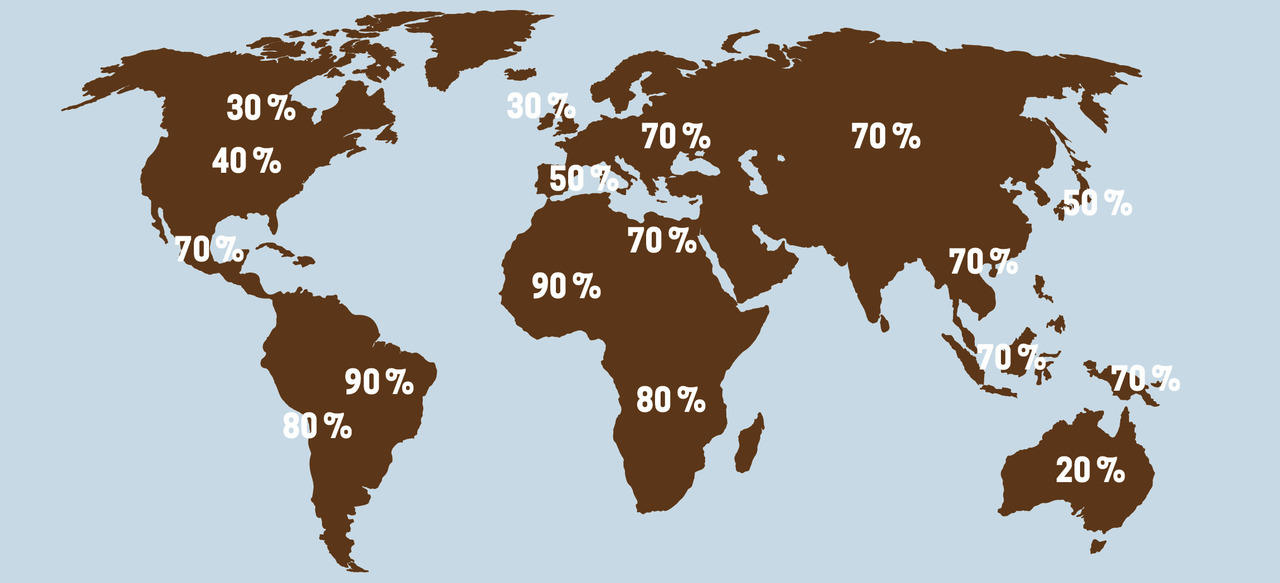
Helicobacter pylori est présente chez environ la moitié de la population mondiale, avec de grandes variations selon les âges et les pays (figure ). Elle est plus fréquente dans les pays en voie développement, en fonction des conditions locales d’hygiène.1 En France, la prévalence de l’infection est de 5 % chez l’enfant et de 50 % après 60 ans, avec une moyenne générale de 15 à 30 % dans la population. Aux États-Unis, plus de 50 % des patients infectés ont plus de 60 ans, contre 20 % chez les moins de 40 ans. Les personnes infestées par Helicobacter pylori ont un risque de 3 % de développer un cancer gastrique et de 10 à 15 % de développer un ulcère gastroduodénal. En revanche, elle aurait un rôle protecteur contre l’obésité et le diabète de type 2.
Helicobacter pylori est présente chez environ la moitié de la population mondiale, avec de grandes variations selon les âges et les pays (
Une infection latente dans la grande majorité des cas
Après ingestion d’aliments ou d’eau contaminés, souvent dans l’enfance, probablement favorisée par la promiscuité, Helicobacter pylori peut persister chez son hôte toute la vie en l’absence de traitement, car elle échappe au système immunitaire humain et ne disparaît pas spontanément.
L’infection peut rester latente dans 70 % des cas ou se manifester par des symptômes divers et d’intensité très variable : épigastralgies, douleurs abdominales, régurgitations, vomissements, nausées, éructations, flatulence, constipation, voire somnolence. Sa recherche est indiquée en cas de gastrite, d’ulcère gastroduodénal, de cancer de l’œsophage ou de l’estomac, d’une prolifération monoclonale des lymphocytes B (lymphome du MALT [mucosal-associated lymphoid tissue]), ou encore d’anémie ferriprive ou d’une carence inexpliquée en vitamine B12. Elle est utile également avant une intervention de chirurgie bariatrique.
L’infection peut rester latente dans 70 % des cas ou se manifester par des symptômes divers et d’intensité très variable : épigastralgies, douleurs abdominales, régurgitations, vomissements, nausées, éructations, flatulence, constipation, voire somnolence. Sa recherche est indiquée en cas de gastrite, d’ulcère gastroduodénal, de cancer de l’œsophage ou de l’estomac, d’une prolifération monoclonale des lymphocytes B (lymphome du MALT [mucosal-associated lymphoid tissue]), ou encore d’anémie ferriprive ou d’une carence inexpliquée en vitamine B12. Elle est utile également avant une intervention de chirurgie bariatrique.
Diagnostic : le test respiratoire
Plusieurs techniques permettent de détecter la bactérie. Une identification par immunochromatographie est possible dans les selles. Un dosage d’anticorps spécifiques permet de révéler l’infection, mais ne peut ni la dater ni en surveiller la guérison, les anticorps persistant plusieurs mois après l’éradication de la bactérie. Ces tests sont de moins en moins utilisés, mais parfois encore en cas de dépistage, chez un patient jamais traité.
Le test le plus fiable, non invasif, simple et rapide est l’analyse de l’air expiré (2 prélèvements de l’air expiré à 30 minutes d’intervalle), détectant le CO2 marqué, après ingestion d’urée marquée au carbone 13. Si le patient est infecté, la bactérie métabolise en effet l’urée en CO2 qui est expulsé par les poumons. Ce test est très sensible (95,4 %) et très spécifique (98,6 %). Il doit être fait à jeun. Cependant, la prise d’antibiotiques et d’inhibiteurs de la pompe à protons (IPP) doit être interrompue avant de le pratiquer (respectivement 4 semaines et 2 semaines avant) car ces médicaments peuvent perturber le résultat.3
En cas de gastroscopie, recommandée chez les patients suspects de pathologie digestive haute et chez les sujets aux antécédents familiaux de cancer gastrique avant 40 ans, les biopsies mettent en évidence des atrophies de l’antre et du fundus. En outre, un test à l’uréase fait directement sur le prélèvement biopsique permet de dépister la bactérie. La culture et la PCR permettent le diagnostic d’infection à Helicobacter pylori ainsi que l’évaluation de sa résistance à certains antibiotiques (tableau 1 ). La résistance aux autres antibiotiques (amoxicilline, tétracycline) reste encore négligeable.
Le test le plus fiable, non invasif, simple et rapide est l’analyse de l’air expiré (2 prélèvements de l’air expiré à 30 minutes d’intervalle), détectant le CO2 marqué, après ingestion d’urée marquée au carbone 13. Si le patient est infecté, la bactérie métabolise en effet l’urée en CO2 qui est expulsé par les poumons. Ce test est très sensible (95,4 %) et très spécifique (98,6 %). Il doit être fait à jeun. Cependant, la prise d’antibiotiques et d’inhibiteurs de la pompe à protons (IPP) doit être interrompue avant de le pratiquer (respectivement 4 semaines et 2 semaines avant) car ces médicaments peuvent perturber le résultat.3
En cas de gastroscopie, recommandée chez les patients suspects de pathologie digestive haute et chez les sujets aux antécédents familiaux de cancer gastrique avant 40 ans, les biopsies mettent en évidence des atrophies de l’antre et du fundus. En outre, un test à l’uréase fait directement sur le prélèvement biopsique permet de dépister la bactérie. La culture et la PCR permettent le diagnostic d’infection à Helicobacter pylori ainsi que l’évaluation de sa résistance à certains antibiotiques (
Quel traitement ?
En raison de l’apparition de mutations de résistance,4 le traitement actuel probabiliste de première intention repose sur une association médicamenteuse (tableau 2 ).5 La vérification de la guérison est obtenue par la négativation du test respiratoire à l’urée marquée, pratiqué au moins 1 mois après l’arrêt des antibiotiques et 15 jours après l’arrêt des IPP.6
Par ailleurs, les probiotiques auraient un effet protecteur en réduisant la concentration de la bactérie, ce qui fait régresser les symptômes en quelques semaines. L’ingestion de jus de canneberge ou de pousse de brocoli aurait des effets similaires. Enfin, des essais vaccinaux n’ont pas été concluants jusqu’à présent.
Par ailleurs, les probiotiques auraient un effet protecteur en réduisant la concentration de la bactérie, ce qui fait régresser les symptômes en quelques semaines. L’ingestion de jus de canneberge ou de pousse de brocoli aurait des effets similaires. Enfin, des essais vaccinaux n’ont pas été concluants jusqu’à présent.
Références
1.Hooi JKY, Lai WY, Ng WK, et al. Global prevalence of Helicobacter pylori infection. Systematic review and meta-analysis. Gastroenterol 2017;153(2):420-9.
2. Bravo D, Hoare A, Soto C, et al. Helicobacter pylori in human health and disease: mechanism for local gastric and systemic effects. World J Gastroenterol 2018; 24(28):3071-89.
3. Pohl D, Keller PM, Bordier V, et al. Review of current diagnostic methods and advance in Helicobacter pylori diagnostics in the era of next generation sequency. World J Gastroenterol 2019;25(32):4629-60.
4. Thung I, Aramin H, Vavinskaya V, et al. The global emergence of Helicobacter pylori antibiotic resistance. Aliment Pharmacol Ther 2016;43(4):514-33.
5. Haute Autorité de santé, Conseil national professionnel d’hépato-gastroentérologie. Pertinence des actes et prescriptions médicamenteuses chez un patient adulte infecté par Helicobacter pylori. Outil d’amélioration des pratiques professionnelles. Juin 2017.
6. Hu Y, Zhu Y, Lu NH. Novel and effective therapeutic regimens for Helicobacter pylori in an era of increasing antibiotic resistance. Front Cell Infect Microbiol 2017;7:168.
2. Bravo D, Hoare A, Soto C, et al. Helicobacter pylori in human health and disease: mechanism for local gastric and systemic effects. World J Gastroenterol 2018; 24(28):3071-89.
3. Pohl D, Keller PM, Bordier V, et al. Review of current diagnostic methods and advance in Helicobacter pylori diagnostics in the era of next generation sequency. World J Gastroenterol 2019;25(32):4629-60.
4. Thung I, Aramin H, Vavinskaya V, et al. The global emergence of Helicobacter pylori antibiotic resistance. Aliment Pharmacol Ther 2016;43(4):514-33.
5. Haute Autorité de santé, Conseil national professionnel d’hépato-gastroentérologie. Pertinence des actes et prescriptions médicamenteuses chez un patient adulte infecté par Helicobacter pylori. Outil d’amélioration des pratiques professionnelles. Juin 2017.
6. Hu Y, Zhu Y, Lu NH. Novel and effective therapeutic regimens for Helicobacter pylori in an era of increasing antibiotic resistance. Front Cell Infect Microbiol 2017;7:168.