Le virus West Nile est un flavivirus d’origine africaine. Il tire son nom du district de West Nile, en Ouganda, où il a été isolé pour la première fois en 1937 chez une patiente ayant une fièvre isolée. Il est transmis par des moustiques du genre Culex. Dans la nature, les réservoirs principaux sont les oiseaux.1 L’homme et les équidés sont des hôtes accidentels, après des piqûres de moustiques infectés. Cette arbovirose a longtemps été considérée comme mineure et très localisée géographiquement jusqu’à ce que des formes neurologiques sévères, à type d’encéphalites, et des épidémies soient identifiées. Nous détaillons ici les principales données récentes concernant l’épidémiologie, les signes cliniques, et les moyens diagnostiques et de prévention de cette arbovirose émergente en France et en Europe.
Modes de transmission
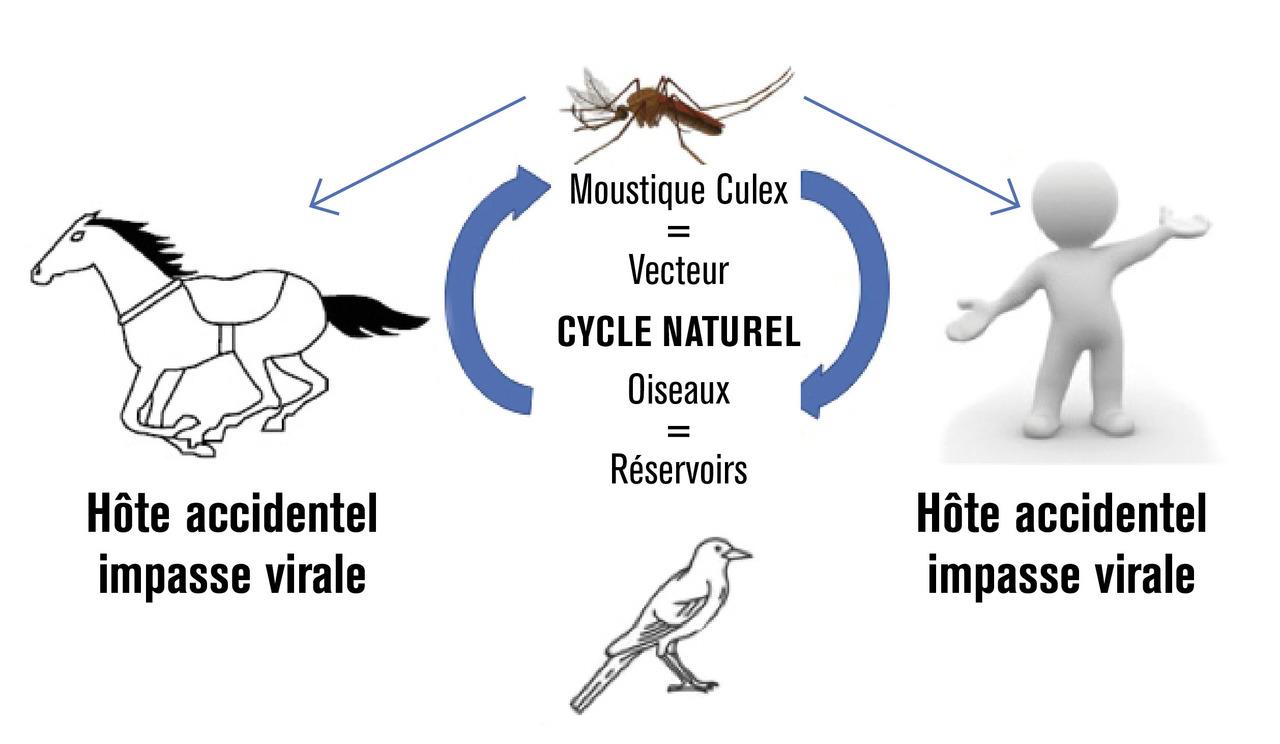
La transmission à l’être humain du virus West Nile se fait par l’intermédiaire de la piqûre des vecteurs que sont les moustiques du genre Culex (fig. 1 ).1 Ces moustiques sont contaminés en se nourrissant sur des oiseaux qui sont le réservoir naturel de la maladie et servent d’hôtes amplificateurs de l’infection (fig. 1 ). Chez l’homme et les chevaux, qui sont des hôtes accidentels, la virémie n’est pas assez importante pour entraîner une nouvelle transmission virale, ce qui en fait des « culs-de-sac épidémiologiques ». Il n’existe donc pas, à l’heure actuelle, de transmission vectorielle du cheval à l’homme ou d’homme à homme. Cependant, de rares cas de transmissions interhumaines après transfusion sanguine, transplantation d’organe ou par voie materno-fœtale ont été rapportés dans les années 2000 aux États-Unis.2 En France, cela a eu pour conséquence l’activation par l’Agence nationale de sécurité du médicament et des produits de santé d’une cellule d’aide à la décision pour l’exclusion éventuelle de donneurs de sang et d’organes dans les zones où des cas d’infection à virus West Nileétaient recensés.3
Des épidémies inédites en France et en Europe ces huit dernières années
Initialement, le virus West Nile était connu pour causer des épidémies localisées dans certains pays d’Afrique, en Asie et au Moyen-Orient. En Europe, des cas humains sont rapportés depuis les années 1960. Mais, depuis 1999, l’émergence d’un nouveau variant viral a coïncidé avec une recrudescence d’épidémies en Europe et avec l’importation de ce virus à New York (États-Unis), d’où il s’est propagé à toute l’Amérique du Nord où la maladie était jusqu’alors inexistante. Le virus y est désormais endémique, après une vague épidémique ayant balayé les États-Unis d’est en ouest.
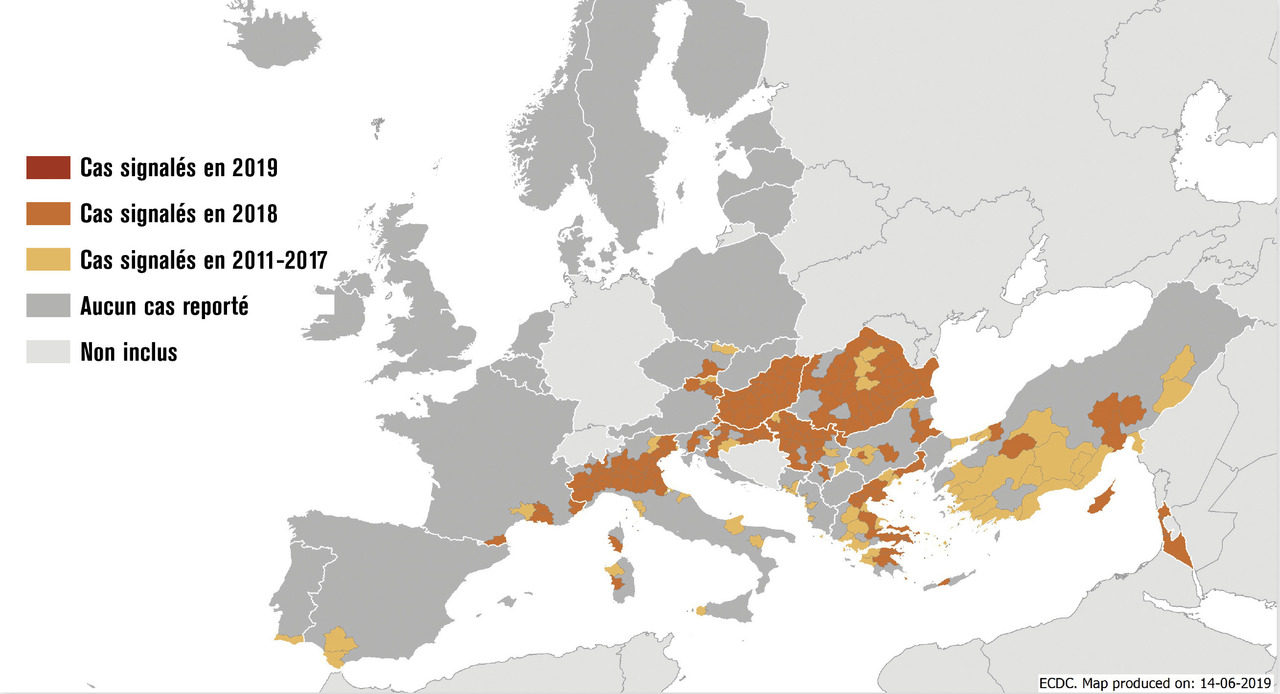
En zone tempérée, la circulation du virus West Nilea lieu de la fin du printemps à l’automne, ce qui correspond à la période d’activité des moustiques vecteurs.2 Sur les huit dernières années, l’Europe continentale et les pays du pourtour méditerranéen ont été particulièrement concernés par la propagation du virus chez les humains et les chevaux, avec un nombre de cas humains record en 2018 de 1 491, répartis dans 10 pays membres de l’Union européenne (fig. 2 ). En France, la première épidémie d’infections à virus West Nile touchant les chevaux et les humains a été rapportée en 1962 en Camargue ;4 d’autres épidémies ont ensuite été décrites dans les années 2000, toujours dans le sud-est de la France (Var).4 2018 a représenté aussi en France une année record en termes de nombre de cas humains, avec un total de 27 cas dont 22 dans la région Sud-Est, avec 7 formes neuro-invasives dont un cas de méningite à Marseille.3, 4 Les vétérinaires ont également identifié des cas chez 13 chevaux et 4 oiseaux en 2018.
En zone tempérée, la circulation du virus West Nilea lieu de la fin du printemps à l’automne, ce qui correspond à la période d’activité des moustiques vecteurs.2 Sur les huit dernières années, l’Europe continentale et les pays du pourtour méditerranéen ont été particulièrement concernés par la propagation du virus chez les humains et les chevaux, avec un nombre de cas humains record en 2018 de 1 491, répartis dans 10 pays membres de l’Union européenne (
Un syndrome pseudo-grippal
L’infection à virus West Nile peut être asymptomatique et il est estimé que 20 à 40 % des patients infectés vont avoir des signes cliniques,1 le plus fréquemment après une incubation de 3 à 15 jours. Les signes cliniques consistent en un syndrome pseudo-grippal avec fièvre, céphalées, arthralgies et courbatures définissant la « fièvre à virus West Nile ». Dans environ 1 % des cas, les patients peuvent développer des infections dites « neuro-invasives » sous forme de méningites, d’encéphalites, de paralysies flasques ou de syndromes de Guillain-Barré.1 Parmi ces formes sévères neuro-invasives, des cas mortels d’encéphalite ont été rapportés, principalement chez des patients de plus de 50 ans. La mortalité de l’infection varie en fonction du tableau clinique allant de 0 % en cas de fièvre isolée jusqu’à 46 à 50 % en cas d’encéphalite sévère ou de paralysie flasque du sujet âgé.1, 5 À l’inverse, les méningites pures semblent être de meilleur pronostic que les autres formes neuro-invasives de la maladie.1
Quels moyens diagnostiques ?
Comme pour les autres arboviroses, le diagnostic de l’infection à virus West Nile repose sur des techniques de diagnostic directes (reverse transcriptase-polymerase chain reaction [RT-PCR], culture) et indirectes (sérologie) en fonction de la durée d’évolution des symptômes. La RT-PCR peut être réalisée sur le sang périphérique, les urines et sur le liquide cérébrospinal en cas de signes neurologiques. Le Centre national de référence des arbovirus, localisé à Marseille, réalise ces analyses sur envoi des prélèvements.6
Diagnostic direct : RT-PCR spécifique et culture cellulaire
La détection de l’ARN du virus West Nile peut se faire dès le début des symptômes et pendant la phase fébrile grâce à des techniques de RT-PCR en temps réel sur tube de sang EDTA, sur les urines ou le liquide cérébrospinal.6 Néanmoins, la sensibilité de la RT-PCR diminue après le 4e jour de l’infection, avec un risque de faux négatif, et il s’agit donc d’un test de diagnostic précoce.1 Ces méthodes de diagnostic direct ont, en revanche, l’avantage d’être plus spécifiques que les sérologies pour lesquelles des réactions croisées peuvent être observées avec les autres arboviroses. Cette très bonne spécificité permet une identification certaine et une éventuelle détermination de types et sous-types viraux.1
L’isolement viral par culture sur des cultures cellulaires est plus délicat et nécessite des centres spécialisés. Elle peut être réalisée à partir de prélèvements positifs avec une charge virale importante tels que le sang ou le liquide céphalorachidien.
L’isolement viral par culture sur des cultures cellulaires est plus délicat et nécessite des centres spécialisés. Elle peut être réalisée à partir de prélèvements positifs avec une charge virale importante tels que le sang ou le liquide céphalorachidien.
Diagnostic indirect : sérologie
La sérologie détecte les anticorps spécifiques, immunoglobines (Ig) de type M ou G, dirigés contre le virus West Nile sur le sérum (tube sec) par la méthode ELISA.6 Les IgM sont détectables au plus tôt 5 à 6 jours après le début des symptômes. Toutefois, l’interprétation d’un résultat sérologique positif peut se heurter à l’existence de réactions croisées avec les autres arboviroses. Dans ce cas, l’existence d’une séroconversion ou une multiplication par 4 du titre des anticorps IgG anti-virus West Nile sur deux prélèvements consécutifs (à plus de 15 jours d’intervalle) confirme le diagnostic sérologique. Un test de séroneutralisation pratiqué dans un laboratoire spécialisé peut également confirmer le diagnostic. Les caractéristiques épidémiologiques et cliniques du patient doivent également être recueillies afin de déterminer laquelle des arboviroses est la plus probable.
Traitement, prévention et mesures de santé publique
Comme pour les autres arboviroses, il n’y a pas de traitement curatif. Le traitement est donc symptomatique pour les tableaux cliniques bénins ; une prise en charge hospitalière est parfois nécessaire, voire réanimatoire en cas d’atteinte neurologique sévère.
La prévention individuelle repose sur la protection contre les piqûres de moustiques dans les zones de circulation du virus. Elle consiste en l’utilisation de répulsifs cutanés à base de N,N-diéthyl-3-méthylbenzamide (DEET), le port de vêtements longs, et l’utilisation de moustiquaires imprégnées. La destruction des gîtes larvaires (eaux stagnantes) au sein des habitations individuelles est également recommandée.
Des mesures de santé publique ont été prises en France, un dispositif de surveillance saisonnière a été mis en place dans les zones géographiques où le risque de circulation du virus est important. Cette surveillance est pluridisciplinaire, avec un volet humain, équin et aviaire ;3 l’objectif est de repérer précocement la circulation du virus pour mettre en place des mesures de prévention et notamment la sécurisation du don de sang et d’organes.4 Les zones actuelles de surveillance renforcées sont 10 départements des régions Provence-Alpes-Côte d’Azur, la Corse et l’Occitanie.
La prévention individuelle repose sur la protection contre les piqûres de moustiques dans les zones de circulation du virus. Elle consiste en l’utilisation de répulsifs cutanés à base de N,N-diéthyl-3-méthylbenzamide (DEET), le port de vêtements longs, et l’utilisation de moustiquaires imprégnées. La destruction des gîtes larvaires (eaux stagnantes) au sein des habitations individuelles est également recommandée.
Des mesures de santé publique ont été prises en France, un dispositif de surveillance saisonnière a été mis en place dans les zones géographiques où le risque de circulation du virus est important. Cette surveillance est pluridisciplinaire, avec un volet humain, équin et aviaire ;3 l’objectif est de repérer précocement la circulation du virus pour mettre en place des mesures de prévention et notamment la sécurisation du don de sang et d’organes.4 Les zones actuelles de surveillance renforcées sont 10 départements des régions Provence-Alpes-Côte d’Azur, la Corse et l’Occitanie.
Références
1. Rizzoli A, Jimenez-Clavero MA, Barzon L, et al. The challenge of West Nile virus in Europe: knowledge gaps and research priorities. Euro Surveill 21 mai 2015;20(20).
2. Domanovi D, Gossner CM, Lieshout-Krikke R, et al. West Nile and Usutu virus infections and challenges to blood safety in the European Union. Emerg Infect Dis 2019;25:1050‑7.
3. Franke F, Grard G, Beck C, et al. Infections à virus West Nile en France, 2018. Journées nationales d’infectiologie, 5‑7 juin 2019.
4. Eldin C, Mailhe M, Zandotti C, et al. West Nile virus outbreak in the South of France: implications for travel medicine. Travel Med Infect Dis 2019;28:100‑1.
5. Yeung MW, Shing E, Nelder M, Sander B. Epidemiologic and clinical parameters of West Nile virus infections in humans: a scoping review. BMC Infect Dis 2017;17:609. http://bit.ly/3bvoDi7
6. Centre national de référence Arbovirus. Les envois de prélèvements. www.cnr-arbovirus.fr ou http://bit.ly/2UVHFbJ
2. Domanovi D, Gossner CM, Lieshout-Krikke R, et al. West Nile and Usutu virus infections and challenges to blood safety in the European Union. Emerg Infect Dis 2019;25:1050‑7.
3. Franke F, Grard G, Beck C, et al. Infections à virus West Nile en France, 2018. Journées nationales d’infectiologie, 5‑7 juin 2019.
4. Eldin C, Mailhe M, Zandotti C, et al. West Nile virus outbreak in the South of France: implications for travel medicine. Travel Med Infect Dis 2019;28:100‑1.
5. Yeung MW, Shing E, Nelder M, Sander B. Epidemiologic and clinical parameters of West Nile virus infections in humans: a scoping review. BMC Infect Dis 2017;17:609. http://bit.ly/3bvoDi7
6. Centre national de référence Arbovirus. Les envois de prélèvements. www.cnr-arbovirus.fr ou http://bit.ly/2UVHFbJ