Les dermo-hypodermites bactériennes nécrosantes et les fasciites nécrosantes, gravissimes, sont extrêmement rares en pédiatrie. Mais elles doivent être reconnues rapidement car ces infections bactériennes cutanées profondes nécessitent une stabilisation hémodynamique, une antibiothérapie et un traitement médico-chirurgical en urgence.
Bien que les infections cutanées soient très fréquentes en pédiatrie, les dermo-hypodermites bactériennes nécrosantes (DHBN), pouvant être associées à une fasciite nécrosante (FN), sont extrêmement rares.1 Les DHBN et les FN sont des infections bactériennes cutanées profondes pouvant, en quelques heures, entraîner de larges plages de nécrose et se compliquer d’un choc septique chez plus de la moitié des patients pédiatriques atteints.2 Ces infections sévères doivent donc être reconnues rapidement car le traitement médico-chirurgical est une urgence.
Destruction des tissus par nécrose
Des recommandations de bonne pratique récentes définissent les DHBN et les FN comme des infections nécrosantes du derme et de l’hypoderme pouvant atteindre le muscle, avec production d’endo- et d’exotoxines.3
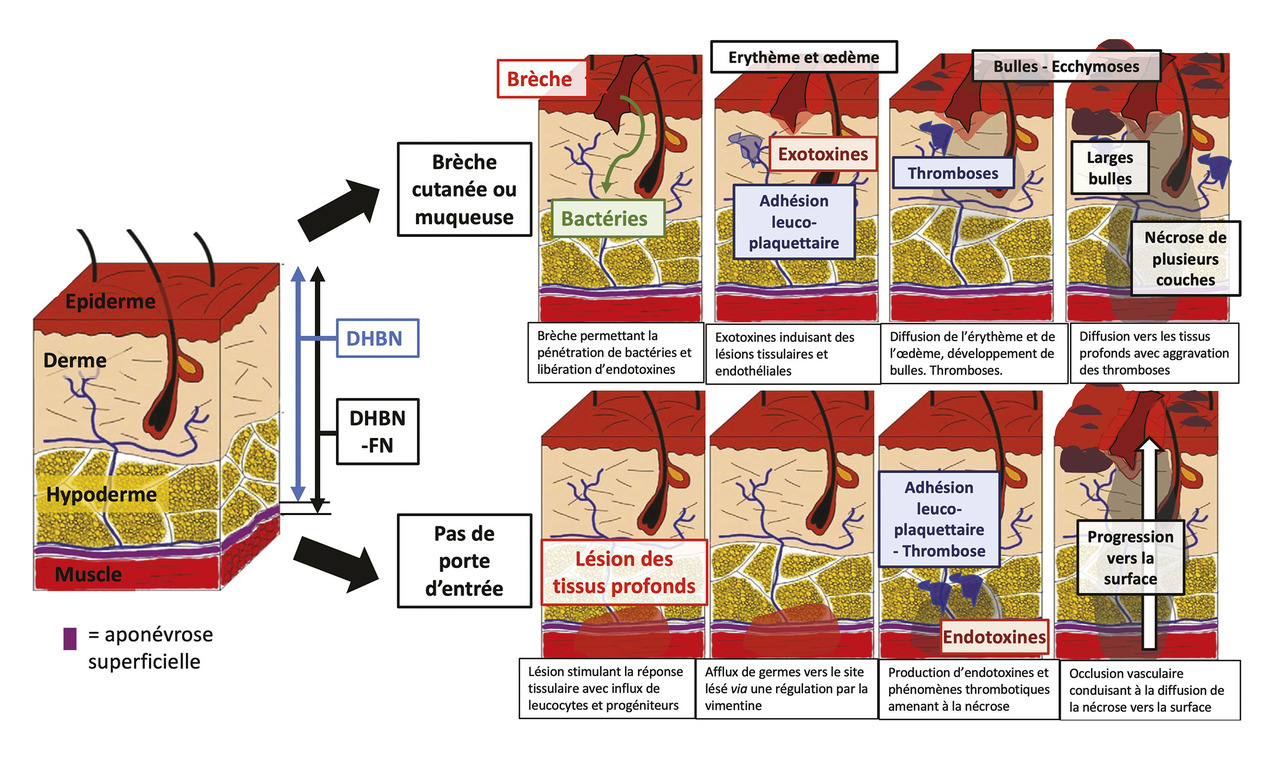
Dans la DHBN, il existe une nécrose des tissus conjonctifs et adipeux (derme et hypoderme) sans atteinte de l’aponévrose superficielle. La FN est définie par l’atteinte de l’aponévrose superficielle (fig. 1). Cette dernière ne modifiant pas la conduite thérapeutique, ces infections sont regroupées sous le sigle DHBN-FN, ou l’appellation plus générale d’infection nécrosante des tissus mous, traduction de l’appellation des Anglo-Saxons « necrotizing soft tissue infections » (NSTI).4
La destruction des tissus par nécrose est secondaire à des phénomènes de thrombose vasculaire associés à la libération locale de toxines et de cytokines. Leur diffusion systémique participe au développement d’un état de choc et à la survenue d’une défaillance multiviscérale. Certaines toxines peuvent notamment se comporter comme des « superantigènes » et induire un recrutement de lymphocytes T activés conduisant à des signes systémiques marqués. L’atteinte initiale peut se faire à partir d’une brèche cutanée (coupure, lésions de varicelle, dermatose, etc.) mais également à partir de lésions profondes tissulaires post-traumatiques ou non (fig. 1).4
Dans la DHBN, il existe une nécrose des tissus conjonctifs et adipeux (derme et hypoderme) sans atteinte de l’aponévrose superficielle. La FN est définie par l’atteinte de l’aponévrose superficielle (fig. 1). Cette dernière ne modifiant pas la conduite thérapeutique, ces infections sont regroupées sous le sigle DHBN-FN, ou l’appellation plus générale d’infection nécrosante des tissus mous, traduction de l’appellation des Anglo-Saxons « necrotizing soft tissue infections » (NSTI).4
La destruction des tissus par nécrose est secondaire à des phénomènes de thrombose vasculaire associés à la libération locale de toxines et de cytokines. Leur diffusion systémique participe au développement d’un état de choc et à la survenue d’une défaillance multiviscérale. Certaines toxines peuvent notamment se comporter comme des « superantigènes » et induire un recrutement de lymphocytes T activés conduisant à des signes systémiques marqués. L’atteinte initiale peut se faire à partir d’une brèche cutanée (coupure, lésions de varicelle, dermatose, etc.) mais également à partir de lésions profondes tissulaires post-traumatiques ou non (fig. 1).4
Deux types de DHBN-FN
Les DHBN-FN de l’enfant sont réparties en deux types selon les germes impliqués : les infections monomicrobiennes, communautaires, essentiellement l’apanage des Cocci à Gram positif, tels que le Staphylococcus aureus (SA) et les streptocoques β-hémolytiques du groupe A (SBHA ; DHBN-FN de type II), et les infections polymicrobiennes, fréquemment liées aux soins, impliquant des Cocci à Gram positif (tous types de streptocoques et de staphylocoques, dont le SA), des entérobactéries (Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae, Proteus sp…) et des germes anaérobies (DHBN-FN de type I).6
Depuis plusieurs années, aux États-Unis, émergent des souches de SA résistantes à la méticilline (SARM) dans les infections cutanées communautaires de l’enfant, pouvant même être résistantes à la clindamycine, ainsi que des souches productrices de toxines très virulentes telles que la leucocidine de Panton-Valentine (LPV). Ces souches sont moins fréquentes en France (12 % de SARM dans une série récente de patients atteints de DHBN-FN hospitalisés en unité de réanimation pédiatrique [URP]), mais il est important de les évoquer face à des tableaux cliniques associant fièvre, rash scarlatiniforme, hypotension artérielle pour l’âge, coagulation intravasculaire disséminée (CIVD), voire défaillance multiviscérale.
Depuis plusieurs années, aux États-Unis, émergent des souches de SA résistantes à la méticilline (SARM) dans les infections cutanées communautaires de l’enfant, pouvant même être résistantes à la clindamycine, ainsi que des souches productrices de toxines très virulentes telles que la leucocidine de Panton-Valentine (LPV). Ces souches sont moins fréquentes en France (12 % de SARM dans une série récente de patients atteints de DHBN-FN hospitalisés en unité de réanimation pédiatrique [URP]), mais il est important de les évoquer face à des tableaux cliniques associant fièvre, rash scarlatiniforme, hypotension artérielle pour l’âge, coagulation intravasculaire disséminée (CIVD), voire défaillance multiviscérale.
Pathologies rares, plus fréquentes chez les garçons
Chez l’enfant, les DHBN-FN sont des pathologies rares. Leur incidence est estimée entre 0,08 et 0,1/100 000 enfants par an.1,2,5 Il semble néanmoins exister des variations géographiques : l’incidence semble nettement plus élevée dans les pays à faibles revenus.
L’âge médian est de 5 ans,1,2,5 et cette pathologie semble plus fréquente chez les garçons (de 55 à 60 %). Dans 77 à 84 % des cas, il existe un facteur favorisant ou une comorbidité.1,2 On observe une certaine corrélation entre le terrain des patients et le type de germe impliqué. Ainsi, les infections monomicrobiennes, qu’elles soient à SA ou SBHA, surviennent le plus souvent chez des enfants sans aucun antécédent.1,5 Il a été montré dans plusieurs études que, pour les DHBN-FN à SBHA de l’enfant, le facteur de risque le plus important est un antécédent de varicelle dans le mois qui précède.7 Bien qu’avancée dans de nombreuses publications, l’implication de la prise d’anti-inflammatoires non stéroïdiens (AINS) au cours de l’épisode de varicelle comme facteur de risque de DBHN-FN à SBHA reste une notion controversée.1 Les DHBN-FN monomicrobiennes peuvent également survenir en cas de pathologie cutanée sous-jacente, allant de l’effraction (plaies ou brûlures) à des traumatismes fermés.1 En cas d’infection polymicrobienne, en revanche, il existe le plus souvent un terrain sous-jacent particulier (dénutrition, diabète, neutropénie post-chimiothérapie, corticothérapie) ou un contexte évocateur (DHBN-FN liée aux soins dans le cadre d’un traumatisme ouvert, d’une chirurgie ou de la présence d’une prothèse de type cathéter central).8
Bien que la mortalité soit nettement plus faible que chez l’adulte,9 elle est de l’ordre de 6 % dans la majorité des séries pédiatriques, soit plus élevée que la mortalité habituelle en URP.2,10
L’âge médian est de 5 ans,1,2,5 et cette pathologie semble plus fréquente chez les garçons (de 55 à 60 %). Dans 77 à 84 % des cas, il existe un facteur favorisant ou une comorbidité.1,2 On observe une certaine corrélation entre le terrain des patients et le type de germe impliqué. Ainsi, les infections monomicrobiennes, qu’elles soient à SA ou SBHA, surviennent le plus souvent chez des enfants sans aucun antécédent.1,5 Il a été montré dans plusieurs études que, pour les DHBN-FN à SBHA de l’enfant, le facteur de risque le plus important est un antécédent de varicelle dans le mois qui précède.7 Bien qu’avancée dans de nombreuses publications, l’implication de la prise d’anti-inflammatoires non stéroïdiens (AINS) au cours de l’épisode de varicelle comme facteur de risque de DBHN-FN à SBHA reste une notion controversée.1 Les DHBN-FN monomicrobiennes peuvent également survenir en cas de pathologie cutanée sous-jacente, allant de l’effraction (plaies ou brûlures) à des traumatismes fermés.1 En cas d’infection polymicrobienne, en revanche, il existe le plus souvent un terrain sous-jacent particulier (dénutrition, diabète, neutropénie post-chimiothérapie, corticothérapie) ou un contexte évocateur (DHBN-FN liée aux soins dans le cadre d’un traumatisme ouvert, d’une chirurgie ou de la présence d’une prothèse de type cathéter central).8
Bien que la mortalité soit nettement plus faible que chez l’adulte,9 elle est de l’ordre de 6 % dans la majorité des séries pédiatriques, soit plus élevée que la mortalité habituelle en URP.2,10
Manifestations cliniques progressives selon le principe de « l’iceberg »
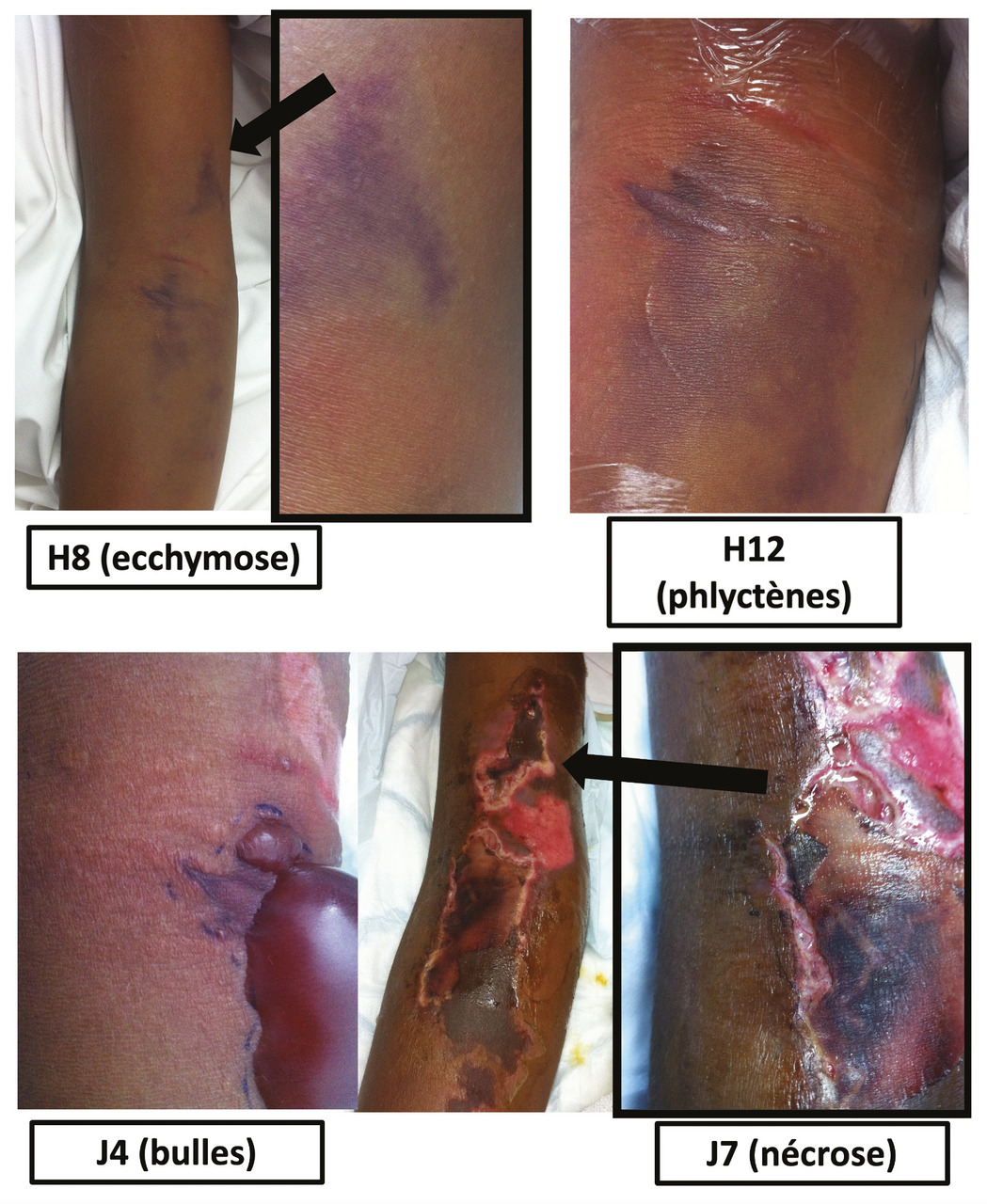
Le diagnostic précoce de ce type d’infection est difficile, car les signes cliniques initiaux sont peu nombreux et peu spécifiques. En effet, la symptomatologie initiale, et notamment l’aspect de la lésion cutanée, ne préjuge en rien de la profondeur de l’infection et de la présence ou non de nécrose. Dans les DHBN-FN, l’infection s’étend d’abord entre le tissu sous-cutané et l’aponévrose musculaire, où elle entraîne une nécrose diffuse, avant de progresser dans un second temps vers la peau superficielle selon le principe de « l’iceberg ».4 La distinction clinique à un stade précoce, alors que la nécrose n’est pas encore visible, est très difficile entre une DHB non nécrosante et une DHBN. En effet, la symptomatologie initiale est commune à celle des DHB non nécrosantes, avec des signes inflammatoires locaux (œdème, érythème, chaleur) auxquels s’ajoutent une induration et une douleur souvent intense et disproportionnée par rapport aux signes locaux, s’étendant au-delà de la zone érythémateuse. Des lésions d’ecchymose apparaissent (taches bleues et grises mal limitées en carte de géographie), puis des vésicules qui, en confluant, forment de véritables bulles (fig. 2 ). Les lésions de nécrose associées à une hypoesthésie sont des signes de DHBN-FN à un stade avancé bien que la nécrose soit cliniquement présente au diagnostic dans un tiers des cas, d’après les publications pédiatriques les plus récentes.1,2
À la phase précoce, les arguments cliniques en faveur d’une DHBN-FN par rapport à une DHB non nécrosante se fondent donc sur la présence d’une douleur intense mais également sur la rapidité d’évolution des lésions cutanées qui doivent être délimitées avec un marqueur (voire photographiées régulièrement) et fréquemment réévaluées. Sur le plan général, on recherche un rash érythémateux généralisé, une polypnée, une fièvre élevée, un aspect toxique ou un taux de plaquettes bas.11
Contrairement à l’adulte où les membres inférieurs représentent la topographie la plus fréquente, les atteintes du tronc, de la région cervicale et des membres supérieurs sont prépondérantes chez l’enfant (de 65 à 75 % des cas).1,2 Au niveau des membres, l’étendue des lésions est souvent bien supérieure à celle suggérée par l’examen clinique du fait de l’extension en profondeur le long des fascias, plutôt que vers la superficie. En cas de localisation cervico-thoracique, une extension possible vers le médiastin est à craindre.
À la phase précoce, les arguments cliniques en faveur d’une DHBN-FN par rapport à une DHB non nécrosante se fondent donc sur la présence d’une douleur intense mais également sur la rapidité d’évolution des lésions cutanées qui doivent être délimitées avec un marqueur (voire photographiées régulièrement) et fréquemment réévaluées. Sur le plan général, on recherche un rash érythémateux généralisé, une polypnée, une fièvre élevée, un aspect toxique ou un taux de plaquettes bas.11
Contrairement à l’adulte où les membres inférieurs représentent la topographie la plus fréquente, les atteintes du tronc, de la région cervicale et des membres supérieurs sont prépondérantes chez l’enfant (de 65 à 75 % des cas).1,2 Au niveau des membres, l’étendue des lésions est souvent bien supérieure à celle suggérée par l’examen clinique du fait de l’extension en profondeur le long des fascias, plutôt que vers la superficie. En cas de localisation cervico-thoracique, une extension possible vers le médiastin est à craindre.
Bilan biologique et hémocultures en urgence
En cas de DHBN-FN, les examens biologiques révèlent des signes d’infection sévère : hyperleucocytose à polynucléaires neutrophiles, thrombopénie, protéine C-réactive (CRP) élevée (pour certains auteurs, plus élevés qu’en cas de DHB non nécrosante). Chez l’adulte, le score LRINEC (laboratory risk indicator for necrotizing fasciitis) a été proposé afin d’aider au diagnostic de FN12, mais il n’a pas été validé chez l’enfant. Il prend en compte les taux de CRP, de leucocytes et d’hémoglobine, la natrémie, la créatininémie et la glycémie. Le faible nombre de cas inclus (51 patients) dans l’étude prospective pédiatrique multicentrique internationale la plus récente n’a pas permis de tester ces items comme facteurs pronostiques chez l’enfant.2
Par ailleurs, une lactatémie et des hémocultures aéro-/anaérobies doivent être réalisées dans l’heure suivant la suspicion diagnostique en suivant les dernières recommandations de la Surviving Sepsis Campaign ;13 la lactatémie initiale est un facteur pronostique important chez l’adulte.14
Par ailleurs, une lactatémie et des hémocultures aéro-/anaérobies doivent être réalisées dans l’heure suivant la suspicion diagnostique en suivant les dernières recommandations de la Surviving Sepsis Campaign ;13 la lactatémie initiale est un facteur pronostique important chez l’adulte.14
Diagnostic formel et bilan d’extension grâce à l’imagerie
Si elle ne doit jamais retarder le début du traitement, l’imagerie peut être intéressante en documentant l’atteinte cutanée profonde et en permettant un bilan d’extension (tissu sous-cutané, muscle, os, articulation) avant l’apparition d’une nécrose cutanée, signe évolutif tardif.
L’échographie, examen non irradiant et facilement réalisable au lit du malade, peut être utile et montrer une infiltration de l’hypoderme, qui apparaît hyperéchogène. Un épaississement du fascia associé à la présence de liquide, un abcès compartimenté dans le plan du fascia et un œdème du derme et de l’hypoderme sont des arguments en faveur d’une FN. Toutefois, les douleurs peuvent gêner sa réalisation.
La tomodensitométrie permet de rechercher des asymétries d’épaississement des fascias et une infiltration de l’hypoderme, permettant un premier bilan d’extension des DHBN-FN. La présence de bulles gazeuses est variable. L’injection de produit de contraste peut permettre de mieux visualiser les fascias profonds. En cas de localisation cervico-faciale, sa réalisation est fortement recommandée du fait du risque d’extension médiastinale à partir de l’espace pharyngé postérieur, pour permettre de guider le geste opératoire et la nécessité d’un éventuel temps thoracique.
Enfin, l’imagerie par résonance magnétique (IRM) est l’examen d’imagerie le plus performant pour le diagnostic des DHBN-FN et pour l’évaluation de leur extension.15 La présence de collections gazeuses sur l’ensemble des séquences, l’atteinte de plusieurs fascias intermusculaires, l’épaississement des fascias (supérieur à 3 mm) en séquence T2 avec saturation de graisse et l’absence complète ou partielle de rehaussement des fascias atteints après injection de produit de contraste en séquence T1 sont des critères en faveur des FN. Il s’agit d’un examen long, qui nécessite la mobilisation d’un malade souvent instable, et qui n’est pas toujours disponible 24 h/24 dans chaque centre hospitalier. Aussi, la réalisation d’une IRM est-elle à discuter au cas par cas, après stabilisation initiale du patient, quand le bilan des lésions est fondamental pour décider du projet thérapeutique. Celle-ci ne doit jamais retarder le traitement médico-chirurgical.
L’échographie, examen non irradiant et facilement réalisable au lit du malade, peut être utile et montrer une infiltration de l’hypoderme, qui apparaît hyperéchogène. Un épaississement du fascia associé à la présence de liquide, un abcès compartimenté dans le plan du fascia et un œdème du derme et de l’hypoderme sont des arguments en faveur d’une FN. Toutefois, les douleurs peuvent gêner sa réalisation.
La tomodensitométrie permet de rechercher des asymétries d’épaississement des fascias et une infiltration de l’hypoderme, permettant un premier bilan d’extension des DHBN-FN. La présence de bulles gazeuses est variable. L’injection de produit de contraste peut permettre de mieux visualiser les fascias profonds. En cas de localisation cervico-faciale, sa réalisation est fortement recommandée du fait du risque d’extension médiastinale à partir de l’espace pharyngé postérieur, pour permettre de guider le geste opératoire et la nécessité d’un éventuel temps thoracique.
Enfin, l’imagerie par résonance magnétique (IRM) est l’examen d’imagerie le plus performant pour le diagnostic des DHBN-FN et pour l’évaluation de leur extension.15 La présence de collections gazeuses sur l’ensemble des séquences, l’atteinte de plusieurs fascias intermusculaires, l’épaississement des fascias (supérieur à 3 mm) en séquence T2 avec saturation de graisse et l’absence complète ou partielle de rehaussement des fascias atteints après injection de produit de contraste en séquence T1 sont des critères en faveur des FN. Il s’agit d’un examen long, qui nécessite la mobilisation d’un malade souvent instable, et qui n’est pas toujours disponible 24 h/24 dans chaque centre hospitalier. Aussi, la réalisation d’une IRM est-elle à discuter au cas par cas, après stabilisation initiale du patient, quand le bilan des lésions est fondamental pour décider du projet thérapeutique. Celle-ci ne doit jamais retarder le traitement médico-chirurgical.
Quelle prise en charge thérapeutique ?
Le traitement initial des DHBN-FN est aspécifique mais repose sur un traitement médico-chirurgical dont la précocité modifie clairement le pronostic.
En cas de présentation initiale au stade de choc septique, celui-ci doit être pris en charge en salle de déchocage des urgences pédiatriques, en suivant les dernières recommandations de la Surviving Sepsis Campaign :13 initialement, réalisation de remplissage vasculaire (RV) permettant de lutter contre l’hypovolémie intense due à la majoration des pertes insensibles, au retard d’apport dans les jours précédant l’admission et à l’évolutivité du choc septique. Chaque RV doit être systématiquement suivi d’une réévaluation clinique scrupuleuse visant à préciser la réponse au traitement et l’apparition d’une dysfonction cardiaque débutante à l’origine d’une augmentation de la précharge cardiaque, qui motiverait l’arrêt des expansions volumiques. En cas de persistance des troubles hémodynamiques malgré un RV adéquat, l’adjonction de noradrénaline doit être précocement associée à un transfert en réanimation.
En cas de présentation initiale au stade de choc septique, celui-ci doit être pris en charge en salle de déchocage des urgences pédiatriques, en suivant les dernières recommandations de la Surviving Sepsis Campaign :13 initialement, réalisation de remplissage vasculaire (RV) permettant de lutter contre l’hypovolémie intense due à la majoration des pertes insensibles, au retard d’apport dans les jours précédant l’admission et à l’évolutivité du choc septique. Chaque RV doit être systématiquement suivi d’une réévaluation clinique scrupuleuse visant à préciser la réponse au traitement et l’apparition d’une dysfonction cardiaque débutante à l’origine d’une augmentation de la précharge cardiaque, qui motiverait l’arrêt des expansions volumiques. En cas de persistance des troubles hémodynamiques malgré un RV adéquat, l’adjonction de noradrénaline doit être précocement associée à un transfert en réanimation.
Antibiothérapie, d’abord probabiliste et fonction du contexte
L’antibiothérapie probabiliste doit associer des antibiotiques qui diffusent parfaitement dans les parties molles et qui ciblent les bactéries les plus fréquemment en cause. Elle est adaptée au contexte clinique et à l’épidémiologie bactérienne locale (tableau ).
Dans les suites d’une varicelle associée ou non à la prise d’AINS, l’antibiothérapie cible le SBHA et dans une moindre mesure le SA ainsi que ses toxines potentielles (amoxicilline + acide clavulanique + clindamycine). En cas d’infection dans les suites d’une chirurgie abdominale ou de DHBN-FN du siège, on choisit une antibiothérapie active contre les entérobactéries, les Cocci à Gram positif et les germes anaérobies (tazocilline + amikacine +/- métronidazole). En cas de patient neutropénique ou immunodéprimé, on opte pour une association efficace sur le P. aeruginosa et les autres entérobactéries (tazocilline + amikacine). Enfin, en l’absence de contexte particulier, on choisit par ordre de fréquence une association d’antibiotiques majoritairement active sur le SBHA, le SA et certaines entérobactéries, à bonne diffusion cutanée et comportant une activité antitoxinique (amoxicilline + acide clavulanique + clindamycine). La clindamycine, en plus de son effet postantibiotique et de son activité antianaérobie, inhibe la production des principales toxines produites par SA et SBHA.
Après identification bactériologique, l’antibiothérapie est adaptée, en réduisant son spectre. La pénicilline A reste l’antibiotique de choix contre le SBHA et la pénicilline M en cas d’infection à SA sensible à la méticilline. En présence de résistance à la méticilline, la vancomycine est préconisée, avec un dosage régulier des taux résiduels pour s’assurer d’être dans les zones thérapeutiques et limiter au minimum la toxicité. Dans tous les cas, on conserve une association avec un antibiotique à activité antitoxinique, comme la clindamycine, en veillant particulièrement à l’absence de résistance dès le résultat du premier antibiogramme. Le linézolide, qui réduit les toxines produites par le SA, peut être utilisé à la place de la clindamycine, notamment en cas de SARM, mais il ne doit pas être utilisé seul à la phase initiale en cas de choc septique du fait de son effet uniquement bactériostatique.
Dans les suites d’une varicelle associée ou non à la prise d’AINS, l’antibiothérapie cible le SBHA et dans une moindre mesure le SA ainsi que ses toxines potentielles (amoxicilline + acide clavulanique + clindamycine). En cas d’infection dans les suites d’une chirurgie abdominale ou de DHBN-FN du siège, on choisit une antibiothérapie active contre les entérobactéries, les Cocci à Gram positif et les germes anaérobies (tazocilline + amikacine +/- métronidazole). En cas de patient neutropénique ou immunodéprimé, on opte pour une association efficace sur le P. aeruginosa et les autres entérobactéries (tazocilline + amikacine). Enfin, en l’absence de contexte particulier, on choisit par ordre de fréquence une association d’antibiotiques majoritairement active sur le SBHA, le SA et certaines entérobactéries, à bonne diffusion cutanée et comportant une activité antitoxinique (amoxicilline + acide clavulanique + clindamycine). La clindamycine, en plus de son effet postantibiotique et de son activité antianaérobie, inhibe la production des principales toxines produites par SA et SBHA.
Après identification bactériologique, l’antibiothérapie est adaptée, en réduisant son spectre. La pénicilline A reste l’antibiotique de choix contre le SBHA et la pénicilline M en cas d’infection à SA sensible à la méticilline. En présence de résistance à la méticilline, la vancomycine est préconisée, avec un dosage régulier des taux résiduels pour s’assurer d’être dans les zones thérapeutiques et limiter au minimum la toxicité. Dans tous les cas, on conserve une association avec un antibiotique à activité antitoxinique, comme la clindamycine, en veillant particulièrement à l’absence de résistance dès le résultat du premier antibiogramme. Le linézolide, qui réduit les toxines produites par le SA, peut être utilisé à la place de la clindamycine, notamment en cas de SARM, mais il ne doit pas être utilisé seul à la phase initiale en cas de choc septique du fait de son effet uniquement bactériostatique.
Traitement chirurgical dans les 24 premières heures
Dès la suspicion clinique, le chirurgien doit être associé à la prise en charge et participer à l’évaluation clinique pluriquotidienne des lésions cutanées. La difficulté principale est de définir le moment optimal de l’intervention chirurgicale. Les données de la littérature pédiatriques sont pauvres et suggèrent que la précocité du traitement chirurgical est associée au pronostic ; le geste chirurgical serait ainsi à réaliser idéalement durant les vingt-quatre premières heures de prise en charge.7,16,17 Les études sont plus nombreuses chez l’adulte et, si la plupart confirment l’importance d’une intervention chirurgicale précoce et systématique en cas de choc septique, le temps nécessaire à la stabilisation préopératoire du patient fait qu’ils sont souvent opérés plus tardivement que les autres (14 heures versus 9 heures en moyenne).18 Ainsi, un diagnostic de DHBN-FN doit faire envisager une prise en charge chirurgicale d’autant plus précoce que le patient était initialement instable sur le plan hémodynamique. Compte tenu de la rareté de ces infections chez l’enfant et de la faible expérience des équipes, le réanimateur pédiatrique doit s’attacher à faire le lien entre les différents acteurs médico-chirurgicaux tout en prenant en charge rapidement le choc septique pour permettre le passage au bloc opératoire. La chirurgie pouvant être prolongée, le patient doit être parfaitement stabilisé, tant du point de vue ventilatoire qu’hémodynamique avant tout transfert au bloc opératoire.
En cas d’absence de choc septique, certains patients peuvent évoluer favorablement sans chirurgie. Dans une série récente pédiatrique, une prise en charge chirurgicale était réalisée uniquement dans 68 % des cas contre 100 % chez l’adulte, et la mortalité observée était inférieure à celle retrouvée chez l’adulte (6 contre 12 %).2,9 Si une abstention première est décidée, une surveillance médico-chirurgicale très rapprochée des signes locaux doit être réalisée, au mieux en unité de soins intensifs pédiatriques (ancienne USC [unité de surveillance continue]) pour réévaluer à tout moment l’indication chirurgicale.
En cas d’absence de choc septique, certains patients peuvent évoluer favorablement sans chirurgie. Dans une série récente pédiatrique, une prise en charge chirurgicale était réalisée uniquement dans 68 % des cas contre 100 % chez l’adulte, et la mortalité observée était inférieure à celle retrouvée chez l’adulte (6 contre 12 %).2,9 Si une abstention première est décidée, une surveillance médico-chirurgicale très rapprochée des signes locaux doit être réalisée, au mieux en unité de soins intensifs pédiatriques (ancienne USC [unité de surveillance continue]) pour réévaluer à tout moment l’indication chirurgicale.
Traitements adjuvants : immunoglobulines et oxygénothérapie encore mal évaluées en pédiatrie
Du fait de l’inflammation locale importante, ces patients sont à risque de thrombose, et un traitement anticoagulant préventif doit être initié afin de prévenir le risque thromboembolique chez les patients pubères, en accord avec le chirurgien. Si les héparines de bas poids moléculaire sont désormais faciles à utiliser chez l’enfant, l’héparine non fractionnée est privilégiée à la phase initiale du fait du risque de chirurgie en urgence.
Chez l’enfant avec neutropénies prolongées, le traitement médico-chirurgical est complété par l’apport de facteurs de croissance de la lignée granulocytaire et la transfusion de leucocytes, après accord des médecins spécialistes.
L’utilisation des immunoglobulines polyvalentes est depuis longtemps proposée comme traitement adjuvant des DHBN-FN, notamment pour l’effet immunomodulateur par liaison aux superantigènes. Toutefois, il n’existe à l’heure actuelle aucune preuve de son efficacité dans la littérature. En cas de DHBN-FN sévère de l’enfant avec signes toxiniques, une transfusion d’immunoglobulines (1 g/kg deux jours de suite) en complément du traitement antibiotique pourrait être discutée au cas par cas bien que l’effet sur le pronostic ne soit pas démontré.19
L’oxygénothérapie hyperbare est actuellement beaucoup utilisée chez l’adulte (jusqu’à 80 % des cas)9 puisqu’une large étude multicentrique a montré une réduction de la mortalité d’un facteur 2 chez les patients en bénéficiant.20 Ce traitement permet d’avoir un effet bactéricide sur les germes anaérobies ainsi qu’une amélioration de l’oxygénation tissulaire et de la phagocytose, mais également une meilleure cicatrisation des incisions chirurgicales dans la phase postopératoire en cas de plaies très délabrantes. Toutefois, là encore, il n’existe actuellement aucune donnée robuste en pédiatrie, et ce traitement peut être proposé en cas d’accès facile à un caisson hyperbare, après stabilisation initiale, et en complément du traitement médico-chirurgical.
Chez l’enfant avec neutropénies prolongées, le traitement médico-chirurgical est complété par l’apport de facteurs de croissance de la lignée granulocytaire et la transfusion de leucocytes, après accord des médecins spécialistes.
L’utilisation des immunoglobulines polyvalentes est depuis longtemps proposée comme traitement adjuvant des DHBN-FN, notamment pour l’effet immunomodulateur par liaison aux superantigènes. Toutefois, il n’existe à l’heure actuelle aucune preuve de son efficacité dans la littérature. En cas de DHBN-FN sévère de l’enfant avec signes toxiniques, une transfusion d’immunoglobulines (1 g/kg deux jours de suite) en complément du traitement antibiotique pourrait être discutée au cas par cas bien que l’effet sur le pronostic ne soit pas démontré.19
L’oxygénothérapie hyperbare est actuellement beaucoup utilisée chez l’adulte (jusqu’à 80 % des cas)9 puisqu’une large étude multicentrique a montré une réduction de la mortalité d’un facteur 2 chez les patients en bénéficiant.20 Ce traitement permet d’avoir un effet bactéricide sur les germes anaérobies ainsi qu’une amélioration de l’oxygénation tissulaire et de la phagocytose, mais également une meilleure cicatrisation des incisions chirurgicales dans la phase postopératoire en cas de plaies très délabrantes. Toutefois, là encore, il n’existe actuellement aucune donnée robuste en pédiatrie, et ce traitement peut être proposé en cas d’accès facile à un caisson hyperbare, après stabilisation initiale, et en complément du traitement médico-chirurgical.
Infections très rares mais gravissimes
Bien que les DHBN-FN soient extrêmement rares en pédiatrie, elles doivent être parfaitement connues de tous. En effet, malgré une symptomatologie locale initiale pauvre, l’évolution peut être gravissime. La stabilisation hémodynamique et l’initiation du traitement antibiotique doivent être une priorité. Le chirurgien doit également être impliqué dès la suspicion clinique et participer à la réévaluation pluriquotidienne en secteur de soins intensifs afin de déterminer le moment optimal pour réaliser un traitement chirurgical. Du fait de la rareté des DHBN-FN et de la nécessité de disposer d’un plateau médico-chirurgical et radiologique afin d’améliorer le parcours de soins, l’expertise des équipes et le pronostic des patients, une filière spécifique adulte-enfant a été mise en place récemment au sein de l’AP-HP pour la prise en charge de ces pathologies.
Références
1. Schröder A, Gerin A, Firth GB, Hoffmann KS, Grieve A, Oetzmann von Sochaczewski C. A systematic review of necrotising fasciitis in children from its first description in 1930 to 2018. BMC Infect Dis 2019;19(1):317.
2. Dauger S, Blondé R, Brissaud O, Marcoux MO, Angoulvant F, Levy M, et al. Necrotizing soft-tissue infections in pediatric intensive care: A prospective multicenter case-series study. Crit Care 2021;25(1):139.
3. Haute Autorité de santé. Prise en charge des infections cutanées bactériennes courantes - Recommandations de bonne pratique clinique. 2019. https://vu.fr/lfPbP
4. Stevens DL, Bryant AE. Necrotizing soft-tissue infections. N Engl J Med 2017;377(23):2253‑65.
5. Zundel S, Lemaréchal A, Kaiser P, Szavay P. Diagnosis and treatment of pediatric necrotizing fasciitis: A systematic review of the literature. Eur J Pediatr Surg 2017;27(2):127‑37.
6. Lancerotto L, Tocco I, Salmaso R, Vindigni V, Bassetto F. Necrotizing fasciitis: Classification, diagnosis, and management. J Trauma Acute Care Surg 2012;72(3):560‑6.
7. Endorf FW, Garrison MM, Klein MB, Richardson A, Rivara FP. Characteristics, therapies, and outcome of children with necrotizing soft tissue infections. Pediatr Infect Dis J 2012;31(3):221‑3.
8. Atger L, Deho A, Apostolou N, Levy M. Necrotizing soft tissue infection following femoral venous catheter infection. Intensive Care Med 2018;44:976‑7.
9. Madsen MB, Skrede S, Perner A, Arnell P, Nekludov M, Bruun T, et al. Patient’s characteristics and outcomes in necrotising soft-tissue infections: Results from a Scandinavian, multicentre, prospective cohort study. Intensive Care Med 2019;45(9):1241‑51.
10. Totapally BR. Epidemiology and outcomes of hospitalized children with necrotizing soft-tissue infections. Pediatr Infect Dis J 2017;36(7):641‑4.
11. Sullivan TB, Bastrom TP, Marino N, Edmonds EW. Presenting features of extremity necrotizing fasciitis in the pediatric patient: A case-control analysis. J Pediatr Orthop B 2018;27(5):461‑6.
12. Wong CH, Khin LW, Heng KS, Tan KC, Low CO. The LRINEC (Laboratory Risk Indicator for Necrotizing Fasciitis) score: A tool for distinguishing necrotizing fasciitis from other soft tissue infections. Crit Care Med 2004;32(7):1535‑41.
13. Weiss SL, Peters MJ, Alhazzani W, Agus MSD, Flori HR, Inwald DP, et al. Surviving sepsis campaign international guidelines for the management of septic shock and sepsis-associated organ dysfunction in children. Intensive Care Med 2020;46(Suppl 1):10‑67.
14. van Stigt S, Knubben M, Schrooten T, Tan E. Prognostic factors for mortality in 123 severe cases of necrotizing fasciitis in 5 hospitals in the Netherlands between 2003 and 2017. Eur J Trauma Emerg Surg 2022;48(2):1189‑95.
15. Kim KT, Kim YJ, Won Lee J, Kim YJ, Park SW, Lim MK, et al. Can necrotizing infectious fasciitis be differentiated from nonnecrotizing infectious fasciitis with MR imaging? Radiology 2011;259(3):816‑24.
16. Dauger S, Benhayoun M, Touzot F, Bonnard A. Images in neonatal medicine. Abdominal cellulitis due to Escherichia coli in a two month old premature newborn. Arch Dis Child Fetal Neonatal Ed 2006;91(6):F442.
17. Gerard D, Mariani-Kurkdjian P, Sachs P, Berrebi D, Van-Den-Abbeele T, Dauger S. Facial necrotizing fasciitis in an infant caused by a five toxin-secreting methicillin-susceptible Staphylococcus aureus. Intensive Care Med 2009;35(6):1145‑6.
18. Boyer A, Vargas F, Coste F, Saubusse E, Castaing Y, Gbikpi-Benissan G, et al. Influence of surgical treatment timing on mortality from necrotizing soft tissue infections requiring intensive care management. Intensive Care Med 2009;35(5):847‑53.
19. Amreen S, Brar SK, Perveen S, Chaudhry MR, AlBabtain S, Khan S. Clinical efficacy of intravenous immunoglobulins in management of toxic shock syndrome: An updated literature review. Cureus 2021;13(1):e12836.
20. Soh CR, Pietrobon R, Freiberger JJ, Chew ST, Rajgor D, Gandhi M, et al. Hyperbaric oxygen therapy in necrotising soft tissue infections: A study of patients in the United States Nationwide Inpatient Sample. Intensive Care Med 2012;38(7):1143‑51.
2. Dauger S, Blondé R, Brissaud O, Marcoux MO, Angoulvant F, Levy M, et al. Necrotizing soft-tissue infections in pediatric intensive care: A prospective multicenter case-series study. Crit Care 2021;25(1):139.
3. Haute Autorité de santé. Prise en charge des infections cutanées bactériennes courantes - Recommandations de bonne pratique clinique. 2019. https://vu.fr/lfPbP
4. Stevens DL, Bryant AE. Necrotizing soft-tissue infections. N Engl J Med 2017;377(23):2253‑65.
5. Zundel S, Lemaréchal A, Kaiser P, Szavay P. Diagnosis and treatment of pediatric necrotizing fasciitis: A systematic review of the literature. Eur J Pediatr Surg 2017;27(2):127‑37.
6. Lancerotto L, Tocco I, Salmaso R, Vindigni V, Bassetto F. Necrotizing fasciitis: Classification, diagnosis, and management. J Trauma Acute Care Surg 2012;72(3):560‑6.
7. Endorf FW, Garrison MM, Klein MB, Richardson A, Rivara FP. Characteristics, therapies, and outcome of children with necrotizing soft tissue infections. Pediatr Infect Dis J 2012;31(3):221‑3.
8. Atger L, Deho A, Apostolou N, Levy M. Necrotizing soft tissue infection following femoral venous catheter infection. Intensive Care Med 2018;44:976‑7.
9. Madsen MB, Skrede S, Perner A, Arnell P, Nekludov M, Bruun T, et al. Patient’s characteristics and outcomes in necrotising soft-tissue infections: Results from a Scandinavian, multicentre, prospective cohort study. Intensive Care Med 2019;45(9):1241‑51.
10. Totapally BR. Epidemiology and outcomes of hospitalized children with necrotizing soft-tissue infections. Pediatr Infect Dis J 2017;36(7):641‑4.
11. Sullivan TB, Bastrom TP, Marino N, Edmonds EW. Presenting features of extremity necrotizing fasciitis in the pediatric patient: A case-control analysis. J Pediatr Orthop B 2018;27(5):461‑6.
12. Wong CH, Khin LW, Heng KS, Tan KC, Low CO. The LRINEC (Laboratory Risk Indicator for Necrotizing Fasciitis) score: A tool for distinguishing necrotizing fasciitis from other soft tissue infections. Crit Care Med 2004;32(7):1535‑41.
13. Weiss SL, Peters MJ, Alhazzani W, Agus MSD, Flori HR, Inwald DP, et al. Surviving sepsis campaign international guidelines for the management of septic shock and sepsis-associated organ dysfunction in children. Intensive Care Med 2020;46(Suppl 1):10‑67.
14. van Stigt S, Knubben M, Schrooten T, Tan E. Prognostic factors for mortality in 123 severe cases of necrotizing fasciitis in 5 hospitals in the Netherlands between 2003 and 2017. Eur J Trauma Emerg Surg 2022;48(2):1189‑95.
15. Kim KT, Kim YJ, Won Lee J, Kim YJ, Park SW, Lim MK, et al. Can necrotizing infectious fasciitis be differentiated from nonnecrotizing infectious fasciitis with MR imaging? Radiology 2011;259(3):816‑24.
16. Dauger S, Benhayoun M, Touzot F, Bonnard A. Images in neonatal medicine. Abdominal cellulitis due to Escherichia coli in a two month old premature newborn. Arch Dis Child Fetal Neonatal Ed 2006;91(6):F442.
17. Gerard D, Mariani-Kurkdjian P, Sachs P, Berrebi D, Van-Den-Abbeele T, Dauger S. Facial necrotizing fasciitis in an infant caused by a five toxin-secreting methicillin-susceptible Staphylococcus aureus. Intensive Care Med 2009;35(6):1145‑6.
18. Boyer A, Vargas F, Coste F, Saubusse E, Castaing Y, Gbikpi-Benissan G, et al. Influence of surgical treatment timing on mortality from necrotizing soft tissue infections requiring intensive care management. Intensive Care Med 2009;35(5):847‑53.
19. Amreen S, Brar SK, Perveen S, Chaudhry MR, AlBabtain S, Khan S. Clinical efficacy of intravenous immunoglobulins in management of toxic shock syndrome: An updated literature review. Cureus 2021;13(1):e12836.
20. Soh CR, Pietrobon R, Freiberger JJ, Chew ST, Rajgor D, Gandhi M, et al. Hyperbaric oxygen therapy in necrotising soft tissue infections: A study of patients in the United States Nationwide Inpatient Sample. Intensive Care Med 2012;38(7):1143‑51.
Dans cet article
- Destruction des tissus par nécrose
- Deux types de DHBN-FN
- Pathologies rares, plus fréquentes chez les garçons
- Manifestations cliniques progressives selon le principe de « l’iceberg »
- Bilan biologique et hémocultures en urgence
- Diagnostic formel et bilan d’extension grâce à l’imagerie
- Quelle prise en charge thérapeutique ?
- Infections très rares mais gravissimes