Cette infection endémique dont la prévalence varie en fonction des conditions sociaux-économiques, avec un risque de réactivation après la primo-infection, expose à de graves complications chez les immunodéprimés, et lors des infections congénitales.
Au sein de la famille des Herpesviridae, le cytomégalovirus est un virus plus confidentiel que les virus herpès simplex ou le virus varicelle-zona et dont la prise en charge suscite parfois des interrogations de la part des praticiens. En effet, les formes cliniques de la primo- infection peuvent être responsables d’une symptomatologie déroutante ou confondue avec la mononucléose infectieuse due au virus d’Epstein-Barr. Même si la plupart des infections de l’immunocompétent sont asymptomatiques ou pauci-symptomatiques, des formes graves peuvent survenir sur ce terrain. Comme les autres membres de sa famille, le cytomégalovirus a la caractéristique d’entrer en phase de latence après la primo-infection, persistant ainsi au sein de l’organisme tout au long de la vie avec la possibilité de se réactiver à tout moment. Les patients immunodéprimés sont les plus à risque de réactivation et ont plus fréquemment des manifestations cliniques symptomatiques. Le diagnostic repose sur des approches multiples dépendant du stade et des circonstances de l’infection. Enfin, le recours au traitement n’est pas systématique, les molécules actuelles ayant une importante toxicité.
Une infection endémique
Les infections à cytomégalovirus sont endémiques et surviennent tout au long de l’année. La séroprévalence du cytomégalovirus est fonction de l’âge et est corrélée avec le niveau socio-économique et l’origine ethnique : dans les pays à niveau socio-économique élevé, elle est basse (< 20 %) chez l’enfant, pour atteindre des valeurs de l’ordre de 50 % chez les jeunes adultes et de 80 % dans la population âgée. Plus de 50 % des femmes en âge de procréer sont séronégatives dans les pays industrialisés. En 2010, la séroprévalence chez les femmes françaises de 15 à 49 ans était évaluée à 45,6 %.1 Dans les pays en voie de développement, l’acquisition du cytomégalovirus se fait plus précocement par l’allaitement et la promiscuité. À l’âge adulte, la séroprévalence atteint 90 à 100 % dans certaines régions du monde.2
Une transmission par contact étroit
Différentes voies de transmission du cytomégalovirus doivent être envisagées.
Exposition sexuelle
Les taux de séroprévalence du cytomégalovirus sont plus élevés chez les patients ayant des partenaires sexuels multiples ou des antécédents de maladies sexuellement transmissibles. Par ailleurs, le virus est détectable au niveau des sécrétions vaginales et du sperme.
Contact rapproché
La séroconversion est bien décrite au sein des membres d’une famille3 et chez les enfants dans les crèches.4 La contamination se produit essentiellement par la salive et l’urine. L’excrétion virale est plus prolongée chez les enfants que chez les adultes immunocompétents. Une exposition professionnelle est donc possible chez les personnes travaillant dans les structures d’accueil de jeunes enfants et les services hospitaliers de pédiatrie ou de maternité. À noter qu’une transmission potentielle a été décrite par l’intermédiaire des surfaces environnementales contaminées par un liquide biologique (salive essentiellement).5
Exposition au sang ou aux tissus
La transmission du cytomégalovirus après la transfusion de produits sanguins s’est considérablement réduite depuis l’utilisation de produits déleucocytés. La transplantation d’organes de donneurs séropositifs reste un facteur de risque majeur de transmission.
Exposition périnatale
Les nouveau-nés et les nourrissons peuvent être infectés par le cytomégalovirus in utero par voie transplacentaire, pendant l’exposition aux sécrétions dans la filière génitale ou après la naissance via le lait maternel. Seule la transmission in utero peut occasionner un risque malformatif.
Un tableau clinique varié chez l’immunocompétent
L’infection à cytomégalovirus acquise chez les enfants et les adolescents en bonne santé est le plus souvent asymptomatique. Cependant, environ 10 % sont symptomatiques. Le cytomégalovirus peut provoquer un syndrome similaire à la mononucléose ; les manifestations les plus courantes sont la fièvre, la fatigue, la pharyngite, les adénopathies (en particulier cervicales) et l’hépatite (tableau 1) . La mononucléose infectieuse est le plus souvent due au virus d’Epstein-Barr (EBV) et se diagnostique par la présence d’immunoglobulines de type M (IgM) anti-capside de l’antigène viral (VCA). Lorsqu’un patient a des symptômes de mononucléose infectieuse classique en l’absence d’anticorps IgM anti-VCA, la cause la plus probable est l’infection à cytomégalovirus, et un diagnostic sérologique doit être envisagé. Des céphalées, des douleurs abdominales accompagnées de diarrhée, des arthralgies et des éruptions cutanées peuvent également survenir. Les signes biologiques les plus fréquents incluent la lymphocytose (syndrome mononucléosique avec lymphocytes activés) voire une lymphopénie avec thrombocytopénie et une cytolyse hépatique avec des transaminases élevées. Plus rarement, une anémie hémolytique peut être retrouvée (tableau 2) .6 Une exposition aux bêtalactamines peut induire une éruption maculo-papuleuse généralisée, analogue à celle observée avec le virus d’Epstein-Barr.
Des formes plus compliquées peuvent être observées, avec une fréquence plus importante chez l’adulte que chez l’enfant ou l’adolescent.7 Sur le plan gastro-intestinal, le cytomégalovirus peut induire une colite s’exprimant par une diarrhée, de la fièvre et des douleurs abdominales. Chez un patient âgé, le diagnostic différentiel avec une colite ischémique peut être délicat. Le cytomégalovirus a également été impliqué dans des œsophagites, gastrites et iléites. Au niveau neurologique, il peut être à l’origine de méningo-encéphalites, la plupart d’évolution favorable, ou d’un syndrome de Guillain-Barré (0,6 à 2,2 cas pour 1 000 primo-infections) touchant plutôt les sujets jeunes (médiane de 32 ans) et les femmes (85 % des cas).8 Les manifestations hépatiques liées au virus sont le plus fréquemment une élévation des transaminases (en règle générale modérée) parfois accompagnée d’une élévation des phosphatases alcalines et de la bilirubine. L’hépatite à cytomégalovirus peut exceptionnellement se compliquer d’une thrombose de la veine porte ou d’une rupture splénique. Enfin, le cytomégalovirus a été impliqué dans de rares cas de pneumopathie, de myopéricardite, et de syndrome hémophagocytaire.
Des formes plus compliquées peuvent être observées, avec une fréquence plus importante chez l’adulte que chez l’enfant ou l’adolescent.7 Sur le plan gastro-intestinal, le cytomégalovirus peut induire une colite s’exprimant par une diarrhée, de la fièvre et des douleurs abdominales. Chez un patient âgé, le diagnostic différentiel avec une colite ischémique peut être délicat. Le cytomégalovirus a également été impliqué dans des œsophagites, gastrites et iléites. Au niveau neurologique, il peut être à l’origine de méningo-encéphalites, la plupart d’évolution favorable, ou d’un syndrome de Guillain-Barré (0,6 à 2,2 cas pour 1 000 primo-infections) touchant plutôt les sujets jeunes (médiane de 32 ans) et les femmes (85 % des cas).8 Les manifestations hépatiques liées au virus sont le plus fréquemment une élévation des transaminases (en règle générale modérée) parfois accompagnée d’une élévation des phosphatases alcalines et de la bilirubine. L’hépatite à cytomégalovirus peut exceptionnellement se compliquer d’une thrombose de la veine porte ou d’une rupture splénique. Enfin, le cytomégalovirus a été impliqué dans de rares cas de pneumopathie, de myopéricardite, et de syndrome hémophagocytaire.
Une infection fréquente chez l’immunodéprimé
L’infection à cytomégalovirus est fréquente chez les patients immunodéprimés, notamment les transplantés d’organe solide ou les receveurs de cellules souches hématopoïétiques.9,10 Elle se traduit par la multiplication et la dissémination sanguine du virus (virémie). L’infection peut résulter d’une réactivation du virus endogène, du virus provenant de l’organe transplanté ou d’une contamination exogène. Lorsque la réplication virale s’étend aux organes, cela définit la maladie à cytomégalovirus se traduisant par des signes cliniques variés, dépendant de l’organe atteint.
Les infections à cytomégalovirus des immunodéprimés ont des taux de morbidité et de mortalité significatifs et induisent un déficit immunitaire accru qui favorise le développement d’autres infections opportunistes et une diminution de la survie du greffon. Les signes généraux de la maladie à cytomégalovirus associent une fièvre d’apparition insidieuse à un malaise général, une anorexie, parfois accompagnée de myalgies ou d’arthralgies. Parmi les manifestations viscérales, l’hépatite et la colite surviennent le plus souvent chez les greffés du foie, la pneumopathie chez les receveurs de greffes de poumon et de moelle osseuse et la myocardite précoce suivie par l’athérosclérose tardive chez les transplantés cardiaques. D’autres localisations, notamment rétinite ou encéphalite beaucoup plus fréquentes au cours du sida, sont rares et associées à une profonde immunosuppression.
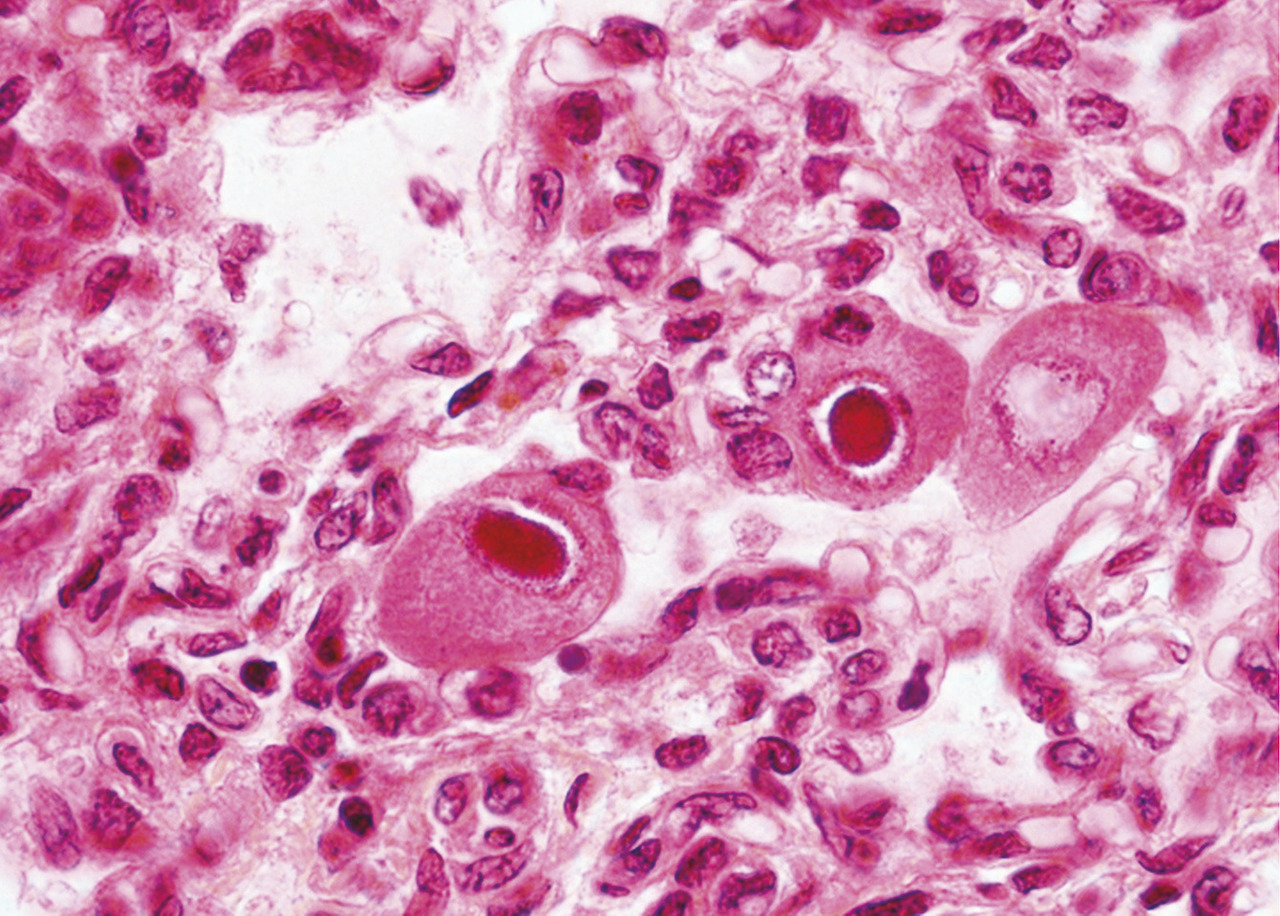
Chez les patients infectés par le virus de l’immunodéficience humaine, la séroprévalence de l’infection à cytomégalovirus est très élevée (> 80 %) du fait des modes de transmission communs, mais les manifestations cliniques liées au cytomégalovirus sont devenues très rares depuis l’utilisation des trithérapies antirétrovirales permettant aux patients de maintenir un nombre de lymphocytes CD4+ largement supérieur à 50/mm3, valeur en dessous de laquelle s’observent les manifestations cliniques de l’infection par la cytomégalovirus telles que la rétinite ou la pneumopathie(fig. 1) .
Les infections à cytomégalovirus des immunodéprimés ont des taux de morbidité et de mortalité significatifs et induisent un déficit immunitaire accru qui favorise le développement d’autres infections opportunistes et une diminution de la survie du greffon. Les signes généraux de la maladie à cytomégalovirus associent une fièvre d’apparition insidieuse à un malaise général, une anorexie, parfois accompagnée de myalgies ou d’arthralgies. Parmi les manifestations viscérales, l’hépatite et la colite surviennent le plus souvent chez les greffés du foie, la pneumopathie chez les receveurs de greffes de poumon et de moelle osseuse et la myocardite précoce suivie par l’athérosclérose tardive chez les transplantés cardiaques. D’autres localisations, notamment rétinite ou encéphalite beaucoup plus fréquentes au cours du sida, sont rares et associées à une profonde immunosuppression.
Chez les patients infectés par le virus de l’immunodéficience humaine, la séroprévalence de l’infection à cytomégalovirus est très élevée (> 80 %) du fait des modes de transmission communs, mais les manifestations cliniques liées au cytomégalovirus sont devenues très rares depuis l’utilisation des trithérapies antirétrovirales permettant aux patients de maintenir un nombre de lymphocytes CD4+ largement supérieur à 50/mm3, valeur en dessous de laquelle s’observent les manifestations cliniques de l’infection par la cytomégalovirus telles que la rétinite ou la pneumopathie
Infection congénitale à cytomégalovirus : un risque de graves séquelles
L’infection congénitale à cytomégalovirus est la principale cause de surdité neurosensorielle non héréditaire. La prévalence de l’infection congénitale à cytomégalovirus est de 0,7 % au niveau mondial (0,4-1 % selon les pays, proportionnellement au taux de séroprévalence dans la population).11 Ces données montrent que le risque de transmission existe non seulement lors des primo-infections des femmes enceintes mais également lors de réinfections ou de réactivations. Si une mère séronégative est infectée pendant la grossesse (1 à 4 % des grossesses séronégatives), la transmission au fœtus se produit dans 30 à 35 % des cas. Chez les femmes séropositives avant la grossesse, la réactivation ou la réinfection (10 à 30 % des grossesses séropositives) entraîne un risque de transmission de moins de 5 %.12 Quel que soit le mode de transmission, une forme symptomatique est retrouvée chez environ 10 % des nouveau-nés tandis qu’environ 90 % n’ont pas de manifestations cliniques à la naissance (infection asymptomatique). Environ 60 % des enfants symptomatiques auront des séquelles permanentes ; la surdité est la complication la plus fréquente, suivie par le retard mental, la rétinite et l’infirmité motrice cérébrale. Néanmoins, 5 à 10 % des enfants asymptomatiques à la naissance développeront tout de même des séquelles avant l’âge de 7 ans. Le plus souvent, il s’agit de surdité, mais des formes plus graves ont été également observées chez ces enfants asymptomatiques telles qu’un retard mental ou une rétinite. De nombreuses études démontrent que le risque d’infection symptomatique à la naissance et les séquelles, en particulier la perte d’audition, sont similaires lors d’une infection primaire et non primaire. Les séquelles semblent être plus graves lorsque l’infection est acquise plus tôt dans la grossesse, en particulier au premier trimestre. Cependant, une forme symptomatique d’infection par le cytomégalovirus peut résulter d’une infection maternelle à tout moment de la grossesse.
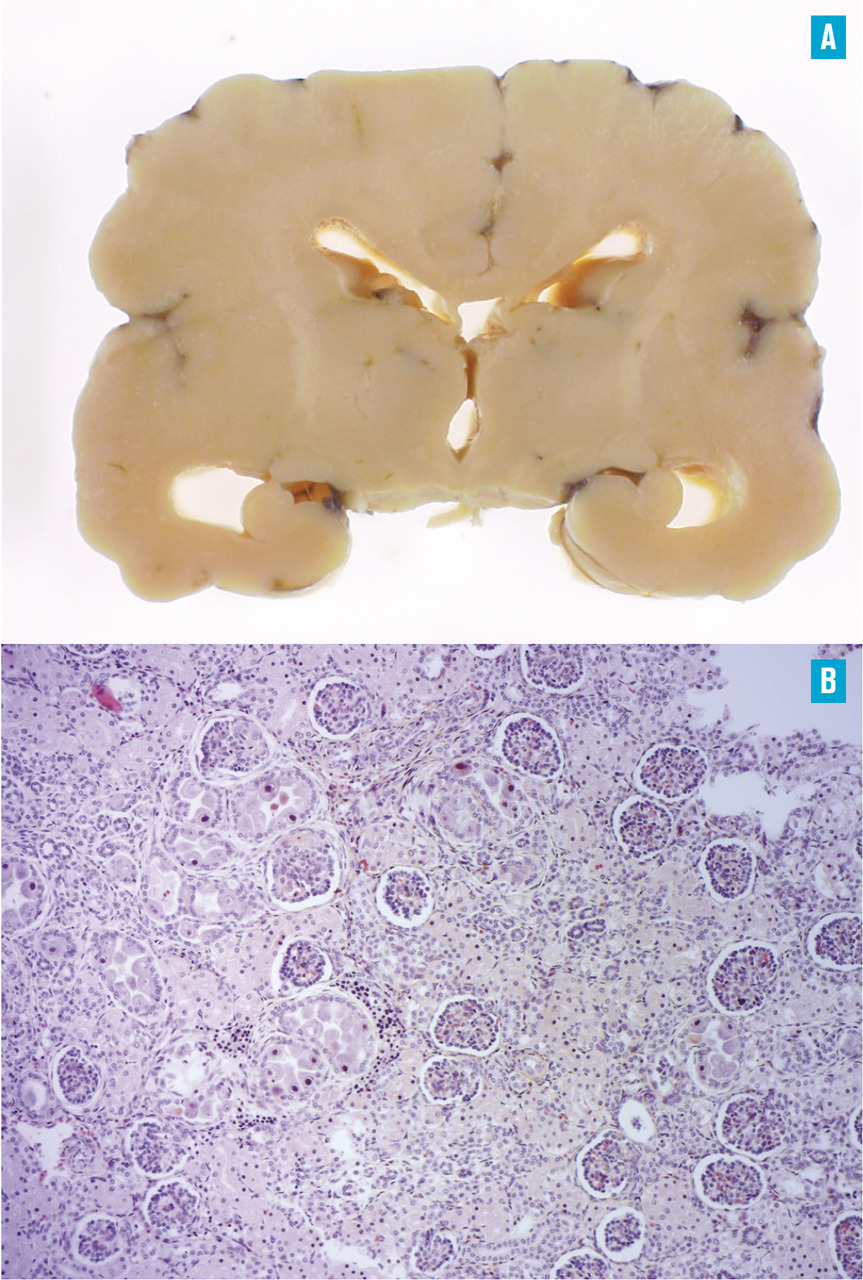
Les formes symptomatiques peuvent se manifester par une thrombocytopénie, des pétéchies, une hépato- splénomégalie, un retard de croissance intra-utérin, une hépatite (augmentation des transaminases ou de la bilirubine), une atteinte du système nerveux central (microcéphalie, ventriculomégalie, calcifications intracérébrales, échogénicité périventriculaire, choriorétinite, et surdité neurosensorielle pouvant être uni- ou bilatérale, de légère à sévère), voire des atteintes multiviscérales(fig. 2) . L’infection congénitale à cytomégalovirus peut également être responsable d’autres déficiences neurodéveloppementales à long terme, notamment une infirmité motrice cérébrale, une déficience intellectuelle, des troubles de la vision et des convulsions.
Les formes symptomatiques peuvent se manifester par une thrombocytopénie, des pétéchies, une hépato- splénomégalie, un retard de croissance intra-utérin, une hépatite (augmentation des transaminases ou de la bilirubine), une atteinte du système nerveux central (microcéphalie, ventriculomégalie, calcifications intracérébrales, échogénicité périventriculaire, choriorétinite, et surdité neurosensorielle pouvant être uni- ou bilatérale, de légère à sévère), voire des atteintes multiviscérales
Quels examens diagnostiques ?
Selon le contexte, le diagnostic nécessite l’utilisation de la sérologie et/ou de la polymerase chain reaction (PCR), la culture virale étant de moins en moins pratiquée dans les laboratoires et l’antigénémie pp65 ayant été majoritairement abandonnée au profit de la PCR.
En cas de suspicion d’infection à cytomégalovirus (CMV) chez l’enfant, l’adolescent ou l’adulte immunocompétent, une sérologie comportant IgM et IgG est demandée. Des réactions croisées peuvent être observées selon les tests utilisés entre IgM CMV et les IgM VCA (sérologie EBV), voire avec d’autres sérologies. Pendant la phase aiguë de l’infection, une PCR CMV sur sang total peut également être positive.
Pour les patients transplantés, la sérologie (IgG CMV) est principalement utilisée pour déterminer le statut du donneur et du receveur avant la greffe afin d’évaluer le risque d’infection à cytomégalovirus chez le receveur après la greffe et adapter la prise en charge. Au cours du suivi post-greffe, on utilise la PCR CMV quantitative sur sang total ou plasma afin de détecter la présence d’une infection/réactivation.13 En fonction de la symptomatologie observée, une PCR peut être réalisée sur différents prélèvements : biopsie colique en cas de suspicion de colite, liquide de lavage broncho-alvéolaire en cas de pneumopathie, ou liquide céphalorachidien en cas de tableau méningo-encéphalitique.
En cas de suspicion d’infection à cytomégalovirus (CMV) chez l’enfant, l’adolescent ou l’adulte immunocompétent, une sérologie comportant IgM et IgG est demandée. Des réactions croisées peuvent être observées selon les tests utilisés entre IgM CMV et les IgM VCA (sérologie EBV), voire avec d’autres sérologies. Pendant la phase aiguë de l’infection, une PCR CMV sur sang total peut également être positive.
Pour les patients transplantés, la sérologie (IgG CMV) est principalement utilisée pour déterminer le statut du donneur et du receveur avant la greffe afin d’évaluer le risque d’infection à cytomégalovirus chez le receveur après la greffe et adapter la prise en charge. Au cours du suivi post-greffe, on utilise la PCR CMV quantitative sur sang total ou plasma afin de détecter la présence d’une infection/réactivation.13 En fonction de la symptomatologie observée, une PCR peut être réalisée sur différents prélèvements : biopsie colique en cas de suspicion de colite, liquide de lavage broncho-alvéolaire en cas de pneumopathie, ou liquide céphalorachidien en cas de tableau méningo-encéphalitique.
Cas de l’infection congénitale
Le diagnostic de l’infection congénitale comporte deux versants : maternel et fœtal. Le diagnostic d’une infection à cytomégalovirus chez la mère au cours de la grossesse repose sur la sérologie (IgM et IgG) prescrite en cas d’anomalies échographiques ou de symptomatologie évocatrice d’infection virale. En effet, le dépistage systématique du cytomégalovirus au cours de la grossesse n’est pas recommandé à ce jour en France. En cas de positivité, une mesure de l’avidité des IgG peut être réalisée afin de préciser la date de la primo-infection. La recherche d’un sérum antérieur au premier prélèvement positif peut s’avérer utile pour dater l’infection en complément de la mesure de l’avidité. Le diagnostic de l’atteinte fœtale en cours de grossesse repose sur la réalisation d’une PCR sur le liquide amniotique, acte qui n’est envisagé que devant l’existence d’anomalies à l’échographie, dans un délai de 6 à 8 semaines après la primo-infection et après 21 à 22 semaines d’aménorrhée. Cependant, la charge virale déterminée sur le liquide amniotique n’a pas de valeur prédictive quant au risque d’évolution vers une forme symptomatique. En l’absence d’anomalies échographiques, l’amniocentèse n’est pas indiquée, et seule la recherche du cytomégalovirus à la naissance permettra de poser le diagnostic d’infection congénitale. La sérologie n’est pas contributive chez le nouveau-né, les anticorps de type IgG pouvant être transmis passivement par la mère. Il convient donc de faire une recherche directe du cytomégalovirus dans les urines ou la salive. Une PCR positive dans la salive doit être confirmée par une PCR dans les urines pour exclure les risques de contamination par du lait maternel présent dans la bouche du nouveau-né, s’il est prélevé dans l’heure suivant l’allaitement. Le suivi des nouveau-nés atteints d’une infection grave à cytomégalovirus (entérocolite nécrosante, hépatite, pneumonie ou thrombocytopénie) et nécessitant un traitement est réalisé par une PCR quantitative dans le sang total ou le plasma.
L’infection postnatale précoce est à différencier de l’infection congénitale car elle ne présente pas de risque malformatif. Le diagnostic de l’infection postnatale précoce est confirmé par une PCR CMV positive après les trois premières semaines de vie parallèlement à un test négatif à la naissance permettant l’exclusion d’une infection congénitale à cytomégalovirus. L’urine est préférée à la salive pour les raisons précisées précédemment. Si une PCR CMV sur l’urine ou la salive n’a pas été effectuée à la naissance, une analyse rétrospective peut être effectuée à l’aide d’une PCR sur spot de sang séché du nouveau-né obtenue dans le cadre du dépistage universel des nouveau-nés.14 Cette analyse permet ainsi un diagnostic rétrospectif de l’infection congénitale à cytomégalovirus devant des atteintes neurosensorielles révélées tardivement.
L’infection postnatale précoce est à différencier de l’infection congénitale car elle ne présente pas de risque malformatif. Le diagnostic de l’infection postnatale précoce est confirmé par une PCR CMV positive après les trois premières semaines de vie parallèlement à un test négatif à la naissance permettant l’exclusion d’une infection congénitale à cytomégalovirus. L’urine est préférée à la salive pour les raisons précisées précédemment. Si une PCR CMV sur l’urine ou la salive n’a pas été effectuée à la naissance, une analyse rétrospective peut être effectuée à l’aide d’une PCR sur spot de sang séché du nouveau-né obtenue dans le cadre du dépistage universel des nouveau-nés.14 Cette analyse permet ainsi un diagnostic rétrospectif de l’infection congénitale à cytomégalovirus devant des atteintes neurosensorielles révélées tardivement.
Traitement : vers un élargissement de l’offre
Trois molécules sont disponibles pour le traitement des infections à cytomégalovirus : un analogue nucléosidique, le ganciclovir, et sa podrogue, le valganciclovir ; un analogue nucléosidique monophosphaté, le cidofovir ; et un analogue de pyrophosphate inorganique, le foscarnet.15 Toutes ces molécules inhibent l’activité de l’ADN polymérase virale et sont donc sans action sur le virus latent. Elles ont toutes une toxicité, rénale (foscarnet et cidofovir) ou hématologique (ganciclovir), les contre-indiquant chez la femme enceinte. Chez l’immunocompétent, le recours à ces molécules est exceptionnel, limité à des atteintes très sévères. Le ganciclovir ou le valganciclovir sont indiqués en première ligne chez les immunodéprimés dont la virémie est positive. Le recours au foscarnet et au cidofovir s’envisage en cas de résistance au ganciclovir, dont la fréquence est de l’ordre de 5 %,16 ou en cas de toxicité hématologique sévère. Deux nouvelles molécules ont passé le stade des essais de phase III, le maribavir et le letermovir (tableau 3) . Elles ont l’avantage de cibler des étapes plus tardives du cycle viral (encapsidation et sortie des capsides virales hors du noyau de la cellule) et, par conséquent, ne présentent pas de résistance croisée avec les molécules actuelles. Ces molécules devraient être disponibles très prochainement sur le marché. Si les immunoglobulines polyvalentes ou CMV-hyperimmune ont été proposées en traitement adjuvant des infections graves à cytomégalovirus, notamment en cas de pneumopathie et en cas d’hypogammaglobulinémie chez le greffé, leur place dans l’arsenal thérapeutique des infections à cytomégalovirus reste à préciser.
L’aciclovir et sa prodrogue, le valaciclovir, ont également une activité anti-cytomégalovirus, avec un mode d’action similaire au ganciclovir mais avec une efficacité moindre. Leur utilisation a été validée en prophylaxie chez les transplantés (aciclovir chez les greffés de cellules souches hématopoïétiques nécessitant une prophylaxie contre herpès simplex). Un traitement par valaciclovir peut dorénavant également être proposé à la femme enceinte en cas d’infection congénitale, compte tenu du bénéfice démontré en termes de réduction de la gravité des symptômes liés à l’infection et de l’absence d’effets indésirables observée dans les études cliniques.17 En cas d’infection congénitale symptomatique, il est recommandé de proposer un traitement du nouveau-né par ganciclovir ou valganciclovir pour une durée de 6 mois afin de limiter la progression des lésions neurosensorielles, associé à une surveillance des polynucléraires neutrophiles les premiers mois.18 V
L’aciclovir et sa prodrogue, le valaciclovir, ont également une activité anti-cytomégalovirus, avec un mode d’action similaire au ganciclovir mais avec une efficacité moindre. Leur utilisation a été validée en prophylaxie chez les transplantés (aciclovir chez les greffés de cellules souches hématopoïétiques nécessitant une prophylaxie contre herpès simplex). Un traitement par valaciclovir peut dorénavant également être proposé à la femme enceinte en cas d’infection congénitale, compte tenu du bénéfice démontré en termes de réduction de la gravité des symptômes liés à l’infection et de l’absence d’effets indésirables observée dans les études cliniques.17 En cas d’infection congénitale symptomatique, il est recommandé de proposer un traitement du nouveau-né par ganciclovir ou valganciclovir pour une durée de 6 mois afin de limiter la progression des lésions neurosensorielles, associé à une surveillance des polynucléraires neutrophiles les premiers mois.18 V
Références
1. Antona D, Lepoutre A, Fonteneau L, et al. Seroprevalence of cytomegalovirus infection in France in 2010. Epidemiol Infect 2017;145:1471-8.
2. Cannon MJ, Schmid DS, Hyde TB. Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection. Rev Med Virol 2010;20:202-13.
3. Pass RF, Little EA, Stagno S, Britt WJ, Alford CA. Young children as a probable source of maternal and congenital cytomegalovirus infection. N Engl J Med 1987;316:1366-70.
4. Grosjean J, Trapes L, Hantz S, et al. Human cytomegalovirus quantification in toddlers saliva from day care centers and emergency unit: a feasibility study. J Clin Virol 2014;61:371-7.
5. Stowell JD, Forlin-Passoni D, Din E, et al. Cytomegalovirus survival on common environmental surfaces: opportunities for viral transmission. J Infect Dis 2012;205:211-4.
6. Faucher JF, Abraham B, Segondy M, Jonquet O, Reynes J, Janbon F. Cytomégalovirose acquise de l’adulte immunocompétent. 116 observations. Presse Med 1998;27:1774-9.
7. Rafailidis PI, Mourtzoukou EG, Varbobitis IC, Falagas ME. Severe cytomegalovirus infection in apparently immunocompetent patients: a systematic review. Virol J 2008;5:47.
8. Orlikowski D, Porcher R, Sivadon-Tardy V, et al. Guillain-Barre syndrome following primary cytomegalovirus infection: a prospective cohort study. Clin Infect Dis 2011;52:837-44.
9. Ljungman P, Hakki M, Boeckh M. Cytomegalovirus in hematopoietic stem cell transplant recipients. Infect Dis Clin North Am 2010;24:319-37.
10. Razonable RR. Epidemiology of cytomegalovirus disease in solid organ and hematopoietic stem cell transplant recipients. Am J Health Syst Pharm 2005;62:S7-13.
11. Manicklal S, Emery VC, Lazzarotto T, Boppana SB, Gupta RK. The “silent” global burden of congenital cytomegalovirus. Clin Microbiol Rev 2013;26:86-102.
12. Emery VC, Lazzarotto T. Cytomegalovirus in pregnancy and the neonate. Version 1. F1000Res 2017;6:138.
13. Pillet S, Roblin X, Cornillon J, Mariat C, Pozzetto B. Quantification of cytomegalovirus viral load. Expert Rev Anti Infect Ther 2014;12:193-210.
14. Barbi M, Binda S, Caroppo S. Diagnosis of congenital CMV infection via dried blood spots. Rev Med Virol 2006;16:385-92.
15. Hantz S, Mazeron MC, Alain S, Leruez-Ville M. Traitement des infections à CMV. Med Therap 2009;15:211-22.
16. Hantz S, Garnier-Geoffroy F, Mazeron MC, et al. Drug-resistant cytomegalovirus in transplant recipients: a French cohort study. J Antimicrob Chemother 2010;65:2628-40.
17. Leruez-Ville M, Ghout I, Bussieres L, et al. In utero treatment of congenital cytomegalovirus infection with valacyclovir in a multicenter, open-label, phase II study. Am J Obstet Gynecol 2016;215:462.e1-462.e10.
18. Rawlinson WD, Boppana SB, Fowler KB, et al. Congenital cytomegalovirus infection in pregnancy and the neonate: consensus recommendations for prevention, diagnosis, and therapy. Lancet Infect Dis 2017;17:e177-e188.
2. Cannon MJ, Schmid DS, Hyde TB. Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection. Rev Med Virol 2010;20:202-13.
3. Pass RF, Little EA, Stagno S, Britt WJ, Alford CA. Young children as a probable source of maternal and congenital cytomegalovirus infection. N Engl J Med 1987;316:1366-70.
4. Grosjean J, Trapes L, Hantz S, et al. Human cytomegalovirus quantification in toddlers saliva from day care centers and emergency unit: a feasibility study. J Clin Virol 2014;61:371-7.
5. Stowell JD, Forlin-Passoni D, Din E, et al. Cytomegalovirus survival on common environmental surfaces: opportunities for viral transmission. J Infect Dis 2012;205:211-4.
6. Faucher JF, Abraham B, Segondy M, Jonquet O, Reynes J, Janbon F. Cytomégalovirose acquise de l’adulte immunocompétent. 116 observations. Presse Med 1998;27:1774-9.
7. Rafailidis PI, Mourtzoukou EG, Varbobitis IC, Falagas ME. Severe cytomegalovirus infection in apparently immunocompetent patients: a systematic review. Virol J 2008;5:47.
8. Orlikowski D, Porcher R, Sivadon-Tardy V, et al. Guillain-Barre syndrome following primary cytomegalovirus infection: a prospective cohort study. Clin Infect Dis 2011;52:837-44.
9. Ljungman P, Hakki M, Boeckh M. Cytomegalovirus in hematopoietic stem cell transplant recipients. Infect Dis Clin North Am 2010;24:319-37.
10. Razonable RR. Epidemiology of cytomegalovirus disease in solid organ and hematopoietic stem cell transplant recipients. Am J Health Syst Pharm 2005;62:S7-13.
11. Manicklal S, Emery VC, Lazzarotto T, Boppana SB, Gupta RK. The “silent” global burden of congenital cytomegalovirus. Clin Microbiol Rev 2013;26:86-102.
12. Emery VC, Lazzarotto T. Cytomegalovirus in pregnancy and the neonate. Version 1. F1000Res 2017;6:138.
13. Pillet S, Roblin X, Cornillon J, Mariat C, Pozzetto B. Quantification of cytomegalovirus viral load. Expert Rev Anti Infect Ther 2014;12:193-210.
14. Barbi M, Binda S, Caroppo S. Diagnosis of congenital CMV infection via dried blood spots. Rev Med Virol 2006;16:385-92.
15. Hantz S, Mazeron MC, Alain S, Leruez-Ville M. Traitement des infections à CMV. Med Therap 2009;15:211-22.
16. Hantz S, Garnier-Geoffroy F, Mazeron MC, et al. Drug-resistant cytomegalovirus in transplant recipients: a French cohort study. J Antimicrob Chemother 2010;65:2628-40.
17. Leruez-Ville M, Ghout I, Bussieres L, et al. In utero treatment of congenital cytomegalovirus infection with valacyclovir in a multicenter, open-label, phase II study. Am J Obstet Gynecol 2016;215:462.e1-462.e10.
18. Rawlinson WD, Boppana SB, Fowler KB, et al. Congenital cytomegalovirus infection in pregnancy and the neonate: consensus recommendations for prevention, diagnosis, and therapy. Lancet Infect Dis 2017;17:e177-e188.