Dernière mise à jour : 28 juin 2024*
Les maladies émergentes occupent depuis quelques années le devant de la scène médiatique et politique. Depuis le début du XXIe siècle, il semble qu’une accélération de l’apparition et de la diffusion d’agents pathogènes s’observe partout sur la planète, dont le Covid- 19, qui a particulièrement marqué les sociétés récemment. Pourtant, ce phénomène est ancien. Il apparaît donc primordial de définir la notion d’émergence afin de bien comprendre les potentielles menaces pour la société et pour notre système de santé.
Maladies infectieuses émergentes : de quoi parle-t-on ?
Si l’on reprend la définition de l’Organisation mondiale de la santé (OMS), l’émergence correspond aux « maladies qui apparaissent dans une population pour la première fois, ou qui existaient sans doute auparavant et qui connaissent une augmentation soudaine en termes d’incidence ou de distribution géographique ». Cette définition semble assez vague, mais elle englobe plusieurs réalités parfois très distinctes ; c’est pour cela que l’on parle plutôt d’émergences au pluriel :
- il y a le nouveau pathogène qui franchit la barrière d’espèce et qui se répand au sein d’une population naïve sur le plan immunologique (SARS-CoV- 2, Ebola, VIH, grippe aviaire). Un grand nombre de maladies dites émergentes sont d’origine zoonotique. Ces zoonoses sont responsables de près de 60 % des maladies infectieuses présentes chez l’homme et représenteraient 75 % des maladies émergentes actuelles ;1
- il existe également la maladie causée par un pathogène bien connu mais dont l’incidence croît fortement au sein d’une population (syphilis, peste, Shigella XDR) ; cette augmentation peut parfois s’associer à une diffusion géographique, comme dans le cas du Mpox en 2022 (ancien Monkeypox) ou de la grippe et de la variole introduites par les colons européens sur le continent américain au XVIe siècle ;
- certains pathogènes peuvent réapparaître dans des zones où ils avaient été éradiqués (paludisme en Europe) ;
- enfin, la notion d’antibiorésistance pourrait être évoquée : bactéries hautement résistantes émergentes (BHRe) comme Escherichia coli, productrice de carbapénèmase.
On comprend, au travers de ces différents exemples, que l’ensemble du monde microbien est potentiellement responsable d’émergences, avec une importance potentiellement plus grande du monde viral et notamment des virus à ARN.
Pour toutes ces émergences, les causes sont très souvent multiples et nécessitent la convergence entre une population susceptible, un agent pathogène et un environnement favorable. La globalisation croissante des échanges, le dérèglement climatique, la diffusion d’un vecteur à d’autres zones géographiques, les inégalités sociales et d’accès aux soins, la destruction des habitats naturels d’espèces animales se retrouvant au contact avec des êtres humains sont autant de facteurs majeurs de ces émergences.2
Ainsi, au regard de la définition donnée précédemment et de l’actualité, la question de savoir si la France doit craindre des infections émergentes peut paraître bien spécieuse, dans le sens où nous sommes déjà touchés par celles-ci, comme l’ont montré la pandémie de Covid- 19 et le Mpox pour les humains, et la grippe aviaire pour les volatiles et certains mammifères.
Seules les principales pathologies – notamment virales, qui connaissent une expansion sur notre territoire ou une activité particulièrement dynamique – sont ici évoquées ; le phénomène d’antibiorésistance n’est pas abordé. Par ailleurs, plusieurs pathologies mentionnées sont déjà présentes dans les différents territoires ultramarins, confrontés historiquement à ces pathogènes. Ainsi, par nécessité de concision et de clarté, cet article ne concerne que la France métropolitaine.
Grippe aviaire : risque faible de pandémie
La grippe aviaire est une maladie infectieuse causée par un ensemble de virus à ARN issus des virus influenzae du groupe A. Le réservoir naturel est constitué d’un ensemble diversifié de virus parmi les populations d’oiseaux sauvages, notamment d’oiseaux aquatiques. Ils sont désignés par le nombre d’hémagglutinines présentes à leur surface (H) et de neuraminidases (N). Les souches en question dans l’épizootie qui sévit actuellement sur quasiment l’ensemble de la planète sont les virus H5Nx (H5N1 particulièrement) et H7Nx (H7N9). Ces virus sont également classés comme étant hautement pathogènes ou faiblement pathogènes en fonction de leur gravité chez les espèces aviaires qu’ils infectent habituellement. Les foyers actuels de A(H5) chez les oiseaux sauvages et les volailles d’élevage affectent plusieurs pays dans le monde et ont provoqué des cas sporadiques de transmission à l’homme.3
L’Europe est particulièrement touchée depuis 2021, avec la présence du virus chez les oiseaux sauvages (goélands, mouettes) et les volailles d’élevage, causant un nombre élevé de décès dans ces populations, soit directement, soit par abattage pour raisons sanitaires.
Passage chez les mammifères, un tournant ?
L’évolution récente et particulièrement marquante reste le passage de la pathologie aux mammifères terrestres et marins partout dans le monde. Ce franchissement de la barrière d’espèce a été mis en évidence chez plus de 28 espèces différentes de mammifères : des colonies de lions de mer et d’otaries ont été décimées en Amérique du Sud, des élevages de furets ont été touchés en France, des canidés (renards) ont été infectés. L’épizootie concerne également les zones reculées : des ours polaires sont morts et leur autopsie a révélé une infection au virus influenza en Alaska.4 En 2024, des cas de virus A(H5N1) ont été détectés dans plus de 100 troupeaux de vaches laitières aux États-Unis, avec une transmission latérale probable entre ces bovins ; trois cas humains en lien avec cette épizootie ont été signalés, mais aucune transmission interhumaine n’a été mise en évidence pour le moment.
Depuis 2021, les patients infectés par les virus A(H5Nx) (H5N1 principalement, mais aussi H5N8) ont tous été en contact avec des oiseaux ou mammifères infectés. Cependant, les cas humains avérés sont finalement assez rares, eu égard à l’ampleur des épizooties, notamment chez les oiseaux. Pour l’instant, aucune transmission interhumaine n’a encore été décrite. L’analyse de risque par les principales structures de veille internationales estime que le risque d’infection humaine par ce virus et pour les grippes zoonotiques est faible. Ainsi, à ce jour, il est raisonnable d’affirmer que le risque de pandémie apparaît très limité, également du fait de l’absence d’infection des voies aériennes supérieures.5,6
Néanmoins, la vigilance s’impose, nécessitant une surveillance renforcée des virus influenzae en circulation (typage, sous-typage). Une sensibilisation des personnels de santé et des travailleurs à risque est également primordiale. En France, tout clinicien prenant en charge une suspicion de grippe zoonotique doit la notifier à l’Agence régionale de santé (ARS), pour un classement du cas.
Les cas humains sont sporadiques et concernent des personnes en contact étroit avec les oiseaux infectés (éleveurs, vétérinaires, travailleurs des marchés aux animaux, gardes forestiers…), la transmission survenant lors d’une exposition massive.
Manifestations cliniques
Les virus du groupe A(H5Nx) [particulièrement H5N1] ont une durée d’incubation de deux à cinq jours en moyenne, avec une période maximale de sept jours. Les manifestations cliniques sont, outre le syndrome grippal classique, l’association fréquente de diarrhées et parfois des atteintes neurologiques (convulsions, confusion, obnubilation). Les signes respiratoires surviennent généralement après cinq jours d’évolution et comprennent une toux et une dyspnée, suivies finalement de détresse respiratoire. Entre 2003 et 2024, l’OMS a recensé 893 cas d’infections humaines par H5N1 et 463 (52,16 %) décès dans 24 pays.7,8
Poser le diagnostic : si le premier test est négatif, toujours en refaire un second !
Le diagnostic biologique de référence se fait par transcription inverse-réaction en chaîne par polymérase (RT-PCR) sur prélèvements respiratoires ou a minima nasopharyngés, avec recherche de diagnostics différentiels. En cas de négativité, il faut idéalement réaliser des prélèvements respiratoires profonds (aspiration trachéale, liquide bronchoalvéolaire).
Ces prélèvements se font en accord avec un médecin infectiologue d’un établissement de santé de référence (ESR)9 et/ou d’un virologue du centre national de référence (CNR) des virus et des infections respiratoires.
Une prise en charge spécifique
L’oséltamivir peut être prescrit d’emblée, avec cependant peu de données de bonne qualité sur l’efficacité clinique dans ce cadre précis.
La prise en charge clinique du patient se fait dans les ESR nationaux et/ou régionaux par des personnels de santé formés à la prise en charge de ces pathologies.
Que peut faire le médecin généraliste ?
Le rôle du médecin de premier recours est principalement de savoir évoquer une telle infection. Ainsi, il y a suspicion diagnostique en cas d’association d’une infection respiratoire aiguë et d’une exposition à risque. Un test PCR doit alors être réalisé, en ciblant la grippe saisonnière (sous-typage) et le Covid- 19, pour éliminer les diagnostics différentiels.
Une exposition à risque (en l’absence de mesures de protection adaptées) est avérée s’il y a eu contact avec des oiseaux domestiques ou sauvages (malades ou morts), des porcs ou sangliers (malades ou morts), des mammifères sauvages terrestres ou marins (malades ou morts), un environnement contaminé (air, litière, déjections), un cas humain confirmé dans l’entourage ou un prélèvement et/ou du matériel biologique contaminé.
Arboviroses
Le terme arbovirose est un mot valise signifiant « arthropod-borne viruses » : il désigne tout virus transmis par un vecteur appartenant à l’embranchement des arthropodes. Ces derniers sont constitués de plusieurs familles : les moustiques, les tiques, les culicoïdes et les phlébotomes. Les virus transmis par ces vecteurs sont dits « à ARN » et ont la capacité de proliférer dans des cellules de vertébrés (animaux, humains) et des vecteurs eux-mêmes. Les arthropodes vecteurs se contaminent et contaminent lors d’un repas sanguin. Seuls la dengue, le chikungunya, le Zika, les virus du Nil occidental (West Nile) et d’Usutu ainsi que l’encéphalite à tiques sont ici abordés.
Physiopathologie des arboviroses
La plupart des arbovirus sont issus des zones tropicales et/ou subtropicales. Leur répartition est d’abord liée à celle des vecteurs et des animaux réservoirs avec lesquels ils se sont associés. Ces zoonoses concernent donc les animaux sauvages (singes) ou le bétail (porc, bovins, ovins). L’être humain en est un hôte accidentel. Toutefois, certaines arboviroses, comme la dengue, ne concernent que les humains, voire peuvent être transmises entre humains par contact ou inhalation, comme la fièvre hémorragique de Crimée-Congo.
Ces maladies se caractérisant souvent par une forte virémie, le don de sang peut être une source d’infection. Des transmissions sexuelles ont été rapportées, notamment pour la dengue et le Zika. La transmission maternofœtale est aussi possible (dengue, chikungunya, Zika…).
De plus en plus fréquentes
L’incidence de ce groupe de virus très hétéroclite est en très forte augmentation, et ceux-ci se diffusent dans de nouvelles zones géographiques, notamment en Europe occidentale depuis près de trente ans. Il s’agit en particulier de la dengue, du chikungunya et du virus West Nile. Plusieurs causes ont été identifiées :
- modifications écologiques des cycles virus-vecteur-vertébré ;
- accroissement de la population urbaine exposée au moustique du genre Aedes dont le principal est A. albopictus (dengue, chikungunya) et aux moustiques du genre Culex (C. pipiens pour les virus West Nile et d’Usutu) ;
- augmentation des voyages et des migrations, essor des transports internationaux ;
- difficultés à vacciner les populations ;
- réchauffement climatique.
Enfin, l’amélioration des outils diagnostiques et des procédures de déclaration des cas a également permis de mieux détecter ces émergences.
Trois catégories cliniques d’arboviroses
Les arboviroses sont souvent identifiées par syndrome afin de faciliter leur classification et le diagnostic en pratique clinique. On reconnaît ainsi trois catégories principales : les fièvres algo-éruptives, celles à manifestations hémorragiques et les formes encéphalitiques. Les principaux virus impliqués en pathologie humaine sont répertoriés dans le tableau.
Dengue
Le virus responsable de la dengue est dit à ARN positif, du genre Flavivirus, et comprend quatre sérogroupes (Denv- 1, Denv- 2, Denv- 3, Denv- 4) sans immunité croisée entre les sérotypes.
Après une première infection, la contraction d’un nouveau sérotype augmente le risque de survenue d’une dengue sévère, par phénomène de facilitation immunologique. Cette maladie est transmise par les moustiques du genre Aedes (principalement A. albopictus mais aussi A. aegypti). Sur le plan épidémiologique, elle connaît une extension notable en Europe du Sud, en corrélation avec l’installation de son vecteur principal, A. albopictus (fig. 1).
Des cas autochtones en France
En 2023, neuf foyers autochtones de dengue (45 cas) ont été recensés, principalement dans la moitié sud du pays mais également, pour la première fois, en Île-de-France. En 2022, 65 cas autochtones avaient été répertoriés. Bien qu’il soit encore trop tôt pour extrapoler une trajectoire précise de cette pathologie en France, il apparaît très probable que celle-ci finisse par s’implanter durablement, particulièrement dans les zones du pourtour méditerranéen, du fait des changements climatiques et de la diffusion des vecteurs, qui est continue.10,11
De plus, en 2023 et 2024, les cas importés de dengue en France hexagonale sont en très forte augmentation, dans un contexte d’épidémie inédite dans les Antilles françaises et en Amérique latine. Entre janvier et juin 2024, près de 3 000 cas importés ont été recensés (mais aucun cas autochtone), contre un peu plus de 100 en moyenne sur la même période des années précédentes.
Maladie asymptomatique dans plus d’un cas sur deux
Cliniquement, la dengue est asymptomatique dans 50 à 90 % des infections. Les premiers symptômes apparaissent le plus souvent entre quatre et sept jours après la contamination ; exceptionnellement, des durées d’incubation de quatorze jours ont été observées. Le tableau clinique est principalement constitué par un syndrome grippal avec une fièvre d’apparition brutale pouvant associer des céphalées, des douleurs rétro-orbitaires (relativement spécifiques de la dengue), des nausées et/ou vomissements, des arthralgies/myalgies et une éruption maculopapulaire transitoire pouvant prendre l’aspect de pétéchies.
Forme sévère : des facteurs de risque bien identifiés
Les formes sévères surviennent dans moins de 5 % des formes symptomatiques, vers le 4e ou 5e jour d’évolution. Elles correspondent à un syndrome de fuite capillaire qui peut évoluer vers un état de choc. Des signes d’alerte (définis en 2009 par l’OMS), auxquels il convient d’être attentif, annoncent généralement cette sévérité :12
- douleurs abdominales persistantes et d’intensité croissante ;
- vomissements persistants ;
- épanchements séreux ;
- hémorragies muqueuses ne cédant pas spontanément ;
- agitation ou somnolence ;
- hépatomégalie ;
- baisse rapide des plaquettes associée à une élévation de l’hématocrite.
Il existe plusieurs facteurs de risque bien connus de dengue sévère, dont :
- la grossesse (en particulier au troisième trimestre) ;
- les âges extrêmes (moins de 2 ans, plus de 65 ans) ;
- l’immunodépression ;
- les pathologies chroniques (diabète, obésité, insuffisance cardiaque, asthme, hépatopathies chroniques) ;
- les syndromes drépanocytaires majeurs : formes S/S, S/C ou S/bêtathalassémie.
Prise en charge surtout symptomatique et préventive !
La prise en charge en réanimation n’empêche pas une lourde mortalité, qui s’élève à 40 %, notamment dans les formes sévères. La prise en charge des patients, quelle que soit la forme, est purement symptomatique.
Les anti-inflammatoires non stéroïdiens (AINS) et l’aspirine sont totalement à bannir dans ce cadre.
La lutte antivectorielle reste la pierre angulaire de la prévention. Il existe un vaccin, Dengvaxia, validé au niveau européen. À l’heure actuelle, les recommandations françaises l’encouragent uniquement pour la prévention de la dengue pour les quatre sérotypes chez les sujets âgés de plus de 6 ans et de moins de 45 ans, avec antécédents d’infection par la dengue et vivant dans des zones d’endémie (avis HAS du 07/12/2021). Il n’y a pas d’indication pour le voyageur.
Chikungunya
L’infection par le virus du chikungunya est à l’origine d’un tableau largement dominé par la fièvre, souvent éruptive et accompagnée d’arthralgies et d’arthrite particulièrement sévères durant la phase aiguë. Parfois, celles-ci peuvent perdurer dans des formes chroniques (20 à 30 % des cas), menant à une invalidité persistante, et sont donc à l’origine d’un fardeau médico-économique important.
Des formes sévères rares existent et surviennent sur des terrains particuliers.
Les facteurs de risque identifiés sont superposables à ceux de la dengue.
Le traitement reste, là aussi, purement symptomatique, avec une grande prudence concernant la prescription d’AINS, qui pourraient avoir un effet aggravant. Depuis l’épidémie de 2005 qui a touché sévèrement l’île de la Réunion, la maladie s’est propagée dans l’ensemble de la zone indo-pacifique, puis dans l’ensemble de l’Amérique latine et des Antilles. Concernant la métropole, de 2010 à 2022, il a été dénombré trois épisodes épidémiques autochtones représentant 31 cas au total. Les cas ont été décrits dans l’Hérault et le Var, qui sont des zones fortement et anciennement colonisées par A. albopictus.11 En Europe, l’Italie a enregistré deux épidémies de chikungunya en 2007 et 2017, avec au total plusieurs centaines de cas. Selon les investigations, ces épidémies autochtones étaient probablement liées à l’absence d’identification des cas primaires importés plutôt qu’à une réelle installation du virus. Néanmoins, le risque d’émergence d’un cycle écologique local pour le virus chikungunya apparaît important dans ces zones du pourtour méditerranéen fortement colonisées, et depuis longtemps, par A. albopictus.13
Zika
Connu depuis 1947 et originaire des forêts d’Afrique de l’Est, le virus Zika est passé sur le devant de la scène médiatique lors de l’épidémie de 2015 au Brésil, associée à la survenue de microcéphalies et de malformations congénitales. Le virus est transmis principalement par les moustiques du genre Aedes, notamment A. albopictus, même s’il se révèle être un vecteur de compétence relativement médiocre. Les Culex, Anopheles et Mansonia peuvent également le transmettre, avec une compétence vectorielle moindre. Des transmissions sexuelles, maternofœtales et sanguines ont aussi été largement décrites.
Le tableau clinique est celui d’une « dengue-like », à l’exception des douleurs rétro-orbitaires qui sont absentes. La résolution est spontanée en quatre à sept jours. Néanmoins, environ 80 % des infections restent asymptomatiques. Des formes neurologiques ont été décrites comme étant significativement associées à des syndromes de type Guillain-Barré, lors des épidémies en Polynésie française, entre autres. Mais les manifestations maternofœtales sont de loin les plus importantes, avec la survenue de malformations cérébrales et de retard cognitif dans les cas des infections du premier et deuxième trimestres chez la femme enceinte. La microcéphalie n’est que la forme émergée de l’iceberg.
Les données récentes publiées par Santé publique France mettent en évidence, sur la période de 2010 à 2022, un seul épisode de transmission autochtone, avec trois cas dans le Var. En complément de ces données, des travaux suggèrent que les Aedes seraient un mauvais vecteur pour le virus Zika. À l’heure actuelle, le risque épidémique en Europe est estimé faible.11
Virus West Nile
Le virus West Nile est identifié en France depuis 1962, avec les premiers cas humains et équins recensés en Camargue.14 Il est transmis par le moustique Culex pipiens.
Les réservoirs du virus sont les oiseaux, qui le transmettent ensuite aux moustiques. Humains et chevaux sont des hôtes dits « cul-de-sac » pour le virus, qui ne se transmet, en effet, ni d’homme à homme ni de cheval à cheval, ni de mammifère à moustique.
Le virus circule en France sur le pourtour méditerranéen, où il est considéré comme endémique sous forme de foyers équins et/ou humains, le plus souvent limités.
Cliniquement, l’infection est asymptomatique dans près de 80 % des cas.14 Les formes symptomatiques apparaissent comme un syndrome pseudogrippal. Des formes neurologiques sévères à type d’encéphalite peuvent survenir dans 1 % des cas (patients immunodéprimés et âgés).
L’année 2023 a été marquée par l’extension du virus West Nile hors du pourtour méditerranéen. En effet, près de 33 cas humains autochtones ont été diagnostiqués en Nouvelle-Aquitaine.14
Malgré cela, les humains étant une impasse infectieuse pour le virus, le risque d’épidémie est considéré comme faible.2 Néanmoins, des risques de transmission par produits sanguins ou dons d’organes solides sont possibles ; des précautions sont donc nécessaires pour les personnes revenant de zone d’endémie ou y résidant.
Virus Usutu
Le virus Usutu est un flavivirus émergent, identifié pour la première fois en 1949 au Swaziland (actuellement Eswatini).
Son réservoir principal est l’avifaune, dans laquelle il est une cause d’importante épizootie, avec un nombre conséquent de décès, notamment chez les passereaux et autres merles noirs. Les oiseaux d’élevage comme les poules ne semblent pas affectés par le virus.
Le virus Usutu a été identifié pour la première fois en France en 2015. Depuis, il s’est diffusé à l’ensemble de l’Europe.15 Il est transmis par les moustiques du genre Culex, notamment C. pipiens, comme le virus West Nile. Les humains sont une impasse infectieuse, avec une infection le plus souvent asymptomatique, bien que l’on observe parfois un tableau clinique « dengue-like ». Des formes neurologiques sévères ont été décrites chez des patients immunodéprimés.16,17
Il est difficile d’évaluer le risque épidémique du virus Usutu actuellement, en raison du faible nombre de cas répertoriés. De plus, l’absence de clinique spécifique, pouvant rapprocher cette infection de celle au virus West Nile, et la difficulté des diagnostics de confirmation du fait de réactions croisées sur les examens de sérologie18 peuvent faire conclure à tort à une infection par le virus West Nile. Une PCR spécifique est disponible au CNR des arboviroses à Marseille (Institut de recherche biomédicale des armées).
Encéphalite à tiques
Le virus de l’encéphalite à tiques est un virus à ARN dont la transmission se fait par piqûres de tique Ixodes ricinus ou de manière plus anecdotique par consommation de lait ou de fromage cru, principalement de chèvre ou de brebis infectée.19 La tique est le réservoir principal, bien que des mammifères de type rongeurs, comme le campagnol, puissent également jouer ce rôle.
Il n’y a pas de données quant à une transmission interhumaine, même si, théoriquement, une transmission sanguine est possible.
Décrite depuis les années 1940 en Europe, la maladie reste mal connue et peu documentée. L’émergence de l’encéphalite à tiques est probablement en lien avec les changements des procédures diagnostiques. Depuis mai 2021, la maladie est à déclaration obligatoire auprès de l’ARS, dans un contexte d’augmentation de l’incidence à l’échelle européenne.
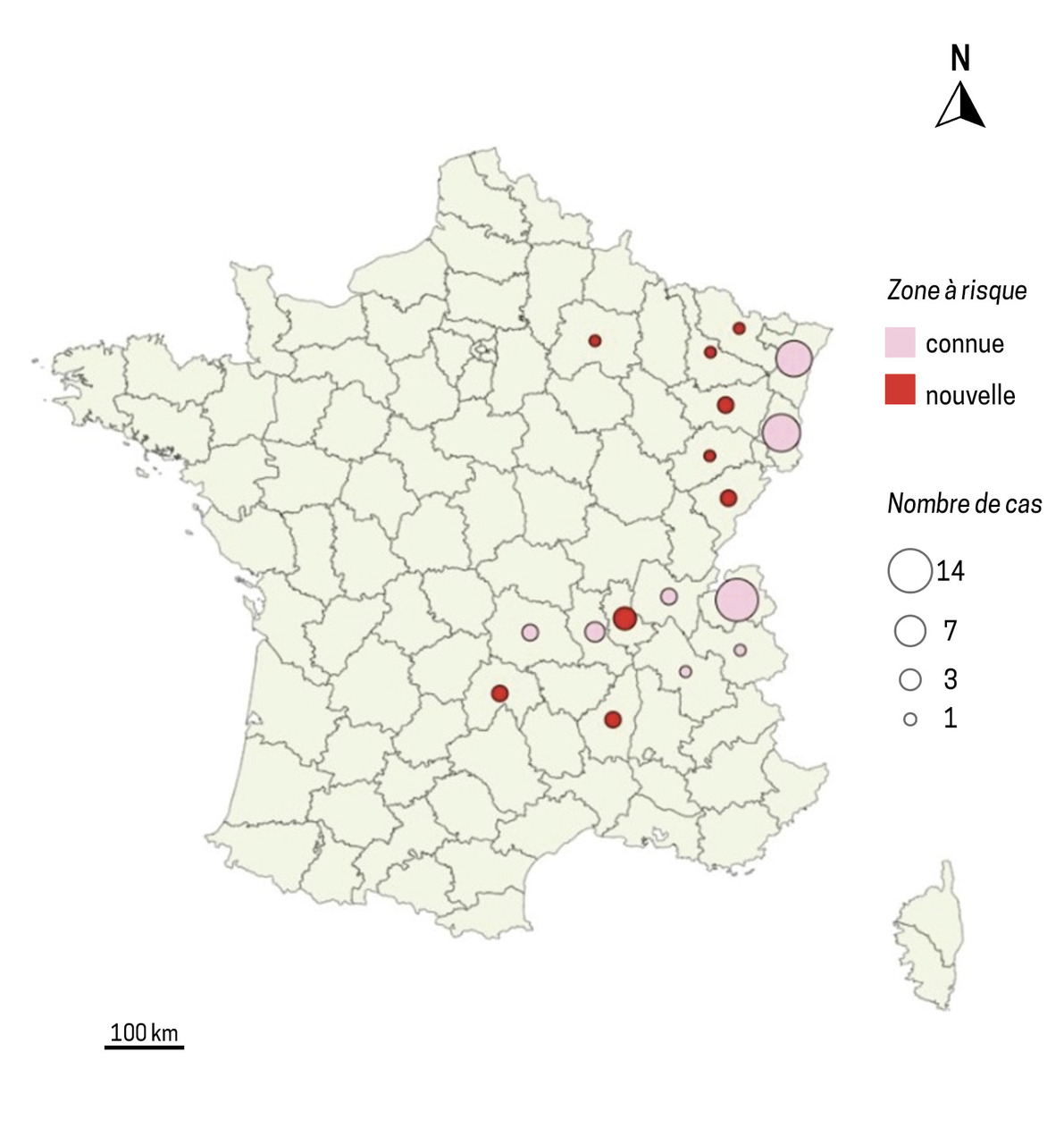
Historiquement, une vingtaine de cas annuels étaient diagnostiqués en France, essentiellement dans l’est du pays ; 105 cas ont été enregistrés entre mai 2021 et octobre 2023 (30 en 2021, 36 en 2022 et 39 en 2023) ; 86 % des cas recensés entre mai 2021 et mai 2023 étaient autochtones (fig. 2).20 Les populations considérées comme étant à risque sont les éleveurs, les agriculteurs, les forestiers et les randonneurs.
Cliniquement, le virus est responsable d’une infection neuro-invasive à type de méningite, encéphalite et myélite. La phase d’invasion correspond à un syndrome pseudogrippal suivi, chez 20 à 30 % des malades, de la forme neurologique. Le taux de létalité est estimé à 1 % et le taux de séquelles persistantes à 40 % chez les patients ayant une atteinte neurologique.20
La prise en charge thérapeutique est uniquement symptomatique.
En matière de prévention, il existe deux vaccins validés (Encepur et Ticovac) par l’Agence européenne des médicaments (EMA) et les autorités sanitaires françaises. La vaccination est recommandée pour les voyageurs séjournant en zone rurale ou boisée dans les régions d’endémie (Europe centrale, orientale et septentrionale, nord de l’Asie centrale, nord de la Chine et nord du Japon), du printemps à l’automne. Elle est également recommandée pour les adultes et les enfants vivant en zone d’endémie.
Fièvres hémorragiques virales
Le terme « fièvres hémorragiques » regroupe des pathologies virales dont le point commun est de causer des hémorragies, dans une proportion variable, souvent relativement faible. Certains virus de cette catégorie sont de classe 4 comme Ebola, Lassa ou la fièvre de Crimée-Congo nécessitant des laboratoires de type P4 et d’autres sont des classes 3 comme la fièvre d’Omsk ou de Kyasanur.
Pas de risque épidémique en métropole
En dehors des arboviroses à risque hémorragique, les virus principaux sont les filovirus constitués des virus Marburg et Ebola. Les arénavirus sont également à l’origine de fièvres hémorragiques virales, comme le virus Lassa, présent surtout en Afrique de l’Ouest, et les arénavirus dits « du nouveau monde » que sont les virus Junin, Machupo, Chapare, Guanarito et Sabia.21
L’ensemble des virus cités ne présentent pas de risque épidémique pour la métropole française. Le risque concerne surtout les personnels de santé exposés aux cas importés.
À ce jour, le virus Lassa est le plus souvent importé ; il a notamment été responsable de cas secondaires en Angleterre et en Allemagne, en milieu de soins et en contamination intrafamiliale.22
Fièvre hémorragique de Crimée-Congo
La fièvre hémorragique de Crimée-Congo (FHCC) est une maladie causée par un virus à ARN du genre Orthonairovirus dont la transmission se fait préférentiellement par piqûre de tiques. Les tiques impliquées sont du genre Hyalomma spp, principalement H. marginatum et H. lusitanicum.
La maladie est présente sur une surface étendue du globe, dont l’Afrique, les Proche- et Moyen-Orient (Iran, Irak) et une large part de l’Asie (Chine et Inde) à l’exception de l’Asie du Sud-Est.
Elle connaît une extension en Europe balkanique depuis les années 1970 et sévit particulièrement en Turquie depuis le début des années 2000.23
Un des principaux fronts actuels de la maladie concerne l’Europe occidentale : les premiers cas humains ont été détectés en Espagne en 2016 et, depuis, près de 12 cas ont été répertoriés. Plus récemment, la présence du virus a été mise en évidence sur des tiques récoltées dans les Pyrénées-Orientales.24 L’importation de tiques infectées en Europe suit principalement les voies de migrations aviaires.
Outre la piqûre de tique, la transmission est possible lors des soins sans précautions par exposition aux sécrétions de patients symptomatiques ou d’un animal infecté. La transmission sexuelle a été occasionnellement décrite.
Les personnes à risque sont les éleveurs, les vétérinaires, les agriculteurs, les agents forestiers, les personnels des abattoirs, les randonneurs et le personnel de santé. Depuis la mise en évidence directe du virus dans les tiques, la stratification du risque de survenue de cas autochtones en France nécessite davantage de données. Le seul cas humain rapporté en France à ce jour était importé du Sénégal en 2004.25
Cliniquement, 70 à 80 % des patients infectés ont une forme asymptomatique ou un syndrome pseudogrippal d’intensité modérée. Parmi les 20 % ayant une forme dite sévère (nécessitant une hospitalisation), 5 à 30 % décèdent, essentiellement de complications hémorragiques, choc et défaillance multiviscérale.23
Le diagnostic repose sur la RT-PCR réalisée par le Centre national de référence des fièvres hémorragiques virales de Lyon. La FHCC est une maladie à déclaration obligatoire auprès de l’ARS : déclaration des cas possibles, probables et confirmés, dont la prise en charge doit être réalisée en ESR.
Le traitement consiste en la prise en charge symptomatique des défaillances et des transfusions itératives, par des équipes dédiées et formées. Un traitement par ribavirine est possible mais fortement débattu dans ce cadre.
Que dire à vos patients ?
Les maladies émergentes sont des maladies nouvelles, réapparaissant ou se diffusant sur un territoire nouveau et/ou connaissant une augmentation significative au sein des populations.
Elles regroupent de nombreux pathogènes aux profils épidémiologiques très divers. Elles peuvent être à transmission aérienne ou par vecteurs (moustiques, tiques).
Le risque épidémique humain est faible, selon les données actuelles, pour les virus de la grippe aviaire hautement pathogènes et la fièvre de Crimée-Congo. Ces pathologies concernent surtout des populations particulières : vétérinaires, éleveurs, agriculteurs, travailleurs dans les abattoirs, gardes forestiers.
Il n’existe pas de traitement spécifique validé pour l’ensemble de ces pathologies, mais les mesures barrières et de lutte antivectorielle, qu’elles soient personnelles (répulsifs, moustiquaire, vêtements longs) ou collectives (élimination des gîtes larvaires, etc.), sont efficaces.
La prévention vaccinale est possible pour plusieurs pathologies, et plusieurs candidats vaccins sont en cours d’approbation finale par l’EMA et/ou déjà approuvés par la FDA (dengue et chikungunya).
2. Bohard L, Gourjault C, d’Ortenzio E, et al. Changement global et risque de maladies vectorielles ou zoonotiques émergentes en Europe. Médecine et Maladies Infectieuses Formation 2023;2(4):171-82.
3. Charostad J, Rezaei Zadeh Rukerd M, Mahmoudvand S, et al. A comprehensive review of highly pathogenic avian influenza (HPAI) H5N1: An imminent threat at doorstep. Travel Med Infect Dis 2023;55:102638.
4. Shi J, Zeng X, Cui P, et al. Alarming situation of emerging H5 and H7 avian influenza and effective control strategies. Emerg Microbes Infect 2023;12(1).
5. Ministère de l’Agriculture et de la Souveraineté alimentaire. Influenza aviaire : la situation en France (en ligne, consulté en mars 2024). 16 février 2024. Disponible sur https://tinyurl.com/44hwepvy
6. OMS. Grippe (aviaire et autres grippes zoonotiques) (en ligne, consulté en mars 2024). Disponible sur https://tinyurl.com/4knf5pma
7. European Centre for Disease Prevention and Control. Facts about avian influenza in humans (en ligne, consulté en mars 2024). 8 février 2023. Disponible sur https://tinyurl.com/2d8mvzzm
8. WHO. Cumulative number of confirmed human cases for avian influenza A(H5N1) reported to WHO, 2003-2024, 7 June 2024. 7 juin 2024. https://tinyurl.com/4t2e7saw
9. Ministère de la Santé et de la Prévention. Les établissements de santé de référence (en ligne, consulté en mars 2024). Mis à jour en décembre 2021. Disponible sur https://tinyurl.com/384555r3
10. Cochet A, Calba C, Jourdain F, et al. Autochthonous dengue in mainland France, 2022: geographical extension and incidence increase. Euro Surveill 2022;27(44).
11. Santé publique France. Chikungunya, dengue et Zika. Données de la surveillance renforcée en France hexagonale 2024. Mis à jour le 26 juin 2024 (disponible sur https://tinyurl.com/4w97a2n9), et : Chikungunya, dengue et Zika. Données de la surveillance renforcée en France métropolitaine en 2023. Mis à jour le 29 avril 2024 (disponible sur https://tinyurl.com/4wcvya2x).
12. Srikiatkhachorn A, Rothman AL, Gibbons R V, et al. Dengue--how best to classify it. Clin Infect Dis 2011;53(6):563–7.
13. Jourdain F, Roiz D, de Valk H, et al. From importation to autochthonous transmission: Drivers of chikungunya and dengue emergence in a temperate area. PLoS Negl Trop Dis 2020;14(5):1-19.
14. Santé publique France. Virus du Nil Occidental (en ligne, consulté en mars 2024). Mis à jour le 1er décembre 2023. Disponible sur https://tinyurl.com/54a3v7s9
15. Clé M, Beck C, Salinas S, et al. Usutu virus: A new threat? Epidemiol Infect 2019;147:1-11.
16. Graninger M, Hubmer S, Riederer F, et al. The First Case of Usutu Virus Neuroinvasive Disease in Austria, 2021. Open Forum Infect Dis 2022;9(7).
17. Cadar D, Simonin Y. Human Usutu Virus Infections in Europe: A New Risk on Horizon? Viruses 2022;15(1).
18. Angeloni G, Bertola M, Lazzaro E, et al. Epidemiology, surveillance and diagnosis of Usutu virus infection in the EU/EEA, 2012 to 2021. Euro Surveill 2023;28(33).
19. Foyer de cas d’encéphalite à tiques liés à la consommation de fromage de chèvre au lait cru dans l’Ain. Point au 19 juin 2020 (en ligne, consulté en mars 2024). 22 juin 2020. Disponible sur https://tinyurl.com/3pzr8d9d
20. Encéphalite à tiques en France : premier bilan des cas recensés par la déclaration obligatoire entre 2021 et 2023 (en ligne, consulté en mars 2024). 7 juillet 2023. Disponible sur https://tinyurl.com/5b56pwks, et : Santé publique France. Bulletin. Cas d'infections par le virus TBE déclarés en France en 2023. 27 juin 2024, disponible sur : https://tinyurl.com/562wt27b
21. Shieh WJ, Demby A, Jones T, et al. Pathology and Pathogenesis of Lassa Fever: Novel Immunohistochemical Findings in Fatal Cases and Clinico-pathologic Correlation. Clin Infect Dis 2022;74(10):1821-30.
22. Wolf T, Ellwanger R, Goetsch U, et al. Fifty years of imported Lassa fever: A systematic review of primary and secondary cases. J Travel Med 2020;7(1):taaa035.
23. Bessis S, Goehringer F, Palich R, et al. Fièvre hémorragique du Crimée-Congo : revue pour la pratique clinique. Médecine et Maladies Infectieuses Formation 2023;2(4):183-91.
24. Cirad. Première détection du virus de la fièvre hémorragique de Crimée-Congo dans le sud de la France (en ligne, consulté en mars 2024). 25 octobre 2023. Disponible sur https://tinyurl.com/4tttvt4a
25. Jauréguiberry S, Tattevin P, Tarantola A, et al. Imported Crimean-Congo hemorrhagic fever. J Clin Microbiol 2005;43(9):4905-7.
Actualités épidémiologiques, veille sanitaire et fiche d’aide à la prise en charge de maladies émergentes sont disponibles sur le site de la Société de pathologie infectieuse de langue française : https://www.infectiologie.com/fr/emergences.html ou sur le site de la mission COREB nationale : https://www.coreb.infectiologie.com/
Des données de veille épidémiologique par région sont également accessibles pour les professionnels de santé : https://agriculture.gouv.fr/influenza-aviaire-la-situation-en-france

 Encadrés
Encadrés