Il existe actuellement quatre indications pour les inhibiteurs de JAK en rhumatologie avec une efficacité démontrée. La tolérance de ces molécules reste cependant à l’étude, et, dans l’attente de données concordantes, des précautions d’emploi sont recommandées.
Le traitement des rhumatismes inflammatoires a profondément évolué depuis l’optimisation de l’utilisation du méthotrexate et avec l’arrivée, il y a maintenant près de vingt-cinq ans, des traitements biologiques. Les anticorps monoclonaux ou protéines recombinantes capables d’inhiber l’action du TNF (tumor necrosis factor), cytokine pro-inflammatoire au centre de la physiopathologie, ont ouvert la voie des traitements dits « ciblés ». Les biothérapies se sont diversifiées, visant, après le TNF, l’interleukine 1 (IL-1), l’IL-6, l’IL-17, l’IL-23 ou les cellules productrices de cytokines, principalement les lymphocytes B et T. Ces traitements ont permis d’améliorer fortement le pronostic de la polyarthrite rhumatoïde (PR), du rhumatisme psoriasique (RPso), des spondyloarthrites (SpA) et de l’arthrite juvénile idiopathique (AJI). Un état de rémission, avec un bon contrôle des manifestations articulaires inflammatoires, et une prévention du handicap sont maintenant obtenus dans près de 50 % des formes les plus sévères.
Plus récemment, les inhibiteurs de Janus kinase (JAK) ont enrichi l’arsenal thérapeutique disponible pour le traitement de ces rhumatismes inflammatoires, en utilisant un concept d’inhibition des cytokines différent de celui des biothérapies.
Plus récemment, les inhibiteurs de Janus kinase (JAK) ont enrichi l’arsenal thérapeutique disponible pour le traitement de ces rhumatismes inflammatoires, en utilisant un concept d’inhibition des cytokines différent de celui des biothérapies.
Biothérapie versus inhibiteur de JAK
La biothérapie utilise une protéine recombinante qui possède une action extracellulaire en agissant directement sur la cytokine cible ou son récepteur, dont elle empêche l’action. Aussi appelée traitement de fond biologique ou biologic disease-modifying anti-rheumatic drug (bDMARD), cette protéine recombinante est administrée par voie parentérale, intraveineuse ou sous-cutanée, avec une demi-vie prolongée, qui permet un traitement comportant une injection toutes les deux ou quatre semaines le plus souvent.
Un inhibiteur de JAK bloque quant à lui la voie de signalisation intracellulaire activée par l’association de la cytokine à son récepteur membranaire. Les inhibiteurs de JAK sont des substances chimiques à demi-vie courte, dont la prise se fait par voie orale quotidienne. Ce sont des traitements de fond synthétiques ciblés (tsDMARD [targeted synthetic DMARD]).
Un inhibiteur de JAK bloque quant à lui la voie de signalisation intracellulaire activée par l’association de la cytokine à son récepteur membranaire. Les inhibiteurs de JAK sont des substances chimiques à demi-vie courte, dont la prise se fait par voie orale quotidienne. Ce sont des traitements de fond synthétiques ciblés (tsDMARD [targeted synthetic DMARD]).
Le concept d’inhibiteur de JAK
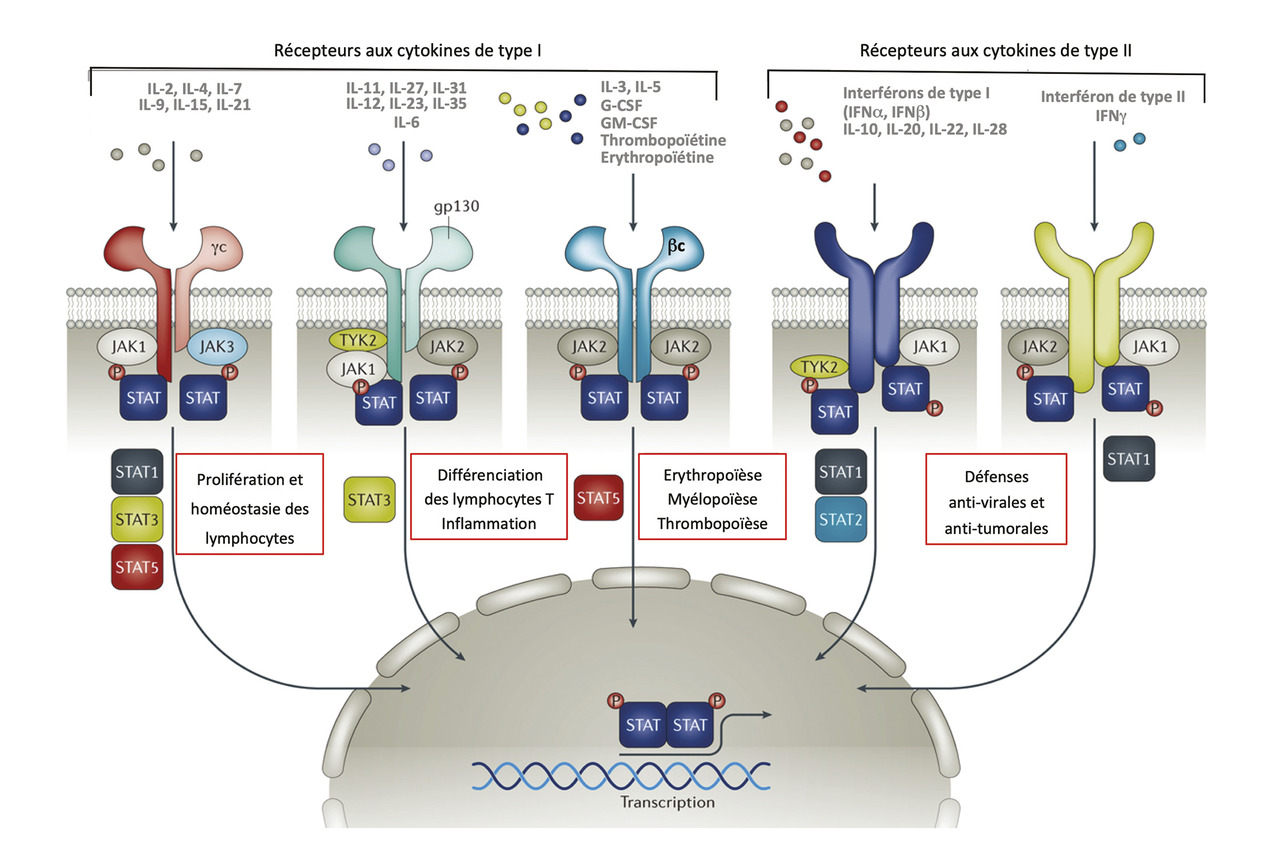
Les JAK sont des tyrosine-kinases associées à la partie intracellulaire des chaînes protéiques qui forment les récepteurs aux cytokines dits « de types I et II ». Le nom de JAK, ou Just another kinase, aurait été donné initialement par le chercheur les ayant identifiées et séquencées au sein du kinome, vaste ensemble d’enzymes nécessaires aux activités métaboliques de l’organisme. Puis les JAK sont devenues les Janus kinases, car l’enzyme possède à la fois un site « kinase activateur » et un site « kinase inhibiteur », lui donnant ainsi deux visages à la manière de Janus, dieu romain des commencements et des fins.
Les JAK constituent un groupe de quatre tyrosine kinases (JAK1, JAK2, JAK3 et TYK2) dont la fonction est de phosphoryler les protéines STAT (Signal transducers and activators of transcription) ; ces protéines intracellulaires STAT, dites « facteurs de transcription », sont capables, après phosphorylation, de se dimériser, de migrer dans le noyau cellulaire, puis de se lier à des séquences d’ADN spécifiques pour induire des modifications dans la synthèse protéique.1 Les STAT sont au nombre de sept. Cet ensemble de quatre JAK et de sept STAT forme la voie de signalisation JAK-STAT, commune à une cinquantaine de protéines, cytokines ou facteurs de croissance, qui possèdent un récepteur membranaire de type I ou II (figure ). Les JAK travaillent par paire, une isoforme associée à chaque chaîne du récepteur. Il peut s’agir le plus souvent d’un hétérodimère, parfois d’un homodimère, voire d’un multimère plus complexe.2 Le rôle respectif de chaque isoforme au sein du couple varie selon le récepteur concerné. L’effet transcriptionnel final induit par une cytokine dépend à la fois des types de JAK et des types de STAT impliqués par le récepteur.
Les inhibiteurs de JAK sont des substances capables d’inhiber cette voie de signalisation. Quatre molécules sont actuellement disponibles en rhumatologie (tableau ), reposant sur un même principe d’inhibition, à savoir la synthèse d’un inhibiteur compétitif de l’adénosine triphosphate (ATP) qui se lie à la conformation active de la kinase, empêchant le transfert d’un phosphore de l’ATP à la protéine STAT. Suivant leur conformation, ces inhibiteurs sont plus ou moins sélectifs pour certaines isoformes de JAK, générant une inhibition préférentielle de certaines cytokines ou facteurs de croissance potentiellement différents selon les molécules.
Les JAK constituent un groupe de quatre tyrosine kinases (JAK1, JAK2, JAK3 et TYK2) dont la fonction est de phosphoryler les protéines STAT (Signal transducers and activators of transcription) ; ces protéines intracellulaires STAT, dites « facteurs de transcription », sont capables, après phosphorylation, de se dimériser, de migrer dans le noyau cellulaire, puis de se lier à des séquences d’ADN spécifiques pour induire des modifications dans la synthèse protéique.1 Les STAT sont au nombre de sept. Cet ensemble de quatre JAK et de sept STAT forme la voie de signalisation JAK-STAT, commune à une cinquantaine de protéines, cytokines ou facteurs de croissance, qui possèdent un récepteur membranaire de type I ou II (
Les inhibiteurs de JAK sont des substances capables d’inhiber cette voie de signalisation. Quatre molécules sont actuellement disponibles en rhumatologie (
La notion de sélectivité des inhibiteurs de JAK
La structure de chaque analogue de l’ATP proposé comme inhibiteur des JAK donne une sélectivité différente pour les quatre isoformes de JAK, comme en témoigne la mesure de la concentration nécessaire pour obtenir une inhibition à 50 % de l’activité enzymatique (IC50).3 C’est ainsi que le tofacitinib possède des concentrations inhibitrices médianes très proches pour JAK1 et JAK3 et est considéré comme un inhibiteur préférentiel de ces deux isoformes d’enzyme. Le baricitinib agit préférentiellement sur JAK1 et JAK2. L’upadacitinib possède une action préférentielle sur JAK1, et à un moindre degré sur JAK2. Le filgotinib est un inhibiteur spécifique de JAK1 (tableau ). L’intérêt d’une sélectivité étroite serait de cibler préférentiellement le groupe des cytokines pro-inflammatoires, IL-6 et IL-23 en particulier, tout en préservant les voies de signalisation des cytokines anti-inflammatoires (IL-4 et IL-10) et celles des facteurs de croissance, limitant ainsi les risques d’effets indésirables. Néanmoins, cette sélectivité in vitro ne se retrouve pas si l’on étudie l’impact des différents inhibiteurs de JAK sur la production des cytokines in vivo,4 sans doute du fait de la complexité du système JAK-STAT et de l’utilisation d’un couple hétérodimérique de JAK par la plu-part des récepteurs. Par ailleurs, l’inhibition de la phosphorylation des protéines STAT est dose-dépendante et l’augmentation de concentration atténue la sélectivité. Tous les inhibiteurs de JAK actuellement disponibles pour le traitement des rhumatismes inflammatoires ont une action similaire sur l’IL-6 dont l’inhibition représente certainement un aspect important dans le contrôle de l’inflammation. Est-ce à dire que tous les inhibiteurs de JAK sont identiques au sein d’une famille homogène de molécules ? Probablement pas ! En effet, une étude de cohorte observationnelle prospective a montré que chez des patients en échec à un premier inhibiteur de JAK, un deuxième inhibiteur de JAK donne un taux de maintien thérapeutique meilleur que si l’on change pour un inhibiteur du TNF.5 Il est donc nécessaire d’attendre des études cliniques comparant différents inhibiteurs de JAK dans une population homogène pour savoir si la sélectivité observée au niveau enzymatique se traduit par des différences en matière d’efficacité et de tolérance.
Des indications précises en rhumatologie
On distingue actuellement quatre indications aux inhibiteurs de JAK en rhumatologie : la polyarthrite rhumatoïde, le rhumatisme psoriasique, la spondylarthrite ankylosante et l’arthrite juvénile idiopathique.
AMM pour les quatre inhibiteurs de JAK dans la polyarthrite rhumatoïde
Les quatre inhibiteurs de JAK ont une autorisation de mise sur le marché (AMM) pour le traitement de la polyarthrite rhumatoïde (PR) active, modérée à sévère, en situation de réponse inadéquate ou d’intolérance à un ou plusieurs traitements de fond (DMARD). Dans cette indication, les études de phase III pour ces inhibiteurs de JAK ont montré une supériorité par rapport au placebo, que ce soit après échec d’un traitement de fond conventionnel synthétique (le méthotrexate le plus souvent) ou après échec d’une ou plusieurs biothérapies. Comparé à un anti-TNF de référence, le tofacitinib et le filgotinib ont démontré une non-infériorité. Pour le baricitinib et l’upadacitinib, une supériorité statistiquement significative par rapport à l’adalimumab est observée mais dont la pertinence clinique est discutable. L’action des inhibiteurs de JAK semble plus rapide que celle des anti-TNF. Tous les inhibiteurs de JAK ont prouvé également une capacité à protéger l’articulation des lésions structurales. Enfin, ils peuvent tous être utilisés en monothérapie si le patient présente une contre-indication ou des signes d’intolérance au méthotrexate.
Deux inhibiteurs de JAK sont disponibles en deux dosages : le baricitinib avec des comprimés à 4 mg et à 2 mg et le filgotinib avec des comprimés à 200 mg et à 100 mg. Dans les deux cas, la posologie la plus élevée est recommandée, la plus basse étant proposée pour les patients âgés (plus de 75 ans) ou ayant certaines comorbidités. Le tofacitinib est disponible à la posologie de 5 mg matin et soir ou de 11 mg en une seule prise, les travaux de pharmacocinétique ayant montré l’équivalence de ces deux posologies. Il dispose aussi d’une forme en solution buvable destinée au traitement des arthrites juvéniles chez des enfants de plus de 2 ans dont la posologie est fonction du poids.
Deux inhibiteurs de JAK sont disponibles en deux dosages : le baricitinib avec des comprimés à 4 mg et à 2 mg et le filgotinib avec des comprimés à 200 mg et à 100 mg. Dans les deux cas, la posologie la plus élevée est recommandée, la plus basse étant proposée pour les patients âgés (plus de 75 ans) ou ayant certaines comorbidités. Le tofacitinib est disponible à la posologie de 5 mg matin et soir ou de 11 mg en une seule prise, les travaux de pharmacocinétique ayant montré l’équivalence de ces deux posologies. Il dispose aussi d’une forme en solution buvable destinée au traitement des arthrites juvéniles chez des enfants de plus de 2 ans dont la posologie est fonction du poids.
Rhumatisme psoriasique, contrôle clinique amélioré par rapport au placebo
Seuls deux inhibiteurs de JAK ont été étudiés et ont obtenu une AMM dans le traitement du rhumatisme psoriasique (RPso) : le tofacitinib et l’upadacitinib. L’indication concerne des patients ayant un RPso actif en réponse inadéquate ou avec une intolérance à un ou plusieurs DMARD. Ces deux molécules ont montré leur supériorité vis-à-vis du placebo pour le contrôle clinique du rhumatisme psoriasique et une équivalence en comparaison avec l’adalimumab.
Une et bientôt deux molécules pour la spondylarthrite ankylosante
Dans l’immédiat, le traitement de la spondylarthrite ankylosante (SpA) ne peut comprendre qu’un seul inhibiteur de JAK : l’upadacitinib. Le tofacitinib a reçu un avis favorable de l’Agence européenne des médicaments (EMA) dans cette indication et devrait très prochainement obtenir également l’accord des autorités françaises. Ces deux molécules ont montré leur supériorité en comparaison au placebo pour le contrôle de la SpA active en réponse inadéquate au traitement conventionnel.
Arthrite juvénile idiopathique : une seule molécule à la galénique adaptée
Dans l’arthrite juvénile idiopathique, seul le tofacitinib possède une forme orale en suspension buvable permettant de traiter des enfants de plus de 2 ans en échec thérapeutique, que ce soit dans le cadre d’une forme polyarticulaire avec ou sans facteur rhumatoïde, d’une forme oligo-articulaire ou d’une arthrite psoriasique juvénile.
Tolérance comparable pour les quatre inhibiteurs de JAK
Les données de la littérature montrent que le risque d’événements indésirables est sensiblement identique pour les quatre inhibiteurs de JAK actuellement disponibles en rhumatologie, permettant d’analyser ces événements indésirables comme ceux d’une classe thérapeutique.
Risque d’infections sévères
Les inhibiteurs de JAK appartiennent à la classe des médicaments dits immunosuppresseurs et, à ce titre, peuvent être responsables d’infections sévères : infections bactériennes, infections opportunistes (en particulier tuberculose), réaction virale. Les cas de tuberculose sont rares, mais tous les patients bénéficient systématiquement d’un dépistage et d’un traitement des tuberculoses latentes, comme pour les traitements biologiques.
Le taux d’incidence pour des infections sévères est sensiblement similaire à celui observé avec les anti-TNF, de l’ordre de 3 pour 100 patients-années.
Les infections les plus fréquentes concernent la sphère ORL, les poumons, l’appareil urinaire, la peau et les tissus mous.6
Une franche augmentation de la réactivation du virus varicelle-zona (VZV) est observée, risque associé à la baisse des défenses immunitaires à médiation cellulaire. La survenue de ces zonas est favorisée par l’âge et la présence d’une corticothérapie associée à l’inhibiteur de JAK. Le taux d’incidence du zona au cours de la PR traitée par inhibiteur de JAK est ainsi évalué à 4,4 pour 100 patients-années, soit 1,5 à 2 fois plus élevé que ce qui est observé au cours de la PR.7 La fréquence de cette réactivation du VZV est 2 à 3 fois plus importante dans les pays asiatiques qu’en Europe. Les formes graves de zona restent exceptionnelles. Le vaccin Zostavax, seul vaccin contre le zona actuellement disponible en France, ne peut malheureusement pas être utilisé pour prévenir cet effet indésirable car il s’agit d’un vaccin vivant atténué, contre-indiqué dans ce contexte.
Le taux d’incidence pour des infections sévères est sensiblement similaire à celui observé avec les anti-TNF, de l’ordre de 3 pour 100 patients-années.
Les infections les plus fréquentes concernent la sphère ORL, les poumons, l’appareil urinaire, la peau et les tissus mous.6
Une franche augmentation de la réactivation du virus varicelle-zona (VZV) est observée, risque associé à la baisse des défenses immunitaires à médiation cellulaire. La survenue de ces zonas est favorisée par l’âge et la présence d’une corticothérapie associée à l’inhibiteur de JAK. Le taux d’incidence du zona au cours de la PR traitée par inhibiteur de JAK est ainsi évalué à 4,4 pour 100 patients-années, soit 1,5 à 2 fois plus élevé que ce qui est observé au cours de la PR.7 La fréquence de cette réactivation du VZV est 2 à 3 fois plus importante dans les pays asiatiques qu’en Europe. Les formes graves de zona restent exceptionnelles. Le vaccin Zostavax, seul vaccin contre le zona actuellement disponible en France, ne peut malheureusement pas être utilisé pour prévenir cet effet indésirable car il s’agit d’un vaccin vivant atténué, contre-indiqué dans ce contexte.
Rares modifications biologiques sévères
Des modifications biologiques peuvent être dues aux inhibiteurs de JAK : neutropénie, lymphopénie, thrombopénie, rares augmentations des transaminases ou de la créatinine... Certaines d’entre elles sont liées à l’inhibition de l’IL-6 (augmentation du cholestérol LDL).
Les inhibiteurs de JAK respectant JAK2 pourraient avoir un moindre impact sur le taux d’hémoglobine, l’action de l’érythropoïétine passant par JAK2.
Des modifications sévères de ces paramètres biologiques restent très rares.
Les inhibiteurs de JAK respectant JAK2 pourraient avoir un moindre impact sur le taux d’hémoglobine, l’action de l’érythropoïétine passant par JAK2.
Des modifications sévères de ces paramètres biologiques restent très rares.
Potentiels risques d’accidents cardiovasculaires et de cancers
Les résultats de l’étude ORAL Surveillance ont mis en évidence une possible augmentation du risque thromboembolique veineux, d’accidents cardiovasculaires et de cancers sous tofacitinib.8 Cette étude de phase IIIB-IV, initiée en 2014 à la demande de la Food and Drug Administration (FDA), visait, à travers une étude randomisée ouverte, à comparer la tolérance du tofacitinib avec celle des anti-TNF au sein d’une population atteinte de PR en réponse inadéquate au méthotrexate. Les patients inclus étaient des patients « à risque » : plus de 50 ans et au moins un facteur de risque cardiovasculaire. L’étude a concerné le tofacitinib, seul inhibiteur de JAK disponible dans cette indication au début de l’étude. Plus de 4 300 patients ont été inclus, répartis en trois bras : tofacitinib 5 mg 2 fois par jour, tofacitinib 10 mg 2 fois par jour et anti-TNF (adalimumab ou étanercept). La médiane de durée du suivi a été de quatre ans. Cette étude conclut à trois sur-risques potentiels d’événements indésirables :
– une augmentation de l’incidence des accidents thromboemboliques veineux graves, dose-dépendante, essentiellement observée à la posologie de 10 mg 2 fois par jour (posologie non indiquée en rhumatologie en France) ;
– un nombre plus élevé d’événements cardiovasculaires majeurs sous tofacitinib (3,4 %) comparé à celui observé chez les patients sous anti-TNF (2,5 %) ; ce risque est d’autant plus important que les patients cumulent des facteurs de risque (âge supérieur à 65 ans, sexe masculin, tabagisme, antécédent d’infarctus du myocarde) ;
– une augmentation de l’incidence des maladies néoplasiques, en particulier cancer du poumon et lymphome (4,2 % avec le tofacitinib et 2,9 % avec l’anti-TNF).
Une étude similaire est en cours avec le baricitinib, également initiée à la demande de la FDA. Cette deuxième étude prospective randomisée est d’autant plus importante que les données de registre n’ont pas identifié à ce jour un sur-risque ni pour les événements cardiovasculaires majeurs ni pour les thromboses veineuses ou les embolies pulmonaires avec les inhibiteurs de JAK.9
– une augmentation de l’incidence des accidents thromboemboliques veineux graves, dose-dépendante, essentiellement observée à la posologie de 10 mg 2 fois par jour (posologie non indiquée en rhumatologie en France) ;
– un nombre plus élevé d’événements cardiovasculaires majeurs sous tofacitinib (3,4 %) comparé à celui observé chez les patients sous anti-TNF (2,5 %) ; ce risque est d’autant plus important que les patients cumulent des facteurs de risque (âge supérieur à 65 ans, sexe masculin, tabagisme, antécédent d’infarctus du myocarde) ;
– une augmentation de l’incidence des maladies néoplasiques, en particulier cancer du poumon et lymphome (4,2 % avec le tofacitinib et 2,9 % avec l’anti-TNF).
Une étude similaire est en cours avec le baricitinib, également initiée à la demande de la FDA. Cette deuxième étude prospective randomisée est d’autant plus importante que les données de registre n’ont pas identifié à ce jour un sur-risque ni pour les événements cardiovasculaires majeurs ni pour les thromboses veineuses ou les embolies pulmonaires avec les inhibiteurs de JAK.9
Évaluer le rapport bénéfice/risque
Cinq contre-indications à connaître
Les contre-indications des inhibiteurs de JAK sont essentiellement au nombre de cinq :
– infections graves (dont la tuberculose) actives ;
– insuffisance hépatique sévère (grade C de Child-Pugh) ;
– insuffisance rénale sévère (clairance de la créatinine < 30 mL/min) ;
– présence d’une neutropénie, d’une lymphopénie ou d’une anémie sévère ;
– grossesse, allaitement, et absence de contraception efficace chez la femme.
– infections graves (dont la tuberculose) actives ;
– insuffisance hépatique sévère (grade C de Child-Pugh) ;
– insuffisance rénale sévère (clairance de la créatinine < 30 mL/min) ;
– présence d’une neutropénie, d’une lymphopénie ou d’une anémie sévère ;
– grossesse, allaitement, et absence de contraception efficace chez la femme.
Des précautions d’emploi étendues aux quatre inhibiteurs de JAK
Des précautions d’emploi ont été énoncées par l’EMA à la suite des données de l’étude ORAL Surveillance pour le tofacitinib, et étendues ensuite aux trois autres inhibiteurs de JAK assimilés au sein d’une même famille de médicaments possédant un mode d’action similaire.10 Ainsi, l’agence établit les recommandations suivantes :
– utiliser les inhibiteurs de JAK avec prudence chez les patients à haut risque de thrombose (patients souffrant d’insuffisance cardiaque, de cancer, de troubles héréditaires de la coagulation ; patients avec antécédents de thrombose ou d’infarctus du myocarde ; patientes sous contraceptif oral combiné ou avec un traitement hormonal substitutif ; patients avec une chirurgie lourde programmée ou une immobilisation) ;
– ne plus prescrire le tofacitinib chez les patients de plus de 65 ans sauf lorsque le médicament est incontournable ;
– prendre en compte d’autres risques comme l’âge, l’obésité, le diabète, l’hypertension artérielle ou le tabagisme.
Très rapidement, l’European Alliance of Associations for Rheumatology (EULAR) avait proposé quatre principes généraux et une série de points à prendre en considération pour encadrer la prescription des inhibiteurs de JAK dans le cadre de la PR.11
Mais à la suite des résultats de l’étude ORAL Surveillance, le comité de pharmacovigilance de l’EMA a lancé en février 2022 une procédure pour réévaluer le rapport bénéfice/risque des inhibiteurs de JAK.
En juin 2022, lors du Congrès européen de rhumatologie, l’EULAR a modifié sa recommandation concernant les traitements de la PR à proposer en cas de réponse inadéquate au méthotrexate. Si, auparavant, biothérapies et inhibiteurs de JAK étaient placés sur une même ligne après échec du méthotrexate, la recommandation propose actuellement l’addition d’une biothérapie au méthotrexate, un inhibiteur de JAK pouvant être considéré mais en tenant compte des facteurs de risque pertinents.
– utiliser les inhibiteurs de JAK avec prudence chez les patients à haut risque de thrombose (patients souffrant d’insuffisance cardiaque, de cancer, de troubles héréditaires de la coagulation ; patients avec antécédents de thrombose ou d’infarctus du myocarde ; patientes sous contraceptif oral combiné ou avec un traitement hormonal substitutif ; patients avec une chirurgie lourde programmée ou une immobilisation) ;
– ne plus prescrire le tofacitinib chez les patients de plus de 65 ans sauf lorsque le médicament est incontournable ;
– prendre en compte d’autres risques comme l’âge, l’obésité, le diabète, l’hypertension artérielle ou le tabagisme.
Très rapidement, l’European Alliance of Associations for Rheumatology (EULAR) avait proposé quatre principes généraux et une série de points à prendre en considération pour encadrer la prescription des inhibiteurs de JAK dans le cadre de la PR.11
Mais à la suite des résultats de l’étude ORAL Surveillance, le comité de pharmacovigilance de l’EMA a lancé en février 2022 une procédure pour réévaluer le rapport bénéfice/risque des inhibiteurs de JAK.
En juin 2022, lors du Congrès européen de rhumatologie, l’EULAR a modifié sa recommandation concernant les traitements de la PR à proposer en cas de réponse inadéquate au méthotrexate. Si, auparavant, biothérapies et inhibiteurs de JAK étaient placés sur une même ligne après échec du méthotrexate, la recommandation propose actuellement l’addition d’une biothérapie au méthotrexate, un inhibiteur de JAK pouvant être considéré mais en tenant compte des facteurs de risque pertinents.
Efficaces, mais avec une tolérance encore en cours d’évaluation
Les inhibiteurs de JAK s’avèrent donc être des molécules efficaces dans le traitement des rhumatismes inflammatoires que sont la PR, le RPso, la SpA et l’AJI, au moins autant qu’un anti-TNF. Ils permettent un retour à un traitement oral et ont l’avantage d’avoir une demi-vie courte. Leur récente mise sur le marché explique l’importance des études de tolérance en cours. Si les données obtenues à partir des registres et des cohortes sont rassurantes, les résultats de l’étude ORAL Surveillance imposent la poursuite d’une évaluation précise de la tolérance de ces molécules. Cette évaluation du rapport bénéfice/risque permettra de mieux définir les patients à risque et de positionner précisément les inhibiteurs de JAK au sein d’un arsenal thérapeutique qui s’est considérablement étoffé pour les rhumatismes inflammatoires depuis le début de ce siècle.
* Les inhibiteurs de JAK ont également des indications dans d’autres domaines que la rhumatologie.
* Les inhibiteurs de JAK ont également des indications dans d’autres domaines que la rhumatologie.
Références
1. O’Shea JJ, Plenge R. JAK and STAT signaling molecules in immunoregulation and immune-mediated disease. Immunity 2012;36:542-50.
2. Banerjee S, Biehl A, Gadina M, et al. JAK-STAT signaling as a target for inflammatory and autoimmune diseases: Current and future prospects. Drugs 2017; 77:521-46.
3. Choy EH. Clinical significance of Janus Kinase inhibitor selectivity. Rheumatology 2019;58:953-62.
4. Dowty ME, Lin TH, Jesson MI, Hegen M, Martin DA, Katkade V, et al. Janus kinase inhibitors for the treatment of rheumatoid arthritis demonstrate similar profiles of in vitro cytokine receptor inhibition. Pharmacol Res Perspect 2019;7:e00537.
5. Amstad A, Papagiannoulis E, Scherer A, Rubbert-Roth A, Finckh A, Mueller R, et al. Comparison of drug retention of TNF inhibitors, other biologics and JAK inhibitors in RA patients who discontinued JAK inhibitor therapy. Rheumatology 2022;online.
6. Bechman K, Subesinghe S, Norton S, Atzeni F, Galli M, Cope AP, et al. A systematic review and meta-analysis of infection risk with small molecule JAK inhibitors in rheumatoid arthritis. Rheumatology 2019;58:1755-66.
7. Windthrop KL. The emerging safety profile of JAK inhibitors in rheumatic disease. Nature Rev Rheumatol 2017;13:234-43.
8. Ytterberg SR, Bhatt DL, Mikuls TR, Koch GG, Fleischmann R, Rivas JL, et al. Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis. N Engl J Med 2022;386:316-26.
9. Kremer JM, Bingham 3rd CO, Cappelli LC, Greenberg JD, Madsen AM, Geier J, et al. Postapproval comparative safety of tofacitinib and biological disease-modifying antirheumatic drugs: 5-year results from a united states-based rheumatoid arthritis registry. ACR Open Rheumatol 2021;3:173-84.
10. Notification to the PRAC/EMA secretariat of a referral under article 20 of regulation (EC) 726/2004. https://www.ema.europa.eu/en/documents/referral/janus-kinase-inhibitors-jaki-article-20-referral-notification_en.pdf
11. Nash P, Kerschbaumer A, Dörner T, Dougados M, Fleischmann RM, Geissler K, et al. Points to consider for the treatment of immune-mediated inflammatory diseases with Janus kinase inhibitors: A consensus statement. Ann Rheum Dis 2021:80:71-87.
2. Banerjee S, Biehl A, Gadina M, et al. JAK-STAT signaling as a target for inflammatory and autoimmune diseases: Current and future prospects. Drugs 2017; 77:521-46.
3. Choy EH. Clinical significance of Janus Kinase inhibitor selectivity. Rheumatology 2019;58:953-62.
4. Dowty ME, Lin TH, Jesson MI, Hegen M, Martin DA, Katkade V, et al. Janus kinase inhibitors for the treatment of rheumatoid arthritis demonstrate similar profiles of in vitro cytokine receptor inhibition. Pharmacol Res Perspect 2019;7:e00537.
5. Amstad A, Papagiannoulis E, Scherer A, Rubbert-Roth A, Finckh A, Mueller R, et al. Comparison of drug retention of TNF inhibitors, other biologics and JAK inhibitors in RA patients who discontinued JAK inhibitor therapy. Rheumatology 2022;online.
6. Bechman K, Subesinghe S, Norton S, Atzeni F, Galli M, Cope AP, et al. A systematic review and meta-analysis of infection risk with small molecule JAK inhibitors in rheumatoid arthritis. Rheumatology 2019;58:1755-66.
7. Windthrop KL. The emerging safety profile of JAK inhibitors in rheumatic disease. Nature Rev Rheumatol 2017;13:234-43.
8. Ytterberg SR, Bhatt DL, Mikuls TR, Koch GG, Fleischmann R, Rivas JL, et al. Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis. N Engl J Med 2022;386:316-26.
9. Kremer JM, Bingham 3rd CO, Cappelli LC, Greenberg JD, Madsen AM, Geier J, et al. Postapproval comparative safety of tofacitinib and biological disease-modifying antirheumatic drugs: 5-year results from a united states-based rheumatoid arthritis registry. ACR Open Rheumatol 2021;3:173-84.
10. Notification to the PRAC/EMA secretariat of a referral under article 20 of regulation (EC) 726/2004. https://www.ema.europa.eu/en/documents/referral/janus-kinase-inhibitors-jaki-article-20-referral-notification_en.pdf
11. Nash P, Kerschbaumer A, Dörner T, Dougados M, Fleischmann RM, Geissler K, et al. Points to consider for the treatment of immune-mediated inflammatory diseases with Janus kinase inhibitors: A consensus statement. Ann Rheum Dis 2021:80:71-87.
Dans cet article
- Biothérapie versus inhibiteur de JAK
- Le concept d’inhibiteur de JAK
- La notion de sélectivité des inhibiteurs de JAK
- Des indications précises en rhumatologie
- Tolérance comparable pour les quatre inhibiteurs de JAK
- Évaluer le rapport bénéfice/risque
- Efficaces, mais avec une tolérance encore en cours d’évaluation