L’imatinib, premier inhibiteur de tyrosine kinase, a transformé le traitement de la leucémie myéloïde chronique (LMC) il y a une vingtaine d’années. Depuis, cinq autres molécules ont rejoint cette classe thérapeutique. Grâce à ces thérapies ciblées, la majorité des patients ont retrouvé une espérance de vie semblable à celle de la population générale.
La leucémie myéloïde chronique (LMC) est une hémopathie maligne liée à la survenue, pour des raisons inconnues, d’une translocation réciproque entre les chromosomes 22 et 9 dans les cellules souches hématopoïétiques.1 Cette translocation fusionne le gène BCR (breakpoint cluster region) en 22q11 au proto-oncogène ABL1 (Abelson) en 9q34.2 BCR::ABL1 code pour une tyrosine kinase (TK) intracellulaire ; l’activation aberrante de cette protéine lui octroie des propriétés transformantes. La LMC peut survenir à tout âge, et l’âge médian au diagnostic est d’environ 65 ans en France.3 Si l’incidence de la LMC est faible et stable, de l’ordre de 1 ou 2 personnes affectées pour 100 000 habitants par an, sa prévalence augmente considérablement depuis un peu plus de vingt ans grâce aux thérapies ciblées, qui ont permis de diminuer le taux de mortalité à 2 %.4 L’avènement des inhibiteurs de la tyrosine kinase (ITK) BCR::ABL1, le moteur de la maladie, a révolutionné le devenir des patients. Par le passé, la LMC engageait le pronostic vital, avec une survie médiane d’environ quatre ans et une évolution fatale en leucémie aiguë. Aujourd’hui, l’espérance de vie des patients rejoint, pour la plupart, celle de la population générale, sous réserve d’un traitement ciblé par ITK bien conduit.
Découverte fortuite ou signes cliniques peu spécifiques
Le diagnostic de LMC peut être effectué à un stade asymptomatique sur la découverte fortuite d’une hyperleucocytose d’importance variable avec myélémie, parfois accompagnée d’une thrombocytose ou d’une anémie. Dans les autres cas, les signes cliniques sont peu spécifiques et incluent amaigrissement, fatigue, splénomégalie ou crise de goutte. Plus rarement, la LMC est révélée par une thrombose, un priapisme, une hémorragie ou un syndrome de leucostase.
Il est fondamental que le diagnostic et la prise en charge soient effectués dans les règles de l’art dans un centre spécialisé en hématologie maligne. En l’absence de complication inaugurale, la prise en charge se doit d’être rapide mais ambulatoire, en consultation d’hématologie, sans passage par les services d’urgence ni hospitalisation.
Le bilan diagnostique comporte un hémogramme, un myélogramme, un caryotype médullaire, à la recherche du chromosome Philadelphie et d’anomalies cytogénétiques additionnelles, une recherche et un typage des transcrits BCR::ABL1 sanguins en biologie moléculaire.
Une cytoréduction transitoire par hydroxyurée peut être prescrite si la leucocytose est majeure ou s’il existe une splénomégalie symptomatique. Il convient de ne pas prescrire d’antiagrégants plaquettaires en cas de thrombocytose du fait d’un risque hémorragique en cas de thrombopathie acquise.
Une fois le diagnostic de LMC posé, la demande de prise en charge en affection de longue durée (ALD) exonérante doit être effectuée par le médecin traitant.
Il est fondamental que le diagnostic et la prise en charge soient effectués dans les règles de l’art dans un centre spécialisé en hématologie maligne. En l’absence de complication inaugurale, la prise en charge se doit d’être rapide mais ambulatoire, en consultation d’hématologie, sans passage par les services d’urgence ni hospitalisation.
Le bilan diagnostique comporte un hémogramme, un myélogramme, un caryotype médullaire, à la recherche du chromosome Philadelphie et d’anomalies cytogénétiques additionnelles, une recherche et un typage des transcrits BCR::ABL1 sanguins en biologie moléculaire.
Une cytoréduction transitoire par hydroxyurée peut être prescrite si la leucocytose est majeure ou s’il existe une splénomégalie symptomatique. Il convient de ne pas prescrire d’antiagrégants plaquettaires en cas de thrombocytose du fait d’un risque hémorragique en cas de thrombopathie acquise.
Une fois le diagnostic de LMC posé, la demande de prise en charge en affection de longue durée (ALD) exonérante doit être effectuée par le médecin traitant.
Six inhibiteurs de tyrosine kinase ont une AMM
Six inhibiteurs oraux de BCR::ABL1, de puissance, spécificité et sélectivité variables, conférant à chaque molécule une efficacité et un profil de tolérance uniques, disposent d’une autorisation de mise sur le marché [AMM] (tableau ).
L’imatinib est l’ITK compétitif de l’adénosine triphosphate (ATP) de première génération qui a permis, à la fin du XXe siècle, d’apporter la preuve du concept du ciblage de BCR::ABL1 et l’amorçage d’une révolution thérapeutique.5,6
Les dasatinib, nilotinib et bosutinib sont des ITK compétitifs de l’ATP de deuxième génération plus puissants que l’imatinib et actifs contre la plupart des mutations ponctuelles du domaine TK de BCR::ABL1 conférant résistance à l’imatinib, à l’exception de la mutation T315I dite « gatekeeper ».7
Le ponatinib est le plus puissant des ITK compétitifs de l’ATP. C’est un ITK de troisième génération, efficace contre la majorité des mutations de résistance, y compris la T315I.8
Enfin, l’asciminib, qui vient de rejoindre l’arsenal thérapeutique, est un inhibiteur allostérique puissant et très sélectif.9 Il est inactif en cas de mutation située sur son site de fixation, la poche de myristoylation de BCR::ABL1, mais il fonctionne contre la plupart des mutations du domaine kinase d’ABL1, y compris la mutation T315I, lorsqu’il est administré à forte dose.
L’imatinib est l’ITK compétitif de l’adénosine triphosphate (ATP) de première génération qui a permis, à la fin du XXe siècle, d’apporter la preuve du concept du ciblage de BCR::ABL1 et l’amorçage d’une révolution thérapeutique.5,6
Les dasatinib, nilotinib et bosutinib sont des ITK compétitifs de l’ATP de deuxième génération plus puissants que l’imatinib et actifs contre la plupart des mutations ponctuelles du domaine TK de BCR::ABL1 conférant résistance à l’imatinib, à l’exception de la mutation T315I dite « gatekeeper ».7
Le ponatinib est le plus puissant des ITK compétitifs de l’ATP. C’est un ITK de troisième génération, efficace contre la majorité des mutations de résistance, y compris la T315I.8
Enfin, l’asciminib, qui vient de rejoindre l’arsenal thérapeutique, est un inhibiteur allostérique puissant et très sélectif.9 Il est inactif en cas de mutation située sur son site de fixation, la poche de myristoylation de BCR::ABL1, mais il fonctionne contre la plupart des mutations du domaine kinase d’ABL1, y compris la mutation T315I, lorsqu’il est administré à forte dose.
Objectif principal : prévenir la transformation en leucémie aiguë
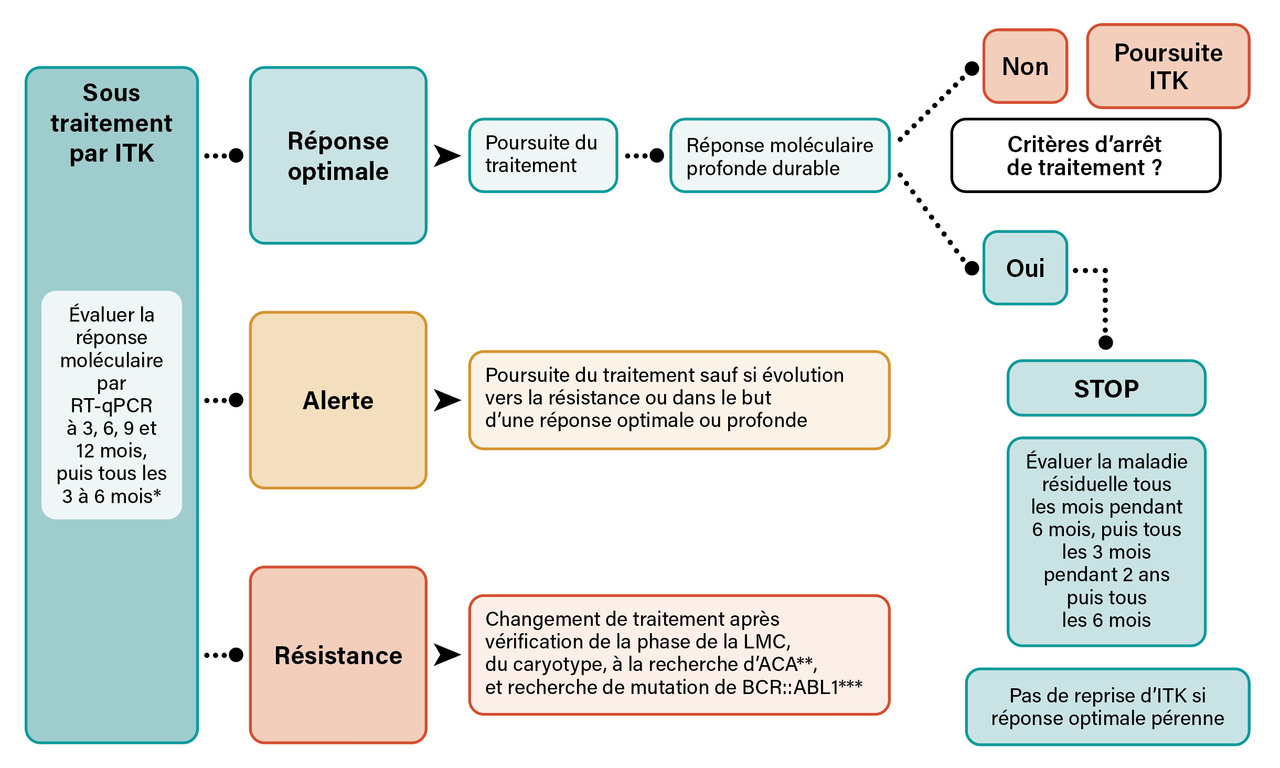
L’objectif thérapeutique principal consiste en l’obtention d’une réponse moléculaire optimale, c’est-à-dire conférant une protection maximale vis-à-vis de la transformation en leucémie aiguë (figure ).10 La réponse moléculaire optimale est un marqueur substitutif solide de survie sans progression ; elle est définie par une diminution progressive de la masse leucémique jusqu’à l’obtention d’une réponse moléculaire majeure (RMM : BCR::ABL1 ≤ 0,1 % IS [International Scale]) entre le douzième et le dix-huitième mois de traitement, puis par le maintien d’une telle réponse sous traitement.10
L’objectif secondaire majeur est la rémission sans traitement ou guérison fonctionnelle.10 Alors qu’il était recommandé de poursuivre les ITK à vie, la découverte que, sous réserve d’une réponse moléculaire profonde (RMP : BCR::ABL1 ≤ 0,01 % IS) et durable, certains patients peuvent demeurer en réponse optimale sans traitement, fait actuellement évoluer les concepts de prise en charge. Bien que les RMP n’apportent pas de bénéfice substantiel supplémentaire en matière de survie, comparé à celui conféré par une RMM simple, elles sont devenues un nouvel objectif à atteindre, en vue d’un arrêt de traitement (figure ).11
L’objectif secondaire majeur est la rémission sans traitement ou guérison fonctionnelle.10 Alors qu’il était recommandé de poursuivre les ITK à vie, la découverte que, sous réserve d’une réponse moléculaire profonde (RMP : BCR::ABL1 ≤ 0,01 % IS) et durable, certains patients peuvent demeurer en réponse optimale sans traitement, fait actuellement évoluer les concepts de prise en charge. Bien que les RMP n’apportent pas de bénéfice substantiel supplémentaire en matière de survie, comparé à celui conféré par une RMM simple, elles sont devenues un nouvel objectif à atteindre, en vue d’un arrêt de traitement (
Stratégie de prise en charge encadrée par des recommandations
La stratégie de traitement par ITK est mise en place par l’hématologue et prend en compte à la fois les caractéristiques de l’hémopathie (phase, facteurs pronostiques initiaux et sous traitement) et celles du patient (âge, comorbidités, mode de vie), comme recommandé par les panels d’experts de l’European LeukemiaNet (ELN) ou du National Comprehensive Cancer Center Network.10,12
ITK de première et deuxième générations en première ligne
Seuls l’imatinib et les ITK de deuxième génération peuvent être prescrits en première ligne. Les essais cliniques d’enregistrement ont formellement démontré une probabilité plus importante de réponse optimale avec les ITK de deuxième génération face à l’imatinib ainsi qu’un taux d’éligibilité à un arrêt de traitement plus élevé du fait d’une diminution plus profonde de la maladie résiduelle.
Aux posologies initiales recommandées, le bosutinib est très souvent responsable de nausées, vomissements, diarrhée et cytolyse hépatique.13
Le dasatinib est très fréquemment responsable d’épanchements pleuraux exsudatifs lymphocytaires et, très rarement, d’hypertension artérielle pulmonaire précapillaire, cette dernière imposant l’arrêt définitif du médicament du fait de son risque létal.13
Le nilotinib augmente le risque d’accident artériel ischémique, surtout chez les patients à haut ou très haut risque cardiovasculaire, et il perturbe le métabolisme glucidolipidique.13
L’imatinib est générateur de nausées, crampes musculaires, diarrhée motrice, œdèmes périphériques et photosensibilisation, d’hypophosphatémie par tubulopathie et d’augmentation à long terme de la créatinine. Les effets indésirables de l’imatinib sont rarement graves mais ils peuvent altérer la qualité de vie.13 Chez les diabétiques, l’imatinib améliore l’équilibre glucidique.
Les effets indésirables des ITK sont en grande partie déterminés par la sélectivité imparfaite de ces thérapies ciblées.
Il est important de spécifier que les ITK dans la LMC ne sont pas immunosuppresseurs ; il n’y a donc pas de précaution anti-infectieuse particulière à prendre, et le calendrier vaccinal national préconisé par les autorités de santé peut être maintenu tel quel par le médecin généraliste.
Les ITK sont métabolisés par le CYP3A4 ; il existe donc un risque théorique d’interactions médicamenteuses en cas de polymédication ; en pratique quotidienne, seules certaines molécules, comme les antiarythmiques, les anticoagulants, les antifongiques oraux ou les inducteurs du CYP3A4 sont à surveiller de près.13
Lorsque l’ITK choisi en première ligne s’avère insatisfaisant du fait d’une résistance ou d’une intolérance, l’ITK doit être changé (figure ).10
Effets indésirables fréquents liés à une sélectivité imparfaite des molécules
Le risque d’effets indésirables sévères est plus élevé avec les ITK de deuxième génération, en particulier chez les patients âgés porteurs de certaines comorbidités, ou lorsque la posologie initiale recommandée des ITK est maintenue telle quelle à moyen ou long terme.Aux posologies initiales recommandées, le bosutinib est très souvent responsable de nausées, vomissements, diarrhée et cytolyse hépatique.13
Le dasatinib est très fréquemment responsable d’épanchements pleuraux exsudatifs lymphocytaires et, très rarement, d’hypertension artérielle pulmonaire précapillaire, cette dernière imposant l’arrêt définitif du médicament du fait de son risque létal.13
Le nilotinib augmente le risque d’accident artériel ischémique, surtout chez les patients à haut ou très haut risque cardiovasculaire, et il perturbe le métabolisme glucidolipidique.13
L’imatinib est générateur de nausées, crampes musculaires, diarrhée motrice, œdèmes périphériques et photosensibilisation, d’hypophosphatémie par tubulopathie et d’augmentation à long terme de la créatinine. Les effets indésirables de l’imatinib sont rarement graves mais ils peuvent altérer la qualité de vie.13 Chez les diabétiques, l’imatinib améliore l’équilibre glucidique.
Les effets indésirables des ITK sont en grande partie déterminés par la sélectivité imparfaite de ces thérapies ciblées.
Suivi rapproché de l’efficacité et de la tolérance
Une fois l’ITK de première ligne choisi et débuté, le patient est revu après le premier mois pour s’assurer de l’obtention d’une réponse hématologique complète et de la tolérance précoce du traitement puis, en l’absence de problème particulier, tous les trois mois pendant la première année puis tous les quatre à six mois par la suite, sauf en cas de changement ou d’arrêt de traitement.10 À chaque consultation, une mesure de la maladie résiduelle sanguine est effectuée et des examens complémentaires adaptés au suivi de la tolérance de chaque médicament sont demandés. Le maintien du lien entre le patient et son médecin généraliste référent est fondamental car, la plupart des patients ayant une espérance de vie comparable à celle de la population générale sous ITK, il convient qu’ils soient suivis et traités de la même façon que le reste de la population pour les autres problèmes de santé éventuels. Dans certains cas, si le traitement par ITK nécessite une attention extrahématologique particulière (notamment cardiovasculaire, pulmonaire ou hépatique), l’hématologue peut faire appel à un suivi conjoint avec d’autres spécialistes.Il est important de spécifier que les ITK dans la LMC ne sont pas immunosuppresseurs ; il n’y a donc pas de précaution anti-infectieuse particulière à prendre, et le calendrier vaccinal national préconisé par les autorités de santé peut être maintenu tel quel par le médecin généraliste.
Les ITK sont métabolisés par le CYP3A4 ; il existe donc un risque théorique d’interactions médicamenteuses en cas de polymédication ; en pratique quotidienne, seules certaines molécules, comme les antiarythmiques, les anticoagulants, les antifongiques oraux ou les inducteurs du CYP3A4 sont à surveiller de près.13
Lorsque l’ITK choisi en première ligne s’avère insatisfaisant du fait d’une résistance ou d’une intolérance, l’ITK doit être changé (
Choix de deuxième ligne multicritère
Le choix de l’ITK suivant se fonde principalement sur le résultat de l’analyse mutationnelle de BCR::ABL1 en cas de résistance, les comorbidités, le spectre des effets indésirables des ITK restants et le risque d’intolérance croisée.10
Chez les patients résistants porteurs d’une mutation de BCR::ABL1, le degré de sensibilité aux ITK des différents mutants in vitro est un guide utile. En présence de résistance sans mutation de BCR::ABL1, un ITK plus puissant que le précédent est choisi.
En 2023, il est très rare de diriger les patients atteints de LMC vers l’allogreffe de cellules souches hématopoïétiques. Seuls les patients multirésistants et ceux mis en rémission après transformation en leucémie aiguë sont concernés, sous réserve qu’ils ne soient pas trop âgés, qu’ils n’aient pas trop de comorbidités et qu’ils aient un donneur apparenté ou non apparenté HLA-compatible.
En deuxième ligne ou au-delà, les ITK compétitifs de deuxième génération peuvent être utilisés, ainsi que le ponatinib ou l’asciminib. Ce dernier ne dispose d’une AMM qu’en troisième ligne hors résistance liée à une mutation T315I, mais il est actuellement évalué en première ligne.14 Les risques du ponatinib sont essentiellement d’ordre cardiovasculaire car ce médicament inhibe le VEGFR-2 et peut provoquer ou déséquilibrer une hypertension artérielle, et il augmente le risque d’occlusion artérielle.15 En outre, il cause souvent des désordres digestifs (constipation, douleurs abdominales) ou cutanés (alopécie, dermatose folliculaire). L’asciminib est le mieux supporté de tous les ITK, probablement du fait de sa très haute sélectivité.
Chez les patients résistants porteurs d’une mutation de BCR::ABL1, le degré de sensibilité aux ITK des différents mutants in vitro est un guide utile. En présence de résistance sans mutation de BCR::ABL1, un ITK plus puissant que le précédent est choisi.
En 2023, il est très rare de diriger les patients atteints de LMC vers l’allogreffe de cellules souches hématopoïétiques. Seuls les patients multirésistants et ceux mis en rémission après transformation en leucémie aiguë sont concernés, sous réserve qu’ils ne soient pas trop âgés, qu’ils n’aient pas trop de comorbidités et qu’ils aient un donneur apparenté ou non apparenté HLA-compatible.
En deuxième ligne ou au-delà, les ITK compétitifs de deuxième génération peuvent être utilisés, ainsi que le ponatinib ou l’asciminib. Ce dernier ne dispose d’une AMM qu’en troisième ligne hors résistance liée à une mutation T315I, mais il est actuellement évalué en première ligne.14 Les risques du ponatinib sont essentiellement d’ordre cardiovasculaire car ce médicament inhibe le VEGFR-2 et peut provoquer ou déséquilibrer une hypertension artérielle, et il augmente le risque d’occlusion artérielle.15 En outre, il cause souvent des désordres digestifs (constipation, douleurs abdominales) ou cutanés (alopécie, dermatose folliculaire). L’asciminib est le mieux supporté de tous les ITK, probablement du fait de sa très haute sélectivité.
Axes d’amélioration des thérapies ciblées dans la LMC
Si les ITK ont révolutionné le pronostic des patients atteints de LMC et fait de cette hémopathie un modèle et un moteur en matière de thérapies ciblées, certains défis et besoins persistent. En particulier, de nombreuses études démontrent que les cellules souches leucémiques quiescentes sont peu sensibles à l’apoptose induite par les ITK et, actuellement, environ 15 % seulement des patients peuvent prétendre à une rémission sans traitement prolongée apparentée à une guérison. Des recherches orientées vers la compréhension des mécanismes à la base de la persistance leucémique sont en cours, dans le but de développer des stratégies pour offrir, dans le futur et sans risque excessif, la guérison définitive à tous les patients. Enfin, d’autres ITK encore plus performants et d’autres manières de les utiliser seuls ou en combinaison pourraient voir le jour.
Références
1. Cortes J, Pavlovsky C, Saussele S. Chronic myeloid leukemia. Lancet 2021;398(10314): 1914-26.
2. Heisterkamp N, Stephenson JR, Groffen J, Hansen PF, de Klein PF, Bartram CR, et al. Localisation of the c-abl oncogene adjacent to a translocation break point in chronic myelocytic leukaemia. Nature 1983;306(5940):239-42.
3. Hehlmann R, Hochhaus A, Baccarani M, European LeukemiaNet. Chronic myeloid leukemia. Lancet 2007;370(9584):342-50.
4. Huang X, Cortes J, Kantarjian H. Estimations of the increasing prevalence and plateau prevalence of chronic myeloid leukemia in the era of tyrosine kinase inhibitor therapy. Cancer 2012;118(12):3123-27.
5. Druker BJ, Guilhot F, O’Brien SG, Gathmann I, Kantarjian H, Gattermann, et al; IRIS Investigators. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med 2006;355(23):2408-17.
6. Rea D. Traitement par imatinib de la leucémie myéloïde chronique : 20 ans après. Bull Ac Nat Med 2023;207(6):732-8.
7. Rosti G, Castagnetti F, Gugliotta G, Baccarani M. Tyrosine kinase inhibitors in chronic myeloid leukaemia: Which, when, for whom? Nat Rev Clin Oncol 2017;14(3):141-54.
8. O’Hare T, Shakespeare WC, Zhu X, Eide CA, Rivera VM, Wang F, et al. AP24534, a pan-BCR-ABL inhibitor for chronic myeloid leukemia, potently inhibits the T315I mutant and overcomes mutation-based resistance. Cancer Cell 2009;16(5):401-12.
9. Rea D, Hughes TP. Development of asciminib, a novel allosteric inhibitor of BCR-ABL1. Crit Rev Oncol Hematol 2022;171:103580.
10. Hochhaus A, Baccarani M, Silver RT, Schiffer C, Apperley JF, Cervantes F, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020;34(4):966-84.
11. Rea D, Ame S, Berger M, Cavuela JM, Charbonnier A, Coiteux V, et al; French Chronic Myeloid Leukemia Study Group. Discontinuation of tyrosine kinase inhibitors in chronic myeloid leukemia: Recommendations for clinical practice from the French Chronic Myeloid Leukemia Study Group. Cancer 2018;124(14):2956-63.
12. Saussele S, Krauss MP, Hehlmann R, Lauseker M, Proetel U, Kalmanti L, et al; Schweizerische Arbeitsgemeinschaft für Klinische Krebsforschung and the German CML Study Group. Impact of comorbidities on overall survival in patients with chronic myeloid leukemia: Results of the randomized CML study IV. Blood 2015;126(1):42-9.
13. Steegmann JL, Baccarani M, Breccia M, Casado LF, Garcia-Gutiérrez V, Hochhaux A, et al. European LeukemiaNet recommendations for the management and avoidance of adverse events of treatment in chronic myeloid leukaemia. Leukemia 2016;30(8):1648-71.
14. Réa D, Mauro MJ, Boquimpani C, Minami Y, Lomaia E, Voloshin S, et al. A phase 3, open-label, randomized study of asciminib, a STAMP inhibitor, vs bosutinib in CML after 2 or more prior TKIs. Blood 2021;138(21):2031-41.
15. Réa D, Messas E, Mirault T, Nicolini FE. French Chronic Myeloid Leukemia Intergroup 2022 recommendations for managing the risk of cardiovascular events on ponatinib in chronic myeloid leukemia. Bull Cancer 2022;109(7-8):862-72.
2. Heisterkamp N, Stephenson JR, Groffen J, Hansen PF, de Klein PF, Bartram CR, et al. Localisation of the c-abl oncogene adjacent to a translocation break point in chronic myelocytic leukaemia. Nature 1983;306(5940):239-42.
3. Hehlmann R, Hochhaus A, Baccarani M, European LeukemiaNet. Chronic myeloid leukemia. Lancet 2007;370(9584):342-50.
4. Huang X, Cortes J, Kantarjian H. Estimations of the increasing prevalence and plateau prevalence of chronic myeloid leukemia in the era of tyrosine kinase inhibitor therapy. Cancer 2012;118(12):3123-27.
5. Druker BJ, Guilhot F, O’Brien SG, Gathmann I, Kantarjian H, Gattermann, et al; IRIS Investigators. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med 2006;355(23):2408-17.
6. Rea D. Traitement par imatinib de la leucémie myéloïde chronique : 20 ans après. Bull Ac Nat Med 2023;207(6):732-8.
7. Rosti G, Castagnetti F, Gugliotta G, Baccarani M. Tyrosine kinase inhibitors in chronic myeloid leukaemia: Which, when, for whom? Nat Rev Clin Oncol 2017;14(3):141-54.
8. O’Hare T, Shakespeare WC, Zhu X, Eide CA, Rivera VM, Wang F, et al. AP24534, a pan-BCR-ABL inhibitor for chronic myeloid leukemia, potently inhibits the T315I mutant and overcomes mutation-based resistance. Cancer Cell 2009;16(5):401-12.
9. Rea D, Hughes TP. Development of asciminib, a novel allosteric inhibitor of BCR-ABL1. Crit Rev Oncol Hematol 2022;171:103580.
10. Hochhaus A, Baccarani M, Silver RT, Schiffer C, Apperley JF, Cervantes F, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020;34(4):966-84.
11. Rea D, Ame S, Berger M, Cavuela JM, Charbonnier A, Coiteux V, et al; French Chronic Myeloid Leukemia Study Group. Discontinuation of tyrosine kinase inhibitors in chronic myeloid leukemia: Recommendations for clinical practice from the French Chronic Myeloid Leukemia Study Group. Cancer 2018;124(14):2956-63.
12. Saussele S, Krauss MP, Hehlmann R, Lauseker M, Proetel U, Kalmanti L, et al; Schweizerische Arbeitsgemeinschaft für Klinische Krebsforschung and the German CML Study Group. Impact of comorbidities on overall survival in patients with chronic myeloid leukemia: Results of the randomized CML study IV. Blood 2015;126(1):42-9.
13. Steegmann JL, Baccarani M, Breccia M, Casado LF, Garcia-Gutiérrez V, Hochhaux A, et al. European LeukemiaNet recommendations for the management and avoidance of adverse events of treatment in chronic myeloid leukaemia. Leukemia 2016;30(8):1648-71.
14. Réa D, Mauro MJ, Boquimpani C, Minami Y, Lomaia E, Voloshin S, et al. A phase 3, open-label, randomized study of asciminib, a STAMP inhibitor, vs bosutinib in CML after 2 or more prior TKIs. Blood 2021;138(21):2031-41.
15. Réa D, Messas E, Mirault T, Nicolini FE. French Chronic Myeloid Leukemia Intergroup 2022 recommendations for managing the risk of cardiovascular events on ponatinib in chronic myeloid leukemia. Bull Cancer 2022;109(7-8):862-72.