L’association entre cancer et insuffisance rénale aiguë est multifactorielle et complexe : les patients atteints de maladie rénale chronique sont davantage susceptibles de développer des cancers, et leurs traitements sont capables d’induire une insuffisance rénale aiguë. Par ailleurs, l’émergence de nouvelles classes pharmacologiques de traitement antinéoplasique a considérablement modifié le pronostic de nombreux cancers et dans le même temps enrichi le répertoire des médicaments néphrotoxiques. La survenue d’une insuffisance rénale aiguë est un tournant dans l’histoire naturelle des cancers en raison de son impact défavorable sur le pronostic vital et les chances de rémission. Néanmoins, l’insuffisance rénale aiguë dans ce contexte ne constitue pas une entité homogène : elle peut s’intégrer dans le contexte d’une défaillance multiviscérale ou survenir isolément et relever de mécanismes extrêmement variés, entérinant de ce fait la naissance d’une nouvelle discipline transversale, l’onconéphrologie.
Épidémiologie et signification pronostique
Plusieurs études ont mis en évidence que l’incidence annuelle de l’insuffisance rénale aiguë était élevée (11-20 %) au cours de l’évolution du cancer.1 L’incidence est la plus élevée lors de la première année de découverte du cancer. Néanmoins, des variations significatives existent selon le type de population et de cancer. L’incidence est maximale (67 %) dans le contexte d’admission en réanimation et d’hémopathie maligne évolutive. Au sein des hémopathies, les patients atteints de leucémies aiguës et de myélome multiple ont le risque le plus élevé de développer une insuffisance rénale aiguë. Parmi les tumeurs solides, les cancers rénaux et de la vessie sont les plus à risque. Outre le type de tumeur, le caractère évolué du cancer, la coexistence d’un diabète et d’une maladie rénale chronique conditionnent le risque d’insuffisance rénale.2
De nombreuses études ont étayé l’impact délétère de l’insuffisance rénale aiguë sur le pronostic des patients atteints de cancer. Elle altère le pronostic vital des patients atteints d’hémopathie maligne aussi bien que ceux ayant des tumeurs solides. On note également que le risque de mortalité est d’autant plus élevé que l’insuffisance rénale est de sévérité accrue, corroborant le concept d’une relation de causalité et non seulement d’une seule association statistique. Les chances de rémission sont également significativement moins bonnes chez les patients qui au cours de leur histoire ont eu une insuffisance rénale aiguë comparativement à ceux qui en ont été épargnés. La survenue d’une insuffisance rénale aiguë peut motiver un changement de type de traitement antinéoplasique, notamment si une néphrotoxicité est envisagée, avec le risque de traitements moins efficaces. Très souvent, elle conduit à différer les cycles de chimiothérapies ou à en réduire les doses, autant de facteurs défavorables pour le pronostic des patients.1
De nombreuses études ont étayé l’impact délétère de l’insuffisance rénale aiguë sur le pronostic des patients atteints de cancer. Elle altère le pronostic vital des patients atteints d’hémopathie maligne aussi bien que ceux ayant des tumeurs solides. On note également que le risque de mortalité est d’autant plus élevé que l’insuffisance rénale est de sévérité accrue, corroborant le concept d’une relation de causalité et non seulement d’une seule association statistique. Les chances de rémission sont également significativement moins bonnes chez les patients qui au cours de leur histoire ont eu une insuffisance rénale aiguë comparativement à ceux qui en ont été épargnés. La survenue d’une insuffisance rénale aiguë peut motiver un changement de type de traitement antinéoplasique, notamment si une néphrotoxicité est envisagée, avec le risque de traitements moins efficaces. Très souvent, elle conduit à différer les cycles de chimiothérapies ou à en réduire les doses, autant de facteurs défavorables pour le pronostic des patients.1
Syndrome de lyse tumorale
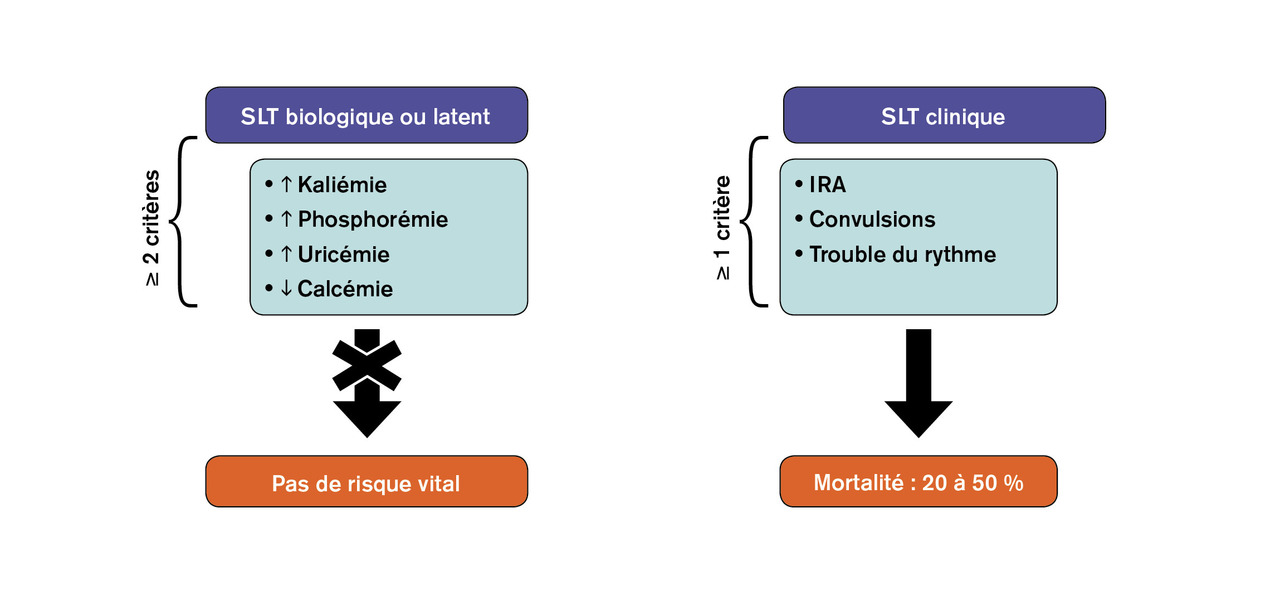
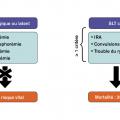
Le syndrome de lyse tumorale constitue une des plus grandes urgences onconéphrologiques pouvant mettre en jeu le pronostic vital dans les heures suivant sa survenue. Il décrit la constellation d’anomalies métaboliques dues au relargage d’acides nucléiques, de potassium et de phosphore, protéines métabolites, consécutive à la destruction rapide de cellules tumorales. L’hypocalcémie est la conséquence de l’hyperphosphorémie par précipitation phosphocalcique. On distingue les formes latentes ou biologiques de ce syndrome, définies par une hyperuricémie, une hyperphosphorémie, une hypocalcémie et une hyperkaliémie (fig. 1 ). Aux formes biologiques de syndrome de lyse tumorale n’engageant pas le pronostic vital s’opposent les formes cliniques caractérisées par la survenue d’une insuffisance rénale aiguë, les troubles du rythme cardiaque qui en font toute la gravité à la phase initiale, et le risque de complications comitiales. Le syndrome de lyse tumorale peut survenir spontanément en l’absence de toute exposition à un traitement antinéoplasique ou, beaucoup plus fréquemment, dans les suites d’un traitement dirigé contre la tumeur. À ce titre, tout type de traitement peut engendrer une lyse tumorale : agents cytolytiques conventionnels, immunothérapies ciblées, corticothérapie, radiothérapie et même la manipulation perchirurgicale d’une tumeur.3
Quelles sont les tumeurs à risque ?
Les tumeurs à l’origine d’un syndrome de lyse tumorale répondent à des critères généraux bien particuliers : une masse tumorale élevée, un temps de doublement tumoral court et/ou une chimiosensibilité exquise. Les types de cancer vérifiant ces caractéristiques sont de façon prédominante les hémopathies malignes. Il s’agit des leucémies aiguës myéloïdes (LAM) myélomonocytaires et monoblastique (LAM 4 et 5 de la classification franco-américano-britannique), des leucémies aiguës lymphoblastiques T et de certains lymphomes non hodgkiniens (v. tableau ). Parmi ceux-ci, les lymphomes non hodgkiniens de Burkitt, les formes lymphoblastiques et les lymphomes non hodgkiniens diffus à grandes cellules sont les plus à risque. Néanmoins, tout type histologique de cancer peut se compliquer d’un syndrome de lyse tumorale, à condition d’être associé à un volume tumoral élevé, en particulier s’il existe une dissémination métastatique ; notamment les tumeurs solides qui peuvent parfois se compliquer de syndrome de lyse tumorale, volontiers de façon retardée après l’introduction de la chimiothérapie (après un délai de plusieurs jours). Certaines formes de cancers solides très invasifs sont également sujets à développer ce syndrome : il s’agit des carcinomes bronchiques à petites cellules, des tumeurs de la lignée germinale, les neuroblastomes et les sarcomes. Enfin, le développement de nouveaux agents antinéoplasiques hautement efficaces s’est accompagné d’une recrudescence des syndromes de lyse tumorale, y compris dans des tumeurs jugées peu propices à ce type de complication (par exemple le vénétoclax dans la prise en charge de la leucémie lymphoïde chronique).
Comment prédire le risque de lyse tumorale ?
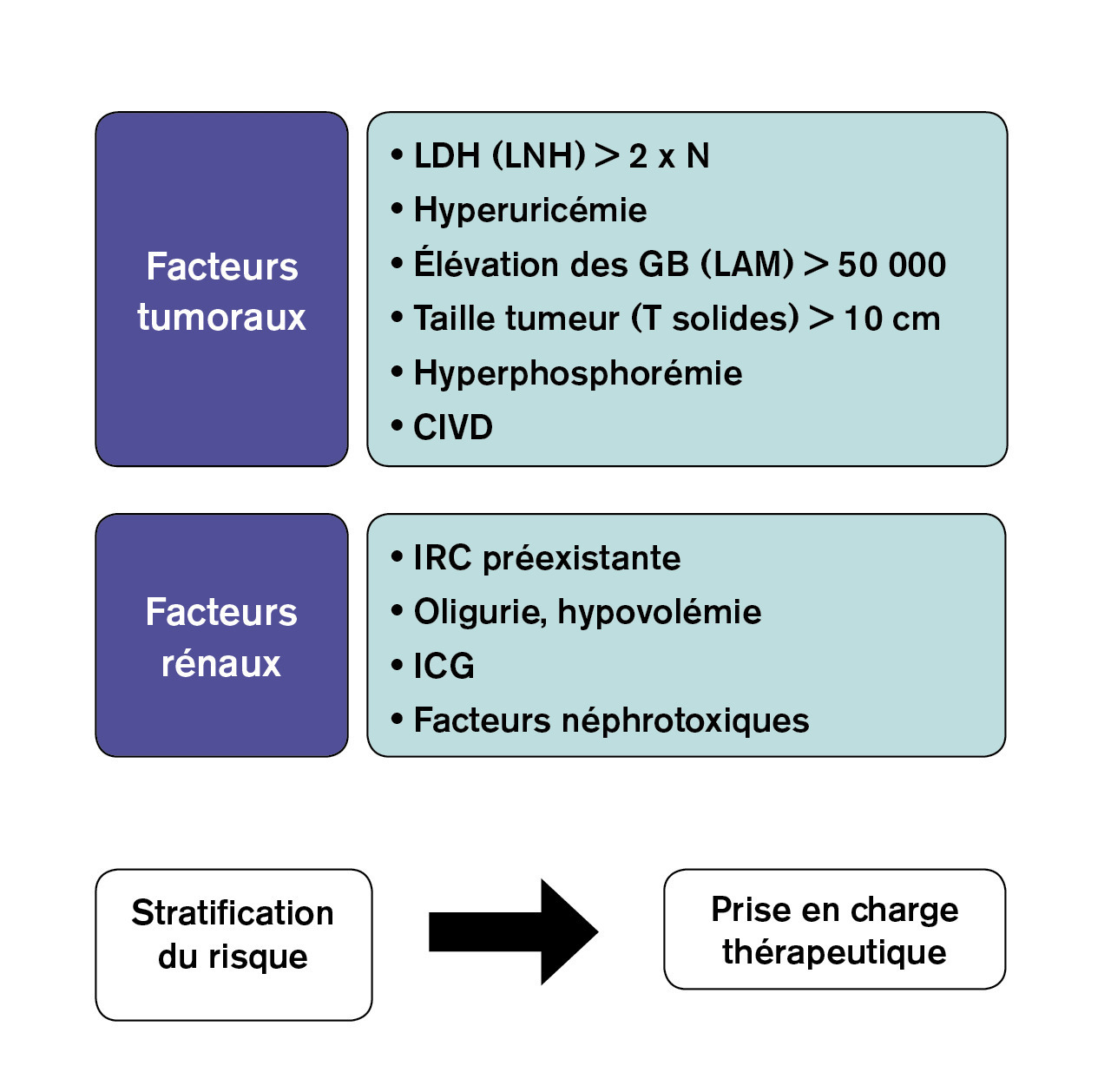
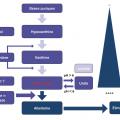
En dehors des arguments liés au type de tumeur et de traitement, différents instruments biologiques ont été élaborés de façon à prédire le risque de syndrome de lyse tumorale (fig. 2 ). Il s’agit de marqueurs biologiques traduisant la masse tumorale élevée ou des stigmates de lyse spontanée, d’une part : des lacticodéshydrogénases (LDH) élevées, une hyperuricémie, une hyperphosphorémie et une élévation des globules blancs (> 50 000) constituent de tels marqueurs. Parallèlement, une hypovolémie, une maladie rénale chronique, la co-administration de traitements néphrotoxiques présagent d’une sensibilité accrue vis-à-vis du risque d’insuffisance rénale aiguë. Un score prédictif de syndrome de lyse tumorale reposant sur les LDH, la phosphorémie et l’existence d’une coagulation intravasculaire disséminée a été élaboré dans le contexte d’hémopathie maligne.
Complications et signification pronostique du syndrome de lyse tumorale
Parmi les complications définissant le syndrome de lyse tumorale clinique, l’insuffisance rénale aiguë est de loin la plus fréquente, représentant plus de 80 % des cas. Les troubles du rythme cardiaque et les complications neurologiques sont beaucoup plus rares. Le mécanisme d’agression du système nerveux central reste incertain : des séries de cas ont montré des tableaux évoquant une encéphalopathie postérieure réversible laissant supposer des lésions vasculaires. La comitialité peut être favorisée par l’hypocalcémie. Surtout, les complications indirectes de la lyse tumorale, qu’elles soient hémorragiques ou infectieuses, jouent un rôle tout aussi important sur le pronostic vital. Enfin, le syndrome de lyse tumorale marque un tournant dans la maladie hématologique du patient, avec une réduction de l’espérance de vie du fait du risque d’ajournement des chimiothérapies, de la diminution des doses et du changement d’agents antinéoplasiques.
Quel mécanisme de l’atteinte rénale ?
Il est de coutume d’imputer l’insuffisance rénale aiguë à un mécanisme d’agression tubulaire provoquée par la cristallisation de cristaux d’acide urique et/ou phosphocalcique. Il a été proposé que les cristaux d’acide urique pourraient servir de noyau de nucléation aux cristaux phosphocalciques. Cependant, l’acide urique et les cristaux phosphocalciques précipitent à pH opposé, acide dans un cas et alcalin dans l’autre. Surtout, cette hypothèse repose sur un niveau de preuve ténu et sur des études anciennes, même si d’authentiques cas de néphrocalcinose aiguë ont été documentés. Les voies physiopathologiques explorées actuellement privilégient le rôle de la coagulation intravasculaire disséminée et de l’hypercytokinémie dans le cadre d’un « orage cytokinique ». Ces mécanismes ont le mérite de rendre compte des tableaux de défaillance multiviscérale souvent associés au syndrome de lyse tumorale.4
Prise en charge
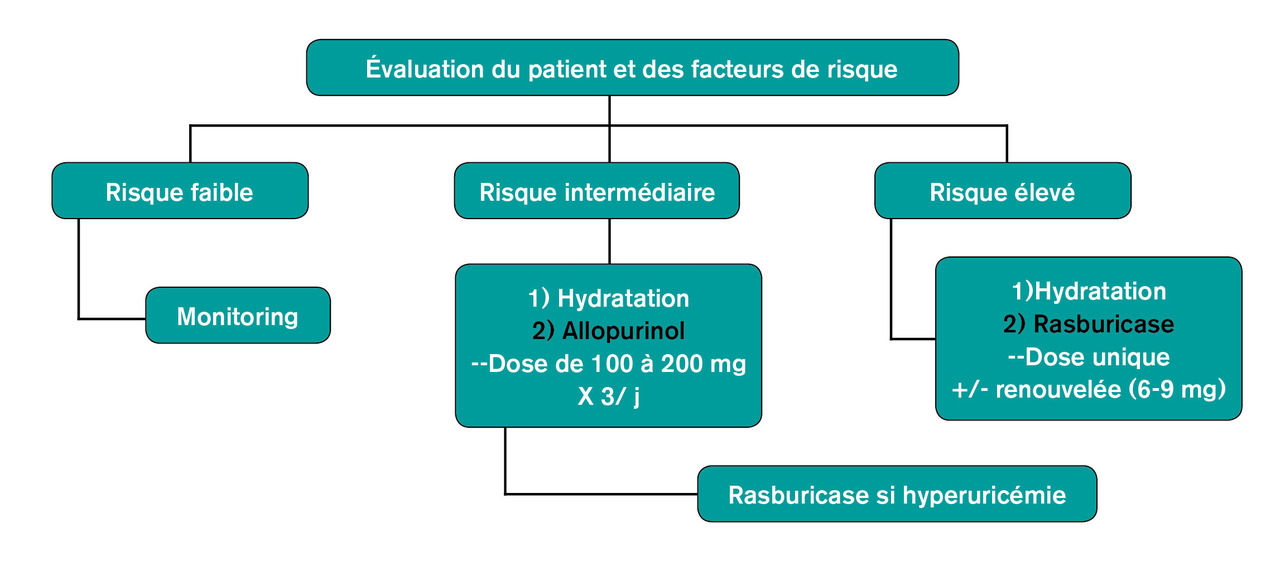
La stratification du risque de syndrome de lyse tumorale est essentielle afin d’optimiser les conditions de prévention.
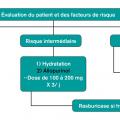
L’hyperhydratation, avec l’administration intraveineuse de volumes de solutés salés isotoniques abondants (2 000-3 000 mL/m2), figurent dans les recommandations ; elle est supposée accroître le flux tubulaire des électrolytes s’accumulant en cas de syndrome de lyse tumorale et de prévenir la cristallisation d’acide urique et phosphocalcique. En dehors du contexte d’hypovolémie, son rôle bénéfique n’est pas prouvé et elle doit s’accompagner d’une surveillance attentive du risque de surcharge cardiaque.
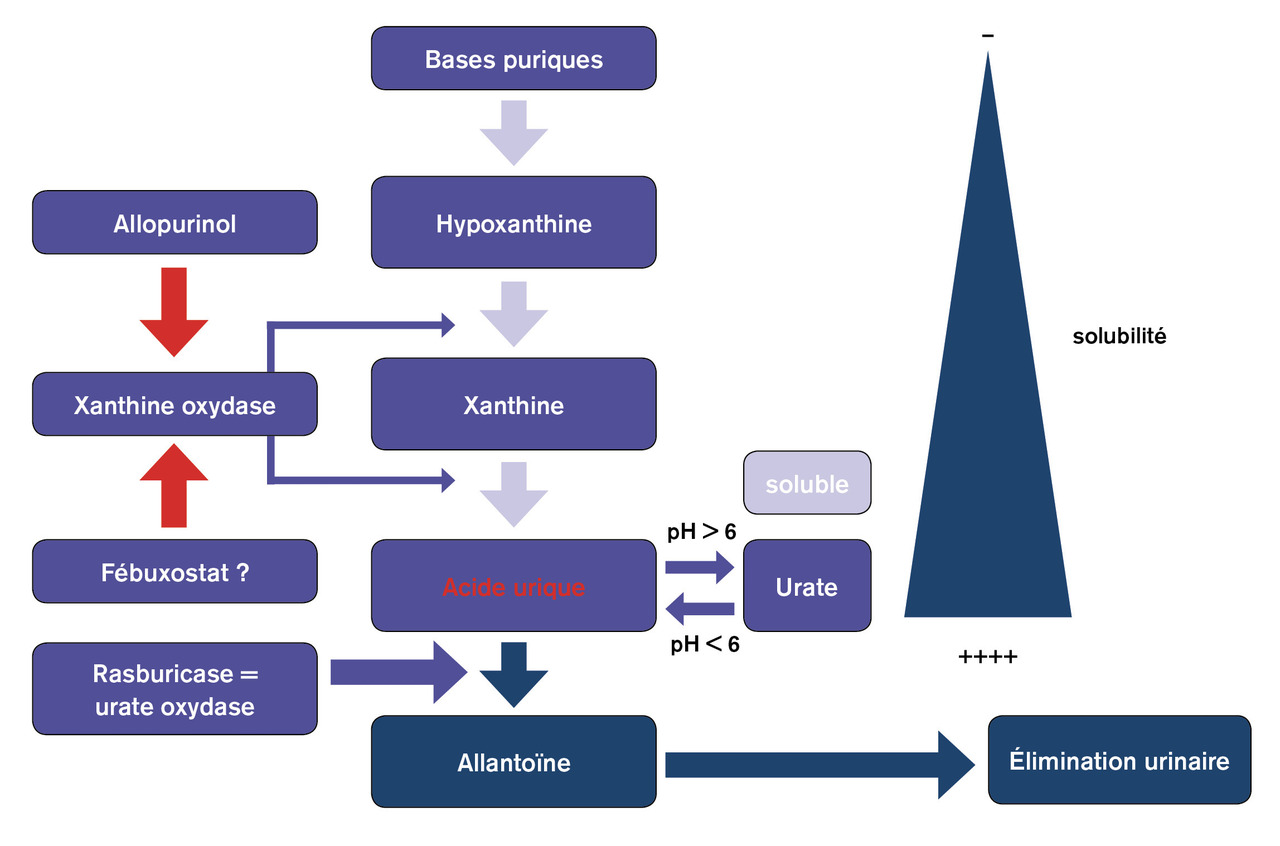
L’alcalinisation, longtemps préconisée car elle prévient la précipitation d’acide urique (fig. 3 ), favorise a contrario la précipitation phosphocalcique et n’est plus indiquée pour cette raison.
Les agents pharmacologiques interviennent (fig. 4 ) dans la prise en charge de l’accumulation d’acide urique qui, outre les effets médiés par sa cristallisation, possède des propriétés délétères pro-oxydantes, pro-inflammatoires et interfère avec l’hémodynamique glomérulaire. La rasburicase, produit hypo-uricémiant beaucoup plus puissant que l’allopurinol, qui par ailleurs n’est efficace qu’en cas d’hyperuricémie, est contre-indiquée chez les patients ayant un déficit en glucose-6-phosphate-déshydrogénase. Surtout, malgré son action massive et beaucoup plus rapide sur l’hyperuricémie, il n’existe pas d’essai randomisé démontrant que la rasburicase diminue l’incidence de l’insuffisance rénale aiguë en comparaison avec l’allopurinol et le recours à l’épuration extrarénale. Il est réservé aux patients à haut risque de syndrome de lyse tumorale. Il faut s’abstenir de compenser l’hypocalcalcémie dans le contexte de ce syndrome, au risque d’aggraver celui de précipitation phosphocalcique. Dans tous les cas, une surveillance clinique et biologique intensive est indiquée, de façon à monitorer les anomalies électrolytiques et poser le cas échéant l’indication d’épuration extrarénale.5
L’hyperhydratation, avec l’administration intraveineuse de volumes de solutés salés isotoniques abondants (2 000-3 000 mL/m2), figurent dans les recommandations ; elle est supposée accroître le flux tubulaire des électrolytes s’accumulant en cas de syndrome de lyse tumorale et de prévenir la cristallisation d’acide urique et phosphocalcique. En dehors du contexte d’hypovolémie, son rôle bénéfique n’est pas prouvé et elle doit s’accompagner d’une surveillance attentive du risque de surcharge cardiaque.
L’alcalinisation, longtemps préconisée car elle prévient la précipitation d’acide urique (
Les agents pharmacologiques interviennent (
Toxicité rénale du méthotrexate
Le méthotrexate est un antimétabolite inhibiteur de la dihydrofolate réductase et de la thymidylate synthase, entraînant un défaut de synthèse des bases puriques et par conséquent un blocage en phase S des cellules à renouvellement rapide (défaut de synthèse d’ADN). Il est partiellement métabolisé au niveau hépatique en 7-OH MTX (métabolite inactif mais toxique). Son élimination se fait principalement par voie rénale : filtration glomérulaire (50-60 %) mais également sécrétion tubulaire au niveau du tube contourné proximal (25-30 % chez le sujet normorénal).
Épidémiologie et mécanismes de toxicité
La toxicité rénale aiguë de ce traitement ne s’observe qu’en cas d’utilisation de hautes doses (≥ 1 g/m²) par voie parentérale (HD-MTX), dont les trois principales indications actuelles sont la leucémie aiguë lymphoblastique de l’enfant et de l’adolescent, certains lymphomes non hodgkiniens de haut grade (en particulier en cas d’atteinte cérébrale) et l’ostéosarcome. Dans ce cadre, l’administration retardée d’acide folinique (selon la concentration plasmatique résiduelle de méthotrexate et le délai post-administration) est indispensable afin de prévenir la toxicité hématologique du méthotrexate.
L’incidence de cette néphrotoxicité est variable (entre 2 et 30 %) en fonction du terrain et de la pathologie traitée (risque maximal en cas de lymphome cérébral chez le sujet âgé ; risque faible en cas de monothérapie pour ostéosarcome du sujet jeune).
Le mécanisme principal de la toxicité rénale est une précipitation intratubulaire de méthotrexate (et de 7-OH-MTX), favorisée par un pH urinaire acide et confirmée par la présence de cristaux ou cylindres urinaires et la documentation histologique récente de cristaux intratubulaires. D’autres mécanismes son également évoqués incluant une toxicité directe du méthotrexate sur les cellules tubulaires proximales (données autopsiques et in vivo chez le rat) ainsi qu’une réaction inflammatoire interstitielle secondaire à la formation des cristaux (via une activation de l’immunité innée).
L’incidence de cette néphrotoxicité est variable (entre 2 et 30 %) en fonction du terrain et de la pathologie traitée (risque maximal en cas de lymphome cérébral chez le sujet âgé ; risque faible en cas de monothérapie pour ostéosarcome du sujet jeune).
Le mécanisme principal de la toxicité rénale est une précipitation intratubulaire de méthotrexate (et de 7-OH-MTX), favorisée par un pH urinaire acide et confirmée par la présence de cristaux ou cylindres urinaires et la documentation histologique récente de cristaux intratubulaires. D’autres mécanismes son également évoqués incluant une toxicité directe du méthotrexate sur les cellules tubulaires proximales (données autopsiques et in vivo chez le rat) ainsi qu’une réaction inflammatoire interstitielle secondaire à la formation des cristaux (via une activation de l’immunité innée).
Tableau clinique et facteurs de risque
La protéinurie est habituellement négligeable, le sédiment urinaire inactif et l’anurie relativement rare. Les principaux diagnostics différentiels sont la nécrose tubulaire aiguë (autre néphrotoxique, sepsis) et le syndrome de lyse tumorale (en cas d’hémopathie à haut risque). L’existence de séquelles rénales à long terme est rare en pédiatrie, mais possible chez le sujet âgé.
La gravité de l’insuffisance rénale post-méthotrexate à haute dose est liée à la survenue d’un retard d’élimination (défini par des taux résiduels de méthotrexate > 10 mmol/L à 24 h, > 1 mmol/L à 48 h ou > 0,1 mmol/L à 72 h) majorant fortement le risque de toxicité extrarénale : médullaire (leucopénie, thrombopénie), cutanéomuqueuse (mucite sévère, érythrodermie) et plus rarement hépatique (cytolyse réversible) ou neurologique (encéphalopathie réversible).6
Les facteurs de risque non modifiables d’insuffisance rénale aiguë et/ou de retard d’élimination incluent l’âge, les comorbidités générales (incluant l’obésité) et l’existence de polymorphismes des transporteurs ou enzymes intervenant dans le métabolisme du méthotrexate. Les facteurs de risque modifiables incluent hypo-albuminémie, l’existence d’un 3e secteur, mais surtout la présence de comédications à risque : par effet sur l’hémodynamique rénale (inhibiteurs de l’enzyme de conversion, antagonistes des récepteurs de l’angiotensine II, anti-inflammatoires non stéroïdiens), par effet acidifiant urinaire (diurétiques de l’anse et thiazidiques, sodas), par toxicité tubulaire directe (aminoside, amphotéricine B, produit de contraste iodé…) ou encore par inhibition des transporteurs impliqués dans l’élimination du méthotrexate (inhibiteur de la pompe à protons, bêtalactamines…).
La gravité de l’insuffisance rénale post-méthotrexate à haute dose est liée à la survenue d’un retard d’élimination (défini par des taux résiduels de méthotrexate > 10 mmol/L à 24 h, > 1 mmol/L à 48 h ou > 0,1 mmol/L à 72 h) majorant fortement le risque de toxicité extrarénale : médullaire (leucopénie, thrombopénie), cutanéomuqueuse (mucite sévère, érythrodermie) et plus rarement hépatique (cytolyse réversible) ou neurologique (encéphalopathie réversible).6
Les facteurs de risque non modifiables d’insuffisance rénale aiguë et/ou de retard d’élimination incluent l’âge, les comorbidités générales (incluant l’obésité) et l’existence de polymorphismes des transporteurs ou enzymes intervenant dans le métabolisme du méthotrexate. Les facteurs de risque modifiables incluent hypo-albuminémie, l’existence d’un 3e secteur, mais surtout la présence de comédications à risque : par effet sur l’hémodynamique rénale (inhibiteurs de l’enzyme de conversion, antagonistes des récepteurs de l’angiotensine II, anti-inflammatoires non stéroïdiens), par effet acidifiant urinaire (diurétiques de l’anse et thiazidiques, sodas), par toxicité tubulaire directe (aminoside, amphotéricine B, produit de contraste iodé…) ou encore par inhibition des transporteurs impliqués dans l’élimination du méthotrexate (inhibiteur de la pompe à protons, bêtalactamines…).
Prise en charge
La prévention de la toxicité rénale du méthotrexate à haute dose passe par une hyperhydratation alcaline (préalable à la perfusion), l’éviction des comédications à risque et un monitoring régulier du pH urinaire, de la créatininémie et du dosage de méthotrexate (pour guider le sauvetage par acide folinique). Celle-ci est primordiale car la survenue d’une toxicité aiguë conduit souvent à l’arrêt du méthotrexate, ce qui impacte le pronostic oncologique (en particulier en cas d’ostéosarcome ou de lymphome cérébral).
En cas de toxicité rénale avérée, la prise en charge symptomatique inclut une poursuite de l’alcalinisation urinaire (en surveillant le risque de surcharge liée à l’hyperhydratation), l’adaptation de posologie d’acide folinique et le traitement des cytopénies (transfusions, facteurs de croissance granulocytaires [G-CSF], antibiothérapie en cas d’aplasie fébrile). Les méthodes d’épuration extrarénale discontinues sont peu efficaces pour épurer le méthotrexate résiduel, du fait d’un important rebond de concentration (fixation protéique, distribution intracellulaire) : en cas d’indication d’épuration extrarénale en urgence (relativement rare du fait de la diurèse préservée), les méthodes continues sont à privilégier.
La glucarpidase (carboxypeptidase G2) est une enzyme métabolisant le méthotrexate extracellulaire en glutamate et en métabolite non toxique à élimination principalement hépatique, l’acide 4-désoxy-4-amino-N10-méthylptéroïque (DAMPA). Son utilisation réduit drastiquement la concentration de méthotrexate sans rebond significatif (monitoring à réaliser par chromatographie en phase liquide à haute performance pour ne pas doser conjointement le DAMPA). Cette molécule onéreuse est disponible en autorisation temporaire d’utilisation en France et est fréquemment utilisée, sans preuve formelle de son efficacité en termes de durée d’hospitalisation ou de complications extrarénales (pas d’essai contrôlé). La sévérité et la durée de l’insuffisance rénale aiguë ne semblent pas impactées par l’utilisation de glucarpidase (absence d’effet sur le méthotrexate intracellulaire et les cristaux intratubulaires) : une évaluation prospective permettrait de mieux préciser les seuils de méthotrexate indiquant un traitement enzymatique.7, 8
En cas de toxicité rénale avérée, la prise en charge symptomatique inclut une poursuite de l’alcalinisation urinaire (en surveillant le risque de surcharge liée à l’hyperhydratation), l’adaptation de posologie d’acide folinique et le traitement des cytopénies (transfusions, facteurs de croissance granulocytaires [G-CSF], antibiothérapie en cas d’aplasie fébrile). Les méthodes d’épuration extrarénale discontinues sont peu efficaces pour épurer le méthotrexate résiduel, du fait d’un important rebond de concentration (fixation protéique, distribution intracellulaire) : en cas d’indication d’épuration extrarénale en urgence (relativement rare du fait de la diurèse préservée), les méthodes continues sont à privilégier.
La glucarpidase (carboxypeptidase G2) est une enzyme métabolisant le méthotrexate extracellulaire en glutamate et en métabolite non toxique à élimination principalement hépatique, l’acide 4-désoxy-4-amino-N10-méthylptéroïque (DAMPA). Son utilisation réduit drastiquement la concentration de méthotrexate sans rebond significatif (monitoring à réaliser par chromatographie en phase liquide à haute performance pour ne pas doser conjointement le DAMPA). Cette molécule onéreuse est disponible en autorisation temporaire d’utilisation en France et est fréquemment utilisée, sans preuve formelle de son efficacité en termes de durée d’hospitalisation ou de complications extrarénales (pas d’essai contrôlé). La sévérité et la durée de l’insuffisance rénale aiguë ne semblent pas impactées par l’utilisation de glucarpidase (absence d’effet sur le méthotrexate intracellulaire et les cristaux intratubulaires) : une évaluation prospective permettrait de mieux préciser les seuils de méthotrexate indiquant un traitement enzymatique.7, 8
Toxicité de la gemcitabine
Les microangiopathies thrombotiques secondaires à la gemcitabine surviennent typiquement après une dose cumulée importante reçue par le patient pour une néoplasie sous-jacente. La gemcitabine a été approuvée par la Food and Drug Administration en 1996 pour le traitement des cancers du pancréas métastatiques. Elle est actuellement utilisée pour traiter d’autres cancers solides (poumon, vessie, sein) et certains lymphomes.
L’incidence de ces microangiopathies thrombotiques secondaires a été initialement estimée à 0,015 %. Cependant, des travaux plus récents font état d’une incidence à 0,4 %, qui pourrait être le reflet d’une augmentation de la reconnaissance des formes modérées grâce à une meilleure conscience des praticiens de cette complication. Étant donné le tableau clinique parfois silencieux de ces microangiopathies thrombotiques, ses caractéristiques cliniques devraient être recherchées avant tout nouveau cycle de gemcitabine.9
Dans une cohorte de 56 patients,9 la durée moyenne entre l’initiation de la gemcitabine et la survenue de la microangiopathie était de 7,5 mois, malgré des variations importantes (0,5-19 mois). La dose cumulée médiane de gemcitabine était de 22,5 ± 14 g (2-70 g). Une macroprotéinurie et une hématurie microscopique étaient observées dans deux tiers des cas. Une hypertension artérielle de novo ou l’aggravation d’une hypertension artérielle préexistante était observée chez 75 % des patients. Les patients étaient traités dans la majorité des cas par échanges plasmatiques ou corticoïdes malgré l’absence de preuve d’efficacité de ces traitements. Bien que les anomalies hématologiques se corrigent le plus souvent, le pronostic rénal est pauvre, avec 70 % des patients qui vont garder une insuffisance rénale chronique. La survie médiane était de 16,5 mois. En dehors de cette dernière étude, il n’existe pas de cohorte importante permettant d’avoir une vision plus précise du pronostic de la microangiopathie thrombotique secondaire à la gemcitabine. Il semble que le pronostic vital soit lié au cancer sous-jacent. Le pronostic hématologique est excellent, avec une normalisation des stigmates biologiques de microangiopathie thrombotique après plusieurs semaines ou mois en l’absence de reprise de la gemcitabine. Le pronostic rénal est plus réservé, avec plus de la moitié des patients qui vont garder une insuffisance rénale chronique.9
Dans une cohorte récente,10 la plus large décrite à ce jour, 120 patients ont développé une microangiopathie thrombotique secondaire à la gemcitabine après une durée médiane de 210 jours et une dose cumulée médiane de 12,9 g/m2. Les symptômes les plus fréquents étaient un syndrome œdémateux (57 %) et/ou l’exacerbation d’une hypertension artérielle (62 %). La thrombopénie manquait chez 25 % des patients. Une insuffisance rénale aiguë était observée chez 97 % des patients ; 28 % des patients ont eu besoin d’une épuration extrarénale.
La physiopathologie des microangiopathies thrombotiques secondaires à la gemcitabine est encore imparfaitement comprise. Il est suggéré que la gemcitabine pourrait avoir une toxicité endothéliale directe avec une activation concomitante de la cascade de la coagulation. Des données histologiques obtenues à partir de biopsies rénales ont suggéré un rôle possible de l’activation du complément : un épaississement des parois capillaires, des thrombus fibrineux, des cellules endothéliales nécrotiques, des dépôts granuleux d’immunoglobulines et de C3 dans les parois artériolaires et dans les glomérules.4 Le rôle possible du complément dans la physiopathologie des microangiopathies thrombotiques secondaires à la gemcitabine a conduit à proposer un traitement inhibiteur de l’activation de la voie alterne du complément, l’éculizumab. C’est un anticorps monoclonal ciblant la fraction C5 et donc la voie effectrice terminale qui a montré une efficacité remarquable chez les patients atteints d’un syndrome hémolytique et urémique atypique.
À notre connaissance, au moins 9 patients traités par éculizumab pour une microangiopathie thrombotique secondaire à la gemcitabine ont fait l’objet d’une publication, avec une réponse hématologique satisfaisante et une réponse rénale partielle. Notre groupe, grâce au réseau du Centre national de référence des microangiopathies thrombotiques, a réalisé une étude observationnelle, rétrospective, multicentrique à propos de 10 patients traités par éculizumab pour une microangiopathie thrombotique secondaire à la gemcitabine entre 2011 et 2016.11 Les patients ont reçu en médiane 4 injections après une durée médiane de 16 jours. Une réponse hématologique complète a été observée chez 80 % des patients, et les besoins transfusionnels ont significativement diminué après le début du traitement par éculizumab ; 20 % des patients ont eu une rémission rénale complète, 60 % une rémission rénale partielle et 20 % une absence de rémission rénale. Les résultats sont compliqués à interpréter sur la fonction rénale, car l’éculizumab a été débuté tardivement après le diagnostic de microangiopathie thrombotique. Dans le syndrome hémolytique et urémique atypique, le traitement est d’autant plus efficace qu’il est administré précocement. Chez les 3 patients ayant bénéficié d’une ponction-biopsie rénale, il était observé une surexpression du c5b9 en comparaison à 3 patients contrôles (lésions glomérulaires minimes), suggérant une potentielle dérégulation transitoire de la voie alterne du complément. En revanche, il n’existe probablement pas de prédisposition génétique car aucun variant pathogène codant les protéines régulatrices du complément n’a été identifié chez des patients ayant développé une microangiopathie thrombotique post-gemcitabine dans la cohorte française.11 Un traitement par éculizumab peut donc être discuté au cas par cas chez un patient ayant une microangiopathie thrombotique secondaire à la gemcitabine, bénéficiant de transfusions globulaires et/ou plaquettaires itératives et/ou avec une insuffisance rénale aiguë, en cas de pronostic oncologique raisonnable (espérance de vie supérieure à 6 mois par exemple). Dans ce cas, diminuer les besoins transfusionnels permet le plus souvent de raccourcir la durée d’hospitalisation et d’améliorer la qualité de vie du patient. L’éventuel bénéfice de l’éculizumab sur le pronostic rénal de ces patients ne pourra être démontré qu’à l’aide d’études prospectives idéalement contrôlées.
L’incidence de ces microangiopathies thrombotiques secondaires a été initialement estimée à 0,015 %. Cependant, des travaux plus récents font état d’une incidence à 0,4 %, qui pourrait être le reflet d’une augmentation de la reconnaissance des formes modérées grâce à une meilleure conscience des praticiens de cette complication. Étant donné le tableau clinique parfois silencieux de ces microangiopathies thrombotiques, ses caractéristiques cliniques devraient être recherchées avant tout nouveau cycle de gemcitabine.9
Dans une cohorte de 56 patients,9 la durée moyenne entre l’initiation de la gemcitabine et la survenue de la microangiopathie était de 7,5 mois, malgré des variations importantes (0,5-19 mois). La dose cumulée médiane de gemcitabine était de 22,5 ± 14 g (2-70 g). Une macroprotéinurie et une hématurie microscopique étaient observées dans deux tiers des cas. Une hypertension artérielle de novo ou l’aggravation d’une hypertension artérielle préexistante était observée chez 75 % des patients. Les patients étaient traités dans la majorité des cas par échanges plasmatiques ou corticoïdes malgré l’absence de preuve d’efficacité de ces traitements. Bien que les anomalies hématologiques se corrigent le plus souvent, le pronostic rénal est pauvre, avec 70 % des patients qui vont garder une insuffisance rénale chronique. La survie médiane était de 16,5 mois. En dehors de cette dernière étude, il n’existe pas de cohorte importante permettant d’avoir une vision plus précise du pronostic de la microangiopathie thrombotique secondaire à la gemcitabine. Il semble que le pronostic vital soit lié au cancer sous-jacent. Le pronostic hématologique est excellent, avec une normalisation des stigmates biologiques de microangiopathie thrombotique après plusieurs semaines ou mois en l’absence de reprise de la gemcitabine. Le pronostic rénal est plus réservé, avec plus de la moitié des patients qui vont garder une insuffisance rénale chronique.9
Dans une cohorte récente,10 la plus large décrite à ce jour, 120 patients ont développé une microangiopathie thrombotique secondaire à la gemcitabine après une durée médiane de 210 jours et une dose cumulée médiane de 12,9 g/m2. Les symptômes les plus fréquents étaient un syndrome œdémateux (57 %) et/ou l’exacerbation d’une hypertension artérielle (62 %). La thrombopénie manquait chez 25 % des patients. Une insuffisance rénale aiguë était observée chez 97 % des patients ; 28 % des patients ont eu besoin d’une épuration extrarénale.
La physiopathologie des microangiopathies thrombotiques secondaires à la gemcitabine est encore imparfaitement comprise. Il est suggéré que la gemcitabine pourrait avoir une toxicité endothéliale directe avec une activation concomitante de la cascade de la coagulation. Des données histologiques obtenues à partir de biopsies rénales ont suggéré un rôle possible de l’activation du complément : un épaississement des parois capillaires, des thrombus fibrineux, des cellules endothéliales nécrotiques, des dépôts granuleux d’immunoglobulines et de C3 dans les parois artériolaires et dans les glomérules.4 Le rôle possible du complément dans la physiopathologie des microangiopathies thrombotiques secondaires à la gemcitabine a conduit à proposer un traitement inhibiteur de l’activation de la voie alterne du complément, l’éculizumab. C’est un anticorps monoclonal ciblant la fraction C5 et donc la voie effectrice terminale qui a montré une efficacité remarquable chez les patients atteints d’un syndrome hémolytique et urémique atypique.
À notre connaissance, au moins 9 patients traités par éculizumab pour une microangiopathie thrombotique secondaire à la gemcitabine ont fait l’objet d’une publication, avec une réponse hématologique satisfaisante et une réponse rénale partielle. Notre groupe, grâce au réseau du Centre national de référence des microangiopathies thrombotiques, a réalisé une étude observationnelle, rétrospective, multicentrique à propos de 10 patients traités par éculizumab pour une microangiopathie thrombotique secondaire à la gemcitabine entre 2011 et 2016.11 Les patients ont reçu en médiane 4 injections après une durée médiane de 16 jours. Une réponse hématologique complète a été observée chez 80 % des patients, et les besoins transfusionnels ont significativement diminué après le début du traitement par éculizumab ; 20 % des patients ont eu une rémission rénale complète, 60 % une rémission rénale partielle et 20 % une absence de rémission rénale. Les résultats sont compliqués à interpréter sur la fonction rénale, car l’éculizumab a été débuté tardivement après le diagnostic de microangiopathie thrombotique. Dans le syndrome hémolytique et urémique atypique, le traitement est d’autant plus efficace qu’il est administré précocement. Chez les 3 patients ayant bénéficié d’une ponction-biopsie rénale, il était observé une surexpression du c5b9 en comparaison à 3 patients contrôles (lésions glomérulaires minimes), suggérant une potentielle dérégulation transitoire de la voie alterne du complément. En revanche, il n’existe probablement pas de prédisposition génétique car aucun variant pathogène codant les protéines régulatrices du complément n’a été identifié chez des patients ayant développé une microangiopathie thrombotique post-gemcitabine dans la cohorte française.11 Un traitement par éculizumab peut donc être discuté au cas par cas chez un patient ayant une microangiopathie thrombotique secondaire à la gemcitabine, bénéficiant de transfusions globulaires et/ou plaquettaires itératives et/ou avec une insuffisance rénale aiguë, en cas de pronostic oncologique raisonnable (espérance de vie supérieure à 6 mois par exemple). Dans ce cas, diminuer les besoins transfusionnels permet le plus souvent de raccourcir la durée d’hospitalisation et d’améliorer la qualité de vie du patient. L’éventuel bénéfice de l’éculizumab sur le pronostic rénal de ces patients ne pourra être démontré qu’à l’aide d’études prospectives idéalement contrôlées.
Références
1. Rosner MH, Perazella MA. Acute kidney injury in the patient with cancer. Kidney Res Clin Pract 2019;38:295‑308.
2. Kitchlu A, McArthur E, Amir E, et al. Acute kidney injury in patients receiving systemic treatment for cancer: a population-based cohort study. J Natl Cancer Inst 2019;111:727‑36.
3. Cairo MS, Bishop M. Tumour lysis syndrome: new therapeutic strategies and classification. Br J Haematol 2004;127:3‑11.
4. Zafrani L, Canet E, Darmon M. Understanding tumor lysis syndrome. Intensive Care Med 2019;45:1608‑11.
5. Jones GL, Will A, Jackson GH, Webb NJA, Rule S, British Committee for Standards in Haematology. Guidelines for the management of tumour lysis syndrome in adults and children with haematological malignancies on behalf of the British Committee for Standards in Haematology. Br J Haematol 2015;169:661‑71.
6. Howard SC, McCormick J, Pui CH, Buddington RK, Harvey RD. Preventing and managing toxicities of high-dose methotrexate. Oncologist 2016;21:1471‑82.
7. Colpart P, Félix S. Néphropathie cristalline secondaire au méthotrexate : une entité rarement objectivée sur biopsie rénale. Ann Pathol 2019;39:18‑23.
8. Garcia H, Leblond V, Goldwasser F, et al. Toxicité rénale du méthotrexate à haute dose. Nephrol Ther 2018;14(Suppl 1):S103‑13.
9. Izzedine H, Isnard-Bagnis C, Launay-Vacher V, et al. Gemcitabine-induced thrombotic microangiopathy: a systematic review. Nephrol Dial Transplant 2006;21:3038‑45.
10. Daviet F, Rouby F, Poullin P, et al. Thrombotic microangiopathy associated with gemcitabine use: Presentation and outcome in a national French retrospective cohort. Br J Clin Pharmacol 2019;85:403‑12.
11. Grall M, Provôt F, Coindre JP, et al. Efficacy of Eculizumab in gemcitabine-induced thrombotic microangiopathy: experience of the French Thrombotic Microangiopathies Reference Centre. Blood 2016;128:136.
2. Kitchlu A, McArthur E, Amir E, et al. Acute kidney injury in patients receiving systemic treatment for cancer: a population-based cohort study. J Natl Cancer Inst 2019;111:727‑36.
3. Cairo MS, Bishop M. Tumour lysis syndrome: new therapeutic strategies and classification. Br J Haematol 2004;127:3‑11.
4. Zafrani L, Canet E, Darmon M. Understanding tumor lysis syndrome. Intensive Care Med 2019;45:1608‑11.
5. Jones GL, Will A, Jackson GH, Webb NJA, Rule S, British Committee for Standards in Haematology. Guidelines for the management of tumour lysis syndrome in adults and children with haematological malignancies on behalf of the British Committee for Standards in Haematology. Br J Haematol 2015;169:661‑71.
6. Howard SC, McCormick J, Pui CH, Buddington RK, Harvey RD. Preventing and managing toxicities of high-dose methotrexate. Oncologist 2016;21:1471‑82.
7. Colpart P, Félix S. Néphropathie cristalline secondaire au méthotrexate : une entité rarement objectivée sur biopsie rénale. Ann Pathol 2019;39:18‑23.
8. Garcia H, Leblond V, Goldwasser F, et al. Toxicité rénale du méthotrexate à haute dose. Nephrol Ther 2018;14(Suppl 1):S103‑13.
9. Izzedine H, Isnard-Bagnis C, Launay-Vacher V, et al. Gemcitabine-induced thrombotic microangiopathy: a systematic review. Nephrol Dial Transplant 2006;21:3038‑45.
10. Daviet F, Rouby F, Poullin P, et al. Thrombotic microangiopathy associated with gemcitabine use: Presentation and outcome in a national French retrospective cohort. Br J Clin Pharmacol 2019;85:403‑12.
11. Grall M, Provôt F, Coindre JP, et al. Efficacy of Eculizumab in gemcitabine-induced thrombotic microangiopathy: experience of the French Thrombotic Microangiopathies Reference Centre. Blood 2016;128:136.