La toxicité rénale des médicaments est toujours une possibilité, et davantage lorsqu’il existe des facteurs de risque supplémentaires, liés au patients (âge, sexe, comorbidités…) ou aux médicaments (surdosages, mauvaises associations…). Le médecin traitant doit savoir identifier les situations à risque, et mettre en place les mesures préventives, voire envisager des adaptations de traitements afin de favoriser le retour à une fonction rénale normale.
Qui est à risque ?
L’augmentation du risque de toxicité rénale peut être liée au patient lui-même ou au médicament utilisé (
Plus le patient est âgé et a des comorbidités, plus il est à risque, en raison de l’altération conjointe des fonctions rénales et hépatiques ayant des répercussions sur l’élimination et le métabolisme des médicaments.
Les patients aux âges extrêmes de la vie, ceux qui ont une maladie rénale chronique, une insuffisance cardiaque ou un diabète sont davantage exposés, ainsi que ceux chez lesquels la pharmacocinétique des médicaments est potentiellement modifiée, conduisant souvent à un surdosage, comme les femmes (moindre volume de distribution, altération de la clairance).
Mécanismes de la toxicité rénale médicamenteuse
Il existe plusieurs mécanismes d’action de toxicité rénale secondaire aux médicaments utilisés, et principalement deux situations fréquentes :
- une toxicité directe sur les cellules tubulaires, dose-dépendante et prévisible (nécrose tubulaire aiguë) ;
- une réaction immuno-allergique, dose-indépendante et imprévisible (néphrite interstitielle) [
D’autres formes d’atteintes, plus rares, sont possibles :
- formation de cristaux responsables d’une obstruction intratubulaire – cristallurie – (à très forte dose avec certaines pénicillines comme dans le traitement des méningites) ;
- anomalies électrolytiques secondaires à des atteintes tubulaires (tubulopathie), souvent discrètes cliniquement et à rechercher systématiquement (hypokaliémie, hypomagnésémie) ;
- atteinte vasculaire (microangiopathie thrombotique) plus rare et surtout observée en oncologie (anti-VEGF, gemcitabine).
Toxicité rénale des médicaments courants en l’absence de facteur de risque
Même en l’absence de facteur de risque, les anti-inflammatoires non stéroïdiens (AINS) et les antibiotiques peuvent induire une toxicité rénale.
Gare aux AINS !
Outre les effets indésirables digestifs – ulcère gastro-duodénal – ou infectieux sévères – cellulite et abcès notamment –, les AINS sont fréquemment à l’origine d’insuffisance rénale par leur toxicité rénale intrinsèque (
L’atteinte rénale la plus fréquente avec les AINS est l’insuffisance rénale aiguë (IRA) fonctionnelle. En effet, ces molécules entraînent – via l’inhibition de la synthèse des prostaglandines – une diminution du débit de perfusion glomérulaire. Les patients à risque d’hypovolémie – sujets âgés, polymédication (notamment prise concomitante d’inhibiteurs de l’enzyme de conversion [IEC] et d’antagonistes des récepteurs de l’angiotensine 2 [ARA2]), comorbidités telles que le diabète, l’insuffisance cardiaque ou l’insuffisance rénale chronique – sont particulièrement concernés. Dans de telles situations, des alternatives thérapeutiques comme le paracétamol, les antalgiques de palier 1 à 3 ou éventuellement les corticoïdes sont à privilégier.
L’utilisation d’AINS par voie transdermique ne doit pas non plus être banalisée ; il existe un passage systémique non négligeable de la molécule active, exposant donc potentiellement aux mêmes effets indésirables.
Plus rarement, les AINS peuvent être responsables d’autres types d’atteinte rénale, telles que des néphrites immunoallergiques ou des syndromes néphrotiques. Le syndrome néphrotique se caractérise le plus souvent par l’apparition d’œdèmes, d’épanchement des séreuses, voire de manifestations thrombo-emboliques. Le diagnostic est confirmé par la présence d’une protéinurie supérieure à 3 g/j (ou 0,3 g/mmol de créatininurie) et d’une hypoalbuminémie inférieure à 30 g/L. La suspicion d’une atteinte de ce type doit faire adresser le patient à un néphrologue en urgence afin de confirmer l’atteinte rénale – le plus souvent par biopsie – et d’initier un traitement spécifique.
Antibiotiques, effets non négligeables
Les antibiotiques sont fréquemment prescrits en médecine générale et hospitalière. En raison de leur élimination rénale dans plus de 50 % des cas, ils sont une cause fréquente d’IRA. Ce risque de néphrotoxicité est plus important lorsqu’il existe des facteurs de risque associés tels que l’existence d’une maladie rénale chronique (surtout de stade 3 ou plus, soit avec un débit de filtration glomérulaire [DFG] inférieur à 60 mL/min/1,73 m2) ou l’utilisation concomitante d’autres traitements néphrotoxiques (IEC ou sartans). La prévention de la néphrotoxicité passe par la correction de l’hypovolémie, une adaptation de la posologie au stade de la maladie rénale (exemple des aminosides) et l’adaptation, voire l’éviction, d’autres médicaments néphrotoxiques.
Réaction immunoallergique : l’exemple des bêtalactamines
Les phénomènes immunoallergiques représentent l’atteinte rénale la plus fréquente ; les bêtalactamines, souvent prescrites en médecine générale, entraînent typiquement cette toxicité. La manifestation clinique est peu spécifique, et la triade classiquement décrite – fièvre, arthralgies et rash cutané – n’est observée que pour 10 % des malades. Biologiquement, une hyperéosinophilie est possible. L’histologie rénale permet le diagnostic de certitude (mais pas directement le diagnostic de causalité). Cette toxicité est imprévisible et dose-indépendante. En pratique clinique, il convient d’y penser devant l’apparition d’une IRA après introduction du traitement (en moyenne 8 à 10 jours sauf si exposition antérieure) ou en cas d’histoire de fièvre, d’arthralgies ou de rash cutané – bien que ces symptômes puissent être absents. Il faut dès lors interrompre le traitement ; l’administration précoce de corticoïdes peut permettre une amélioration de la fonction rénale (si possible après confirmation du diagnostic histologique).
Inhibition de la sécrétion tubulaire par sulfaméthoxazole-triméthoprime
L’association sulfaméthoxazole-triméthoprime, fréquemment utilisée, entraîne une majoration de la créatinine sans modification du DFG, par inhibition de la sécrétion tubulaire de créatinine. Cette augmentation est inférieure à 30 µmol/L en cas de fonction rénale de base normale, mais elle peut être plus importante en cas d’atteinte rénale sous-jacente. Cette association peut entraîner un risque de toxicité rénale par précipitation de cristaux intratubulaires, surtout en cas de pH urinaire acide (pH < 5,5). Le risque est majoré en cas d’administration de fortes doses (4 à 6 g/j), d’hypo–albuminémie ou d’hypovolémie. La prévention passe par la correction de l’hypovolémie, l’alcalinisation des urines et l’adaptation des posologies au DFG.
En cas d’IRA, il convient d’interrompre le traitement.
Enfin, le sulfaméthoxazole-triméthoprime est responsable d’hyperkaliémie par inhibition de la sécrétion du potassium dans le tube collecteur cortical.2
Médicaments toxiques en cas de facteurs de risque : diurétiques, IEC et ARA2
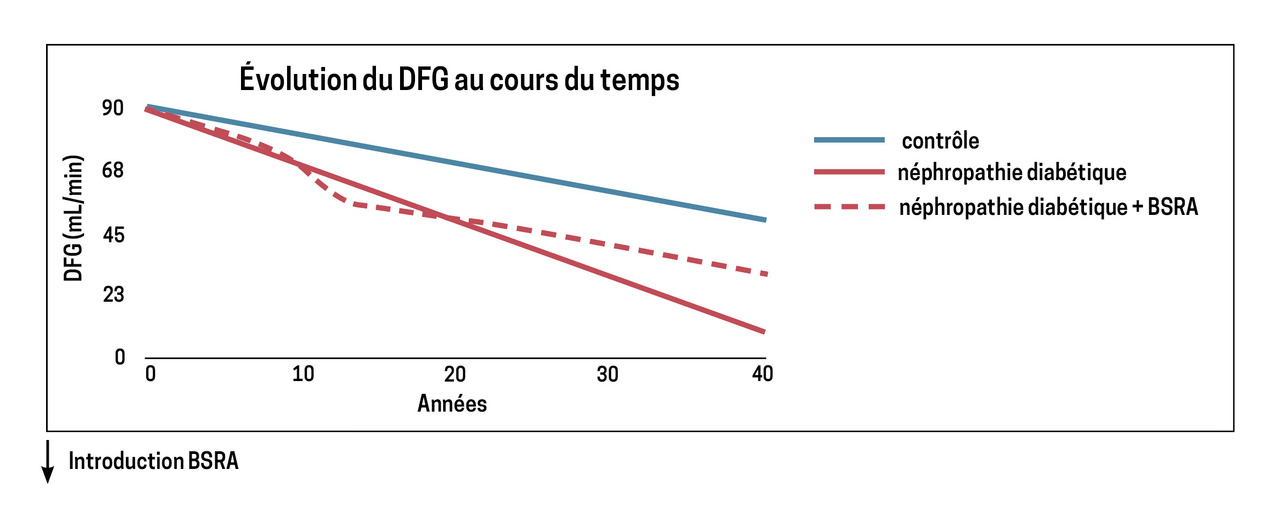
Les bloqueurs du système rénine-angiotensine (BSRA), IEC et ARA2, sont des molécules fréquemment utilisées, aussi bien en néphrologie (effet antihypertenseur et antiprotéinurique) qu’en cardiologie (insuffisance cardiaque ou cardiopathie ischémique). Leur introduction peut toutefois nécessiter un suivi (
Ils peuvent être introduits même chez des patients ayant une insuffisance rénale avancée, en raison de leurs bénéfices démontrés sur le plan cardiovasculaire et sur la néphroprotection. Une introduction au stade terminal – DFG inférieur à 15 mL/min/1,73 m2 – est cependant à discuter au cas par cas du fait du risque d’aggravation brutale de la fonction rénale, pouvant « précipiter » le patient en dialyse. Ils sont théoriquement contre-indiqués en cas de sténose bilatérale des artères rénales ou sténose unilatérale sur rein unique fonctionnel. Cependant, leur introduction est parfois possible même dans ces conditions mais doit se faire en hospitalisation en raison du risque d’hypotension brutale et d’IRA ; leur bénéfice est en effet établi dans le traitement médical des lésions des artères rénales, en combinaison avec les antiagrégants et les statines.
Cinq jours après l’introduction et après chaque changement de posologie, un dosage de la créatininémie et de la kaliémie peut être réalisé chez les patients à risque (pathologie vasculaire, diabétique, insuffisant cardiaque ou rénal). Du fait de la diminution de la perfusion glomérulaire qu’ils entraînent, une augmentation de la créatininémie et une baisse du DFG sont attendues après l’introduction de ces traitements et ne doivent pas conduire à leur arrêt. En effet, après une dégradation initiale, la fonction rénale doit normalement se stabiliser ou décliner moins rapidement (
Les BSRA bloquent les mécanismes d’autorégulation de la perfusion glomérulaire ; il convient donc d’éduquer les patients à interrompre leur traitement temporairement dans les situations entraînant une hypoperfusion rénale (en cas de fortes chaleurs ou de diarrhées notamment).
À l’inverse, les BSRA doivent la plupart du temps être maintenus même si la fonction rénale se dégrade du fait de l’évolution « naturelle » de la maladie rénale chronique. Il semblerait en effet que le bénéfice en matière de mortalité et de survenue d’événements cardiovasculaires persiste, même chez les patients devant débuter la dialyse.3
Même si un bénéfice modeste peut être obtenu avec une bithérapie en matière de contrôle tensionnel ou de la protéinurie, l’association IEC et ARA2 expose à un sur-risque non négligeable d’hypotension symptomatique, d’hyperkaliémie et d’IRA.4 Leur association est donc fortement déconseillée, sauf dans des cas exceptionnels.
Toxicité des produits de contraste iodés
Les produits de contraste iodés (PCI) sont quasiment exclusivement éliminés par les reins. Ils sont responsables d’un effet toxique direct sur les cellules tubulaires et endothéliales rénales mais aussi d’un effet vasoconstricteur intrarénal responsable d’une hypoxie entretenant les lésions rénales générées.
La néphrotoxicité des PCI est définie par une IRA survenant dans les quarante-huit à soixante-douze heures suivant l’injection, en absence d’autre cause. Des recommandations en la matière ont été publiées en 2018 par l’European Society of Urogenital Radiology.5
Facteurs de risque de néphrotoxicité
Les facteurs de risque de néphrotoxicité des PCI doivent systématiquement être recherchés avant l’examen radiologique : le principal est l’existence d’une maladie rénale chronique définie par un DFG inférieur à 60 mL/min/1,73 m2 et, a fortiori, en deçà de 45 mL/min/1,73 m2. D’autres facteurs de risque peuvent être associés et sont à prendre en compte ; les principaux sont : l'âge supérieur à 75 ans, le diabète, l'insuffisance cardiaque. Tout état d’hypovolémie constitue également un facteur de risque majeur et doit être corrigé, de même que la prise d’autres néphrotoxiques.
Les caractéristiques intrinsèques des PCI sont à prendre en considération, car leur toxicité augmente avec la haute osmolarité (supérieure à 1 000 mOsmol/kg H2O), l’injection intra-artérielle (qui implique des doses plus importantes) et les injections répétées (sur moins de 72 heures).
En résumé, plusieurs situations à risque élevé de néphrotoxicité aux PCI peuvent être définies :
- DFG inférieur à 30 mL/min/1,73 m2 ;
- DFG inférieur à 45 mL/min/1,73 m2 associé à plusieurs autres facteurs de risque ;
- DFG inférieur à 45 mL/min/1,73 m2 et injection intra-artérielle.
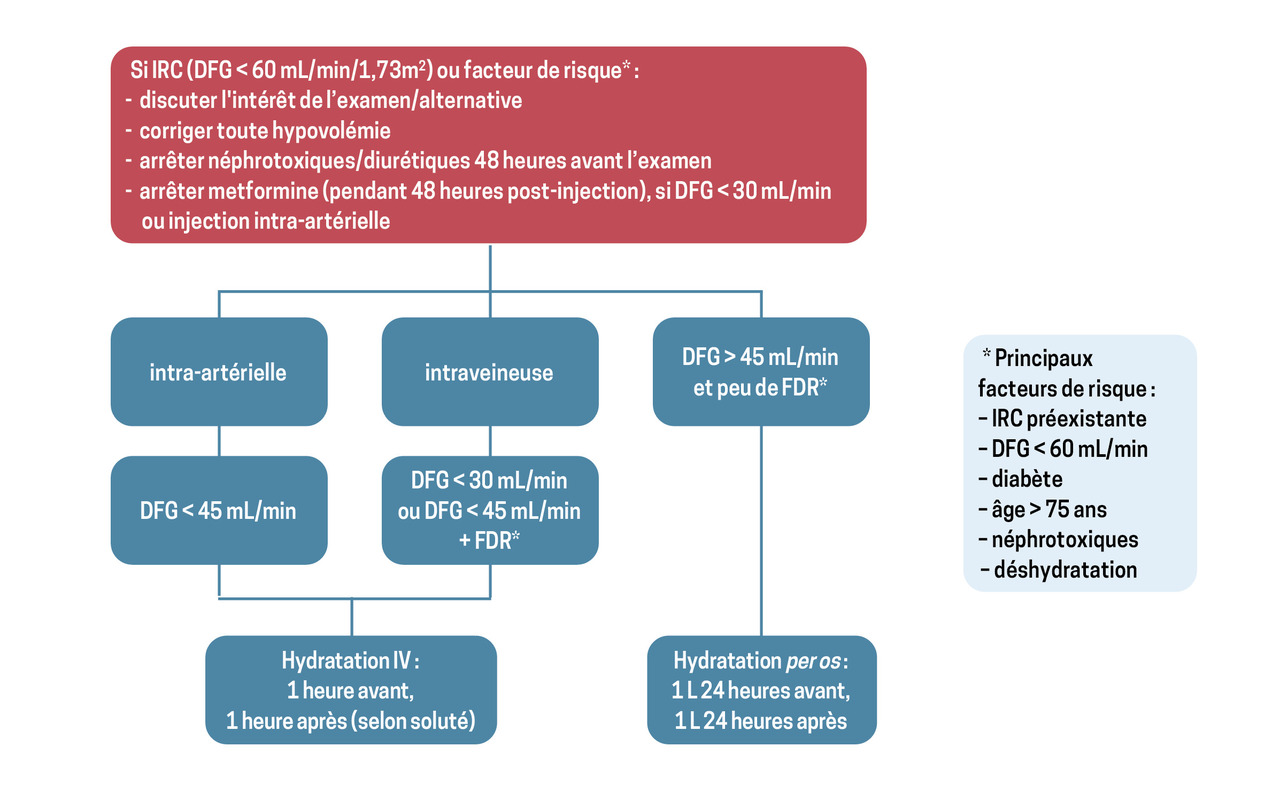
Quelle prévention ?
Des mesures de prévention efficaces et simples existent (
Dans tous les cas, le rapport bénéfice-risque de l’examen radiologique doit être évalué et la question d’une imagerie alternative telle que l’IRM doit être discutée si le patient est à haut risque.
Si l’indication est maintenue, il convient de suivre plusieurs recommandations :
- arrêter les autres néphrotoxiques quarante-huit heures avant l’examen (AINS, aminosides...) ;
- arrêter les diurétiques, si possible, quarante-huit heures avant l’examen ;
- il n’est pas recommandé de suspendre les IEC ni les ARA2 ;
- arrêter la metformine pour les quarante-huit heures suivant l’injection d’iode, si le DFG est inférieur à 30 mL/min/1,73 m2 ou en cas d’injection intra-artérielle, pour prévenir le risque d’acidose lactique ;
- proposer une bonne hydratation :
- intraveineuse si risque élevé (indifféremment sérum salé isotonique ou bicarbonate de sodium isotonique à débuter avant l’examen dans le cadre d’une hospitalisation de jour ou d’une hospitalisation conventionnelle : NaCl 0,9 % 10 mL/kg de poids [soit pour 60 kg, par exemple, 240 mL une heure avant et 360 mL une heure après] ou bicarbonate de sodium 1,4 % 3 mL/kg/h, une heure avant l’examen) ;
- si une injection intra-artérielle est envisagée, l’hydratation doit se poursuivre après l’examen, quel que soit le soluté ;
- l’hydratation par voie orale pendant quarante-huit heures peut être choisie chez les patients à faible risque (environ 2 L d’eau préférentiellement salée, comme l’eau de Vichy St-Yorre) et débutée vingt-quatre heures avant l’examen ;
- privilégier les PCI iso- ou hypo-osmolaires (moins de 1 000 mOsmol/kg H2O) ;
- éviter les injections répétées d’iode (sur moins de 72 heures) ; les espacer, au mieux, de deux semaines.
Chez les patients à risque élevé, la fonction rénale doit être réévaluée deux à cinq jours après l’injection d’iode. Il n’est pas nécessaire de surveiller la fonction rénale chez les patients n’ayant pas de facteurs de risque, sauf si une oligurie ou des signes généraux sont rapportés par le patient.
Antidiabétiques toxiques et protecteurs : metformine et acidose lactique ; SGLT2
La prévalence du diabète de type 2 est en constante progression, et de nombreux patients diabétiques ont une altération de leur fonction rénale souvent méconnue ou sous-estimée. Cependant, la plupart des antidiabétiques oraux ont des limites d’utilisation lorsque la fonction rénale décline et peuvent devenir toxiques à un certain stade de dysfonction rénale.
Metformine
La metformine, médicament de référence de première ligne du diabète de type 2, peut favoriser le développement d’une acidose lactique par un mécanisme encore mal connu. Son élimination étant exclusivement rénale avec une épuration proportionnelle au DFG, il est indispensable d’adapter la posologie en cas de DFG inférieur à 60 mL/min/1,73 m2 et d’interrompre le traitement en cas de DFG inférieur à 30 mL/min/1,73 m2.
La prévention repose essentiellement sur l’interruption du traitement en cas d’affection susceptible de diminuer le DFG telle qu’une déshydratation, une infection, une intervention chirurgicale ou une injection de produit de contraste iodé. Il est donc primordial de sensibiliser les patients sur le respect des posologies prescrites et sur les premiers signes de surdosage (vomissements, crampes musculaires, douleurs abdominales…), de leur conseiller de consulter immédiatement si ces symptômes surviennent et d’interrompre le traitement en cas de situations ou maladies aiguës (arrêt de la metformine 48 heures avant une intervention chirurgicale ou une injection de produit de contraste iodé et jusqu’à 48 heures après).
Gliflozines
Récemment, une nouvelle classe d’antidiabétiques oraux, les inhibiteurs du cotransporteur sodium-glucose de type 2 (iSGLT2), ou gliflozines, ont montré un bénéfice cardiovasculaire et un bénéfice majeur sur la néphroprotection.6 Leur utilisation est donc de plus en plus répandue en néphrologie. En France, il existe trois molécules : la dapagliflozine, la canagliflozine et l’empagliflozine. Leur profil de tolérance est globalement bon, selon les études actuelles. Les principaux effets secondaires comprennent : un risque accru d’infections urogénitales mycotiques, d'hypovolémies (justifiant la réduction des diurétiques à l’initiation) ainsi que d'acidocétoses diabétiques euglycémiques (très rare). Cette dernière complication est favorisée en cas de déshydratation, d’hypoglycémie, d’infection concomitante ou chez les patients alcooliques.
Comme pour les BSRA, en raison de leurs effets sur l’hémodynamique glomérulaire, une diminution modérée du DFG et donc une majoration de la créatininémie sont observées à l’instauration du traitement. Ce déclin est réversible et ne doit pas constituer une cause d’arrêt du traitement.
Anticancéreux : immunothérapie et thérapies ciblées
Immunothérapie
La découverte de l’existence de voies essentielles à la tolérance immunitaire induite par les cellules cancéreuses a permis la révolution thérapeutique qu’est l’immunothérapie du cancer. Les mécanismes impliqués passent par une anergie des lymphocytes T (LT), par l’activation de la voie CTLA-4 (cytotoxic T lymphocyte antigen-4) ou encore l’activation du récepteur PD-1 des LT (programmed cell death-1) par son ligand PD-L1 (programmed cell death ligand-1) exprimé par les cellules cancéreuses. Ces dernières années, de nombreuses molécules sont arrivées sur le marché et les indications se multiplient, avec des résultats intéressants, à la fois en monothérapie mais plus volontiers aujourd’hui en bithérapie ou en association avec d’autres traitements comme les thérapies ciblées.
Avec ces combinaisons, les effets secondaires sont également très fréquents et atteignent parfois les reins. L’atteinte est plutôt une IRA dont le diagnostic précis est difficile devant la combinaison d’une déshydratation liée aux effets secondaires digestifs de l’immunothérapie, d'un obstacle parfois lié au cancer, d'une infection ou de la toxicité d’autres molécules associées.
La biopsie rénale est idéalement proposée, dans la mesure du possible, pour confirmer le diagnostic histologique qui serait une néphropathie interstitielle aiguë si l’atteinte est secondaire à l’immunothérapie, répondant bien au traitement par corticoïdes.
Thérapies ciblées
Les thérapies ciblées sont principalement inductrices d’hypertension artérielle (80 % des patients) et de protéinurie. L’accompagnement des patients pour le suivi à domicile des chiffres de pression artérielle et l’apprentissage de l’auto-adaptation du traitement antihypertenseur peuvent influer très favorablement sur la tolérance du traitement.
Les BSRA et les inhibiteurs calciques sont souvent proposés pour contrôler à la fois la pression artérielle et la protéinurie.
En l’absence de recommandation, l’adaptation de dose des thérapies ciblées est parfois proposée par les oncologues pour pouvoir maintenir le traitement.
Plus rarement, ces thérapies ciblées induisent des microangiopathies thrombotiques, dont la particularité est d’être observées uniquement sur la biopsie rénale dans la moitié des cas, avec un bilan d’hémolyse normal. Néanmoins, la surveillance des paramètres biologiques d’hémolyse est pertinente (recherche de schizocytes, lactate déshydrogénase [LDH] et haptoglobine) pour favoriser un diagnostic précoce de ces atteintes se manifestant souvent sous forme d'insuffisances rénales aiguës ou d'autres complications d'organes plus graves comme le syndrome d’encéphalopathie postérieure réversible (PRES).
Que dire à vos patients ?
Les médicaments sont des molécules actives qui peuvent avoir des effets non attendus, éventuellement toxiques pour la fonction des reins. Lorsque l’on prend un traitement, il faut être attentif à la fois aux bénéfices ressentis et aux symptômes nouveaux ou inattendus, et les décrire au médecin. Tout effet secondaire pénible doit lui être rapporté.
Le nombre de médicaments n’est pas un problème s’ils sont donnés à la bonne dose en fonction de votre situation médicale et n’ont pas d’interaction entre eux.
Une bonne hydratation et un apport en sel suffisant (eaux alcalines, eau de Vichy St-Yorre) sont nécessaires lorsqu’on prend beaucoup de médicaments (la quantité de sel utile est à fixer avec le médecin traitant en fonction du contexte). En effet, être déshydraté (en cas de troubles digestifs, de manque d’appétit…) induit une concentration du médicament dans l’organisme qui peut être à risque de toxicité.
Les informations contenues sur les notices de médicaments à propos des effets indésirables sont des données issues d’études cliniques qui ne sont pas un bon reflet du risque individuel. Votre médecin est la personne qui pourra le mieux vous conseiller sur la survenue d’effets indésirables. L’arrêt d’un traitement prescrit par peur de ces effets peut aussi vous faire prendre un risque. Parlez-en avec votre médecin !
La toxicité rénale associée aux médicaments est un phénomène fréquent qui peut être grave : 14 à 26 % de la population adulte est concernée, principalement au décours d’une hospitalisation. L’insuffisance rénale aiguë, quelle que soit sa cause, affecte la survie des patients.
Même si la réglementation de mise sur le marché des produits pharmaceutiques a évolué, la toxicité rénale des médicaments est souvent révélée après les études d’enregistrement, lorsque les produits sont utilisés dans la population générale, qui a davantage de facteurs de susceptibilité que les patients inclus dans les essais thérapeutiques.
1. Perazella MA. Pharmacology behind Common Drug Nephrotoxicities. Clin J Am Soc Nephrol 2018;13(12):1897-908.
2. Ngatchou N, Masserey-Bonvin V, Gobin N, et al. Antibiotiques : quelques considérations pratiques. Rev Med Suisse 2016;12(529):1468-73.
3. Fu EL, Evans M, Clase CM, et al. Stopping Renin-Angiotensin System Inhibitors in Patients with Advanced CKD and Risk of Adverse Outcomes: A Nationwide Study. J Am Soc Nephrol 2021;32(2):424-35.
4. Makani H, Bangalore S, Desouza KA, et al. Efficacy and safety of dual blockade of the renin-angiotensin system: meta-analysis of randomised trials. BMJ 2013;346:f360.
5. van der Molen AJ, Reimer P, Dekkers IA, et al. Post-contrast acute kidney injury. Part 2: risk stratification, role of hydration and other prophylactic measures, patients taking metformin and chronic dialysis patients : Recommendations for updated ESUR Contrast Medium Safety Committee guidelines. Eur Radiol 2018;28(7):2856-69.
6. Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med 2019;380(24):2295-306.
Dans cet article
- Qui est à risque ?
- Mécanismes de la toxicité rénale médicamenteuse
- Toxicité rénale des médicaments courants en l’absence de facteur de risque
- Médicaments toxiques en cas de facteurs de risque : diurétiques, IEC et ARA2
- Toxicité des produits de contraste iodés
- Antidiabétiques toxiques et protecteurs : metformine et acidose lactique ; SGLT2
- Anticancéreux : immunothérapie et thérapies ciblées

 Encadrés
Encadrés