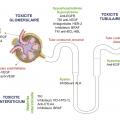
Depuis le développement de l’imatinib et du trastuzumab, les deux premières thérapies ciblées à succès, l’idée d’une oncologie de précision avec des traitements guidés par les altérations de chaque tumeur a constitué un moteur de découvertes thérapeutiques.1 Dans certaines localisations tumorales, comme le cancer du rein à cellules claires, les thérapies moléculaires ciblées antiangiogéniques occupent désormais une place incontournable dans la prise en charge des formes avancées ou métastatiques.2 Accompagnant ces nouvelles prescriptions, des toxicités rénales de nature variée ont été mises en évidence : hypertension artérielle, glomérulopathies, atteintes tubulaires, et bien d’autres. Entre 2011 et 2015, la Food and Drug Administration a recensé 2 943 déclarations d’effets indésirables comportant une atteinte rénale : le sex-ratio était équilibré, les désordres hydroélectrolytiques étaient le trouble le plus fréquent, et le cétuximab était la molécule la plus souvent signalée.3
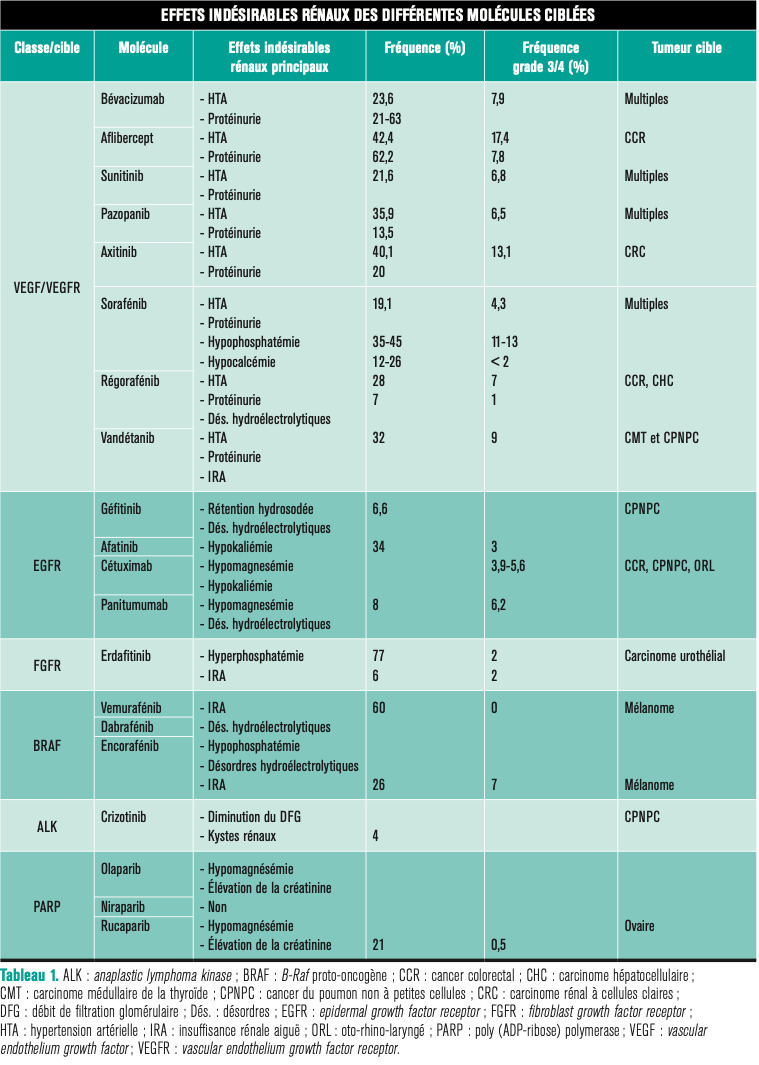
L’objectif est ici de résumer les toxicités néphrologiques des principales molécules ciblées, avec leurs fréquences et leurs mécanismes, mais aussi de proposer une prise en charge ainsi qu’une adaptation posologique en cas d’insuffisance rénale. Il est important de signaler que les molécules ciblant les kinases réagissent en sus de leur cible préférentielle, avec d’autres kinases, d’où le terme d’effet « multikinase », laissant augurer des effets indésirables parfois inattendus. Les effets secondaires rénaux des différentes molécules ciblées et les atteintes rénales en fonction des thérapies ciblées (physiopathologie et prise en charge) décrites ci-dessous sont résumés dans lestableaux 1 et 2 .
L’objectif est ici de résumer les toxicités néphrologiques des principales molécules ciblées, avec leurs fréquences et leurs mécanismes, mais aussi de proposer une prise en charge ainsi qu’une adaptation posologique en cas d’insuffisance rénale. Il est important de signaler que les molécules ciblant les kinases réagissent en sus de leur cible préférentielle, avec d’autres kinases, d’où le terme d’effet « multikinase », laissant augurer des effets indésirables parfois inattendus. Les effets secondaires rénaux des différentes molécules ciblées et les atteintes rénales en fonction des thérapies ciblées (physiopathologie et prise en charge) décrites ci-dessous sont résumés dans les
Classes impliquées dans les atteintes rénales
Thérapies anti-VEGF/VEGFR
Éléments de physiopathologie des atteintes rénales
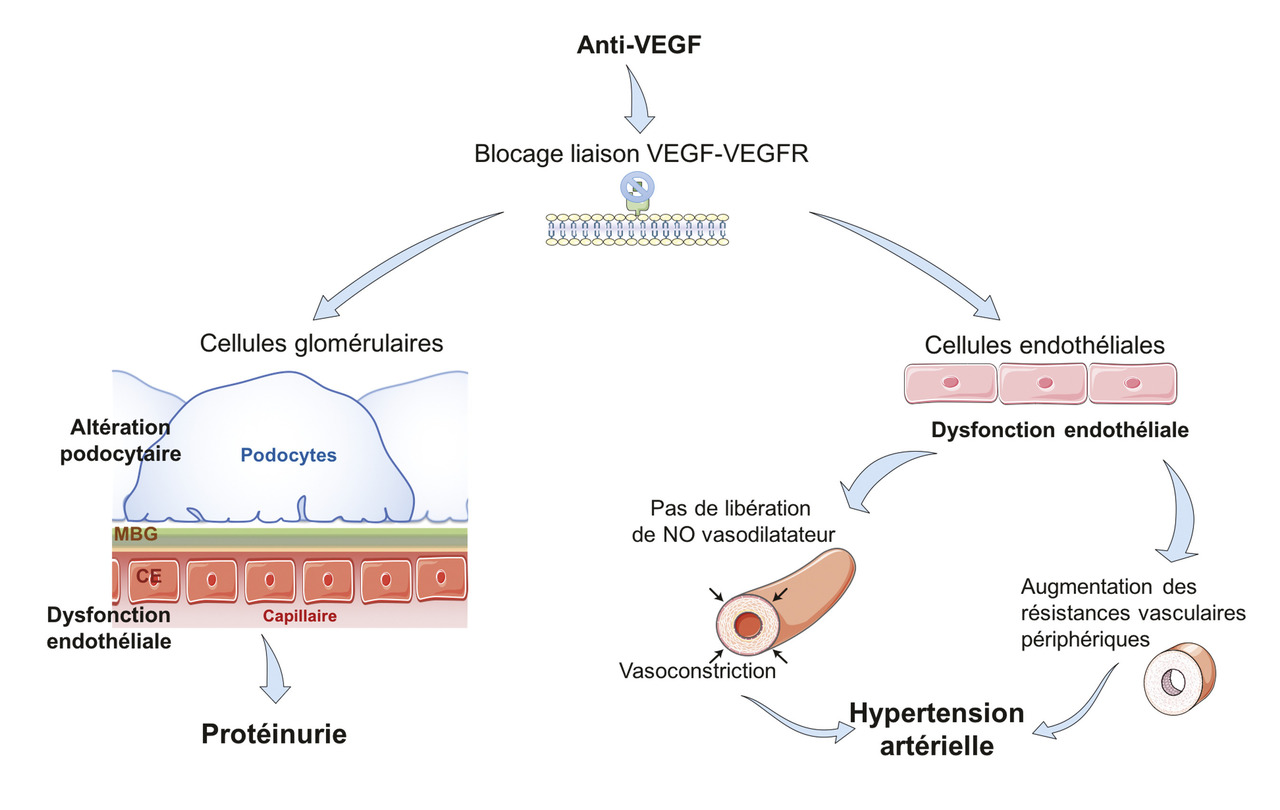
Généralement, les antiangiogéniques ciblant le vascular endothelial growth factor (VEGF) circulant ou son récepteur (VEGFR) sont divisés en deux catégories : les anticorps monoclonaux et protéines de fusion, dont font partie le bévacizumab, l’aflibercept et le ramucirumab, et les inhibiteurs de kinases tels que le sunitinib, le pazopanib, le sorafénib et l’axitinib. Leur spectre d’inhibition du kinome (ensemble des kinases exprimées dans une cellule) est source de tolérance variable selon les molécules.4Le VEGF est produit par les podocytes et se lie sur ses récepteurs présents à la surface des cellules endothéliales. Son absence altère la cellule endothéliale qui compose la membrane basale glomérulaire. Les remaniements structurels liés à l’absence de VEGF peuvent entraîner une perte de la perméabilité sélective de la membrane basale glomérulaire, expliquant la protéinurie observée avec ces traitements (
Protéinurie liée aux inhibiteurs de la voie VEGF/VEGFR
Cette protéinurie est plus fréquente chez les patients ayant un cancer du rein, avec une maladie rénale préexistante (ou ayant subi une néphrectomie unilatérale), quand il existe une combinaison avec de la chimiothérapie et quand la dose de bévacizumab augmente.5 L’incidence de la protéinurie dépend à la fois de la molécule mais aussi du cancer traité. En effet, l’étude MARS a évalué la tolérance rénale du bévacizumab de manière prospective, multicentrique, sur plus de 1 000 patients avec un suivi d’un an. La protéinurie était de 56,8 % dans les cancers ovariens,6 22,1 % dans les cancers du poumon7 et 61,7 % dans les cancers du sein,8 ce qui peut être le reflet de la variabilité de la clairance de ces thérapeutiques en fonction du type de cancer. Pour l’axitinib, l’incidence de la protéinurie varie de 36 à 52 % dans les cancers du rein.9La protéinurie et l’hypertension artérielle doivent être systématiquement recherchées avant de débuter le traitement, puis suivies par bandelette urinaire et par automesure tensionnelle à domicile, en particulier précocement après l’introduction de l’anti-VEGF.
Microangiopathie thrombotique
La microangiopathie thrombotique est due à une lésion endothéliale vasculaire et glomérulaire. Une équipe10 a étudié 100 biopsies rénales chez des patients traités par anti-VEGF. Des lésions de microangiopathie thrombotique étaient retrouvées sur 71 % des biopsies. Dans plus de 80 % des cas, ces lésions survenaient après un traitement par anticorps (bévacizumab, aflibercept).10 Sur 6 cas cliniques de patients ayant développé une microangiopathie thrombotique sous bévacizumab, rapportés par une autre équipe, 50 % avaient une fonction rénale et/ou une protéinurie qui s’amélioraient après arrêt du traitement.11Prise en charge
Les recommandations françaises préconisent l’arrêt de l’antiangiogénique en cas d’urgence hypertensive seulement.12 Par ailleurs, le reste de la prise en charge fait référence aux recommandations établies par la Société française d’hypertension artérielle (SFHTA). Si une protéinurie est associée, il est conseillé de privilégier les inhibiteurs de l’enzyme de conversion (IEC) et les antagonistes du récepteur à l’angiotensine II (ARA2).L’administration d’antiangiogéniques doit être suspendue, et un avis spécialisé demandé en cas de syndrome néphrotique ou de protéinurie supérieure à 3 g de protéinurie/24 h (ou 300 mg/mmol). Si le débit de filtration glomérulaire est inférieur à 30 mL/min, un avis néphrologique est préconisé avant administration de l’antiangiogénique.
Il semble que le changement pour un autre antiangiogénique après un événement sévère comme un syndrome néphrotique ou une microangiopathie thrombotique ne garantisse pas l’absence de récidive.13 Toute réintroduction après ces événements doit donc être évitée dans la mesure du possible et monitorée de près en cas de reprise de la même classe pharmacologique.
Autres atteintes liées aux médicaments de cette classe
Le sorafénib est fréquemment source d’une hypophosphatémie, qui serait liée à l’induction d’une insuffisance pancréatique exocrine, causant un défaut d’absorption de vitamine D et ainsi une hyperparathyroïdie secondaire. Une hypocalcémie est fréquemment observée, probablement en raison du même mécanisme. Le vandétanib est à l’origine d’insuffisances rénales, qui pourraient s’expliquer par l’inhibition de transporteurs comme les multidrug and toxin extrusion proteins 1 and 2 (MATE-1 et 2), qui augmentent la concentration de toxiques dans les cellules rénales. Enfin, le régorafénib est associé à de multiples désordres électrolytiques : hypocalcémie, hyponatrémie, hypokaliémie et hypophosphatémie.4Inhibiteurs de BRAF-MEK
Le vémurafénib et le dabrafénib sont des inhibiteurs de la mutation V600E de l’oncogène BRAF. Le cobimétinib ou le tramétinib sont des inhibiteurs de mitogen-activated extracellular signal-regulated kinase (MEK) souvent associés aux anti-BRAF, dans le mélanome métastatique par exemple. Jusqu’à maintenant, aucune toxicité rénale spécifique n’a été rapportée avec les inhibiteurs de MEK, en dehors de l’hypertension artérielle.
Les toxicités rénales décrites lors de l’utilisation des inhibiteurs de BRAF sont variées : néphropathie tubulo-interstitielle immuno-allergique, nécrose tubulaire aiguë ou encore syndrome de Fanconi, néphrites interstitielles,14 ou granulomatoses avec atteinte rénale.4
La combinaison la plus récente, encorafénib-binimétinib (respectivement anti-BRAF et anti-MEK), sur une série de 57 mélanomes, a entraîné 26 % d’insuffisances rénales aiguës, survenant en médiane à 27 jours, dont 7 % de grade 3, majoritairement transitoires.15 Un cas de glomérulonéphrite extracapillaire avec granulomes a aussi été rapporté.16
En revanche, il existe une hypothèse selon laquelle le tramétinib pourrait lutter contre la fibrose rénale, notamment par la voie des MAP kinases, en particulier via l’extracellular signal-regulated kinase 1/2 (ERK 1/2).17 La physiopathologie n’est pas encore élucidée : la toxicité est principalement tubulaire, même si BRAF est exprimé par les podocytes glomérulaires et les cellules épithéliales tubulaires.5, 18 Il est donc possible que la toxicité ne soit pas directement liée à l’inhibition des kinases, mais plutôt à un mécanisme immuno-allergique ou physicochimique.
En raison de ces toxicités, certes rares mais parfois graves, il semble raisonnable de contrôler la fonction rénale lors des premiers mois de traitement. Si une dysfonction rénale survient, une biopsie rénale pourra informer sur le mécanisme de toxicité et guider la prise en charge. En cas de grade 3, il est plus prudent d’interrompre le traitement.19
Les toxicités rénales décrites lors de l’utilisation des inhibiteurs de BRAF sont variées : néphropathie tubulo-interstitielle immuno-allergique, nécrose tubulaire aiguë ou encore syndrome de Fanconi, néphrites interstitielles,14 ou granulomatoses avec atteinte rénale.4
La combinaison la plus récente, encorafénib-binimétinib (respectivement anti-BRAF et anti-MEK), sur une série de 57 mélanomes, a entraîné 26 % d’insuffisances rénales aiguës, survenant en médiane à 27 jours, dont 7 % de grade 3, majoritairement transitoires.15 Un cas de glomérulonéphrite extracapillaire avec granulomes a aussi été rapporté.16
En revanche, il existe une hypothèse selon laquelle le tramétinib pourrait lutter contre la fibrose rénale, notamment par la voie des MAP kinases, en particulier via l’extracellular signal-regulated kinase 1/2 (ERK 1/2).17 La physiopathologie n’est pas encore élucidée : la toxicité est principalement tubulaire, même si BRAF est exprimé par les podocytes glomérulaires et les cellules épithéliales tubulaires.5, 18 Il est donc possible que la toxicité ne soit pas directement liée à l’inhibition des kinases, mais plutôt à un mécanisme immuno-allergique ou physicochimique.
En raison de ces toxicités, certes rares mais parfois graves, il semble raisonnable de contrôler la fonction rénale lors des premiers mois de traitement. Si une dysfonction rénale survient, une biopsie rénale pourra informer sur le mécanisme de toxicité et guider la prise en charge. En cas de grade 3, il est plus prudent d’interrompre le traitement.19
Inhibiteurs d’ALK et de ROS1
Le crizotinib est un inhibiteur de tyrosine kinase ciblant l’anaplasic lymphoma kinase (ALK), le ROS proto-oncogène 1 (ROS1) et l’hepatocyte growth factor receptor (HGFR) aussi appelé MET. Après 12 semaines de traitement chez des patients atteints de cancer du poumon non à petites cellules, 23,9 % ont une diminution du débit de filtration glomérulaire (DFG), avec 56,3 % de récupération à l’arrêt.20 Ce phénomène pourrait être expliqué par une compétition entre la créatinine et le crizotinib au niveau des récepteurs HGF. Il s’agit donc d’une élévation de la créatinine plasmatique par défaut d’excrétion. Celle-ci entraîne une baisse du DFG estimé alors que sa mesure réelle reste inchangée.
Environ 4 % des patients traités par crizotinib développent des kystes rénaux de novo dont le mécanisme physiopathologique est inconnu.4 Aucune lésion maligne identifiée à la suite du développement de ces kystes n’a été observée.13 Les patients développant des kystes sous crizotinib ou ceux ayant des kystes préexistants peuvent être suivis par l’imagerie. Ces kystes peuvent être complexes (Bosniak ≥ 3), mais aucun cas de malignité n’a été rapporté.13 De plus, après arrêt du crizotinib, les kystes régressent généralement.21
Dans le cadre d’une étude de phase II portant sur 38 patients atteints de carcinomes hépatocellulaires avancés, le capmatinib, un autre anti-MET, a entraîné également une élévation de la créatinémie et, dans 5 % des cas, des insuffisances rénales aiguës sévères.22
Environ 4 % des patients traités par crizotinib développent des kystes rénaux de novo dont le mécanisme physiopathologique est inconnu.4 Aucune lésion maligne identifiée à la suite du développement de ces kystes n’a été observée.13 Les patients développant des kystes sous crizotinib ou ceux ayant des kystes préexistants peuvent être suivis par l’imagerie. Ces kystes peuvent être complexes (Bosniak ≥ 3), mais aucun cas de malignité n’a été rapporté.13 De plus, après arrêt du crizotinib, les kystes régressent généralement.21
Dans le cadre d’une étude de phase II portant sur 38 patients atteints de carcinomes hépatocellulaires avancés, le capmatinib, un autre anti-MET, a entraîné également une élévation de la créatinémie et, dans 5 % des cas, des insuffisances rénales aiguës sévères.22
Inhibiteurs de l’EGFR
De même que pour les antiangiogéniques, il existe d’un côté les inhibiteurs de kinases oraux comme le géfitinib, l’erlotinib, l’afatinib et l’osimertinib, et de l’autre les anticorps monoclonaux comme le cétuximab et le panitumumab.
L’un des effets néphrologiques les plus fréquents avec ces anticorps est l’hypomagnésémie (17 %), un mécanisme proposé est l’inhibition du signal de l’EGF sur le récepteur TRPM6 présent dans le tube contourné distal.23 La fréquence de l’hypomagnésémie augmente avec la durée du traitement.24 Une hypokaliémie d’origine inconnue est observée chez 34 % des patients traités par panitumumab, bien que la diarrhée puisse être une explication.
Les inhibiteurs de kinases oraux sont, quant à eux, plutôt pourvoyeurs d’hypokaliémie via les diarrhées.4 L’osimertinib, un inhibiteur de kinase de 3e génération, se liant beaucoup plus sélectivement à l’EGFR tumoral muté qu’à l’EGFR sauvage des cellules saines, présente donc moins de toxicité liée à l’inhibition d’EGFR, avec 13 % d’événements de grade 3 ou plus, ce qui est moins en comparaison des données historiques des autres inhibiteurs de kinases anti-EGFR.25
La prise en charge des troubles hydroélectrolytiques sous anti-EGFR comprend un suivi systématique de la magnésémie et de la kaliémie ainsi qu’une supplémentation de l’ion manquant et l’interruption du traitement selon la gravité du trouble.26
L’un des effets néphrologiques les plus fréquents avec ces anticorps est l’hypomagnésémie (17 %), un mécanisme proposé est l’inhibition du signal de l’EGF sur le récepteur TRPM6 présent dans le tube contourné distal.23 La fréquence de l’hypomagnésémie augmente avec la durée du traitement.24 Une hypokaliémie d’origine inconnue est observée chez 34 % des patients traités par panitumumab, bien que la diarrhée puisse être une explication.
Les inhibiteurs de kinases oraux sont, quant à eux, plutôt pourvoyeurs d’hypokaliémie via les diarrhées.4 L’osimertinib, un inhibiteur de kinase de 3e génération, se liant beaucoup plus sélectivement à l’EGFR tumoral muté qu’à l’EGFR sauvage des cellules saines, présente donc moins de toxicité liée à l’inhibition d’EGFR, avec 13 % d’événements de grade 3 ou plus, ce qui est moins en comparaison des données historiques des autres inhibiteurs de kinases anti-EGFR.25
La prise en charge des troubles hydroélectrolytiques sous anti-EGFR comprend un suivi systématique de la magnésémie et de la kaliémie ainsi qu’une supplémentation de l’ion manquant et l’interruption du traitement selon la gravité du trouble.26
Inhibiteurs du FGFR
Les inhibiteurs du fibroblast growth factor receptor (FGFR), dont fait partie l’erdafitinib, traitement du cancer de la vessie métastatique, peuvent entraîner une hyperphosphatémie dans 77 % des cas, dont 2 % de grade 3. Il existe également 6 % d’insuffisances rénales aiguës liées à l’hyperphosphatémie. Cette dernière est un biomarqueur de l’inhibition de FGFR et peut permettre de surveiller l’observance thérapeutique.27
L’homéostasie du phosphate est régulée par le FGF23 et la parathormone dans une boucle de rétrocontrôle incluant le FGF23 synthétisé par l’os. Le FGF23 agit au niveau cellulaire en se liant à son récepteur FGFR/Klotho. Le FGF23 permet l’excrétion rénale du phosphate. Or l’inhibition des récepteurs FGFR empêche cette excrétion, ce qui entraîne une hyperphosphatémie et une augmentation du FGF23 en rétrocontrôle, qui ne peut plus se lier à son récepteur.28
Il est préconisé, à l’initiation de l’erdafitinib, de coprescrire un chélateur du phosphore, le sévélamer, qui permet de diminuer les apports alimentaires de phosphore. Un régime alimentaire pauvre en phosphore doit également être instauré, ainsi qu’un suivi diététique quand cela est possible. En cas d’hyperphosphatémie non contrôlée malgré ces mesures, un avis néphrologique peut être demandé, et des pauses thérapeutiques instaurées.
L’homéostasie du phosphate est régulée par le FGF23 et la parathormone dans une boucle de rétrocontrôle incluant le FGF23 synthétisé par l’os. Le FGF23 agit au niveau cellulaire en se liant à son récepteur FGFR/Klotho. Le FGF23 permet l’excrétion rénale du phosphate. Or l’inhibition des récepteurs FGFR empêche cette excrétion, ce qui entraîne une hyperphosphatémie et une augmentation du FGF23 en rétrocontrôle, qui ne peut plus se lier à son récepteur.28
Il est préconisé, à l’initiation de l’erdafitinib, de coprescrire un chélateur du phosphore, le sévélamer, qui permet de diminuer les apports alimentaires de phosphore. Un régime alimentaire pauvre en phosphore doit également être instauré, ainsi qu’un suivi diététique quand cela est possible. En cas d’hyperphosphatémie non contrôlée malgré ces mesures, un avis néphrologique peut être demandé, et des pauses thérapeutiques instaurées.
Inhibiteurs de PARP
Les inhibiteurs de poly(ADP-ribose) polymerase (PARP) ont pour effets secondaires fréquents une élévation de la créatinémie.29 Celle-ci est observée, dans les cancers de l’ovaire, pour 15 % des patientes avec le rucaparib30 et 11 % de celles traitées par olaparib.31 Elle survient surtout dans les premières semaines de traitement. Cela pourrait être dû à l’inhibition de MATE1 et MATE2-K qui jouent un rôle dans la sécrétion de créatinine.30 Cette élévation de la créatinine ne semble pas traduire une diminution du DFG.29 Une hypomagnésémie de 11 à 14 % est également observée. Le niraparib, autre inhibiteur de PARP, n’entraîne pas ces effets. Il ne s’agit donc vraisemblablement pas d’un effet de classe.
Certaines molécules de cette classe avaient été testées en préclinique à visée de néphroprotection en association avec les sels de platine, permettant une diminution de la production de dérivés réactifs de l’oxygène dans le rein et une baisse de près de 90 % de la créatininémie chez les rats traités par 20 mg/kg de cisplatine.32
Il n’y a donc pas d’exploration complémentaire ou d’adaptation posologique à faire lorsque l’élévation de la créatinine est modérée. En cas d’élévation importante, ou à distance suffisante de l’introduction du traitement, cette élévation doit être explorée.
Certaines molécules de cette classe avaient été testées en préclinique à visée de néphroprotection en association avec les sels de platine, permettant une diminution de la production de dérivés réactifs de l’oxygène dans le rein et une baisse de près de 90 % de la créatininémie chez les rats traités par 20 mg/kg de cisplatine.32
Il n’y a donc pas d’exploration complémentaire ou d’adaptation posologique à faire lorsque l’élévation de la créatinine est modérée. En cas d’élévation importante, ou à distance suffisante de l’introduction du traitement, cette élévation doit être explorée.
Imatinib
L’imatinib est un inhibiteur de BCR-ABL, du stem cell factor receptor (SCFR) et du platelet-derived growth factor receptor (PDGFR). Il a un statut à part, puisque ses effets seraient néphroprotecteurs. En effet, ses cibles moléculaires sont toutes profibrosantes. Des modèles murins ont montré une amélioration significative de la fibrose et de l’inflammation dans des reins lésés traités par imatinib. Dans une étude préclinique, le traitement précoce par imatinib prévenait la néphropathie chronique d’allogreffe, via l’inhibition du PDGFR et du transforming growth factor beta 1 (TGF-β1).4
Pharmacocinétique des thérapies ciblées
Thérapies ciblées orales
La plupart des inhibiteurs de kinases sont des molécules généralement trop hydrophobes pour être éliminées directement dans les urines. Ainsi, les altérations de la fonction rénale ont généralement peu d’impact sur leur concentration plasmatique.33
Cependant, les antiangiogéniques doivent être utilisés avec précaution en raison des effets cardiovasculaires potentiellement graves, d’autant plus chez les patients dialysés aux lourdes comorbidités vasculaires.33-35
Chez les patients hémodialysés, un risque accru de survenue d’effets indésirables a été suggéré malgré une initiation du sorafénib à doses réduites par exemple.36 Bien que les paramètres pharmacocinétiques diffèrent peu et que l’élimination rénale du sorafénib soit faible, une étude de pharmacocinétique démontre l’augmentation de sa concentration plasmatique au cours de l’hémodialyse et préconise ainsi de débuter à doses réduites.36
La disponibilité récente du dosage plasmatique des principales molécules utilisées en thérapie ciblée permet d’adapter les doses chez les patients d’une façon générale et plus particulièrement en cas de réduction néphronique, y compris en situation de dialyse.
Les différentes adaptations posologiques à réaliser en fonction des molécules sont résumées dans letableau 3 .
Cependant, les antiangiogéniques doivent être utilisés avec précaution en raison des effets cardiovasculaires potentiellement graves, d’autant plus chez les patients dialysés aux lourdes comorbidités vasculaires.33-35
Chez les patients hémodialysés, un risque accru de survenue d’effets indésirables a été suggéré malgré une initiation du sorafénib à doses réduites par exemple.36 Bien que les paramètres pharmacocinétiques diffèrent peu et que l’élimination rénale du sorafénib soit faible, une étude de pharmacocinétique démontre l’augmentation de sa concentration plasmatique au cours de l’hémodialyse et préconise ainsi de débuter à doses réduites.36
La disponibilité récente du dosage plasmatique des principales molécules utilisées en thérapie ciblée permet d’adapter les doses chez les patients d’une façon générale et plus particulièrement en cas de réduction néphronique, y compris en situation de dialyse.
Les différentes adaptations posologiques à réaliser en fonction des molécules sont résumées dans le
Anticorps monoclonaux
Les anticorps monoclonaux sont éliminés principalement dans l’endothélium vasculaire ou lors de sa fixation à sa cible.37 Ainsi, son élimination ne dépend pas de la fonction rénale. La clairance peut cependant varier avec la cible tumorale. Par exemple, la clairance du bévacizumab est plus importante dans les cancers de l’estomac qui ont une sécrétion plus importante de VEGF circulant.
Il n’y a donc pas d’adaptation posologique à faire en cas d’insuffisance rénale ou de dialyse.
Il n’y a donc pas d’adaptation posologique à faire en cas d’insuffisance rénale ou de dialyse.
Une pharmacovigilance indispensable
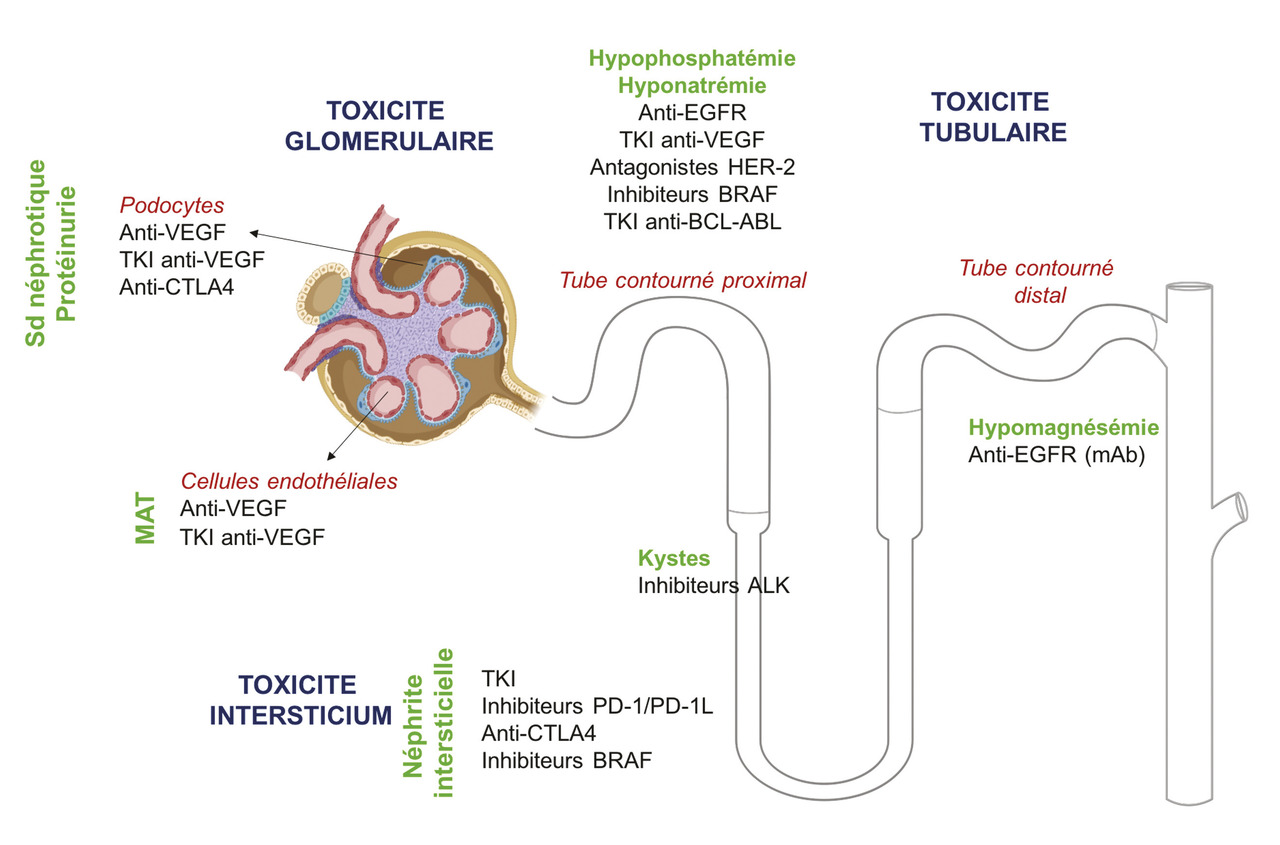
Les toxicités néphrologiques des thérapies moléculaires ciblées sont extrêmement variées (fig. 2 ). Si certaines toxicités commencent à être bien décrites, comme celles concernant la voie VEGF/VEGFR, d’autres ont un mécanisme physiopathologique qui n’est pas élucidé à ce jour. Le développement rapide de l’oncologie et les nouveaux traitements qui arrivent sur le marché chaque année entraînent un défi pour la mise à jour des connaissances. Ainsi, un recueil systématique de ces toxicités semble indispensable afin de déterminer lesquelles peuvent bénéficier d’une surveillance rapprochée. De plus, l’oncologue comme le néphrologue doivent être sensibilisés à ces toxicités, dont la prévalence ne fera qu’augmenter.
Références
1. Prasad V, Fojo T, Brada M. Precision oncology: origins, optimism, and potential. Lancet Oncol 2016;17:e81‑6.
2. Escudier B. Renal cell carcinoma: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2019;30:15.
3. Jhaveri KD, Wanchoo R, Sakhiya V, Ross DW, Fishbane S. adverse renal effects of novel molecular oncologic targeted therapies: a narrative review. Kidney Int Rep 2017;2:108‑23.
4. Porta C, Cosmai L, Gallieni M, Pedrazzoli P, Malberti F. Renal effects of targeted anticancer therapies. Nat Rev Nephrol 2015;11:354‑70.
5. Małyszko J, Kozłowska K, Kozłowski L, Małyszko J. Nephrotoxicity of anticancer treatment. Nephrol Dial Transplant 2017;32:924‑36.
6. Launay-Vacher V, Aapro M, De Castro G, et al. Renal effects of molecular targeted therapies in oncology: a review by the Cancer and the Kidney International Network (C-KIN). Ann Oncol 2015;26:1677‑84.
7. Goldwasser F , Janus N , Morere JF,.et al. Results of the MARS study on the management of antiangiogenics’ renovascular safety in lung cancer. European Cancer Congress, Eur J Cancer 2013;49:S819(abstr 3471).
8. Gligorov J, Janus N, Daniel C, et al. Results of the MARS study on the management of antiangiogenics’ renovascular safety in breast cancer. J Clin Oncol 2013;31:e12504‑e12504.
9. Izzedine H, Massard C, Spano JP, Goldwasser F, Khayat D, Soria JC. VEGF signalling inhibition-induced proteinuria: Mechanisms, significance and management. Eur J Cancer 2010;46:439‑48.
10. Izzedine H, Escudier B, Lhomme C, et al. Kidney diseases associated with anti-vascular endothelial growth factor (VEGF): an 8-year observational study at a single center. Medicine (Baltimore) 2014;93:333‑9.
11. Eremina V, Jefferson JA, Kowalewska J, et al. VEGF inhibition and renal thrombotic microangiopathy. N Engl J Med 2008;358:1129‑36.
12. Halimi JM, Azizi M, Bobrie G, et al. Effets vasculaires et rénaux des médicaments anti-angiogéniques : recommandations françaises pour la pratique (SN, SFHTA, APNET, FFCD). Nephrol Therap 2008;4:602‑15.
13. Abbas A, Mirza MM, Ganti AK, Tendulkar K. Renal toxicities of targeted therapies. Target Oncol 2015;10:487‑99.
14. Regnier Rosencher E, Lazareth H, Gressier L, Avril MF, Thervet E, Dupin N. Acute kidney injury in patients with severe rash on vemurafenib treatment for metastatic melanomas. Br J Dermatol 2013;169:934‑8.
15. Seethapathy H, Bates H, Chute DF, et al. Acute kidney injury following encorafenib and binimetinib for metastatic melanoma. Kidney Med 2020;2:373‑5.
16. Maanaoui M, Saint-Jacques C, Gnemmi V, et al. Glomerulonephritis and granulomatous vasculitis in kidney as a complication of the use of BRAF and MEK inhibitors in the treatment of metastatic melanoma: A case report. Medicine (Baltimore) 2017;96:e7196.
17. Andrikopoulos P, Kieswich J, Pacheco S, et al. The MEK inhibitor trametinib ameliorates kidney fibrosis by suppressing ERK1/2 and mTORC1 signaling. J Am Soc Nephrol 2019;30:33‑49.
18. Chaib H, Hoskins BE, Ashraf S, Goyal M, Wiggins RC, Hildebrandt F. Identification of BRAF as a new interactor of PLCepsilon1, the protein mutated in nephrotic syndrome type 3. Am J Physiol Renal Physiol 2008;294:F93-99.
19. Wanchoo R, Jhaveri KD, Deray G, Launay-Vacher V. Renal effects of BRAF inhibitors: a systematic review by the Cancer and the Kidney International Network. Clin Kidney J 2016;9:245‑51.
20. Brosnan EM, Weickhardt AJ, Lu X, et al. Drug-induced reduction in estimated glomerular filtration rate in patients with ALK-positive non-small cell lung cancer treated with the ALK inhibitor crizotinib. Cancer 2014;120:664‑74.
21. Lin YT, Wang YF, Yang JCH, et al. Development of renal cysts after crizotinib treatment in advanced ALK-positive non-small-cell lung cancer. J Thorac Oncol 2014;9:1720‑5.
22. Qin S, Chan SL, Sukeepaisarnjaroen W, et al. A phase II study of the efficacy and safety of the MET inhibitor capmatinib (INC280) in patients with advanced hepatocellular carcinoma. Ther Adv Med Oncol 2019 Dec 11;11:1758835919889001.
23. Groenestege WMT, Thebault S, van der Wijst J, et al. Impaired basolateral sorting of pro-EGF causes isolated recessive renal hypomagnesemia. J Clin Invest 2007;117:2260‑7.
24. Maliakal P, Ledford A. Electrolyte and protein imbalance following anti-EGFR therapy in cancer patients: a comparative study. Exp Ther Med 2010;1:307‑11.
25. Gao X, Le X, Costa DB. The safety and efficacy of osimertinib for the treatment of EGFR T790M mutation positive non-small-cell lung cancer. Expert Rev Anticancer Ther 2016;16:383‑90.
26. Izzedine H, Perazella MA. Adverse kidney effects of epidermal growth factor receptor inhibitors. Nephrol Dial Transplant 2017;32:1089‑97.
27. Loriot Y, Necchi A, Park SH, et al. Erdafitinib in locally advanced or metastatic urothelial carcinoma. N Engl J Med 2019;381:338‑48.
28. Yanochko GM, Vitsky A, Heyen JR, et al. Pan-FGFR inhibition leads to blockade of FGF23 signaling, soft tissue mineralization, and cardiovascular dysfunction. Toxicol Sci 2013;135:451‑64.
29. LaFargue CJ, Dal Molin GZ, Sood AK, Coleman RL. Exploring and comparing adverse events between PARP inhibitors. Lancet Oncol 2019;20:e15‑28.
30. Coleman RL, Oza AM, Lorusso D, et al. Rucaparib maintenance treatment for recurrent ovarian carcinoma after response to platinum therapy (ARIEL3): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017;390:1949‑61.
31. Pujade-Lauraine E, Ledermann JA, Selle F, et al. Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2017;18:1274‑84.
32. Racz I, Tory K, Gallyas F, et al. BGP-15—a novel poly(ADP-ribose) polymerase inhibitor-protects against nephrotoxicity of cisplatin without compromising its antitumor activity. Biochem Pharmacol 2002;63:1099‑111.
33. Gougis P, Palmieri LJ, Funck-Brentano C, et al. Major pitfalls of protein kinase inhibitors prescription: A review of their clinical pharmacology for daily use. Crit Rev Oncol Hematol 2019;141:112‑24.
34. Gougis P, Wassermann J, Spano JP, Keynan N, Funck-Brentano C, Salem JE. Clinical pharmacology of anti-angiogenic drugs in oncology. Crit Rev Oncol Hematol 2017;119:75‑93.
35. Masson E. Gestion des chimiothérapies chez les patients hémodialysés. EM- https://www.em-consulte.com/article/964716
36. Leonetti A, Bersanelli M, Castagneto B, et al. Outcome and safety of sorafenib in metastatic renal cell carcinoma dialysis patients: a systematic review. Clin Genitourin Cancer 2016;14:277‑83.
37. Geraud A, Gougis P, Vozy A, et al. Clinical pharmacology and interplay of immune checkpoint agents: a yin-yang balance. Annu Rev Pharmacol Toxicol. 1 sept 2020.
2. Escudier B. Renal cell carcinoma: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2019;30:15.
3. Jhaveri KD, Wanchoo R, Sakhiya V, Ross DW, Fishbane S. adverse renal effects of novel molecular oncologic targeted therapies: a narrative review. Kidney Int Rep 2017;2:108‑23.
4. Porta C, Cosmai L, Gallieni M, Pedrazzoli P, Malberti F. Renal effects of targeted anticancer therapies. Nat Rev Nephrol 2015;11:354‑70.
5. Małyszko J, Kozłowska K, Kozłowski L, Małyszko J. Nephrotoxicity of anticancer treatment. Nephrol Dial Transplant 2017;32:924‑36.
6. Launay-Vacher V, Aapro M, De Castro G, et al. Renal effects of molecular targeted therapies in oncology: a review by the Cancer and the Kidney International Network (C-KIN). Ann Oncol 2015;26:1677‑84.
7. Goldwasser F , Janus N , Morere JF,.et al. Results of the MARS study on the management of antiangiogenics’ renovascular safety in lung cancer. European Cancer Congress, Eur J Cancer 2013;49:S819(abstr 3471).
8. Gligorov J, Janus N, Daniel C, et al. Results of the MARS study on the management of antiangiogenics’ renovascular safety in breast cancer. J Clin Oncol 2013;31:e12504‑e12504.
9. Izzedine H, Massard C, Spano JP, Goldwasser F, Khayat D, Soria JC. VEGF signalling inhibition-induced proteinuria: Mechanisms, significance and management. Eur J Cancer 2010;46:439‑48.
10. Izzedine H, Escudier B, Lhomme C, et al. Kidney diseases associated with anti-vascular endothelial growth factor (VEGF): an 8-year observational study at a single center. Medicine (Baltimore) 2014;93:333‑9.
11. Eremina V, Jefferson JA, Kowalewska J, et al. VEGF inhibition and renal thrombotic microangiopathy. N Engl J Med 2008;358:1129‑36.
12. Halimi JM, Azizi M, Bobrie G, et al. Effets vasculaires et rénaux des médicaments anti-angiogéniques : recommandations françaises pour la pratique (SN, SFHTA, APNET, FFCD). Nephrol Therap 2008;4:602‑15.
13. Abbas A, Mirza MM, Ganti AK, Tendulkar K. Renal toxicities of targeted therapies. Target Oncol 2015;10:487‑99.
14. Regnier Rosencher E, Lazareth H, Gressier L, Avril MF, Thervet E, Dupin N. Acute kidney injury in patients with severe rash on vemurafenib treatment for metastatic melanomas. Br J Dermatol 2013;169:934‑8.
15. Seethapathy H, Bates H, Chute DF, et al. Acute kidney injury following encorafenib and binimetinib for metastatic melanoma. Kidney Med 2020;2:373‑5.
16. Maanaoui M, Saint-Jacques C, Gnemmi V, et al. Glomerulonephritis and granulomatous vasculitis in kidney as a complication of the use of BRAF and MEK inhibitors in the treatment of metastatic melanoma: A case report. Medicine (Baltimore) 2017;96:e7196.
17. Andrikopoulos P, Kieswich J, Pacheco S, et al. The MEK inhibitor trametinib ameliorates kidney fibrosis by suppressing ERK1/2 and mTORC1 signaling. J Am Soc Nephrol 2019;30:33‑49.
18. Chaib H, Hoskins BE, Ashraf S, Goyal M, Wiggins RC, Hildebrandt F. Identification of BRAF as a new interactor of PLCepsilon1, the protein mutated in nephrotic syndrome type 3. Am J Physiol Renal Physiol 2008;294:F93-99.
19. Wanchoo R, Jhaveri KD, Deray G, Launay-Vacher V. Renal effects of BRAF inhibitors: a systematic review by the Cancer and the Kidney International Network. Clin Kidney J 2016;9:245‑51.
20. Brosnan EM, Weickhardt AJ, Lu X, et al. Drug-induced reduction in estimated glomerular filtration rate in patients with ALK-positive non-small cell lung cancer treated with the ALK inhibitor crizotinib. Cancer 2014;120:664‑74.
21. Lin YT, Wang YF, Yang JCH, et al. Development of renal cysts after crizotinib treatment in advanced ALK-positive non-small-cell lung cancer. J Thorac Oncol 2014;9:1720‑5.
22. Qin S, Chan SL, Sukeepaisarnjaroen W, et al. A phase II study of the efficacy and safety of the MET inhibitor capmatinib (INC280) in patients with advanced hepatocellular carcinoma. Ther Adv Med Oncol 2019 Dec 11;11:1758835919889001.
23. Groenestege WMT, Thebault S, van der Wijst J, et al. Impaired basolateral sorting of pro-EGF causes isolated recessive renal hypomagnesemia. J Clin Invest 2007;117:2260‑7.
24. Maliakal P, Ledford A. Electrolyte and protein imbalance following anti-EGFR therapy in cancer patients: a comparative study. Exp Ther Med 2010;1:307‑11.
25. Gao X, Le X, Costa DB. The safety and efficacy of osimertinib for the treatment of EGFR T790M mutation positive non-small-cell lung cancer. Expert Rev Anticancer Ther 2016;16:383‑90.
26. Izzedine H, Perazella MA. Adverse kidney effects of epidermal growth factor receptor inhibitors. Nephrol Dial Transplant 2017;32:1089‑97.
27. Loriot Y, Necchi A, Park SH, et al. Erdafitinib in locally advanced or metastatic urothelial carcinoma. N Engl J Med 2019;381:338‑48.
28. Yanochko GM, Vitsky A, Heyen JR, et al. Pan-FGFR inhibition leads to blockade of FGF23 signaling, soft tissue mineralization, and cardiovascular dysfunction. Toxicol Sci 2013;135:451‑64.
29. LaFargue CJ, Dal Molin GZ, Sood AK, Coleman RL. Exploring and comparing adverse events between PARP inhibitors. Lancet Oncol 2019;20:e15‑28.
30. Coleman RL, Oza AM, Lorusso D, et al. Rucaparib maintenance treatment for recurrent ovarian carcinoma after response to platinum therapy (ARIEL3): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017;390:1949‑61.
31. Pujade-Lauraine E, Ledermann JA, Selle F, et al. Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2017;18:1274‑84.
32. Racz I, Tory K, Gallyas F, et al. BGP-15—a novel poly(ADP-ribose) polymerase inhibitor-protects against nephrotoxicity of cisplatin without compromising its antitumor activity. Biochem Pharmacol 2002;63:1099‑111.
33. Gougis P, Palmieri LJ, Funck-Brentano C, et al. Major pitfalls of protein kinase inhibitors prescription: A review of their clinical pharmacology for daily use. Crit Rev Oncol Hematol 2019;141:112‑24.
34. Gougis P, Wassermann J, Spano JP, Keynan N, Funck-Brentano C, Salem JE. Clinical pharmacology of anti-angiogenic drugs in oncology. Crit Rev Oncol Hematol 2017;119:75‑93.
35. Masson E. Gestion des chimiothérapies chez les patients hémodialysés. EM- https://www.em-consulte.com/article/964716
36. Leonetti A, Bersanelli M, Castagneto B, et al. Outcome and safety of sorafenib in metastatic renal cell carcinoma dialysis patients: a systematic review. Clin Genitourin Cancer 2016;14:277‑83.
37. Geraud A, Gougis P, Vozy A, et al. Clinical pharmacology and interplay of immune checkpoint agents: a yin-yang balance. Annu Rev Pharmacol Toxicol. 1 sept 2020.