Sachant que différentes maladies peuvent être liées au gluten, l’enjeu consiste à ne pas méconnaître les entités qui relèvent d’un régime d’éviction strict.
L’intolérance au gluten, ou maladie cœliaque (MC), est un trouble dysimmunitaire systémique déclenché par l’ingestion de gluten, qui peut débuter à tous les âges de la vie. Sa fréquence estimée varie de 1/150 à 1/200 personnes en France, soit environ 1 % de la population. Elle se développe chez des sujets génétiquement prédisposés ; en effet, on estime qu’un HLA-DQ2 et/ou un HLA-DQ8 est présent dans 98 % des cas.
La gliadine des céréales (blé, orge, seigle) est soumise à l’action de la transglutaminase tissulaire au niveau de l’intestin grêle. Cette enzyme provoque une désamidation des protéines en résidus peptidiques chargés négativement qui ont une affinité pour le HLA-DQ chargé positivement présent à la surface des cellules présentatrices d’antigènes. Cette reconnaissance par les lymphocytes T déclenche une réaction immunitaire avec production de cytokines pro-inflammatoires, qui provoquent une destruction de la muqueuse intestinale et une atrophie villositaire subtotale à totale.
À ce jour, il n’existe pas de méthode de prévention pour les sujets génétiquement prédisposés : l’allaitement maternel, longtemps mis en avant, ne semble pas réellement protecteur, selon les études randomisées contrôlées les plus récentes.1, 2 De même, l’introduction précoce du gluten ne réduit pas le risque de maladie cœliaque ultérieure chez les enfants prédisposés. Le gluten ne doit pas être introduit avant l’âge de 4 mois. Il est conseillé d’en limiter la quantité au début de la diversification alimentaire, puis sa consommation doit être progressivement croissante jusqu’à 1 an.3
La gliadine des céréales (blé, orge, seigle) est soumise à l’action de la transglutaminase tissulaire au niveau de l’intestin grêle. Cette enzyme provoque une désamidation des protéines en résidus peptidiques chargés négativement qui ont une affinité pour le HLA-DQ chargé positivement présent à la surface des cellules présentatrices d’antigènes. Cette reconnaissance par les lymphocytes T déclenche une réaction immunitaire avec production de cytokines pro-inflammatoires, qui provoquent une destruction de la muqueuse intestinale et une atrophie villositaire subtotale à totale.
À ce jour, il n’existe pas de méthode de prévention pour les sujets génétiquement prédisposés : l’allaitement maternel, longtemps mis en avant, ne semble pas réellement protecteur, selon les études randomisées contrôlées les plus récentes.1, 2 De même, l’introduction précoce du gluten ne réduit pas le risque de maladie cœliaque ultérieure chez les enfants prédisposés. Le gluten ne doit pas être introduit avant l’âge de 4 mois. Il est conseillé d’en limiter la quantité au début de la diversification alimentaire, puis sa consommation doit être progressivement croissante jusqu’à 1 an.3
La maladie cœliaque sous-diagnostiquée en pédiatrie car hétérogène
En 2012, des experts de la Société européenne de gastroentérologie, hépatologie et nutrition pédiatriques (ESPGHAN) avaient établi des recommandations pour le diagnostic de la maladie cœliaque de l’enfant, incluant notamment la possibilité d’éviter les biopsies digestives dans certaines situations.4 À partir de nouvelles données de la littérature, ils ont actualisé ces critères en 2020.5
Le diagnostic doit être suspecté devant un tableau classique de malabsorption, avec diarrhée chronique, retard de croissance et perte de poids. Plusieurs travaux ont cependant montré que des symptômes moins spécifiques, comme un syndrome de l’intestin irritable avec diarrhée, une anémie par carence martiale, une constipation chronique, une aphtose buccale récidivante ou encore des anomalies de l’émail dentaire, doivent faire évoquer une maladie cœliaque de l’enfant.6 De plus, une maladie cœliaque doit être recherchée dans des situations spécifiques d’antécédents familiaux, d’auto-immunité ou encore dans le cadre de certains syndromes (formes silencieuses ou latentes).
En pratique, les experts recommandent de rechercher une maladie cœliaque dans la population pédiatrique devant certains signes et symptômes (tableau 1 ).5
Le diagnostic doit être suspecté devant un tableau classique de malabsorption, avec diarrhée chronique, retard de croissance et perte de poids. Plusieurs travaux ont cependant montré que des symptômes moins spécifiques, comme un syndrome de l’intestin irritable avec diarrhée, une anémie par carence martiale, une constipation chronique, une aphtose buccale récidivante ou encore des anomalies de l’émail dentaire, doivent faire évoquer une maladie cœliaque de l’enfant.6 De plus, une maladie cœliaque doit être recherchée dans des situations spécifiques d’antécédents familiaux, d’auto-immunité ou encore dans le cadre de certains syndromes (formes silencieuses ou latentes).
En pratique, les experts recommandent de rechercher une maladie cœliaque dans la population pédiatrique devant certains signes et symptômes (
Quand les biopsies sont-elles requises ?
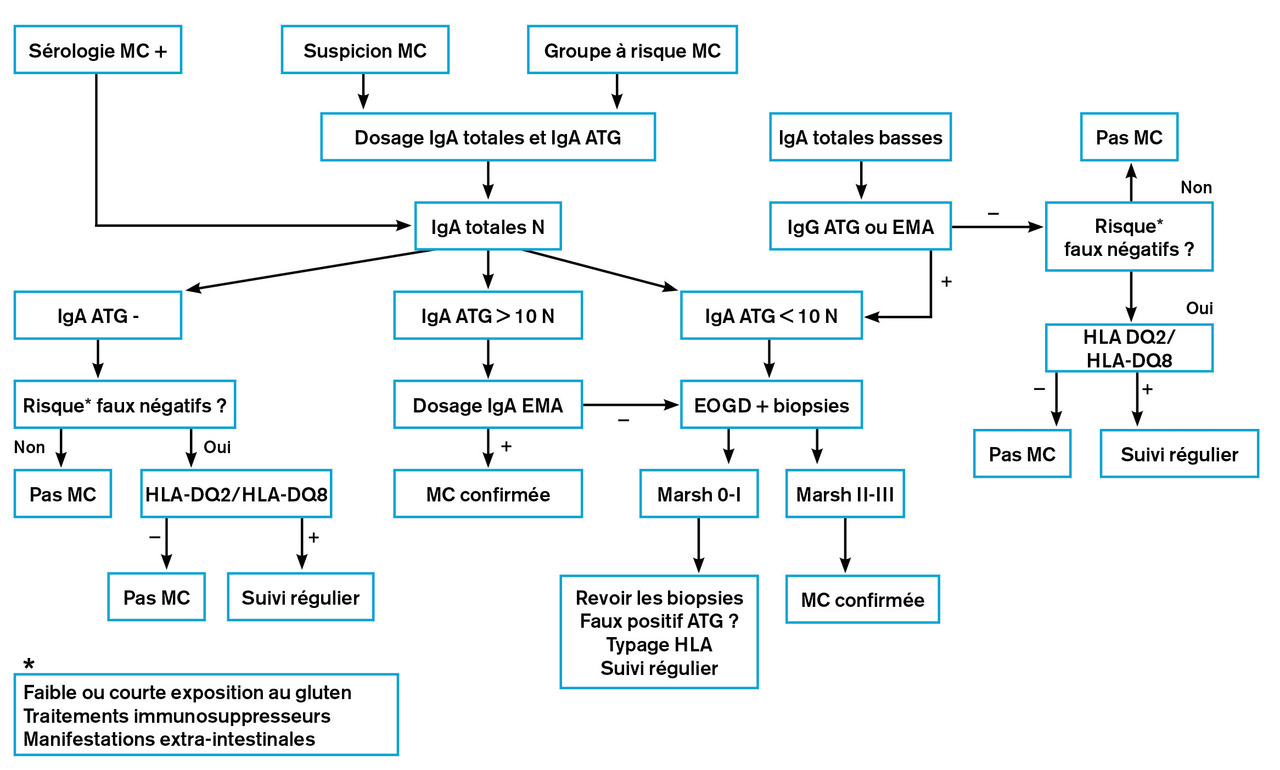
Les dosages des IgA totales et des IgA antitransglutaminase (ATG) doivent être prescrits en première intention chez les enfants suspects de maladie cœliaque ou issus d’un groupe à risque, qu’ils soient ou non symptomatiques et quel que soit leur âge. Il faut au préalable vérifier que l’enfant consomme des quantités normales de gluten.
– Si les IgA ATG sont supérieures ou égales à 10 fois la limite supérieure de la normale, seuil prédisant une entéropathie avec atrophie villositaire partielle ou totale (classification de Marsh II/III,tableau 2 ), et si un second prélèvement montre des IgA anti-endomysium (EMA) positifs, le diagnostic de MC peut être affirmé sans biopsie, y compris si l’enfant est asymptomatique.7 Ce deuxième prélèvement est indispensable car les IgA EMA sont très spécifiques. Il permet d’éliminer les faux positifs en confirmant l’auto-immunité cœliaque. Cette stratégie requiert l’accord des parents et de l’enfant, si possible.
– Si les IgA ATG sont positives mais leur taux inférieur à 10 fois la limite supérieure de la normale, une endoscopie digestive haute avec biopsies doit être réalisée.
– Si la concentration des IgA est basse (inférieure à la normale pour l’âge ou inférieure à 0,2 g/L chez l’enfant de plus de 3 ans), un dosage sérique des IgG (IgG antipeptides désaminés de la gliadine ou EMA ou ATG) est indiqué en deuxième intention. Si l’un de ces premiers tests est positif, il est recommandé d’adresser l’enfant à un pédiatre spécialisé en gastroentérologie pour réaliser une endoscopie digestive haute avec biopsies.
Les patients dont les IgA antitransglutaminase et anti-endomysium sont positives sans lésion histologique, ou en présence de lésions mineures, sont considérés comme ayant une maladie cœliaque latente. Cependant, de tels résultats peuvent être observés en cas de consommation faible de gluten au moment des biopsies, de mauvaises conditions de prélèvement ou d’orientation inadéquate des biopsies au moment de leur lecture. La vérification de ces données est nécessaire pour distinguer une maladie cœliaque latente d’une réelle maladie cœliaque.
Les lésions histologiques de type Marsh I augmentent le risque d’atrophie villositaire au cours du temps, comparativement à l’absence de lésion histologique.8 Un suivi clinique et biologique prolongé (marqueurs sériques, nouvelles biopsies) est donc nécessaire.
Les modalités de dépistage d’une maladie cœliaque sont bien codifiées (figure ).5
– Si les IgA ATG sont supérieures ou égales à 10 fois la limite supérieure de la normale, seuil prédisant une entéropathie avec atrophie villositaire partielle ou totale (classification de Marsh II/III,
– Si les IgA ATG sont positives mais leur taux inférieur à 10 fois la limite supérieure de la normale, une endoscopie digestive haute avec biopsies doit être réalisée.
– Si la concentration des IgA est basse (inférieure à la normale pour l’âge ou inférieure à 0,2 g/L chez l’enfant de plus de 3 ans), un dosage sérique des IgG (IgG antipeptides désaminés de la gliadine ou EMA ou ATG) est indiqué en deuxième intention. Si l’un de ces premiers tests est positif, il est recommandé d’adresser l’enfant à un pédiatre spécialisé en gastroentérologie pour réaliser une endoscopie digestive haute avec biopsies.
Les patients dont les IgA antitransglutaminase et anti-endomysium sont positives sans lésion histologique, ou en présence de lésions mineures, sont considérés comme ayant une maladie cœliaque latente. Cependant, de tels résultats peuvent être observés en cas de consommation faible de gluten au moment des biopsies, de mauvaises conditions de prélèvement ou d’orientation inadéquate des biopsies au moment de leur lecture. La vérification de ces données est nécessaire pour distinguer une maladie cœliaque latente d’une réelle maladie cœliaque.
Les lésions histologiques de type Marsh I augmentent le risque d’atrophie villositaire au cours du temps, comparativement à l’absence de lésion histologique.8 Un suivi clinique et biologique prolongé (marqueurs sériques, nouvelles biopsies) est donc nécessaire.
Les modalités de dépistage d’une maladie cœliaque sont bien codifiées (
Maladie cœliaque : régime sans gluten strict et à vie
Après le diagnostic de maladie cœliaque, le régime sans gluten strict comprend l’exclusion du blé, du seigle et de l’orge. L’avoine est autorisée en petite quantité. Une consultation de diététique est préconisée.
La supplémentation en certains micronutriments est fonction des carences observées. Un projet d’accueil individualisé (PAI), avec panier repas, doit être mis en place pour la crèche et l’école.
Les familles ont droit à une allocation compensatoire mensuelle pour acheter les produits sans gluten.
Un dépistage de la fratrie doit être systématiquement proposé.
Une surveillance clinique et biologique est effectuée tous les six mois : la normalisation des ATG peut s’échelonner sur plusieurs mois. Il est important de vérifier l’observance au régime car des complications (ostéopénie, cancers, autres maladies auto-immunes) à long terme ont été décrites en cas de consommation régulière de gluten.9
La supplémentation en certains micronutriments est fonction des carences observées. Un projet d’accueil individualisé (PAI), avec panier repas, doit être mis en place pour la crèche et l’école.
Les familles ont droit à une allocation compensatoire mensuelle pour acheter les produits sans gluten.
Un dépistage de la fratrie doit être systématiquement proposé.
Une surveillance clinique et biologique est effectuée tous les six mois : la normalisation des ATG peut s’échelonner sur plusieurs mois. Il est important de vérifier l’observance au régime car des complications (ostéopénie, cancers, autres maladies auto-immunes) à long terme ont été décrites en cas de consommation régulière de gluten.9
D’autres maladies sont liées au gluten
Outre la maladie cœliaque, le blé, notamment, peut être en cause dans d’autres maladies du nourrisson et de l’enfant.
L’allergie au blé IgE-médiée : éviction stricte souvent temporaire
L’allergie au blé de type IgE-médiée concernerait moins de 1 % des enfants européens. Elle se manifeste par des signes cliniques de type urticaire, œdème de Quincke, bronchospasme, vomissements, voire un véritable choc anaphylactique dans les minutes qui suivent la consommation de blé.
Le dosage des IgE spécifiques peut être prescrit si l’on suspecte ce diagnostic. En cas de doute, un test de provocation orale est réalisé à l’hôpital. Si le diagnostic est avéré, une éviction stricte du blé est mise en place. Le pronostic à long terme est généralement favorable, la majorité des enfants devenant tolérants à l’âge scolaire.10
Le dosage des IgE spécifiques peut être prescrit si l’on suspecte ce diagnostic. En cas de doute, un test de provocation orale est réalisé à l’hôpital. Si le diagnostic est avéré, une éviction stricte du blé est mise en place. Le pronostic à long terme est généralement favorable, la majorité des enfants devenant tolérants à l’âge scolaire.10
L’hypersensibilité non cœliaque n’impose pas de régime strict
L’hypersensibilité au gluten non cœliaque (HSGNC) est définie par des troubles digestifs (souvent ballonnements, diarrhée, douleurs abdominales) et extradigestifs (souvent fatigue, irritabilité) après la prise de gluten, souvent améliorés par le retrait de celui-ci.
Pour retenir ce diagnostic, une maladie cœliaque et une allergie au blé IgE-médiée doivent être éliminées.11 Cependant, aucun marqueur biologique spécifique n’est disponible, ce qui complique souvent le diagnostic. Actuellement, seul un tiers des patients des études randomisées en double insu répondent à la définition de l’HSGNC. Pour les autres, il s’agit essentiellement d’un effet placebo/nocebo du régime.
Plusieurs études ont rapporté une augmentation des taux d’IgG anti-gliadine (30-70 %) chez les patients souffrant d’une hypersensibilité au gluten non cœliaque par rapport à la population générale (2-8 %). La prévalence d’un haplotype HLA-DQ2 ou HLA-DQ8 serait un peu augmentée, soit environ 50 %, contre 40 % dans la population générale. La place de l’histologie est actuellement limitée, elle sert essentiellement à éliminer une maladie cœliaque. D’après plusieurs travaux, certains patients avec une HSGNC ont une lymphocytose intra-épithéliale (classification de Marsh I).
En tant qu’entité clinique individualisable, l’hypersensibilité au gluten non cœliaque est discutable. En effet, certains patients pourraient réagir à d’autres composants du blé comme les carbohydrates, les oligosaccharides fermentables, disaccharides, monosaccharides, et polyols (ou FODMAP) ou d’autres protéines du blé exerçant un effet pro-inflammatoire, les inhibiteurs de l’amylase-trypsine (ATI).
En cas de suspicion, un régime sans gluten peut être tenté pour une durée déterminée. En général, une éviction stricte n’est pas nécessaire : de petites quantités de gluten sont tolérées. Il convient de réévaluer régulièrement ce seuil de tolérance car, le plus souvent, l’enfant parvient progressivement à consommer du gluten en quantité « normale », ce qui lui évite un régime inutile et contraignant.
Pour retenir ce diagnostic, une maladie cœliaque et une allergie au blé IgE-médiée doivent être éliminées.11 Cependant, aucun marqueur biologique spécifique n’est disponible, ce qui complique souvent le diagnostic. Actuellement, seul un tiers des patients des études randomisées en double insu répondent à la définition de l’HSGNC. Pour les autres, il s’agit essentiellement d’un effet placebo/nocebo du régime.
Plusieurs études ont rapporté une augmentation des taux d’IgG anti-gliadine (30-70 %) chez les patients souffrant d’une hypersensibilité au gluten non cœliaque par rapport à la population générale (2-8 %). La prévalence d’un haplotype HLA-DQ2 ou HLA-DQ8 serait un peu augmentée, soit environ 50 %, contre 40 % dans la population générale. La place de l’histologie est actuellement limitée, elle sert essentiellement à éliminer une maladie cœliaque. D’après plusieurs travaux, certains patients avec une HSGNC ont une lymphocytose intra-épithéliale (classification de Marsh I).
En tant qu’entité clinique individualisable, l’hypersensibilité au gluten non cœliaque est discutable. En effet, certains patients pourraient réagir à d’autres composants du blé comme les carbohydrates, les oligosaccharides fermentables, disaccharides, monosaccharides, et polyols (ou FODMAP) ou d’autres protéines du blé exerçant un effet pro-inflammatoire, les inhibiteurs de l’amylase-trypsine (ATI).
En cas de suspicion, un régime sans gluten peut être tenté pour une durée déterminée. En général, une éviction stricte n’est pas nécessaire : de petites quantités de gluten sont tolérées. Il convient de réévaluer régulièrement ce seuil de tolérance car, le plus souvent, l’enfant parvient progressivement à consommer du gluten en quantité « normale », ce qui lui évite un régime inutile et contraignant.
L’hypersensibilité non cœliaque encore débattue
L’intolérance au gluten de type maladie cœliaque est relativement fréquente chez le nourrisson et l’enfant. Indépendamment de sa forme digestive classique, avec altération de la croissance staturo-pondérale, elle doit être évoquée devant plusieurs situations cliniques. En cas de suspicion, un dosage des IgA totales et antitransglutaminase doit être réalisé en première intention. Pour confirmer le diagnostic, les biopsies digestives ne sont pas utiles si les antitransglutaminases sont supérieures ou égales à 10 fois la limite supérieure de la normale et si un second dosage révèle des IgA anti-endomysium positives. Dans les autres cas, une endoscopie digestive haute est nécessaire. Si la maladie cœliaque est confirmée, un régime sans gluten strict à vie doit être mis en place.
D’autres pathologies liées au gluten peuvent être observées chez le nourrisson et l’enfant : l’allergie IgE-médiée au blé, avec des signes cliniques immédiats après la prise de l’aliment, et l’hypersensibilité au gluten non cœliaque, diagnostic d’élimination dont l’entité clinique reste débattue.
D’autres pathologies liées au gluten peuvent être observées chez le nourrisson et l’enfant : l’allergie IgE-médiée au blé, avec des signes cliniques immédiats après la prise de l’aliment, et l’hypersensibilité au gluten non cœliaque, diagnostic d’élimination dont l’entité clinique reste débattue.
Références
1. Vriezinga SL, Auricchio R, Bravi E, Castillejo G, Chmielewska A, Crespo Escobar P, et al. Randomized feeding intervention in infants at high risk for celiac disease. N Engl J Med 2014;371:1304-15.
2. Lionetti E, Castellaneta S, Francavilla R, Pulvirenti A, Tonutti E, Amarri S, et al. Introduction of gluten, HLA status, and the risk of celiac disease in children. N Engl J Med 2014;371:1295-303.
3. Fewtrell M, Bronsky J, Campoy C, Domellöf M, Embleton N, Fidler Mis N, et al. Complementary feeding: A position paper by the European Society for Paediatric Gastroenterology, Hepatology, and Nutrition (ESPGHAN) committee on nutrition. J Pediatr Gastroenterol Nutr 2017;64:119-32.
4. Husby S, Koletzko S, Korponay-Szabo IR, Mearin ML, Phillips A, Shamir R, et al; ESPGHAN Working Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr 2012;54:136-60.
5. Husby S, Koletzko S, Korponay-Szabo I, Kurppa K, Mearin ML, Ribes-Koninckx C, et al. European Society Paediatric Gastroenterology, Hepatology and Nutrition guidelines for diagnosing coeliac disease 2020. J Pediatr Gastroenterol Nutr 2020;70:141-56.
6. Kansu A, Kuloglu Z, Demir A, Aytaç Yaman 1, Turkish Celiac Study Group. Yield of coeliac screening in abdominal pain-associated functional gastrointestinal system disorders. J Paediatr Child Health 2015;51:1066-70.
7. Jansen M, van Zelm M, Groeneweg M, Jaddoe V, Dik W, Schreurs M, et al. The identification of celiac disease in asymptomatic children: the Generation R Study. J Gastroenterol 2018;53:377-86.
8. Auricchio R, Tosco A, Piccolo E, Galatola M, Izzo V, Maglio M, et al. Potential celiac children: 9-year follow-up on a gluten-containing diet. Am J Gastroenterol 2014;109:913-21.
9. Cosnes J, Nion-Larmurier I. Complications of celiac disease. Pathol Biol 2013;61:e21-6.
10. Ricci G, Andreozzi L, Cipriani F, Giannetti A, Gallucci M, Caffarelli C. Wheat allergy in children: a comprehensive update. Medicina 2019;55:400.
11. Fasano A, Sapone A, Zevallos V, Schuppan D. Nonceliac gluten sensitivity. Gastroenterology 2015;148:1195-204.
2. Lionetti E, Castellaneta S, Francavilla R, Pulvirenti A, Tonutti E, Amarri S, et al. Introduction of gluten, HLA status, and the risk of celiac disease in children. N Engl J Med 2014;371:1295-303.
3. Fewtrell M, Bronsky J, Campoy C, Domellöf M, Embleton N, Fidler Mis N, et al. Complementary feeding: A position paper by the European Society for Paediatric Gastroenterology, Hepatology, and Nutrition (ESPGHAN) committee on nutrition. J Pediatr Gastroenterol Nutr 2017;64:119-32.
4. Husby S, Koletzko S, Korponay-Szabo IR, Mearin ML, Phillips A, Shamir R, et al; ESPGHAN Working Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr 2012;54:136-60.
5. Husby S, Koletzko S, Korponay-Szabo I, Kurppa K, Mearin ML, Ribes-Koninckx C, et al. European Society Paediatric Gastroenterology, Hepatology and Nutrition guidelines for diagnosing coeliac disease 2020. J Pediatr Gastroenterol Nutr 2020;70:141-56.
6. Kansu A, Kuloglu Z, Demir A, Aytaç Yaman 1, Turkish Celiac Study Group. Yield of coeliac screening in abdominal pain-associated functional gastrointestinal system disorders. J Paediatr Child Health 2015;51:1066-70.
7. Jansen M, van Zelm M, Groeneweg M, Jaddoe V, Dik W, Schreurs M, et al. The identification of celiac disease in asymptomatic children: the Generation R Study. J Gastroenterol 2018;53:377-86.
8. Auricchio R, Tosco A, Piccolo E, Galatola M, Izzo V, Maglio M, et al. Potential celiac children: 9-year follow-up on a gluten-containing diet. Am J Gastroenterol 2014;109:913-21.
9. Cosnes J, Nion-Larmurier I. Complications of celiac disease. Pathol Biol 2013;61:e21-6.
10. Ricci G, Andreozzi L, Cipriani F, Giannetti A, Gallucci M, Caffarelli C. Wheat allergy in children: a comprehensive update. Medicina 2019;55:400.
11. Fasano A, Sapone A, Zevallos V, Schuppan D. Nonceliac gluten sensitivity. Gastroenterology 2015;148:1195-204.