Le monoxyde de carbone est un gaz résultant d’une combustion incomplète de toute matière carbonée. Respirer ce gaz entraîne une intoxication grave voire létale qui est encore assez fréquente compte tenu d’une moindre méfiance de la population.
Survenant de façon probablement sporadique avant 1750, la fréquence des intoxications au monoxyde de carbone (CO) s’est accrue considérablement durant la révolution industrielle du XIXe siècle du fait de l’urbanisation rapide et de l’emploi du charbon pour la production de vapeur et le chauffage. L’abandon du gaz de houille au profit du gaz naturel dans les années 1960-1970 n’a pas entraîné la disparition de cette intoxication mais a sûrement diminué la méfiance de la population et la connaissance des médecins vis-à-vis de ce toxique.
Données épidémiologiques
L’intoxication au CO entraîne 50 000 visites annuelles dans les services d’urgence médicale aux États-Unis et 4 000 en Angleterre ; en France, on en compte annuellement 1 000 à 1 500. Toutes ces données sont sous-estimées,1 notamment par méconnaissance du diagnostic. En Europe, la plupart des intoxications sont accidentelles même si l’intoxication volontaire n’est pas exceptionnelle (gaz d’échappement dans un garage fermé, par exemple), et touchent toutes les classes d’âge.
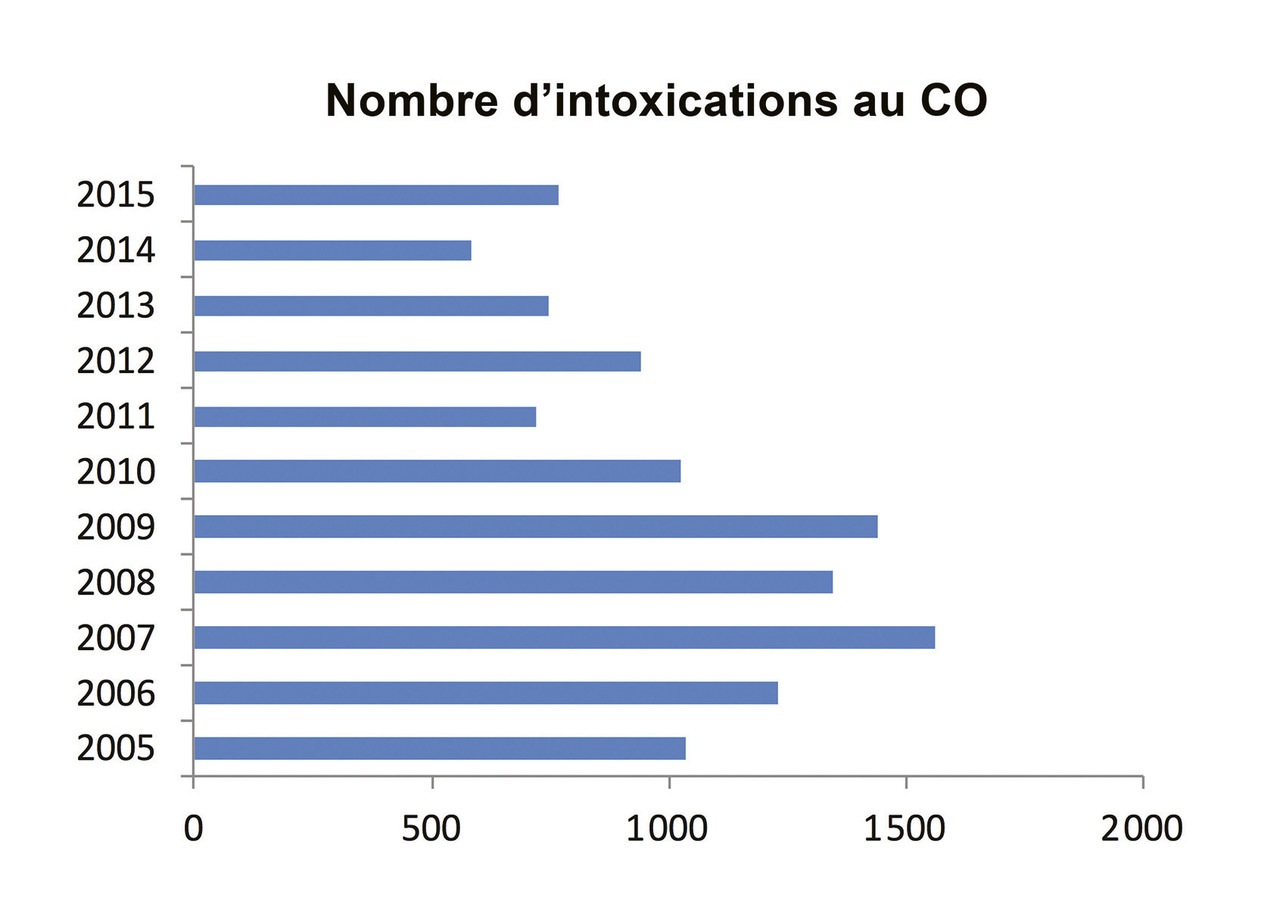
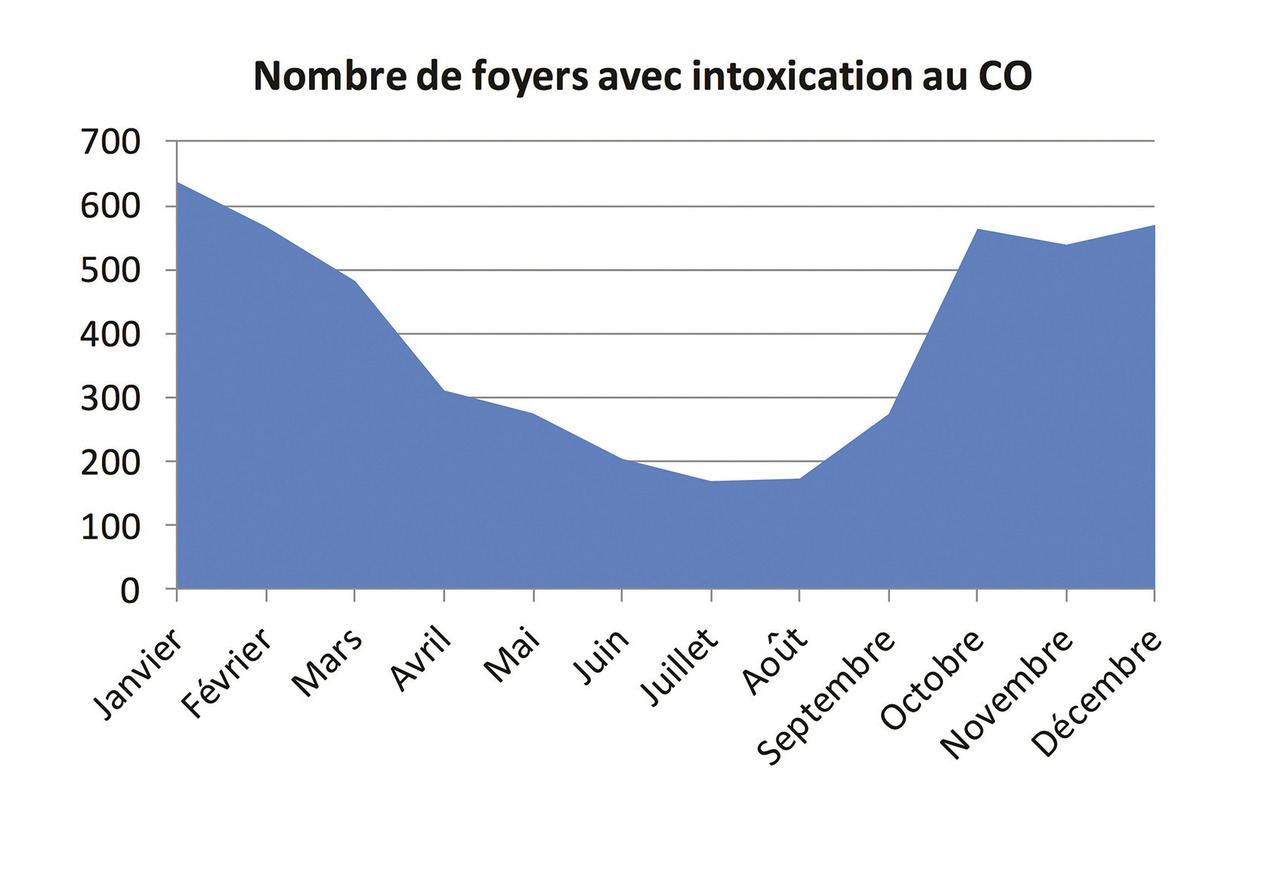
La région Nord-Pas-de-Calais connaissant un nombre particulièrement élevé d’intoxications au CO, un réseau de surveillance de ces intoxications a été mis en place dès 1986. C’est actuellement l’agence régionale de santé (ARS) qui collecte les données et coordonne les prises en charge. Ce réseau a permis une approche plus précise de l’épidémiologie de cette intoxication. D’après ce système de surveillance, le CO a été responsable ces 10 dernières années (2005-2015) de 11 404 intoxications (dont 2 478, soit 22,5 %, touchaient des enfants), réparties de manière homogène sur 10 ans mais avec une tendance à la diminution sur les 5 dernières années (fig. 1). Il existe une incidence bien plus importante les mois de chauffe, d’octobre à avril (fig. 2).
Le CO est responsable de 136 décès sur ces 10 ans. Il reste la première cause de décès par intoxication. Sur ces 136 décès, 83 (61 %) sont survenus à domicile ou avant l’admission à l’hôpital. Ce fait explique que les statistiques de mortalité hospitalière ne rendent que mal compte de la mortalité provoquée par le CO. L’origine des décès était accidentelle dans la grande majorité des cas, 76 sur 83 (92 %) et 54 (65 %) avaient comme origine un moyen de chauffage ou chauffe-eau défectueux, 23 (28 %) un incendie et 6 (7 %) seulement une origine suicidaire par inhalation de gaz d’échappement de voiture. Ces résultats sont très différents de ceux d’Amérique du Nord où l’origine des décès est en premier lieu le suicide, puis l’incendie.
La région Nord-Pas-de-Calais connaissant un nombre particulièrement élevé d’intoxications au CO, un réseau de surveillance de ces intoxications a été mis en place dès 1986. C’est actuellement l’agence régionale de santé (ARS) qui collecte les données et coordonne les prises en charge. Ce réseau a permis une approche plus précise de l’épidémiologie de cette intoxication. D’après ce système de surveillance, le CO a été responsable ces 10 dernières années (2005-2015) de 11 404 intoxications (dont 2 478, soit 22,5 %, touchaient des enfants), réparties de manière homogène sur 10 ans mais avec une tendance à la diminution sur les 5 dernières années (fig. 1). Il existe une incidence bien plus importante les mois de chauffe, d’octobre à avril (fig. 2).
Le CO est responsable de 136 décès sur ces 10 ans. Il reste la première cause de décès par intoxication. Sur ces 136 décès, 83 (61 %) sont survenus à domicile ou avant l’admission à l’hôpital. Ce fait explique que les statistiques de mortalité hospitalière ne rendent que mal compte de la mortalité provoquée par le CO. L’origine des décès était accidentelle dans la grande majorité des cas, 76 sur 83 (92 %) et 54 (65 %) avaient comme origine un moyen de chauffage ou chauffe-eau défectueux, 23 (28 %) un incendie et 6 (7 %) seulement une origine suicidaire par inhalation de gaz d’échappement de voiture. Ces résultats sont très différents de ceux d’Amérique du Nord où l’origine des décès est en premier lieu le suicide, puis l’incendie.
Source de monoxyde de carbone
Le CO est un gaz incolore, inodore et sans saveur (parfois appelé le « tueur silencieux ») qui provient de la combustion incomplète (par apport d’oxygène insuffisant) de matières carbonées. Dans les habitations, les principales sources de CO sont les foyers utilisant un combustible carboné (bois, charbon, gaz, pétrole...), que ce soit des appareils de chauffage, de production d’eau chaude, un four ou une cuisinière. La quantité de CO qui se dégage est influencée par l’apport d’air frais (ventilation) et l’évacuation des gaz brûlés. L’association d’une surproduction de CO par des appareils défectueux et d’une diminution de son évacuation/ventilation est majoritairement à l’origine des intoxications. De nombreuses résidences sont maintenant équipées d’un détecteur de CO, tout comme les pompiers qui portent sur eux des détecteurs et diagnostiquent ainsi rapidement une intoxication au CO.
Une affinité particulière pour l’hémoglobine
Le CO inhalé traverse facilement la membrane alvéolo-capillaire. Dans le sang, il est présent sous deux formes : dissous ou (majoritairement) fixé sur l’hémoglobine. L’hémoglobine a 250 fois plus d’affinité pour le CO que pour l’oxygène. La coopération allostérique des sous- unités de l’hémoglobine est alors compromise, expliquant un déplacement de la courbe de dissociation de l’O2 de l’hémoglobine vers la gauche (effet Haldane). Cela réalise une hypoxie « anémique ». Mais 10-15 % du CO se fixe en dehors du secteur vasculaire.2 En effet, dans les tissus, le CO se fixe sur toutes les autres protéines héminiques de l’organisme entraînant diverses manifestations toxiques. Ainsi le CO se fixe particulièrement : sur la myoglobine, entraînant une diminution du transport intracellulaire de l’oxygène au niveau des muscles squelettiques et myocardique avec pour conséquence potentielle une rhabdomyolyse et une défaillance myocardique ; et sur le cytochrome oxydase (cytochrome a3), bloquant la chaîne respiratoire mitochondriale et diminuant la production aérobie d’adénosine triphosphate (ATP).3 Le syndrome post-intervallaire (v. infra) pourrait être lié au stress oxydatif lié à cette atteinte cytopathique.4
L’inhibition des protéines héminiques persiste longtemps, restant proche de 50 % au 3e jour après une intoxication au CO même modérée (alors même que la carboxyhémoglobine [HbCO] est mesurée de 0 à 25 %).3
L’intoxication au CO exerce une action tissulaire délétère par :
– une diminution de la délivrance tissulaire en oxygène, liée à une baisse du contenu sanguin en oxygène par la formation de carboxyhémoglobine, une limitation du débit cardiaque liée à la formation de carboxymyoglobine et un déplacement vers la gauche de la courbe de dissociation de l’oxyhémoglobine ;
– une action cellulaire directe liée à la fixation du CO sur le cytochrome a3 entraînant une perturbation de l’utilisation de l’oxygène moléculaire et une diminution de la production d’énergie cellulaire ;
– des lésions survenant lors de la phase de réoxygénation, certaines identiques à celles des syndromes d’ischémie-reperfusion avec apparition d’une peroxydation lipidique cérébrale liée à une activation des polynucléaires neutrophiles et une agression endothéliale liée à la formation de péroxynitrite, et d’autres cellules avec augmentation de la libération de neurotransmetteurs, d’acides aminés excitateurs. Ces deux mécanismes peuvent mettre en route, dans certaines cellules vulnérables, les mécanismes apoptotiques qui sont responsables du syndrome post-intervallaire (v. infra).
L’inhibition des protéines héminiques persiste longtemps, restant proche de 50 % au 3e jour après une intoxication au CO même modérée (alors même que la carboxyhémoglobine [HbCO] est mesurée de 0 à 25 %).3
L’intoxication au CO exerce une action tissulaire délétère par :
– une diminution de la délivrance tissulaire en oxygène, liée à une baisse du contenu sanguin en oxygène par la formation de carboxyhémoglobine, une limitation du débit cardiaque liée à la formation de carboxymyoglobine et un déplacement vers la gauche de la courbe de dissociation de l’oxyhémoglobine ;
– une action cellulaire directe liée à la fixation du CO sur le cytochrome a3 entraînant une perturbation de l’utilisation de l’oxygène moléculaire et une diminution de la production d’énergie cellulaire ;
– des lésions survenant lors de la phase de réoxygénation, certaines identiques à celles des syndromes d’ischémie-reperfusion avec apparition d’une peroxydation lipidique cérébrale liée à une activation des polynucléaires neutrophiles et une agression endothéliale liée à la formation de péroxynitrite, et d’autres cellules avec augmentation de la libération de neurotransmetteurs, d’acides aminés excitateurs. Ces deux mécanismes peuvent mettre en route, dans certaines cellules vulnérables, les mécanismes apoptotiques qui sont responsables du syndrome post-intervallaire (v. infra).
Comment faire le diagnostic ?
Les atteintes neurologiques et cardiaques sont prédominantes dans les intoxications au CO et dépendent surtout de l’intensité et de la durée d’exposition. Les symptômes d’intoxication ne sont pas spécifiques. Graduellement, les symptômes neurologiques sont des céphalées, des myalgies, des vertiges, des désordres neuropsychologiques, une confusion, une perte de conscience et un coma. Au niveau cardiaque, les symptômes sont une douleur thoracique, un syndrome coronaire aigu, un choc cardiogénique jusqu’à un décès. L’intoxication chronique au CO est caractérisée par une fatigue, des problèmes émotionnels et des anomalies neurologiques diverses.
Le diagnostic d’intoxication au CO est clinique, fondé sur la présence de symptômes qui peuvent correspondre à cette intoxication, sur le contexte et si possible sur la mesure de la présence de CO. L’histoire clinique compatible avec une possible inhalation de CO est un élément déterminant du diagnostic. Ainsi, la présence à domicile d’une source probable et l’intoxication collective sont des arguments majeurs en faveur de ce diagnostic.
La certitude d’une exposition au CO peut être obtenue par une mesure locale à domicile, rendue possible par des détecteurs (présents sur place ou portés par les pompiers), par une mesure transcutanée du CO (mesure par oxymétrie de pouls de la saturation en CO grâce à certains appareils spécifiques), ou par une mesure sanguine de la carboxyhémoglobine. À noter que cette dernière peut être normale car la demi-vie de la carboxyhémoglobine est relativement courte et que, si le patient respire rapidement de l’oxygène, il peut arriver à l’hôpital avec des valeurs normales de carboxyhémoglobine. Cette dernière peut être mesurée sur oxymètre avec du sang artériel ou veineux. Dans la plupart des études cliniques, le diagnostic est posé devant une HbCO à plus de 5 % chez les non-fumeurs et plus de 10 % chez les fumeurs afin d’inclure seulement des diagnostics certains. Mais pour le diagnostic clinique habituel, une carboxyhémoglobine à 3 ou 4 % chez les non-fumeurs est déjà considérée comme anormale. Le taux d’HbCO n’est pas un facteur de risque fiable de morbidité.5
Il est possible de constater des lésions à l’imagerie cérébrale (tomodensitométrie ou imagerie par résonance magnétique [IRM]) mais ces lésions n’ont à ce stade aucun caractère pronostique et ne sont pas définitives.
Les manifestations retardées de l’intoxication au CO sont connues depuis longtemps. En effet, en 1973, une équipe a suivi 74 patients intoxiqués et a montré une détérioration neurologique grave chez 8 patients, des troubles de la personnalité chez 21 d’entre eux, des troubles de la mémoire chez 27 autres.6 Une autre étude publiée en 1976 notait 15 à 40 % de manifestations neuropsychiques secondaires après une intoxication au CO.7 Pour ces raisons, il est indispensable de mettre en place un traitement adéquat qui ait comme objectif premier non pas la survie car la mortalité hospitalière de l’intoxication au CO est faible, mais la diminution voire l’absence de manifestations neuropsychiques secondaires. Si ces complications à long terme surviennent souvent environ trois semaines après l’intoxication au CO, elles peuvent survenir du 3e au 240e jour après l’intoxication. Aucun signe clinique ou biologique ne permet de prédire l’apparition de ce syndrome post-intervallaire ; la réalisation d’explorations cliniques ou paracliniques systématiques dans ce contexte fait varier considérablement l’incidence de ce syndrome. En effet, certaines anomalies (troubles de l’attention, par exemple) peuvent ne pas être rattachées à ce syndrome si elles ne sont pas systématiquement recherchées. Seul l’âge supérieur à 60 ans et l’existence d’un trouble de conscience au cours de l’intoxication semblent être des facteurs de risque.8 Le syndrome post-intervallaire peut avoir comme signe clinique un syndrome parkinsonien, une dépression, une confusion, un coma prolongé, des troubles de la personnalité, de l’attention ou de la mémoire jusqu’à une démence. Ainsi toutes les études cliniques thérapeutiques choisissent (et devraient choisir) comme critère principal d’efficacité, une diminution du syndrome post-intervallaire.
Le diagnostic d’intoxication au CO est clinique, fondé sur la présence de symptômes qui peuvent correspondre à cette intoxication, sur le contexte et si possible sur la mesure de la présence de CO. L’histoire clinique compatible avec une possible inhalation de CO est un élément déterminant du diagnostic. Ainsi, la présence à domicile d’une source probable et l’intoxication collective sont des arguments majeurs en faveur de ce diagnostic.
La certitude d’une exposition au CO peut être obtenue par une mesure locale à domicile, rendue possible par des détecteurs (présents sur place ou portés par les pompiers), par une mesure transcutanée du CO (mesure par oxymétrie de pouls de la saturation en CO grâce à certains appareils spécifiques), ou par une mesure sanguine de la carboxyhémoglobine. À noter que cette dernière peut être normale car la demi-vie de la carboxyhémoglobine est relativement courte et que, si le patient respire rapidement de l’oxygène, il peut arriver à l’hôpital avec des valeurs normales de carboxyhémoglobine. Cette dernière peut être mesurée sur oxymètre avec du sang artériel ou veineux. Dans la plupart des études cliniques, le diagnostic est posé devant une HbCO à plus de 5 % chez les non-fumeurs et plus de 10 % chez les fumeurs afin d’inclure seulement des diagnostics certains. Mais pour le diagnostic clinique habituel, une carboxyhémoglobine à 3 ou 4 % chez les non-fumeurs est déjà considérée comme anormale. Le taux d’HbCO n’est pas un facteur de risque fiable de morbidité.5
Il est possible de constater des lésions à l’imagerie cérébrale (tomodensitométrie ou imagerie par résonance magnétique [IRM]) mais ces lésions n’ont à ce stade aucun caractère pronostique et ne sont pas définitives.
Les manifestations retardées de l’intoxication au CO sont connues depuis longtemps. En effet, en 1973, une équipe a suivi 74 patients intoxiqués et a montré une détérioration neurologique grave chez 8 patients, des troubles de la personnalité chez 21 d’entre eux, des troubles de la mémoire chez 27 autres.6 Une autre étude publiée en 1976 notait 15 à 40 % de manifestations neuropsychiques secondaires après une intoxication au CO.7 Pour ces raisons, il est indispensable de mettre en place un traitement adéquat qui ait comme objectif premier non pas la survie car la mortalité hospitalière de l’intoxication au CO est faible, mais la diminution voire l’absence de manifestations neuropsychiques secondaires. Si ces complications à long terme surviennent souvent environ trois semaines après l’intoxication au CO, elles peuvent survenir du 3e au 240e jour après l’intoxication. Aucun signe clinique ou biologique ne permet de prédire l’apparition de ce syndrome post-intervallaire ; la réalisation d’explorations cliniques ou paracliniques systématiques dans ce contexte fait varier considérablement l’incidence de ce syndrome. En effet, certaines anomalies (troubles de l’attention, par exemple) peuvent ne pas être rattachées à ce syndrome si elles ne sont pas systématiquement recherchées. Seul l’âge supérieur à 60 ans et l’existence d’un trouble de conscience au cours de l’intoxication semblent être des facteurs de risque.8 Le syndrome post-intervallaire peut avoir comme signe clinique un syndrome parkinsonien, une dépression, une confusion, un coma prolongé, des troubles de la personnalité, de l’attention ou de la mémoire jusqu’à une démence. Ainsi toutes les études cliniques thérapeutiques choisissent (et devraient choisir) comme critère principal d’efficacité, une diminution du syndrome post-intervallaire.
Quelle prise en charge ?
Quelle problématique ?
La dissociation des complexes CO- hémoprotéines suit la loi d’action de masse. Les vitesses de dissociation ne dépendent donc que de la proportion d’oxygène, de CO, de protéines et de leurs affinités relatives. Ainsi, retirer le patient de l’atmosphère toxique pour éliminer le CO de l’air inspiré et administrer de l’oxygène sont les deux mesures thérapeutiques fondamentales. La dissociation de la carboxyhémoglobine débute dès que le patient est retiré de l’atmosphère toxique. Elle suit une loi exponentielle avec une demi-vie de 230 à 320 minutes en air ambiant.9 Les vitesses de dissociation des autres complexes CO-hémoprotéines sont moins bien connues mais sont beaucoup plus lentes puisqu’elles dépendent de la quantité d’oxygène arrivant aux tissus qui dépend elle-même de la quantité de carboxyhémoglobine restante. Des auteurs ont montré que l’inhibition du cytochrome a3 mitochondrial atteignait 76 % lors de la phase aiguë d’intoxications au CO pourtant modérées (HbCO entre 0 et 25 %) et qu’elle persistait encore à 48 % au 3e jour.3 Cette inhibition, présente alors même que la carboxyhémoglobine est redevenue normale, pourrait expliquer la persistance de manifestations cliniques.
Prise en charge immédiate
Devant toute suspicion d’intoxication au CO, la première mesure urgente est l’arrêt immédiat de la source potentielle, et l’éviction immédiate du patient du milieu toxique. La protection des sauveteurs est indispensable car des taux élevés de CO dans l’air les mettent devant un risque personnel. On doit évaluer très rapidement l’urgence de la situation afin d’optimiser la prise en charge en évaluant la condition cardiorespiratoire et l’état neurologique (conscience, réponse motrice à la stimulation, réactivité). Une réanimation spécialisée est parfois nécessaire avec intubation-ventilation du patient et drogues inotropes, voire réanimation d’un arrêt cardiorespiratoire. Si le tableau clinique est compatible avec une intoxication au CO, on administre de l’oxygène au patient soit avec un masque à haute concentration, soit en ventilation contrôlée avec une fraction inspirée d’oxygène à 1. Le patient est ensuite amené vers un service d’urgences hospitalier. Si d’emblée il existe une indication d’oxygénothérapie hyperbare, le patient est transporté médicalement jusqu’au centre hyperbare le plus proche. Il est également nécessaire de s’enquérir de la présence d’autres victimes.
Dans le service d’urgences
Arrivé à l’hôpital, on réalise rapidement le diagnostic de l’intoxication au CO en précisant les circonstances d’intoxication, en vérifiant que le tableau clinique est compatible, et en mesurant si nécessaire la carboxyhémoglobine (v. supra). Les premiers traitements symptomatiques et curatifs sont poursuivis (remplissage vasculaire et drogues inotropes si besoin et oxygénothérapie normobare). Le patient est rapidement pris en charge en oxygénothérapie hyperbare si le bilan initial confirme sa nécessité.
Oxygénothérapie hyperbare
L’oxygénothérapie hyperbare permet une normalisation immédiate de la délivrance périphérique en oxygène par augmentation très rapide du contenu sanguin en oxygène. La carboxy- hémoglobine est dissociée progressivement dès l’arrêt de l’exposition. Cette dissociation se fait de manière exponentielle avec une demi-vie de 230 à 320 minutes en air ambiant, 90 minutes en oxygène pur, 35 minutes en oxygène pur à 2 atmosphères et 22 minutes en oxygène pur à 3 atmosphères. La dissociation avec les autres hémoprotéines se fait de manière plus lente car elle dépend de la quantité d’oxygène délivrée au tissu. L’hémoglobine est donc d’abord détoxifiée avant les autres hémoprotéines. C’est lorsque la délivrance périphérique en oxygène devient satisfaisante que la dissociation des autres carboxyprotéines commence. Ce retard à la détoxication des autres hémoprotéines par rapport à l’hémoglobine explique la persistance de signes cliniques alors même que la carboxyhémoglobine est négative. L’oxygénothérapie hyperbare permet au cytochrome a3 de reprendre une forme fonctionnelle avec remise en fonction de la chaîne respiratoire mitochondriale. De plus, l’oxygénothérapie hyperbare diminue les lésions vasculaires liées à l’ischémie-reperfusion.
Les indications de l’oxygénothérapie hyperbare dans l’intoxication au CO ont été longtemps débattues à travers les études. Les conclusions récentes de la conférence de consensus européenne de 2016 ont retenu comme indication de traitement par l’oxygénothérapie hyperbare toute intoxication au CO symptomatique, notamment les pertes de connaissance initiales.10 Cela reste vrai même si les symptômes ont disparu car le but de ce traitement est de détoxifier plus rapidement les cytochromes a3 et donc d’éviter la survenue d’un syndrome post- intervallaire, qui est loin d’être systématiquement réversible.
Les indications de l’oxygénothérapie hyperbare dans l’intoxication au CO ont été longtemps débattues à travers les études. Les conclusions récentes de la conférence de consensus européenne de 2016 ont retenu comme indication de traitement par l’oxygénothérapie hyperbare toute intoxication au CO symptomatique, notamment les pertes de connaissance initiales.10 Cela reste vrai même si les symptômes ont disparu car le but de ce traitement est de détoxifier plus rapidement les cytochromes a3 et donc d’éviter la survenue d’un syndrome post- intervallaire, qui est loin d’être systématiquement réversible.
Prévention des récidives
L’intoxication au CO est souvent accidentelle, raison pour laquelle une prévention secondaire est indispensable. En effet, il existe de nombreuses récidives (environ 5 % des patients intoxiqués). Ces mesures préventives sont réalisées à différents niveaux :
– au niveau du patient ; il est nécessaire de l’informer sur la gravité de l’intoxication et la possibilité de développement d’un syndrome post- intervallaire, mais il faut également l’informer sur la manière de dépister et d’éviter ces intoxications au CO ;
– une enquête technique doit être réalisée quant à la source de l’intoxication au CO ; une enquête est donc réalisée par un ingénieur sanitaire de l’ARS, cette enquête permet également de déclencher les services sociaux si nécessaire ;
– au niveau des autorités sanitaires, le signalement est obligatoire auprès de l’ARS et du centre antipoison régional, permettant une réadaptation des dispositifs préventifs en fonction des données épidémiologiques recueillies.
– au niveau du patient ; il est nécessaire de l’informer sur la gravité de l’intoxication et la possibilité de développement d’un syndrome post- intervallaire, mais il faut également l’informer sur la manière de dépister et d’éviter ces intoxications au CO ;
– une enquête technique doit être réalisée quant à la source de l’intoxication au CO ; une enquête est donc réalisée par un ingénieur sanitaire de l’ARS, cette enquête permet également de déclencher les services sociaux si nécessaire ;
– au niveau des autorités sanitaires, le signalement est obligatoire auprès de l’ARS et du centre antipoison régional, permettant une réadaptation des dispositifs préventifs en fonction des données épidémiologiques recueillies.
À distance
Des évolutions défavorables tardives, appelées syndrome post-intervallaire, peuvent survenir avec des troubles de la mémorisation, une dépression, une anxiété, des difficultés à calculer, des problèmes vestibulaires ou moteurs. Les séquelles cognitives suivant une intoxication au CO sont fréquentes. Il est aussi reconnu que les intoxications au CO peuvent précipiter une entrée en démence de patients âgés.
Tous les patients victimes d’une intoxication au CO doivent être vus cliniquement 1 mois et 3 mois après l’événement afin d’opérer une réévaluation notamment neurologique. Il est fréquent que les patients ayant des signes cliniques cardiaques nécessitent par la suite une véritable évaluation cardiaque car l’intoxication au CO peut révéler des atteintes coronariennes non connues précédemment.
Différentes anomalies cérébrales ont été retrouvées par les techniques d’imagerie : tomodensitométrie, résonance magnétique nucléaire et tomographie d’émission de positons. L’IRM joue un rôle central dans l’évaluation des séquelles d’une intoxication au CO. Elle montre des lésions dans des zones particulièrement vulnérables du cerveau comme le cortex cérébral, l’hippocampe, les noyaux gris centraux et le cervelet. Les lésions du globus pallidus sont classiques et généralement vues à ce stade d’une intoxication au CO.
Tous les patients victimes d’une intoxication au CO doivent être vus cliniquement 1 mois et 3 mois après l’événement afin d’opérer une réévaluation notamment neurologique. Il est fréquent que les patients ayant des signes cliniques cardiaques nécessitent par la suite une véritable évaluation cardiaque car l’intoxication au CO peut révéler des atteintes coronariennes non connues précédemment.
Différentes anomalies cérébrales ont été retrouvées par les techniques d’imagerie : tomodensitométrie, résonance magnétique nucléaire et tomographie d’émission de positons. L’IRM joue un rôle central dans l’évaluation des séquelles d’une intoxication au CO. Elle montre des lésions dans des zones particulièrement vulnérables du cerveau comme le cortex cérébral, l’hippocampe, les noyaux gris centraux et le cervelet. Les lésions du globus pallidus sont classiques et généralement vues à ce stade d’une intoxication au CO.
Cas particulier de la femme enceinte
L’intoxication au CO est extrêmement grave pour le fœtus car l’état clinique de la mère ne présage absolument pas de l’état clinique du fœtus. Dans notre expérience, nous avons montré que l’intoxication au CO multiplie par 4 le risque de mort fœtale in utero. L’extrême gravité de cette intoxication sur le fœtus est liée à plusieurs items physiopathologiques. D’une part, le CO diffuse à travers la barrière placentaire tout comme l’oxygène. Seulement ce dernier doit d’abord franchir la barrière placentaire pour que l’élimination du CO fœtal commence. Il existe donc un retard à la détoxification du fœtus par rapport à celle de la mère. De plus, l’hémoglobine fœtale est beaucoup plus affine que l’hémoglobine adulte pour le CO. Enfin, l’hypoxie fœtale est beaucoup plus marquée, entraînant une fixation du CO sur les hémoprotéines plus importante. Comme il est impossible d’évaluer précisément la gravité de l’intoxication fœtale au CO, il est recommandé de réaliser une séance d’oxygénothérapie hyperbare chez toute femme enceinte exposée au CO (conférence européenne de consensus Lille 2016).10 V
Références
1. Ghosh RE, Close R, McCann LJ, et al. Analysis of hospital admissions due to accidental non-fire-related carbon monoxide poisoning in England, between 2001 and 2010. J Public Health 2016;38:76-83.
2. Luomanmäki K, Coburn RF. Effects of metabolism and distribution of carbon monoxide on blood and body stores. Am J Physiol 1969;217:354-63.
3. Miró O, Casademont J, Barrientos A, et al. Mitochondrial cytochrome c oxidase inhibition during acute carbon monoxide poisoning. Pharmacol Toxicol 1998;82:199-202.
4. Garrabou G, Inoriza JM, Morén C, et al. Mitochondrial injury in human acute carbon monoxide poisoning: the effect of oxygen treatment. J Environ Sci Health Part C Environ Carcinog Ecotoxicol Rev 2011;29:32-51.
5. Hampson NB, Piantadosi CA, Thom SR, et al. Practice recommendations in the diagnosis, management, and prevention of carbon monoxide poisoning. Am J Respir Crit Care Med 2012;186:1095-101.
6. Smith JS, Brandon S. Morbidity from acute carbon monoxide poisoning at three-year follow-up. Br Med J 1973;1:318-21.
7. Ginsberg R, Romano J. Carbon monoxide encephalopathy: need for appropriate treatment. Am J Psychiatry 1976;133:317-20.
8. Mathieu D, Nolf M, Durocher A, et al. Acute carbon monoxide poisoning. Risk of late sequelae and treatment by hyperbaric oxygen. J Toxicol Clin Toxicol 1985;23:315-24.
9. Pace N, Strajman E, Walker EL. Acceleration of carbon monoxide elimination in man by high pressure oxygen. Science 1950;111:652-4.
10. Mathieu D, Marroni A, Kot J. Tenth European Consensus Conference on Hyperbaric Medicine: recommendations for accepted and non-accepted clinical indications and practice of hyperbaric oxygen treatment. Diving Hyperb Med 2017;47:24-32.
2. Luomanmäki K, Coburn RF. Effects of metabolism and distribution of carbon monoxide on blood and body stores. Am J Physiol 1969;217:354-63.
3. Miró O, Casademont J, Barrientos A, et al. Mitochondrial cytochrome c oxidase inhibition during acute carbon monoxide poisoning. Pharmacol Toxicol 1998;82:199-202.
4. Garrabou G, Inoriza JM, Morén C, et al. Mitochondrial injury in human acute carbon monoxide poisoning: the effect of oxygen treatment. J Environ Sci Health Part C Environ Carcinog Ecotoxicol Rev 2011;29:32-51.
5. Hampson NB, Piantadosi CA, Thom SR, et al. Practice recommendations in the diagnosis, management, and prevention of carbon monoxide poisoning. Am J Respir Crit Care Med 2012;186:1095-101.
6. Smith JS, Brandon S. Morbidity from acute carbon monoxide poisoning at three-year follow-up. Br Med J 1973;1:318-21.
7. Ginsberg R, Romano J. Carbon monoxide encephalopathy: need for appropriate treatment. Am J Psychiatry 1976;133:317-20.
8. Mathieu D, Nolf M, Durocher A, et al. Acute carbon monoxide poisoning. Risk of late sequelae and treatment by hyperbaric oxygen. J Toxicol Clin Toxicol 1985;23:315-24.
9. Pace N, Strajman E, Walker EL. Acceleration of carbon monoxide elimination in man by high pressure oxygen. Science 1950;111:652-4.
10. Mathieu D, Marroni A, Kot J. Tenth European Consensus Conference on Hyperbaric Medicine: recommendations for accepted and non-accepted clinical indications and practice of hyperbaric oxygen treatment. Diving Hyperb Med 2017;47:24-32.