Dues à l’exposition chronique aux rayons UV, les kératoses actiniques – fréquentes après 70 ans – ont un risque non négligeable de transformation en carcinome épidermoïde. La prise en charge est assez simple et ne nécessite pas systématiquement un avis dermatologique. Ce qu’il faut savoir.
Bien qu’il n’existe pas de données épidémiologiques précises sur les kératoses actiniques (KA) ou solaires en France, on estime leur prévalence à 3-5 millions d’individus, chiffre qui devrait augmenter avec le vieillissement de la population, l’âge moyen d’apparition étant environ 70 ans. La prise en charge est assez simple et ne nécessite pas systématiquement un avis dermatologique, d’autant que les patients concernés seront de plus en plus nombreux…
Sous le soleil, exactement…
Le facteur étiologique majeur est l’exposition répétée aux UV, générant des radicaux libres, source d’agression de l’ADN kératinocytaire. Avec l’âge, le système de réparation de l’ADN devient moins efficace, laissant survenir des mutations responsables du développement de kératinocytes atypiques. Ce risque est cumulatif, l’exposition solaire répétée dans l’enfance et l’adolescence participe donc grandement à la survenue des KA de la personne âgée. Autres facteurs de risque : phototype clair, âge, sexe masculin et immunodépression (en particulier pour les patients greffés). Elles sont considérées comme des carcinomes in situ1 et leur devenir est imprévisible : un faible nombre (entre 5 et 20 %) peut régresser spontanément, en particulier dans les premiers mois, mais la plupart récidivent et évoluent parfois vers un carcinome épidermoïde invasif. On estime que plus de 50 % des carcinomes invasifs se sont développés à partir d’une KA.
Croûtes superficielles
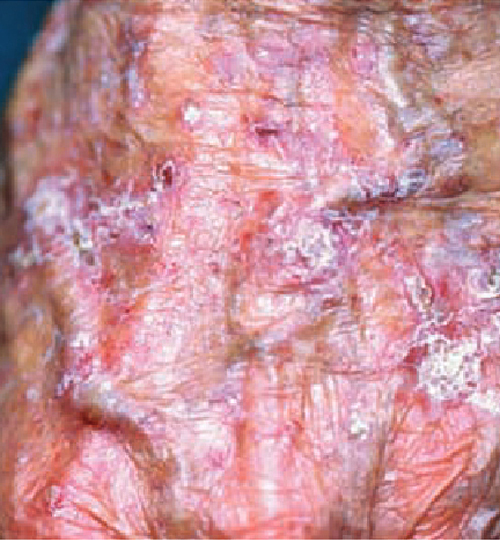
Les lésions siègent sur les zones les plus photo-exposées : visage, hélix, dos des mains (fig. 1) et cuir chevelu chez les patients avec calvitie.
Elles sont millimétriques, non infiltrées, parfois érythémateuses, recouvertes de squames jaunâtres ou de petites croûtes. Leur détection nécessite un examen visuel attentif. Le toucher du tégument vise à repérer les lésions rugueuses couleur peau. Le patient les décrit comme une croûte parfois saignante qui ne cicatrise pas. Il ne faut pas hésiter à la retirer pour évaluer l’extension.
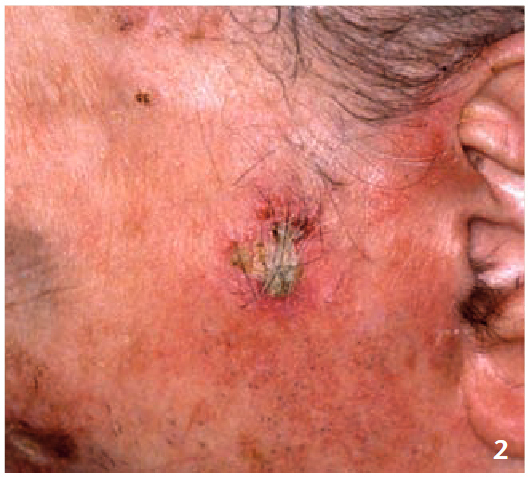
Une KA est superficielle. Creusante ou infiltrée, elle impose une biopsie pour éliminer un carcinome épidermoïde sous-jacent (fig. 2). Examiner l’ensemble du tégument est primordial. En effet, un patient peut avoir des KA multifocales, sur tous les sites photo-exposés. L’exemple classique est celui du sujet chauve consultant pour des KA multiples du cuir chevelu : l’examen en révèle souvent d’autres sur les dos des mains, non remarquées par le patient.
Options thérapeutiques
La cryothérapie par azote liquide consiste en l’application d’azote refroidi à – 200 °C à l’aide d’un coton-tige ou d’un cryospray pendant 20 à 30 secondes en 2 ou 3 applications espacées de 15 jours. C’est le choc thermique qui détruit les cellules.
Les traitements topiques sont des agents cytotoxiques qui induisent une forte réponse inflammatoire via la libération de cytokines. Il s’agit principalement du 5-fluorouracil 5 % crème (Efudix), application biquotidienne pendant 4 semaines ; de l’imiquimod 5 % crème (Aldara) 1 fois par jour, 3 fois par semaine pendant 4 semaines.
La photothérapie dynamique conventionnelle (PDT) se déroule en deux temps au cours d’une même journée : application d’une crème photosensibilisante en couche mince sous occlusion pendant 3 heures puis séance d’illumination avec une lampe à LED, et ce durant 7 à 15 minutes. Une séance peut être suffisante, renouvelable si besoin 1 mois plus tard.
Son principe est la photosensibilisation sélective : une fois la crème appliquée, les molécules photosensibilisantes (porphyrines) pénètrent dans l’épiderme et s’accumulent préférentiellement dans les kératinocytes atypiques. Puis la zone à traiter est illuminée par une source lumineuse dont la longueur d’onde correspond à celle du spectre d’absorption des porphyrines. L’énergie lumineuse entraîne la destruction des cellules tumorales. Les résultats de la PDT sont le plus souvent excellents sous réserve d’avoir au préalable réduit au maximum l’hyperkératose (application d’émollients durant les 5 jours précédents).
Lorsqu’elle est réalisée avec une lampe (PDT dite conventionnelle), elle a largement prouvé son efficacité, mais son utilisation est limitée par la nécessité de disposer d’une lampe à LED et par la sensation de brûlure lors de l’illumination, qui peut amener à interrompre précocement la séance.
La PDT en lumière naturelle, en remplacement de la lampe, a l’avantage d’être moins douloureuse et plus rapide (pas d’occlusion préalable), mais elle a quelques contraintes météorologiques.
D’autres traitements moins souvent utilisés ont montré leur efficacité : diclofénac topique 3 % (Solaraze), lasers CO2 et Er:YAG.
Quel que soit le traitement employé, il s’ensuit une inflammation locale d’intensité variable, attendue et souhaitée, reflet de la nécrose des kératinocytes atypiques. Cette réaction doit être expliquée au patient, ainsi que ses modalités de prise en charge : nettoyage au savon doux et application d’une crème cicatrisante (Cicabio, Cicaplast ou vaseline simple) qui permet de réduire les complications. On peut espacer les administrations d’Aldara ou d’Efudix en cas de mauvaise tolérance, avec par exemple un schéma 1 jour sur 2 voire 3 fois par semaine. Dans de rares cas, l’inflammation cutanée peut être très marquée et source de surinfection, le patient doit donc être averti de la nécessité de consulter si elle persiste au-delà de 5 jours ou en cas d’apparition de pustules.
Quel traitement pour quel patient ?
Le choix est fonction de l’étendue lésionnelle (tableau). Les recommandations actuelles en distinguent 2 types :2
– atteinte pauci-lésionnelle : entre 1 et 5 KA par zone de traitement* ;
– lésions multiples : plus de 5 KA distinctes par zone de traitement* ou bien présence d’un champ de cancérisation,3 lésions précancéreuses non cliniquement identifiables, localisées en périphérie de KA, siégeant sur une peau endommagée par le soleil (héliodermie, hyperkératose).
* Une zone de traitement représente une surface d’environ 25 cm2, soit le dos d’une main ou le front par exemple.
Une combinaison de traitements est parfois nécessaire. Pour désépaissir une KA avant PDT, on peut commencer par un topique (Efudix ou Aldara). Quelques lésions bien individualisées récidivantes peuvent être traitées par azote liquide puis avec un topique (avec un intervalle de 1 mois pour limiter l’inflammation). Le terrain (observance, état général, fonctions cognitives) ainsi que les moyens matériels disponibles participent au choix thérapeutique.
Chez les immunodéprimés, le risque de transformation en carcinome épidermoïde invasif est accru. Les recommandations sont similaires à celles des immunocompétents mais une surveillance plus rapprochée est préconisée, ainsi que la réalisation précoce de biopsie(s) en cas de persistance des lésions ou de majoration de l’infiltration malgré un traitement bien mené.
L’efficacité s’évalue dans les 6 mois, si possible au 3e mois. Une bonne réponse est définie par une diminution d’au moins 75 % du nombre et de l’épaisseur des KA. Il est très fréquent qu’un traitement unique ne soit pas suffisant pour les éradiquer, on peut alors le répéter, ou choisir une deuxième ligne.
En cas de changement d’aspect après un premier cycle thérapeutique avec majoration de la taille et/ou épaississement, il est conseillé de biopsier pour ne pas méconnaître un carcinome épidermoïde.
Suivi et prévention
Quel que soit le traitement entrepris, les récidives ou la survenue de nouvelles KA sont très fréquentes.Un suivi régulier est donc recommandé, dont le rythme dépend du nombre de KA, des antécédents de carcinomes épidermoïdes et bien sûr du terrain. La survenue de kératoses est la résultante de nombreuses années d’exposition solaire. Cette notion d’exposition cumulative doit être expliquée au patient qui ne comprend pas toujours pourquoi les KA récidivent alors qu’il a stoppé toute exposition solaire. Une éducation à la photoprotection doit être initiée dès la première consultation puis rappelée à chaque fois : ne pas s’exposer durant les heures ensoleillées ; insister sur le fait que la photoprotection la plus efficace et sans impact écologique délétère, c’est la protection vestimentaire : manches longues et chapeau (plutôt que casquette). Les crèmes solaires avec indice élevé (SPF 50 +) viennent en complément sur les zones qui ne peuvent pas être couvertes ; leur efficacité n’est optimale qu’en cas d’application régulièrement renouvelée.
Terrains à risque : une surveillance plus rapprochée
Les patients de phototype clair ayant une immunodépression sont à haut risque de KA et plus globalement de carcinomes cutanés. Ce risque est particulièrement élevé chez les patients greffés d’organes ou ceux ayant une hémopathie et il augmente au fil des années. Ces patients sont également plus à risque d’avoir des KA transformées en carcinomes épidermoïdes cutanés. Un suivi plus rapproché, entre 6 et 12 mois, peut alors être proposé.
L’essentiel
- Les kératoses actiniques siègent sur des zones photo-exposées et sont souvent associées à d’autres carcinomes cutanés.
- Le traitement précoce prévient dans la majorité des cas l’évolution vers un carcinome épidermoïde invasif. Le choix est fonction de l’étendue lésionnelle et du terrain.
- Une surveillance annuelle est préconisée pour les patients aux antécédents de KA.
- En cas de doute sur un contingent invasif, une biopsie s’impose.
Le présent article est une mise à jour de ce texte publié en 2016 dans La Revue du Praticien Médecine Générale : Brunet-Possenti F, Descamps V. Kératoses actiniques. Rev Prat Med Gen 2016;30(957):206-7.
Références :
1. Röwert-Huber J, Patel MJ, Forschner T, et al. Actinic keratosis is an early in situ squamous cell carcinoma: a proposal for reclassification. Br J Dermatol 2007;156(suppl 3):8-12.
2. Werner RN, Jacobs A, Rosumeck S, et al. Methods and Results Report – Evidence and consensus-based (S3) Guidelines for the Treatment of Actinic Keratosis – International League of Dermatological Societies in coopera- tion with the European Dermatology Forum. J Eur Acad Dermatol Venereol 2015;29:e1-66.
3. Szeimies RM, Torezan L, Niwa A, et al. Clinical, histopathological and immunohistochemical assessment of human skin field cancerization before and after photodynamic therapy. Br J Dermatol 2012;167:150-9.

 Encadrés
Encadrés