Elle sévit toujours dans les pays tropicaux.
Par Patrice Bourée1, 2, Yves Cazal2, Clément Tabard2,Dalila Mohand-Ouassaïd3
1. Institut Alfred-Fournier ; service de parasitologie- mycologie, hôpital Cochin, AP-HP, 75014 Paris.patrice.bouree@aphp.fr 2. Hôpital de Dzaoudzi, 97615 Dzaoudzi, Mayotte. 3. Consultation lèpre, Mayotte.
Autrefois cosmopolite, elle a quasiment disparu des pays industria-lisés mais persiste en zone tropicale (Afrique, Amérique latine et Asie ; tableau 1) ; 17 pays concentrent 94 % des cas, particulièrement l’Inde, l’Indonésie et le Brésil.
Si la prévalence a beaucoup diminué depuis 1990 (environ 200 000 cas mon-diaux en 2016), l’incidence a peu varié ces 10 dernières années. Les cas français sont recensés parmi les migrants des zones d’endémie (Afrique, Asie, Amérique latine) et les citoyens des DOM-TOM, en particulier à Mayotte où la prévalence reste élevée : 6,2 pour 10 000 habitants en 20081, 3,11 pour 10 000 en 2015. Parmi les 475 nouveaux cas diagnostiqués depuis 10 ans, 212 sont paucibacillaires (PB) et 246 multi-bacillaires (MB) ; 63 % des patients sont d’origine comorienne.2
1. Institut Alfred-Fournier ; service de parasitologie- mycologie, hôpital Cochin, AP-HP, 75014 Paris.
Autrefois cosmopolite, elle a quasiment disparu des pays industria-lisés mais persiste en zone tropicale (Afrique, Amérique latine et Asie ; tableau 1) ; 17 pays concentrent 94 % des cas, particulièrement l’Inde, l’Indonésie et le Brésil.
Si la prévalence a beaucoup diminué depuis 1990 (environ 200 000 cas mon-diaux en 2016), l’incidence a peu varié ces 10 dernières années. Les cas français sont recensés parmi les migrants des zones d’endémie (Afrique, Asie, Amérique latine) et les citoyens des DOM-TOM, en particulier à Mayotte où la prévalence reste élevée : 6,2 pour 10 000 habitants en 20081, 3,11 pour 10 000 en 2015. Parmi les 475 nouveaux cas diagnostiqués depuis 10 ans, 212 sont paucibacillaires (PB) et 246 multi-bacillaires (MB) ; 63 % des patients sont d’origine comorienne.2
Bacille de Hansen
La lèpre concerne tous les âges ; sa prévalence varie de 0,3 % à 38 % chez les enfants selon les pays, avec un sex-ratio H/F de 2/1 et une infestation le plus souvent pauci-bacillaire, comme en Inde. Le réservoir de Mycobaterium leprae est l’homme. La contamination s’effectue par contact proche avec un sujet lépromateux qui excrète des bacilles dans les sécrétions nasales. La pénétration s’effectuerait essentiellement par les voies aériennes supérieures, éventuellement par effraction cutanée. La protection contre M. leprae dépend de l’immunité à médiation cellulaire, qui oriente l’évolution vers une forme clinique. La maladie n’apparaît que chez 5 % des sujets en contact : sous forme tuberculoïde s’ils ont une bonne immunité (60 %), ou lépromateuse dans le cas contraire.
Mycobacterium leprae, germe intracellulaire, acido-alcoolo-résistant, à multiplication lente, ne se cultive pas in vitro. Dans un frottis de sérosité dermique, les bacilles apparaissent sous forme de bâtonnets de 1 à 8 x 0,3 μ, isolés ou en amas, appelés « globi » ; 90 % de leurs gènes sont communs avec Mycobacterium tuberculosis.
La PCR permet non seulement de détecter M. leprae mais aussi de tester sa résistance aux différents traitements.
Mycobacterium leprae, germe intracellulaire, acido-alcoolo-résistant, à multiplication lente, ne se cultive pas in vitro. Dans un frottis de sérosité dermique, les bacilles apparaissent sous forme de bâtonnets de 1 à 8 x 0,3 μ, isolés ou en amas, appelés « globi » ; 90 % de leurs gènes sont communs avec Mycobacterium tuberculosis.
La PCR permet non seulement de détecter M. leprae mais aussi de tester sa résistance aux différents traitements.
Formes cliniques
La maladie se manifeste sous 2 formes « polaires » : tuberculoïde ou lépromateuse avec plusieurs formes de transition dites « borderline ».
Le stade initial ou lèpre indéterminée, visible surtout chez l’enfant, se manifeste par une tache cutanée légèrement hypochrome, de quelques centimètres de diamètre, à limites floues, avec de très légers troubles de la sensibilité. Elle disparaît spontanément dans la majorité des cas, ou évolue vers une forme polaire selon l’état immun.
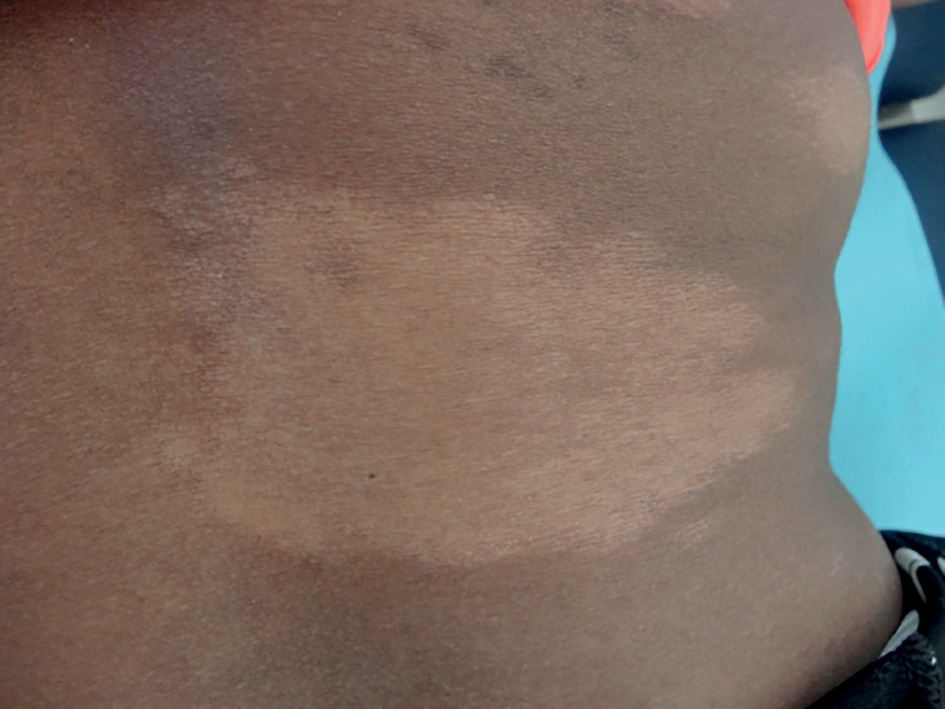
Dans la lèpre tuberculoïde, quelques macules cutanées, de plusieurs centimètres de diamètre, hypochromes, à limites nettes et de répartition asymétrique (fig. 1), toujours anesthésiques, disparaissent sans cicatrice si le traitement est précoce. Diagnostic différentiel : vitiligo, mycose.3
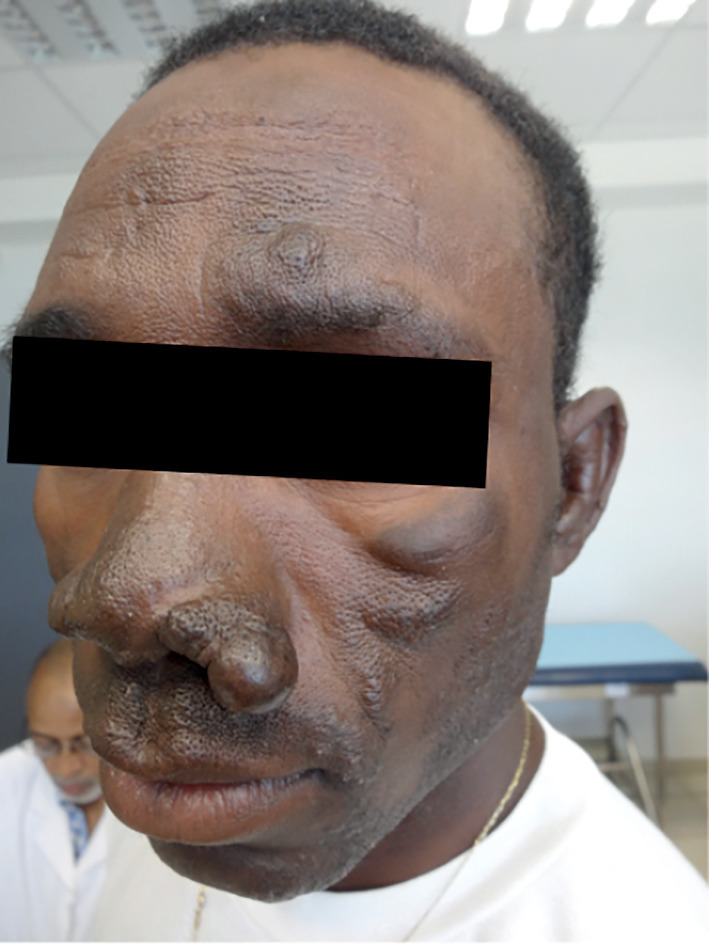
La lèpre lépromateuse doit être évoquée devant des lésions maculeuses de petite taille légèrement hypochromes ou érythémateuses, à limites floues. Leur infiltration est soit totale formant des lépromes de teinte cuivrée, soit limitée à la bordure donnant un aspect annulaire mal limité, de 5 à 10 centimètres de diamètre. Elles sont nombreuses (plusieurs dizaines), bilatérales et symétriques, siégeant au lobule des oreilles, aux doigts et aux orteils et non anesthésiques. Une alopécie de la queue des sourcils est visible dans les formes avancées. Toutes disparaissent sans cicatrice sous traitement.
Les formes de transition ou borderline comprennent quelques lésions de grande taille (de 5 à 20 cm), maculeuses ou infiltrées, asymétriques et hypoesthésiques (forme borderline tuberculoïde ou BT) ; ou une dizaine de lépromes et de lésions annulaires, bilatérales, non anesthésiques (forme borderline lépromateuse ou BL).
L’atteinte nerveuse est constante. Dans la forme tuberculoïde, quelques nerfs sont touchés de façon asymétrique, avec une anesthésie en « gant » ou en « chaussette », responsable de troubles trophiques comme le mal perforant plantaire. Les paralysies entraînent un steppage, des déformations des mains (main de singe, griffe cubitale) et des pieds (orteils en marteau).
La variante lépromateuse touche de plus nombreux nerfs, de façon bilatérale et symétrique : cubital, radial, médian, sciatique poplité externe, tibial postérieur ainsi que le plexus cervical superficiel.
Cette dernière peut affecter d’autres organes. Une rhinite mucopurulente peut évoluer vers une forme atrophique, puis une fonte des os propres du nez, donnant un aspect en « coup de hache ». L’atteinte osseuse provoque des lyses phalangiennes, des destructions « en sucre d’orge sucé » responsables d’une amputation des doigts et des orteils.
Le stade initial ou lèpre indéterminée, visible surtout chez l’enfant, se manifeste par une tache cutanée légèrement hypochrome, de quelques centimètres de diamètre, à limites floues, avec de très légers troubles de la sensibilité. Elle disparaît spontanément dans la majorité des cas, ou évolue vers une forme polaire selon l’état immun.
Dans la lèpre tuberculoïde, quelques macules cutanées, de plusieurs centimètres de diamètre, hypochromes, à limites nettes et de répartition asymétrique (fig. 1), toujours anesthésiques, disparaissent sans cicatrice si le traitement est précoce. Diagnostic différentiel : vitiligo, mycose.3
La lèpre lépromateuse doit être évoquée devant des lésions maculeuses de petite taille légèrement hypochromes ou érythémateuses, à limites floues. Leur infiltration est soit totale formant des lépromes de teinte cuivrée, soit limitée à la bordure donnant un aspect annulaire mal limité, de 5 à 10 centimètres de diamètre. Elles sont nombreuses (plusieurs dizaines), bilatérales et symétriques, siégeant au lobule des oreilles, aux doigts et aux orteils et non anesthésiques. Une alopécie de la queue des sourcils est visible dans les formes avancées. Toutes disparaissent sans cicatrice sous traitement.
Les formes de transition ou borderline comprennent quelques lésions de grande taille (de 5 à 20 cm), maculeuses ou infiltrées, asymétriques et hypoesthésiques (forme borderline tuberculoïde ou BT) ; ou une dizaine de lépromes et de lésions annulaires, bilatérales, non anesthésiques (forme borderline lépromateuse ou BL).
L’atteinte nerveuse est constante. Dans la forme tuberculoïde, quelques nerfs sont touchés de façon asymétrique, avec une anesthésie en « gant » ou en « chaussette », responsable de troubles trophiques comme le mal perforant plantaire. Les paralysies entraînent un steppage, des déformations des mains (main de singe, griffe cubitale) et des pieds (orteils en marteau).
La variante lépromateuse touche de plus nombreux nerfs, de façon bilatérale et symétrique : cubital, radial, médian, sciatique poplité externe, tibial postérieur ainsi que le plexus cervical superficiel.
Cette dernière peut affecter d’autres organes. Une rhinite mucopurulente peut évoluer vers une forme atrophique, puis une fonte des os propres du nez, donnant un aspect en « coup de hache ». L’atteinte osseuse provoque des lyses phalangiennes, des destructions « en sucre d’orge sucé » responsables d’une amputation des doigts et des orteils.
Deux états réactionnels
La « réaction de réversion » (type 1) est due à un phénomène d’hypersensibilité retardée. Elle est constatée chez 15 à 45 % des patients borderline qu’elle oriente vers la forme tuberculoïde dans les premiers mois du traitement. Brutalement survient une turgescence des lésions déjà connues qui peuvent s’ulcérer, des arthralgies et surtout une névrite aiguë, hypertrophique et douloureuse.
L’érythème noueux lépreux (type 2) observé chez 50 % des patients lépromateux, apparaît en début de traitement et évolue par poussées en relation avec une infection intercurrente ou une grossesse. Apparaissent une fièvre, une altération de l’état général, des arthralgies, des polyadénopathies, une névrite aiguë et des nodules hypodermiques chauds, douloureux et violacés,4 en lien avec une élévation du TNF alpha sérique.
L’érythème noueux lépreux (type 2) observé chez 50 % des patients lépromateux, apparaît en début de traitement et évolue par poussées en relation avec une infection intercurrente ou une grossesse. Apparaissent une fièvre, une altération de l’état général, des arthralgies, des polyadénopathies, une névrite aiguë et des nodules hypodermiques chauds, douloureux et violacés,4 en lien avec une élévation du TNF alpha sérique.
Diagnostic et indices
Les bacilles de Hansen sont mis en évidence dans le suc dermique prélevé au lobule de l’oreille ou dans les lésions cutanées. Les frottis permettent de déterminer 2 indices :
– bactériologique (IB = nombre de bacilles/ champ ; de 1+ [1 à 10 bacilles/100 champs] à 6+ [> 1 000 bacilles /champ]) ;
– morphologique (IM = pourcentage de bacilles entiers vus dans le prélèvement).
Forme tuberculoïde. L’IB est négatif ou 1+, l’IM est négatif. L’infiltration histiolymphocytaire périannexielle atteint des filets nerveux et des glandes sudorales.
Forme lépromateuse. L’IB est positif ou > 2+, les bacilles sont regroupés en globi, l’IM est positif (1 à 30 %). L’infiltrat dense, histiolymphocytaire péricapillaire et péri-annexiel, comporte des cellules spumeuses de Virchow…
– bactériologique (IB = nombre de bacilles/ champ ; de 1+ [1 à 10 bacilles/100 champs] à 6+ [> 1 000 bacilles /champ]) ;
– morphologique (IM = pourcentage de bacilles entiers vus dans le prélèvement).
Forme tuberculoïde. L’IB est négatif ou 1+, l’IM est négatif. L’infiltration histiolymphocytaire périannexielle atteint des filets nerveux et des glandes sudorales.
Forme lépromateuse. L’IB est positif ou > 2+, les bacilles sont regroupés en globi, l’IM est positif (1 à 30 %). L’infiltrat dense, histiolymphocytaire péricapillaire et péri-annexiel, comporte des cellules spumeuses de Virchow…
Polychimiothérapie efficace
Depuis une vingtaine d’années, le traitement comprend la rifampicine, la dapsone et/ou la clofazimine (qui provoque une coloration violette de la peau ; fig. 2), diversement combinés selon qu’il s’agit d’une forme paucibacillaire ou multibacillaire (tableau 2).
Une lésion unique ne nécessite que la « ROM » (rifampicine, ofloxacine, mino-cycline ou clarithromycine)5 en une prise mensuelle : pendant 6 mois pour les formes PB, 12 à 24 mois pour les MB.
Les états réactionnels ne doivent pas interrompre la thérapeutique en cours. Une réaction de réversion justifie cependant une corticothérapie (0,5 à 1 mg/kg/j) pendant 6 mois, ou un AINS. Un érythème noueux lépreux requiert la prise de thalidomide, avec contraception obligatoire de couverture.
La prophylaxie est difficile. L’isolement des patients est inutile en raison de la très longue incubation. Il n’existe ni chimioprophylaxie ni vaccination.
1. De Carsalade GY, Achirafi A. La lèpre à Mayotte : étude rétrospective de 1990 à 2008. Bull ALLF 2010; 25:16-7.
2. Tabard C. La lèpre à Mayotte. Étude des nouveaux cas de 2006 à 2015. Thèse : Méd : Université de Bordeaux, 2017.
3. De Carsalade GY, Achirafi A, Bourée P. Triple atteinte dermatologique à Mayotte. Med Trop (Mars) 2006;66:189-92.
4. Bourée P, Bisaro F, Lançon A, Djibo N. Un éry-thème noueux tropical. Rev Fr Lab 2009;39:61-5.
5. Legendre DP, Muzny CA, Swiatlo E. Hansen’s disease (leprosy): current and future pharmaco-therapy and treatment of disease-related immunologic reactions. Pharmacotherapy 2012;32:27-37 .
Les auteurs déclarent n’avoir aucun lien d’intérêts.
(P. Bourée).
L’ESSENTIEL
➜ La lèpre est une affection tropicale, répandue surtout en Inde, en Indonésie et au Brésil.
➜ Elle est due à Mycobacterium leprae, bacille acido-alcoolo-résistant, ne poussant sur aucun milieu de laboratoire.
➜ Le diagnostic est évoqué cliniquement, sur des plaques cutanées hypochromes et anesthésiques et confirmé par le frottis séreux des lésions.
➜ La polychimiothérapie est efficace en 6 à 24 mois selon le stade de la maladie.
(P. Bourée).
Une lésion unique ne nécessite que la « ROM » (rifampicine, ofloxacine, mino-cycline ou clarithromycine)5 en une prise mensuelle : pendant 6 mois pour les formes PB, 12 à 24 mois pour les MB.
Les états réactionnels ne doivent pas interrompre la thérapeutique en cours. Une réaction de réversion justifie cependant une corticothérapie (0,5 à 1 mg/kg/j) pendant 6 mois, ou un AINS. Un érythème noueux lépreux requiert la prise de thalidomide, avec contraception obligatoire de couverture.
La prophylaxie est difficile. L’isolement des patients est inutile en raison de la très longue incubation. Il n’existe ni chimioprophylaxie ni vaccination.
Les auteurs déclarent n’avoir aucun lien d’intérêts.
(P. Bourée).
L’ESSENTIEL
➜ La lèpre est une affection tropicale, répandue surtout en Inde, en Indonésie et au Brésil.
➜ Elle est due à Mycobacterium leprae, bacille acido-alcoolo-résistant, ne poussant sur aucun milieu de laboratoire.
➜ Le diagnostic est évoqué cliniquement, sur des plaques cutanées hypochromes et anesthésiques et confirmé par le frottis séreux des lésions.
➜ La polychimiothérapie est efficace en 6 à 24 mois selon le stade de la maladie.
(P. Bourée).
références
1. De Carsalade GY, Achirafi A. La lèpre à Mayotte : étude rétrospective de 1990 à 2008. Bull ALLF 2010; 25:16-7.
2. Tabard C. La lèpre à Mayotte. Étude des nouveaux cas de 2006 à 2015. Thèse : Méd : Université de Bordeaux, 2017.
3. De Carsalade GY, Achirafi A, Bourée P. Triple atteinte dermatologique à Mayotte. Med Trop (Mars) 2006;66:189-92.
4. Bourée P, Bisaro F, Lançon A, Djibo N. Un éry-thème noueux tropical. Rev Fr Lab 2009;39:61-5.
5. Legendre DP, Muzny CA, Swiatlo E. Hansen’s disease (leprosy): current and future pharmaco-therapy and treatment of disease-related immunologic reactions. Pharmacotherapy 2012;32:27-37
2. Tabard C. La lèpre à Mayotte. Étude des nouveaux cas de 2006 à 2015. Thèse : Méd : Université de Bordeaux, 2017.
3. De Carsalade GY, Achirafi A, Bourée P. Triple atteinte dermatologique à Mayotte. Med Trop (Mars) 2006;66:189-92.
4. Bourée P, Bisaro F, Lançon A, Djibo N. Un éry-thème noueux tropical. Rev Fr Lab 2009;39:61-5.
5. Legendre DP, Muzny CA, Swiatlo E. Hansen’s disease (leprosy): current and future pharmaco-therapy and treatment of disease-related immunologic reactions. Pharmacotherapy 2012;32:27-37