Cette reconnaissance éclaire une thématique de santé publique qui a connu en 30 ans une véritable révolution, de l’identification du virus en 1988 à la politique d’élimination de l’OMS en 2017, exemplaire par la transdisciplinarité suscitée et l’interaction réciproque entre scientifiques, cliniciens, virologues, pharmacologues et épidémiologistes.
Le prix Nobel de médecine 2020 a été attribué aux Drs Harvey Alter, Michael Houghton et Charles Rice le 5 octobre 2020 pour leurs contributions décisives à la découverte du virus de l’hépatite C.
Pourquoi ce prix Nobel de médecine et de physiologie ?
Cette récompense légitime reconnaît leur apport dans la lutte contre une hépatite à transmission parentérale qui est, avec le virus de l’hépatite B (VHB), l’un des problèmes de santé majeur dans le monde, à l’origine de manifestations hépatiques (cirrhose et cancer du foie) mais aussi de manifestations extra-hépatiques liées à une vascularite cryoglobulinémique et/ou à l’inflammation chronique. Les hépatites virales sont devenues (excepté la triste mortalité actuelle liée à la Covid-19) la deuxième cause de mort de cause infectieuse, dépassant la mortalité liée à l’infection par le virus de l’immunodéficience humaine (VIH), la tuberculose ou le paludisme.1 La découverte du virus de l’hépatite B (VHB) par Baruch Blumberg en 1967 (prix Nobel de médecine en 1976)2, avait, après la découverte du virus de l’hépatite A (VHA), permis de distinguer des hépatites à transmission féco-orale (VHA) et parentérale ou sexuelle (VHB). Harvey Alter a été un pionnier dans la description des infections virales « non A non B », responsables de la plupart des cas d’hépatites post-transfusionnelles persitant malgré l’identification des VHA et VHB.3 Au National Institute of Health, il a montré que ces virus « non A non B » étaient transmissibles aux chimpanzés, seul hôte susceptible autre que l’être humain. D’autres études ont montré que cet agent infectieux avait les caractéristiques d’un virus, et Harvey Alter a ainsi défini une nouvelle entité clinique, l’hépatite « non A non B ».
Pendant 15 ans, ces virus « non A non B » n’ont pas été caractérisés, et c’est l’équipe de Michael Houghton travaillant au laboratoire Chiron qui a eu le privilège d’identifier le virus de l’hépatite C par le criblage d’une banque d’ADN provenant du sang d’un chimpanzé infecté par du virus « non A non B ».4 Partant du principe que ces acides nucléiques incluraient bien sûr des fragments du génome du chimpanzé mais aussi des fragments du virus inconnu, ils ont criblé cette banque d’ADN avec des anticorps provenant de patients ayant une hépatite « non A non B ». Un clone a été identifié, correspondant à un nouveau virus à ARN enveloppé appartenant à la famille des Flavivirus et appelé virus de l’hépatite C (VHC). La présence d’anticorps chez les patients ayant une hépatite chronique « non A non B » suggérait fortement que ce virus correspondait à l’agent viral recherché. Le VHC pouvait-il seul causer une hépatite ? Charles Rice, à l’université Washington de Saint-Louis, a identifié une région du génome viral C importante pour la réplication virale et a généré des variants du VHC qui incluaient cette région stratégique du génome dont l’injection dans le foie des chimpanzés générait la détection dans le sang du VHC et des anomalies histopathologiques hépatiques comparables aux hépatites chronique observées chez les humains infectés.5 C’était la dernière preuve que le VHC seul pouvait être à l’origine des cas inexpliqués de contamination transfusionnelle « non A non B ».
La découverte du VHC a été capitale pour les stratégies diagnostiques et thérapeutiques ultérieures, qui ont connu une véritable révolution dans les années 1990 à 2010.6 Des tests diagnostiques sensibles sérologiques puis virologiques (par reverse transcriptase polymerase chain reaction [RT-PCR] permettant l’identification de l’ARN viral, sa quantification, l’établissement de l’un des 7 génotypes et des nombreux sous-types viraux) ont été développés, permettant non seulement le dépistage des sujets infectés mais aussi l’exclusion des donneurs de sang infectés souvent asymptomatiques renforçant ainsi l’hémovigilance, avec notamment la mise en place d’un diagnostic génomique viral dans les banques du sang effondrant le risque transfusionnel d’hépatite C à environ 1 pour 1 million de culots globulaires.
La découverte du virus a enfin contribué au développement rapide de traitements antiviraux. Après des traitements empiriques et lourds utilisant l’interféron alpha à la fin des années 1980 (en auto-injections sous-cutanées quotidiennes, puis trihebdomadaires, puis hebdomadaires lorsque l’interféron a été pégylé en 1997), combiné à un analogue nucléosidique, la ribavirine, en 1994,7 les taux de guérison virologique (définie par l’indétectabilité de l’ARN viral C 12 semaines après la fin du traitement) ont crû de 5 % à 50 % au début des années 2010. La caractérisation des protéines virales impliquées dans la réplication du virus, incluant la protéase NS3/NS4, le complexe de replication NS5A et la polymérase NS5B,8 a conduit au développement d’antiviraux oraux inhibant spécifiquement ces enzymes cruciales dans la réplication du virus qui permettent la guérison aujourd’hui de pratiquement tous les patients.9, 10
La découverte du VHC en 1988 a donc conduit au dépistage des sujets infectés, à la description d’une pathologie certes hépatique mais aussi systémique et à la possibilité de traiter tous les sujets infectés permettant d’espérer une élimination du virus à l’horizon 2030, selon l’Organisation mondiale de la santé (OMS).11 Ces progrès thérapeutiques invitent à un dépistage élargi pour un accès plus large aux traitements les plus efficaces, dans la perspective d’une élimination de l’infection par le VHC. Cette histoire unique méritait bien un prix Nobel, et un dossier sur les hépatites et leur traitement a été publié dans La Revue du Praticien en 2018.
Une pathologie virale chronique fréquente, systémique dont on guérit
Épidémiologie et diagnostic
Le virus de l’hépatite C est à l’origine d’hépatites aiguës spontanément résolutives dans un tiers des cas. Le taux de passage à la chronicité de l’infection virale C est élevé, de l’ordre de 70 %.9, 10 Le VHC est, au moins dans les pays industrialisés, l’une des causes principales de transplantation hépatique et de carcinome hépatocellulaire dont l’augmentation est prévue jusqu’à environ 2030.9, 10 L’infection par le VHC est la seule infection virale chronique dont on puisse espérer guérir, et la capacité unique de régénération hépatique permet que la fibrose, conséquence de l’activité nécrotico-inflammatoire, soit en permanence remodelée, ce qui permet d’observer sa régression, en l’absence de comorbidité hépatique. Cette réparation partielle (ou complète) s’observe aussi pour les manifestations extrahépatiques.
La prévalence de l’infection chronique par le VHC dans le monde décroît, puisque nous sommes passés de 150 millions dans les années 1990 à 71 millions de personnes en 2016.11 Les régions les plus touchées sont l’Afrique, l’Asie centrale et l’Asie. En 2004 en France, la prévalence estimée était de 0,83 % (enquête de l’Institut de veille sanitaire [InVS] chez des assurés sociaux), soit environ 232 000 adultes contre 1,2 % en 1996 ; l’évaluation la plus récente par modélisation rapporte une prévalence autour de 0,3 %, correspondant à 125 000 adultes, dont environ 40 % n’auraient pas été diagnostiqués.12
Le VHC a une transmission principalement parentérale. Les infections nosocomiales, notamment par la transfusion sanguine, ont été la cause principale en France avant 1990 (et le reste dans les pays en développement). Dans les pays développés, l’usage de drogues par voie intraveineuse (et éventuellement par voie nasale) est aujourd’hui son principal mode de transmission. La transmission sexuelle est faible (< 1 %) mais peut être augmentée en cas de rapports sexuels traumatiques, en particulier chez les hommes ayant des relations sexuelles avec des hommes (HSH). La transmission materno-infantile du VHC est de l’ordre de 5 % mais est multipliée par 4 en cas d’infection associée par le VIH. La moitié des enfants contaminés par transmission materno-infantile guérissent dans les deux premières années de vie.
D’autres modes de contamination (transcutanés, communautaires, folkloriques…) existent puisqu’aucun facteur de risque n’est identifié chez environ 20 % des patients infectés par le VHC ; on suspecte des risques comportementaux oubliés, voire déniés ou nosocomiaux ignorés, les soins dentaires, les tatouages ou le piercing.
La présence des anticorps anti-VHC dépistée par des tests ELISA témoigne d’une rencontre antérieure avec le virus. En cas de positivité des anticorps anti-VHC, le caractère actif de l’infection, c’est-à-dire la présence d’une réplication virale, est affirmé par l’identification de l’ARN viral par une technique de RT-PCR dès la semaine suivant l’infection. La séroconversion anti-VHC a lieu environ une dizaine de semaines après la contamination, mais peut être retardée chez les immunodéprimés.
Une infection aux conséquences hépatiques et extrahépatiques
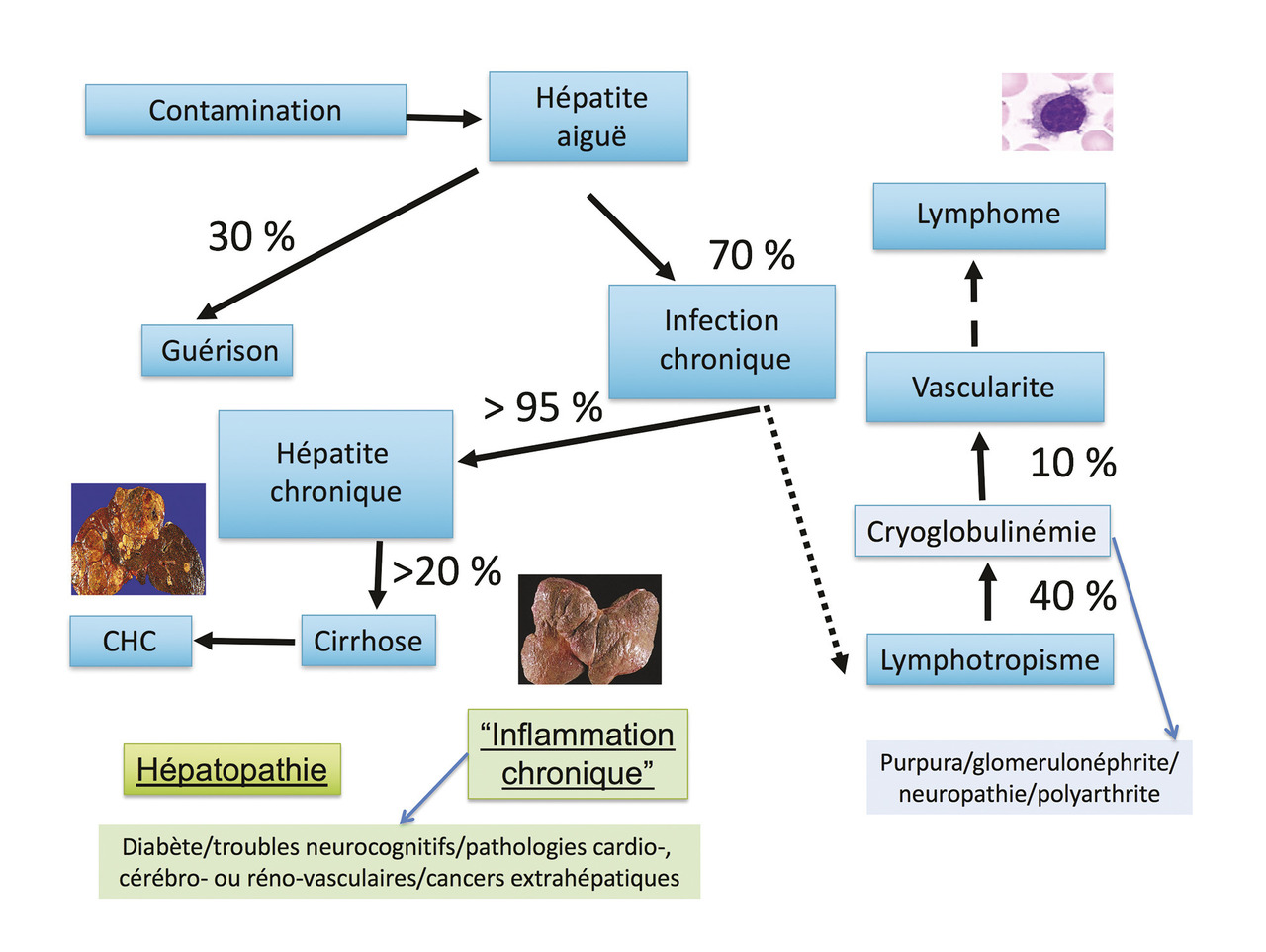
L’histoire naturelle de l’infection virale C est caractérisée par une hépatite aiguë survenant 5 à 45 jours après la contamination : si l’hypertransaminasémie est constante, l’ictère ne sera présent que dans 20 % des cas. Il n’y a pas de forme fulminante de l’hépatite aiguë, dont le taux de guérison spontanée est de l’ordre d’un tiers : l’évolution vers la chronicité est donc observée dans 60 à 80 % des cas (
L’infection virale C associe des manifestations hépatiques (hépatotropisme du virus) et systémiques de vascularite cryoglobulinémique (lymphotropisme du virus) ou générales liées à l’inflammation chronique associée à l’infection.
L’atteinte hépatique en cas d’infection chronique par le VHC est principalement immunomédiée : la reconnaissance des hépatocytes infectés par les lymphocytes T cytotoxiques est responsable de l’hépatite chronique9, 10 caractérisée par une activité nécrotico-inflammatoire et une fibrose. Elle résulte dans un tiers des cas en une fibrose extensive ou une cirrhose, qui favorisent la survenue du carcinome hépatocellulaire par la régénération hépatique (
Une cryoglobulinémie, le plus souvent mixte de type II (contingent polyclonal immunoglobuline [Ig] G et monoclonal IgM kappa à type de facteur rhumatoïde), liée au lymphotropisme du VHC, est détectée chez 40 % des patients infectés ; au moins 10 % des patients cryoglobulinémiques ont des manifestations cutanées (purpura vasculaire), rhumatologiques (polyarthrite), néphrologiques (glomérulonéphrite membranoproliférative) ou neurologiques (polyneuropathie périphérique) par dépôts cryoglobulinémiques dans les artères de petit et moyen calibre.6 Il existe aussi un risque de lymphome (notamment de lymphome splénique villeux)9, 10 lié à l’infection chronique du lymphocyte B par sélection clonale des lymphocytes infectés et/ou à l’activation lymphocytaire en rapport avec l’inflammation chronique. D’autres manifestations extrahépatiques témoignent de l’inflammation chronique associée à l’infection virale C (activation lymphocytaire, comme celle de l’infection par le VIH) et sont observées avec un risque relatif de 1,5 à 3 de diabète non insulindépendant, d’atteintes cardio-, cérébro- ou rénovasculaires et également de cancers extrahépatiques (
Traitements et guérison de l’infection virale C
Bénéfices associés à la guérison
L’infection virale est la seule infection virale chronique dont il soit possible de guérir : il n’y a pas de réservoir viral, et la réponse virologique prolongée correspond à une vraie guérison : l’ARN viral reste indétectable dans les potentiels lieux de réplication, foie comme cellules mononucléées ;14 il n’y a pas de rechute tardive, même en cas d’immunosuppression puissante, comme après une transplantation.
Ces vingt dernières années, le traitement du VHC a évolué, avec un taux croissant de réponses virologiques prolongées. De 1997 à 2011, une injection sous-cutanée hebdomadaire d’interféron pégylé associé à la ribavirine augmentait l’efficacité thérapeutique, permettant de guérir l’infection de 45 %, 85 %, 70 %, 65 % des sujets infectés respectivement par un génotype 1, 2, 3, et 47 au prix de nombreux effets indésirables liés à l’interféron (syndrome pseudogrippal, troubles neurocognitifs, immunostimulation de situations préexistantes asymptomatiques – tuberculose, sarcoïdose, dysthyroïdie, diabète, hypoplasie médullaire…) ou à la ribavirine (troubles neurocognitifs, éruptions cutanées, prurit, toux, sécheresse cutanéomuqueuse, anémie…) d’autant plus fréquents que le traitement était prolongé de 24 (génotypes 2 et 3) à 48 semaines (génotypes 1, 4, 5), voire 72 semaines (génotypes 1 avec réponse virologique lente).
La réponse virologique prolongée est bénéfique sur les plans hépatique et extrahépatique : disparition de l’asthénie dans deux tiers des cas où elle existait, normalisation de l’hypertransaminasémie, régression et disparition des manifestations extrahépatiques (cutanées, articulaires, neurologiques, rénales) de vascularite cryoglobulinémique, incluant même la rémission des lymphomes.9, 10 La réponse virologique prolongée permet le remodelage de la fibrose hépatique en l’absence de comorbidité hépatique (surpoids, diabète, surconsommation d’alcool) même au stade de cirrhose15, expliquant que la morbi-mortalité hépatique soit réduite, particulièrement en cas de cirrhose préexistante (quasi-disparition des complications non carcinomateuses de la cirrhose et réduction significative de l’incidence du carcinome hépatocellulaire ou de sa récidive).
De larges cohortes rétrospectives16 mais surtout prospectives et notamment françaises de sujets mono-infectés VHC virémiques ou non virémiques17, 18 ou co-infectés VIH-VHC ayant une réponse virologique prolongée ou non ont montré une réduction de la mortalité globale, hépatique ou extrahépatique (cardiovasculaire, cérébrovasculaire ou par cancer extrahépatique) en cas de guérison dans la cohorte Hepather de l’Agence nationale de recherches sur le sida et les hépatites virales (ANRS).18 Surtout, la cohorte prospective CirVir de l’ANRS (environ 1 350 cirrhoses compensées histologiquement prouvées liées à l’infection au VHC)17 a montré que la guérison virologique réduit significativement le risque de carcinome hépatocellulaire, de décompensation de la cirrhose, d’infections bactériennes et les risques vasculaires de 50 % à 3 ans.
Une révolution thérapeutique
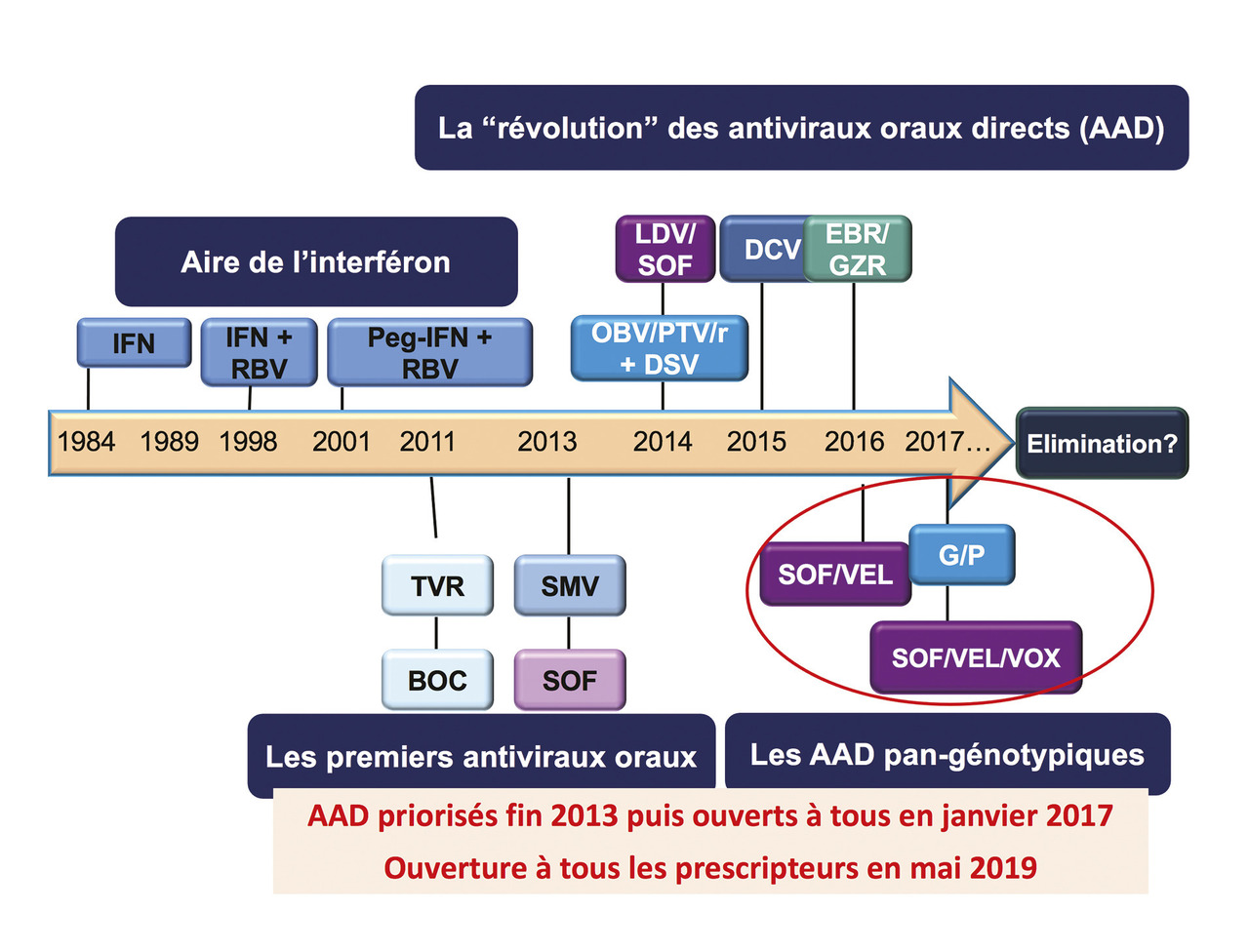
La meilleure connaissance des mécanismes d’entrée ou de relargage du VHC au cours des années 2000 et la caractérisation des protéines virales impliquées dans la réplication du VHC ont permis le développement d’antiviraux spécifiques du VHC (
Des inhibiteurs de protéase, et notamment le télaprévir et le bocéprévir, ont été les premiers mis sur le marché en France en 2011, permettant chez les sujets infectés par un génotype 1 et en combinaison avec l’interféron et la ribavirine d’obtenir une fréquence plus élevée de guérison virologique chez deux tiers des patients, avec une réduction de 48 à 24 semaines de la durée du traitement chez la moitié des patients, au prix d’effets indésirables qui s’ajoutaient à ceux liés au traitement classique, notamment cutanés pour le télaprévir.
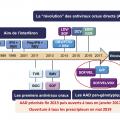
Ces deux antiviraux oraux de première génération ont constitué la première étape de la révolution thérapeutique (2011-2013) et ont été rapidement dépassés par des inhibiteurs spécifiques de deuxième vague et de deuxième génération. La vraie révolution a été la combinaison d’antiviraux directs coformulés en une seule gélule et l’affranchissement de l’interféron pégylé, puis de la ribavirine (
En résumé, trois combinaisons orales ayant une activité pangénotypique sont disponibles depuis avril 2017 et permettent la guérison virologique de tous les patients dépistés et donc traités pour 8 semaines (3 gélules/j de glécaprévir-pibrentasvir) ou 12 semaines (1 gélule/j de sofosbuvir-velpatasvir avec ou sans voxilaprévir) avec une tolérance satisfaisante.
Depuis janvier 2017, le traitement est pris intégralement en charge pour tous les patients infectés (chroniques) par le VHC (après une politique de priorisation de l’accès au traitement selon la sévérité des patients entre 2014 et 2017), et la prescription est ouverte à tous les médecins depuis 2019.
Les défis de l’élimination du virus
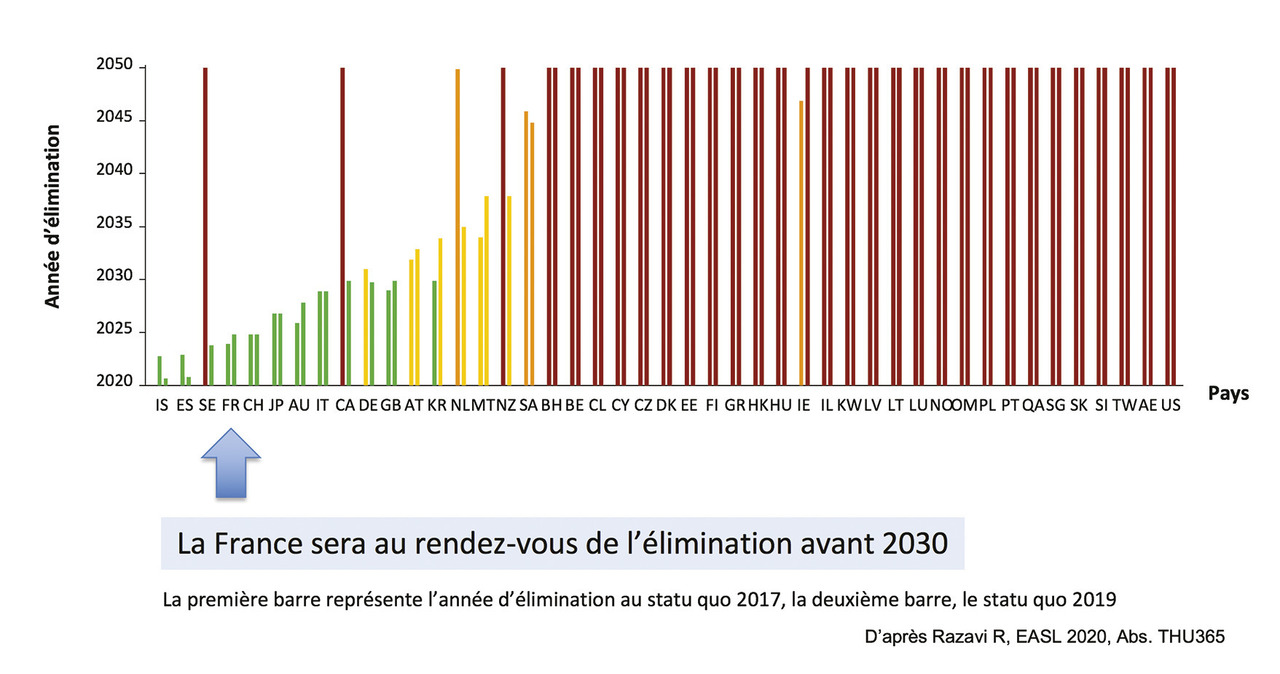
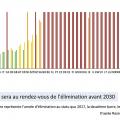
Grâce aux combinaisons efficaces d’antiviraux, des politiques nationales d’élimination du VHC sont mises en place dans de nombreux pays, et environ 10 pays industrialisés seront au rendez-vous en 2030 du plan d’élimination des hépatites de l’Organisation mondiale de la santé (OMS).
L’espoir réaliste d’élimination du VHC (plus que d’éradication, en l’absence de vaccin) suppose des politiques actives de dépistage et d’accès aux traitements. Au niveau mondial, probablement moins de 10 % de la population infectée a été dépistée, et il existe une relation inverse entre la prévalence et l’efficacité du dépistage ; en France, il est estimé que 65 % de la population infectée a été dépistée, sans doute en partie du fait du traumatisme du scandale du sang contaminé dans les années 1980. Les politiques proposées de dépistage varient selon les pays et leur épidémiologie propre. Le dépistage de tous les baby boomers nés entre 1945 et 1965 proposé aux États-Unis serait une politique inadaptée en Italie, où la moyenne d’âge des sujets infectés est de l’ordre de 70 ans, contre 57 ans en France. En France, le rapport d’experts de 2015 suggérait de dépister tous les hommes de plus de 18 ans et toutes les femmes enceintes, négligeant l’important contingent de femmes septuagénaires majoritairement infectées lors des transfusions de la délivrance ou de chirurgies gynécologiques avant 1990 ; la proposition d’un dépistage universel n’a pas été retenue par la Haute Autorité de santé en 2019. Le remboursement des tests rapides d’orientation diagnostique (TROD) devrait améliorer le dépistage des populations précaires, usagers de drogues de bas seuil, prisonniers ou migrants, souvent éloignées des systèmes de soins.
Le dépistage amélioré, il conviendra aussi d’améliorer le système d’accès au traitement et d’en lever les freins, dont les prises en charge sociales, là encore pour les populations les plus marginales (usagers de drogues, prisonniers, populations psychiatriques) et sans droits (migrants), qui représentent la majorité des nouvelles contaminations. La délocalisation du dépistage et des soins des hôpitaux médecine-chirurgie-obstétrique aux structures de prise en charge en addictologie (centres de soins, d’accompagnement et de prévention en addictologie [CSAPA] ou centres d’accueil et d’accompagnement à la réduction des risques pour usagers de drogues [CAARUD]), prisons, hôpitaux psychiatriques ou structures de soins aux migrants devrait permettre l’optimisation de la cascade de soins. La France sera au rendez-vous de l’élimination pour 2025, ce qui ne sera pas le cas des États-Unis par exemple (
L’essentiel reste à faire
En résumé, 32 ans après sa découverte et 2 ans après sa première visualisation en microscopie électronique, l’histoire du VHC semble s’achever, avec la promesse que presque tous les patients dépistés seront guéris. De nombreux défis restent cependant à relever, dont celui du dépistage et de l’amélioration de l’accès aux soins, notamment pour les populations les plus vulnérables qui en sont la cible principale, mais aussi un défi économique car les traitements coûtent trop cher et il faut se battre pour en réduire les coûts. Le dernier défi est préventif : le développement d’un vaccin prophylactique est essentiel mais reste limité par la très grande variabilité du virus. Ainsi, si la réalité théorique permet d’espérer une élimination de l’infection virale C dans les pays favorisés (et en pratique en France), l’essentiel du travail reste à faire dans notre monde globalisé.
Remerciements Le Dr Stanislas Pol remercie Mme Nathalie Phalippou pour son assistance secrétariale.
1. Stanaway JD, Flaxman AD, Naghavi M, et al. The global burden of viral hepatitis from 1990 to 2013: findings from the Global Burden of Disease Study 2013. Lancet 2016;388:1081-8.
2. Blumberg BS. Hepatitis B and beyond. Interviewed by Pam Das. Lancet Infect Dis 2002;2:767-71.
3. Alter HJ, Holland PV, Purcell RH, et al. Posttransfusion hepatitis after exclusion of commercial and hepatitis-B antigen positive donors. Ann Intern Med 1972;77:691-9.
4. Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, Houghton M. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science 1989;244:359-62.
5. Kolykhalov AA, Agapov EV, Blight KJ, Mihalik K, Feinstone SM, Rice CM. Transmission of hepatitis C by intrahepatic inoculation with transcribed RNA. Science 1997;277:570-4.
6. Pol S, Lagaye S. The remarkable history of the hepatitis C virus. Microbes Infect 2019;21:263-70.
7. Mchutchison JG, Lawitz, EJ, Shiffman ML, et al. Peginterferon alfa-2b or alfa-2a with ribavirin for treatement of hepatitis C infection. N Engl J Med 2009;361:580-93.
8. Buhler S, Bartenschlager R. New targets for antiviral therapy of chronic hepatitis C. Liver Int 2012;32:19-6.
9. European Association for the Study of the Liver (EASL) recommendations on treatment of hepatitis C: final update of the series. J Hepatol 2020;73:1170-218.
10. AASLD-IDSA. Recommendations for testing, managing, and treating hepatitis C. 2017; http://www.hcvguidelines.org.
11. WHO Global Hepatitis Report 2017. https://creativecommons.org/licenses/by-nc-sa/3.0/igo
12. Brouard C, Saboni L, Gautier A, et al. HCV and HBV prevalence based on home blood self-sampling and screening history in the general population in 2016: contribution to the new French screening strategy. BMC Infect Dis 2019;19:896.
13. Simmons B, Saleem J, Hill A, Riley RD, Cooke GS. Risk of late relapse or reinfection with hepatitis C virus after achieving a sustained virological response: a systematic review and meta-analysis. Clin Infect Dis 2016;15:62:68394.
14. Fontaine H, Chaix ML, Lagneau JL, et al. Recovery from chronic hepatitis C in long-term responders to ribavirin plus interferon alfa. Lancet 2000;356:41.
15. Mallet V, Gilgenkrantz H, Serpaggi J, et al. Brief communication: the relationship of regression of cirrhosis to outcome in chronic hepatitis C. Ann Intern Med 2008;149:399-403.
16. Lee MH, Yang HI, Lu SN, et al. Chronic hepatitis C virus infection increases mortality from hepatic and extrahepatic diseases: a community-based long-term prospective study. J Infect Dis 2012;206:469-77.
17. Trinchet JC, Bourcier V, Chaffaut C, et al. Complications and competing risks of death in compensated viral cirrhosis (ANRS CO12 CirVir prospective cohort). Hepatology 2015;62:737-50.
18. Carrat F, Fontaine H, Dorival C, et al. Clinical outcomes in patients with chronic hepatitis C following direct-acting antiviral therapy: a prospective cohort study. Lancet 2019;393:1453-64.
19. Zeuzem S, Ghalib R, Reddy KR, et al. Grazoprevir-elbasvir combination therapy for treatment-naive cirrhotic and noncirrhotic patients with chronic HCV genotype 1, 4, or 6 infection: a randomized trial. Ann Intern Med 2015;163:1-13.
20. Bourlière M, Gordon SC, Flamm SL, et al. Sofosbuvir, velpatasvir, and voxilaprevir for previously treated HCV infection. N Engl J Med 2017;376:2134-46.