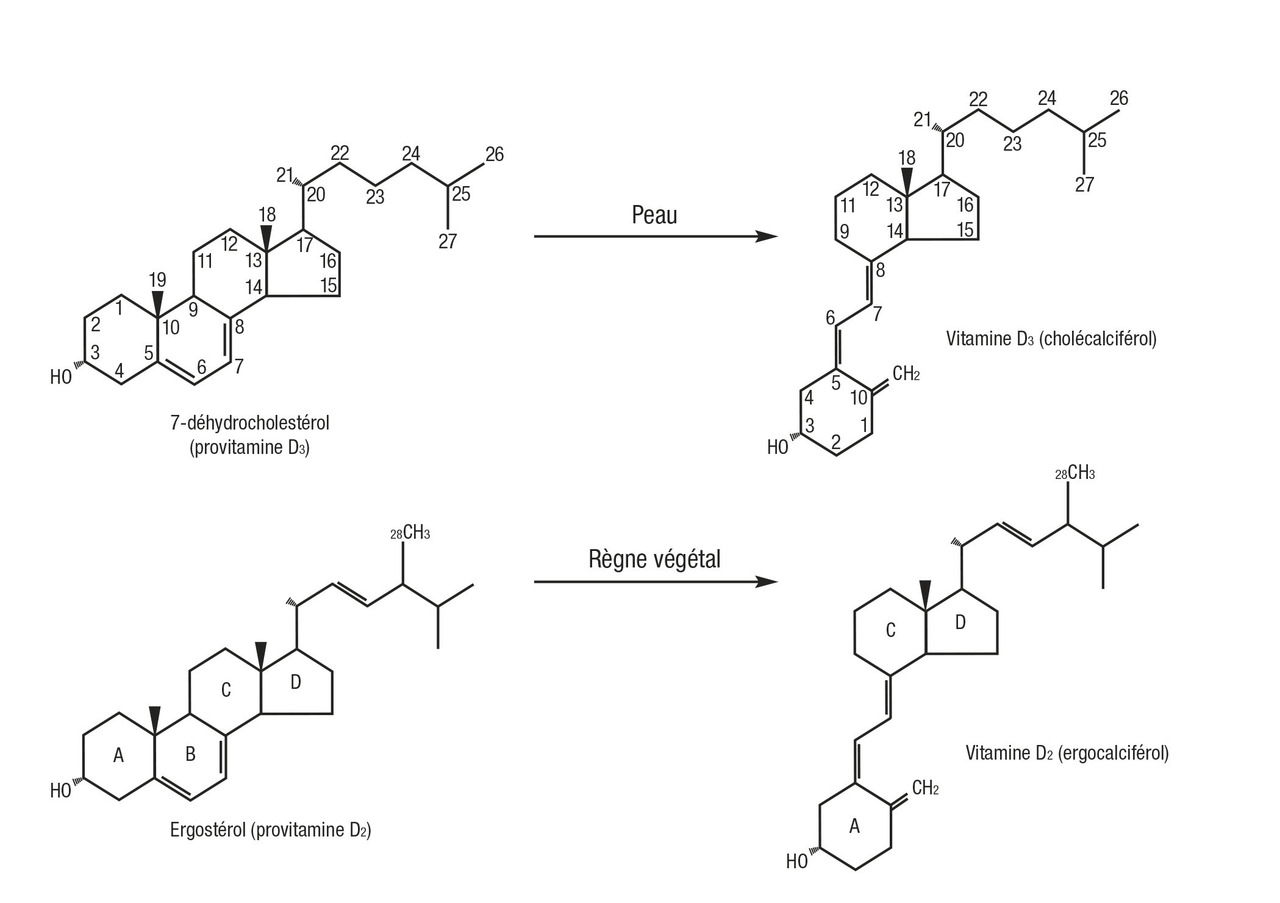
Vitamine D. Les recommandations de supplémentation diffèrent selon que l’on s’adresse à la population générale ou à certains patients. Les études plaident plutôt pour une administration quotidienne et, à défaut, pour une supplémentation intermittente utilisant de plus fortes doses.
La vitamine D n’est pas une vitamine au sens propre du terme (c’est-à-dire un produit dont on a besoin en petite quantité mais qu’on ne peut pas synthétiser) puisque la source principale est une synthèse cutanée lors de l’exposition de la peau à des rayons ultraviolets B (UVB). Elle doit être plutôt considérée comme le précurseur d’un système hormonal et doit être transformée deux fois pour devenir active, d’abord en 25-hydroxyvitamine D (25OHD) au niveau hépatique, puis en 1,25 dihydroxyvitamine D dans le rein mais aussi dans de nombreux autres tissus (v. figure). La vitamine D est clairement associée à la santé musculo-squelettique. Elle stimule l’absorption digestive du calcium et du phosphate, régule, en synergie avec la parathormone (PTH), la réabsorption rénale distale du calcium et le remodelage osseux, et exerce un rétrocontrôle sur la sécrétion de PTH. Une carence profonde en vitamine D est responsable de pathologies caractérisées par un défaut de minéralisation osseuse, rachitisme et ostéomalacie, et de douleurs musculaires diffuses. Différents essais randomisés contre placebo ont montré qu’une supplémentation en vitamine D, en général associée à du calcium, réduisait le risque de fractures non vertébrales chez des patients de plus de 65 ans1 et réduisait le risque de chutes chez les patients de plus de 70 ans2 à condition qu’elle apporte au moins 20 µg (800 UI) de vitamine D par jour. Il a été montré par ailleurs qu’un statut vitaminique D optimal était nécessaire pour une bonne efficacité antifracturaire des traitements antiostéoporotiques qui inhibent la résorption osseuse comme les bisphosphonates.3 Par ailleurs, il existe de très nombreuses études observationnelles et expérimentales en faveur d’effets « non classiques » de la vitamine D pour la prévention de nombreuses pathologies comme le diabète, les maladies cardiovasculaires, certains cancers, le déclin cognitif lié à l’âge, des pathologies infectieuses ou auto-immunes.4 Toutefois, les résultats des études d’intervention contrôlées qui ont testé ces effets sont contradictoires. Certaines, en effet, ne trouvent pas de bénéfice à la supplémentation en vitamine D par rapport à un placebo, alors que d’autres trouvent un effet bénéfique, en particulier sur des paramètres intermédiaires. L’analyse en intention de traiter de ces études aboutit souvent à des résultats neutres (la vitamine D ne fait pas mieux que le placebo), alors que les analyses en sous-groupes montrent fréquemment des effets positifs de la vitamine D lorsqu’on ne tient compte que des données des patients qui sont déficitaires en vitamine D en début d’étude5 ou qui ont atteint pendant l’étude les concentrations de vitamine D ciblées par les auteurs.6 Le niveau de preuves qui permettrait d’affirmer la réalité de ces effets « non classiques » de la vitamine D n’étant pas (encore ?) atteint, il paraît raisonnable de se fonder uniquement sur les effets musculo-squelettiques pour établir la définition d’un statut vitaminique D optimal ainsi que des apports adéquats en vitamine D.
Que signifie « statut vitaminique D optimal » ?
Le statut vitaminique D est défini par la concentration sérique de 25OHD. Le mode d’établissement des valeurs de référence utilisées pour la majorité des paramètres biologiques (recruter une population apparemment en bonne santé, doser le paramètre à évaluer et définir un intervalle dans lequel on trouve 95 % des valeurs mesurées) ne s’applique toutefois pas à la 25OHD. On devrait en effet définir dans ce cas (par exemple) des « normes » d’été et des « normes » d’hiver, la 25OHD étant, à nos latitudes, significativement plus basse en hiver qu’en été. Les experts considèrent tous qu’il faut plutôt déterminer les concentrations sériques de 25OHD au-dessous et au-dessus desquelles il peut exister des effets délétères, ou celles pour lesquelles on profitera au mieux des effets bénéfiques de la vitamine D en se fondant le plus possible sur les études d’intervention. On parlera pour la 25OHD de valeurs « souhaitables » ou « recommandées » plutôt que de valeurs « normales » ou « de référence ». Différents seuils pour ces valeurs « souhaitables » ont été proposés par des groupes d’experts ou des sociétés savantes dans le cadre de recommandations pour la prise en charge du déficit en vitamine D. Si tout le monde est d’accord sur le fait qu’une concentration de 25OHD inférieure à 10-12 ng/mL peut être qualifiée de « carence » en vitamine D (c’est-à-dire possiblement associée au rachitisme ou à l’ostéomalacie), les concentrations qui définissent le déficit et/ou l’insuffisance en vitamine D semblent moins consensuelles. En fait, il est important de faire la différence entre les recommandations qui concernent la population générale et celles qui concernent la prise en charge des patients.
Les patients ostéoporotiques ou à risque d’ostéoporose en raison de traitements potentiellement délétères pour le squelette (corticoïdes à forte dose, antiaromatase, analogues de la gonadotropin releasing hormone, etc.) ou de maladies associées comme certaines pathologies endocriniennes ou des malabsorptions (maladie cœliaque, mucoviscidose, chirurgie bariatrique type bypass, etc.), ainsi que les patients insuffisants rénaux chroniques. Chez ces patients, de nombreux groupes d’experts considèrent que la concentration minimale de 25OHD permettant d’optimiser la santé est de 30 ng/mL (soit 75 nmol/L).7 Le dosage préalable de la 25OHD est justifié ainsi que le dosage pendant la supplémentation vitaminique afin d’adapter la posologie de vitamine D (avec pour ces patients des apports calciques « corrects »).
La population générale (c’est-à-dire les gens apparemment en bonne santé) pour laquelle les experts de l’Institute of Medicine nord-américain proposent des apports nutritionnels conseillés qui doivent permettre d’atteindre chez une majorité de personnes (sans dosage préalable) une concentration de 25OHD de 20 ng/mL (soit 50 nmol/L) considérée comme suffisante dans cette population.8
Les patients atteints de maladies chroniques pour lesquelles des effets bénéfiques de la vitamine D sont suggérés par de très nombreuses études observationnelles et expérimentales mais dont le niveau de preuves est encore insuffisant selon les règles les plus strictes de l’evidence-based medicine. Chez ces patients, il n’y a pas de consensus, et les experts sont partagés entre une concentration minimale de 20 ng/mL (comme en population générale) ou de 30 ng/mL.
Par souci de prudence, la concentration maximale de 25OHD à ne pas dépasser est aujourd’hui fixée entre 50 et 60 ng/mL.8 Cette zone est en effet proche des concentrations maximales retrouvées dans des populations qui s’exposent généreusement à un soleil apportant des UVB toute l’année. Elle est par ailleurs suffisamment éloignée de la concentration minimale associée à une possible intoxication à la vitamine D (150 ng/mL). Il faut aussi souligner le fait que dans quelques études observationnelles, la relation entre concentration de 25OHD et risque relatif de la maladie étudiée était au mieux représentée par une courbe en U (ou plutôt en J inversé), ce qui veut dire un risque plus élevé pour les valeurs basses mais aussi pour les valeurs élevées, avec une élévation du risque pour des concentrations à partir de 50-60 ng/mL. Même si aucune relation de causalité ne peut être déduite de ce type d’études observationnelles, le principe de précaution incite à faire en sorte de ne pas dépasser ces niveaux de 25OHD.
En population générale, environ 40-50 % des Français ont une concentration de 25OHD inférieure à 20 ng/mL (50 nmol/L) et 80 % ont une concentration inférieure à 30 ng/mL (75 nmol/L).9
Les patients ostéoporotiques ou à risque d’ostéoporose en raison de traitements potentiellement délétères pour le squelette (corticoïdes à forte dose, antiaromatase, analogues de la gonadotropin releasing hormone, etc.) ou de maladies associées comme certaines pathologies endocriniennes ou des malabsorptions (maladie cœliaque, mucoviscidose, chirurgie bariatrique type bypass, etc.), ainsi que les patients insuffisants rénaux chroniques. Chez ces patients, de nombreux groupes d’experts considèrent que la concentration minimale de 25OHD permettant d’optimiser la santé est de 30 ng/mL (soit 75 nmol/L).7 Le dosage préalable de la 25OHD est justifié ainsi que le dosage pendant la supplémentation vitaminique afin d’adapter la posologie de vitamine D (avec pour ces patients des apports calciques « corrects »).
La population générale (c’est-à-dire les gens apparemment en bonne santé) pour laquelle les experts de l’Institute of Medicine nord-américain proposent des apports nutritionnels conseillés qui doivent permettre d’atteindre chez une majorité de personnes (sans dosage préalable) une concentration de 25OHD de 20 ng/mL (soit 50 nmol/L) considérée comme suffisante dans cette population.8
Les patients atteints de maladies chroniques pour lesquelles des effets bénéfiques de la vitamine D sont suggérés par de très nombreuses études observationnelles et expérimentales mais dont le niveau de preuves est encore insuffisant selon les règles les plus strictes de l’evidence-based medicine. Chez ces patients, il n’y a pas de consensus, et les experts sont partagés entre une concentration minimale de 20 ng/mL (comme en population générale) ou de 30 ng/mL.
Par souci de prudence, la concentration maximale de 25OHD à ne pas dépasser est aujourd’hui fixée entre 50 et 60 ng/mL.8 Cette zone est en effet proche des concentrations maximales retrouvées dans des populations qui s’exposent généreusement à un soleil apportant des UVB toute l’année. Elle est par ailleurs suffisamment éloignée de la concentration minimale associée à une possible intoxication à la vitamine D (150 ng/mL). Il faut aussi souligner le fait que dans quelques études observationnelles, la relation entre concentration de 25OHD et risque relatif de la maladie étudiée était au mieux représentée par une courbe en U (ou plutôt en J inversé), ce qui veut dire un risque plus élevé pour les valeurs basses mais aussi pour les valeurs élevées, avec une élévation du risque pour des concentrations à partir de 50-60 ng/mL. Même si aucune relation de causalité ne peut être déduite de ce type d’études observationnelles, le principe de précaution incite à faire en sorte de ne pas dépasser ces niveaux de 25OHD.
En population générale, environ 40-50 % des Français ont une concentration de 25OHD inférieure à 20 ng/mL (50 nmol/L) et 80 % ont une concentration inférieure à 30 ng/mL (75 nmol/L).9
Supplémentation en vitamine D, en pratique
L’objectif est donc de faire en sorte que la majorité de la population générale ait une concentration sérique de 25OHD comprise entre 20 et 50-60 ng/mL et que les patients ostéoporotiques, insuffisants rénaux chroniques ou atteints d’une malabsorption aient une 25OHD entre 30 et 50-60 ng/mL. Jusqu’à une période récente, la pratique était de doser la 25OHD des femmes et de les supplémenter de manière personnalisée en fonction de la concentration mesurée (donner plus de vitamine D à celles qui ont les concentrations les plus basses). Cette pratique était confortable mais a généré un nombre considérable de prescriptions de dosages de la 25OHD et un coût très important de remboursement. La Caisse nationale de l’assurance maladie (CNAM) a alors demandé un avis sur l’intérêt de ce dosage à la Haute Autorité de santé (HAS) qui a suggéré de le dérembourser en dehors de certaines indications* que de très nombreux experts ont trouvées insuffisantes.10 Il faut donc s’adapter à cette nouvelle situation et pénaliser le moins possible les patients tout en étant capable de justifier que la raison pour laquelle un dosage de 25OHD est prescrit ne s’écarte pas des recommandations de la HAS. Le nombre de prescriptions de dosages de 25OHD chez des patients qui n’en ont pas besoin a diminué significativement (ce n’est pas pour cette raison qu’il ne faut pas donner de la vitamine D à de nombreux patients… mais sans dosage préalable).
Contrairement à la supplémentation en calcium qui doit être quotidienne, l’administration de vitamine D peut être intermittente en raison de la demi-vie longue de la 25OHD. En France, les deux modes d’administration sont possibles et on a le choix entre des petites doses quotidiennes administrées sous forme de gouttes (une goutte = 300 ou 400 UI de vitamine D) ou sous forme de comprimés ou sachets combinant calcium et vitamine D3, et des doses plus importantes administrées de manière intermittente. En France, des doses de 80 000, 100 000 et 200 000 UI de vitamine D3 et 600 000 UI de vitamine D2 sont disponibles**. Des doses de 50 000 UI de vitamine D3 devraient être disponibles début 2018. L’observance des prises journalières de vitamine D, surtout lorsqu’elles sont associées à du calcium, est souvent faible.11 C’est pourquoi la prescription de fortes doses administrées de manière intermittente est souvent préférée aujourd’hui en France, avec l’idée de favoriser l’observance. Deux principes importants sont à respecter toutefois :
– ne prescrire que de la vitamine D3 en cas de prises « espacées » car celle-ci permet de maintenir un statut vitaminique D satisfaisant beaucoup plus longtemps que la vitamine D2 ;12
– en cas de prescription de doses « espacées », exclure les doses très fortes et très espacées, en particulier chez les femmes les plus âgées car une étude chez des femmes australiennes de plus de 80 ans a montré qu’une dose annuelle de 500 000 UI de vitamine D3 administrée pendant 4 ans avait augmenté le risque de fractures et de chutes par rapport à un placebo.13 En France, l’intervalle entre les prises espacées de vitamine D est généralement de 2 à 3 mois pour les doses de 80 000 et 100 000 UI selon les recommandations déjà anciennes du Groupe de recherche et d’information sur les ostéoporoses.14
Une étude récente a comparé trois groupes de femmes ménopausées finlandaises qui ont reçu soit un placebo tous les 3 mois, soit 100 000 UI de vitamine D3 tous les 3 mois, soit 200 000 UI de vitamine D3 tous les 3 mois.15 La 25OHD était dosée avant et 7 jours après chacune de ces prises trimestrielles. Le groupe qui recevait 200 000 UI tous les 3 mois avait logiquement, 7 jours après chacune des prises, une concentration sérique de 25OHD plus élevée que le groupe qui recevait 100 000 UI tous les 3 mois ; en revanche, juste avant la prise suivante, la concentration sérique de 25OHD était exactement la même dans les deux groupes. Les principaux messages de ce travail étaient que : plus on élève la concentration sérique de 25OHD rapidement, plus celle-ci baisse rapidement ; un intervalle de 3 mois entre des prises de 100 000 ou 200 000 UI de vitamine D3 est caractérisé par des fluctuations importantes de la concentration de 25OHD et est probablement trop espacé. En effet, il existe aujourd’hui des études montrant que les fluctuations de la concentration de 25OHD s’accompagnent de variations dans le sens inverse des concentrations sériques de PTH et du CTX, un marqueur de la résorption osseuse (la PTH et le CTX s’élèvent lorsque la 25OHD baisse), ce qui témoigne d’un effet indésirable, tout au moins pour l’os.16
Des études déjà anciennes avaient conclu qu’en termes de stabilité de la concentration de 25OHD, un espacement de 1 mois entre les prises était équivalent aux doses journalières (par exemple 1 500 UI/j équivalait à 45 000 UI/mois).17 Cet intervalle de 1 mois a été testé dans une étude randomisée plus récente où des sujets âgés (67 % de femmes) ayant fait au moins une chute dans l’année précédente ont reçu pendant 1 an une dose de 60 000 UI de vitamine D3 par mois, équivalente en théorie à 2 000 UI/j, ou une dose de 24 000 UI par mois, équivalente en théorie à 800 UI/j.18 Des doses de vitamine D de 800 UI/j associées à du calcium ayant démontré leur efficacité à réduire les chutes d’environ 20 % chez les sujets âgés,2 l’objectif de cette étude était d’évaluer si les fortes doses pouvaient diminuer encore plus le risque de chutes. Le résultat fut décevant puisqu’au bout d’un an les chutes ont été plus nombreuses dans le groupe qui avait reçu 60 000 UI/mois que dans celui qui avait reçu 24 000 UI/mois. Une explication possible pour ce résultat pouvait être que les fortes doses et/ou l’obtention de concentrations élevées de 25OHD étaient responsables de cet excès de chutes. Un argument en faveur de cette hypothèse est que le risque de chutes était plus important chez les participantes qui avaient une concentration supérieure à 20 ng/mL à l’inclusion dans cette étude et/ou qui avaient atteint une concentration élevée de 25OHD sous supplémentation (dans le quartile supérieur, soit 45-99 ng/mL).
Les résultats d’une étude contrôlée un peu plus ancienne par les mêmes auteurs étaient toutefois contre cette hypothèse.19 En effet, chez des femmes âgées comparables à celles de leur étude récente18 en termes d’âge et de nombre de patientes incluses et dont le critère d’inclusion dans l’étude était d’avoir eu une fracture de la hanche récemment, le risque de chutes n’était pas différent dans un groupe qui avait reçu 800 UI/j pendant 1 an par rapport à un groupe qui avait reçu 2 000 UI/j pendant la même période. En revanche, le nombre de réhospitalisations, en particulier pour causes infectieuses, et les complications post-chutes étaient significativement moins nombreuses dans le groupe qui avait reçu 2 000 UI/j que dans le groupe qui avait reçu 800 UI/j, en faveur d’un effet bénéfique des doses les plus fortes de cette étude. On peut cependant noter que les concentrations de 25OHD en début d’étude (13,2 ng/mL en moyenne dans le groupe 2 000 UI/j et 12,3 ng/mL en moyenne dans le groupe 800 UI/j) étaient plus basses que dans l’étude récente18 (18,7 ng/mL dans le groupe 24 000 UI/mois et 20,9 ng/mL en moyenne dans le groupe 60 000 UI/mois).
Dans une autre étude, 107 patients résidant en établissement d’hébergement pour personnes âgées dépendantes (EHPAD) ont reçu soit 100 000 UI de vitamine D3 par mois pendant 1 an soit une dose plus faible de l’ordre de 18 000 UI par mois.20 Si l’incidence des infections respiratoires était significativement plus faible dans le groupe recevant 100 000 UI/mois, le nombre de chutes était, en revanche, significativement plus élevé.
Pour terminer cette revue des études récentes pouvant remettre en question les modalités de supplémentation en vitamine D, il faut citer un essai randomisé où des femmes âgées de 57 à 87 ans, déficitaires en vitamine D (25OHD < 20 ng/mL en début d’étude) et non hospitalisées ont reçu soit un placebo, soit différentes doses de vitamine D3 administrées de façon journalière et allant de 400 à 4 800 UI/j.21 Lorsque les auteurs divisaient les patientes en trois groupes en fonction des doses de vitamine D reçues, celles qui avaient reçu les doses moyennes (de 1 600 à 3 200 UI/j) avaient un risque de chutes significativement réduit par rapport à celles qui avaient reçu le placebo ou les faibles doses (400 UI ou 800 UI/j)mais aussi par rapport à celles qui avaient reçu les fortes doses (4 000 ou 4 800 UI/j), mettant une nouvelle fois en évidence une courbe en U entre le risque de chutes et les doses de vitamine D.
Les résultats des études discutées ci-dessus incitent à plusieurs commentaires :– il faut tout d’abord insister sur le fait que les deux études d’intervention réalisées par l’équipe du Pr Bischoff-Ferrari18, 19 ne comportaient pas de groupe placebo, et qu’on ne peut donc pas conclure qu’une dose mensuelle de 60 000 UI/mois de vitamine D3 augmente le risque de chutes chez les sujets âgés, d’autant plus qu’une étude contrôlée récente a trouvé une réduction significative du risque de chutes chez des sujets de 78 ans en moyenne qui avaient reçu 100 000 UI de vitamine D3 par mois pendant 5 mois par rapport à ceux qui avaient reçu un placebo.22 On peut seulement dire qu’avec 60 000 UI/mois on fait moins bien qu’avec 24 000 UI/mois sur le risque de chutes, et que 2 000 UI/j ont fait mieux que 800 UI/j sur les réhospitalisations pour infections et les complications post-chutes, sans toutefois montrer un avantage sur le risque de chutes ;– malgré les incertitudes liées à un manque de données « définitives », les études citées plus haut sont en faveur de l’utilisation de doses journalières modérées de vitamine D plutôt que de fortes doses administrées de manière intermittente. Cela avait déjà été recommandé par certains experts bien avant ces publications récentes,23, 24 et différentes méta-analyses évaluant l’effet d’une supplémentation en vitamine D sur la force musculaire25 ou le risque d’infections respiratoires26 avaient rapporté un effet bénéfique d’une supplémentation en vitamine D administrée quotidiennement mais pas en fortes doses espacées. Comme indiqué plus haut, le problème est qu’en France les formes pharmaceutiques de vitamine D destinées à une administration journalière sont sous forme de gouttes afin de pouvoir être administrées aux nouveau-nés et aux enfants les plus jeunes. Elles sont peu adaptées à la médecine d’adulte et en particulier aux patients hospitalisés et aux résidents des EHPAD pour qui la supplémentation en vitamine D est pourtant importante et recommandée par toutes les sociétés savantes. Il existe bien sûr de nombreuses spécialités pharmaceutiques combinant calcium et vitamine D, mais elles sont en général mal tolérées ou peu appréciées par les patients qui arrêtent souvent très précocement cette forme de supplémentation. Différents éléments comme le goût, la nature des excipients, la taille du comprimé, et donc la facilité à l’avaler, jouent un rôle sur l’observance des patients à ces combinaisons calcium-vitamine D. De plus, la répartition du calcium et de la vitamine D dans ces préparations pharmaceutiques (400 UI de vitamine D3 avec 500 mg de calcium ou 800 UI de vitamine D3 avec 1 000 mg de calcium en général) est déséquilibrée, apportant (souvent) trop de calcium et pas assez de vitamine D. Comme indiqué plus haut, les apports alimentaires journaliers de la majorité des femmes ménopausées françaises sont en moyenne de 600-700 mg de calcium et très peu de vitamine D. Les recommandations dans cette catégorie de la population étant de 1 200 mg de calcium et de 800-1 200 UI de vitamine D par jour, il serait très utile qu’un laboratoire pharmaceutique soit en mesure de proposer des combinaisons calcium-vitamine D apportant 400-600 mg de calcium et environ 1 000 UI de vitamine D par comprimé et que la forme galénique desdits comprimés soit optimisée pour qu’ils soient acceptés par le plus grand nombre ;– l’étude discutée plus haut18 qui montre un excès de chutes dans un groupe qui a reçu 60 000 UI de vitamine D3 par mois pendant 1 an par rapport à un groupe qui a reçu 24 000 UI/mois a suscité de nombreuses interrogations quant aux modalités de supplémentation en vitamine D, en particulier chez les sujets âgés, avec l’idée que les doses mensuelles les plus fortes utilisées dans cette étude devraient être proscrites. Toutefois, les analyses secondaires en sous-groupes ont montré que cet excès de chutes ne concernait que les participants dont la concentration initiale de 25OHD était supérieure à 20 ng/mL. Cela suggère qu’il peut être important d’évaluer le statut vitaminique D avant de supplémenter afin de ne pas traiter à l’aveugle et de cibler la supplémentation sur ceux/celles qui ont une insuffisance en vitamine D. Cependant, en raison des nouvelles règles de remboursement du dosage de la 25OHD restreignant la prise en charge de cet acte à quelques situations cliniques, il paraît pertinent de trouver d’autres moyens d’évaluer si une personne est à risque de déficit en vitamine D. Il existe depuis peu des scores simples fondés sur les facteurs de risque d’hypovitaminose D identifiés dans les études épidémiologiques permettant de détecter les patients statistiquement à risque de déficit ou d’insuffisance en vitamine D. Ces scores sont très faciles à obtenir à partir de l’interrogatoire des patients, et certains ont été établis dans des populations françaises et sont spécifiques soit des sujets âgés,27 soit de la population générale d’âge intermédiaire (jusqu’à 65 ans) [tableau 1].28
L’utilisation de doses journalières modérées de vitamine D plutôt que de fortes doses administrées de manière intermittente semble donc à privilégier (tableau 2). En se fondant sur des études d’intervention ayant comparé les concentrations de 25OHD atteintes dans des groupes de sujets européens recevant des doses journalières variées de vitamine D3, on peut considérer qu’en population générale de 1 000 à 1 200 UI/j sont nécessaires pour que la majorité de ces sujets aient une concentration de 25OHD comprise entre 20 et 50-60 ng/mL (sans dosage préalable).29 La mise à disposition de formes pharmaceutiques de vitamine D proposant des comprimés ou capsules molles contenant 1 000 à 1 200 UI de vitamine D3 est à encourager fortement. En population générale, une supplémentation, en particulier hivernale, par 1 000 ou 1 200 UI/j pourrait être proposée chez les sujets ayant des facteurs de risque d’hypovitaminose D identifiés grâce aux questionnaires cités plus haut.
Pour les patients ostéoporotiques (tableau 2) chez qui on vise plutôt une concentration supérieure à 30 ng/mL en dosant la 25OHD, il serait facile, en fonction de la concentration initiale de 25OHD, de prescrire plusieurs doses par jour pendant quelque temps (par exemple 3 x 1 000 ou 3 x 1 200 UI par jour pendant 3 ou 4 mois chez ceux qui ont une concentration < 20 ng/mL) suivies par un traitement au long cours par 1 000 à 2 000 UI/j avec réajustement de la posologie en fonction d’un dosage de contrôle. C’est ce qui est déjà préconisé par certains groupes d’experts dans le domaine de l’ostéoporose et des pathologies osseuses.30 En attendant la disponibilité de formes pharmaceutiques permettant une administration journalière simple et efficace, on ne peut que conseiller pour une administration intermittente d’utiliser les plus petites des fortes doses disponibles, soit 80 000 UI aujourd’hui et 50 000 UI bientôt.
Contrairement à la supplémentation en calcium qui doit être quotidienne, l’administration de vitamine D peut être intermittente en raison de la demi-vie longue de la 25OHD. En France, les deux modes d’administration sont possibles et on a le choix entre des petites doses quotidiennes administrées sous forme de gouttes (une goutte = 300 ou 400 UI de vitamine D) ou sous forme de comprimés ou sachets combinant calcium et vitamine D3, et des doses plus importantes administrées de manière intermittente. En France, des doses de 80 000, 100 000 et 200 000 UI de vitamine D3 et 600 000 UI de vitamine D2 sont disponibles**. Des doses de 50 000 UI de vitamine D3 devraient être disponibles début 2018. L’observance des prises journalières de vitamine D, surtout lorsqu’elles sont associées à du calcium, est souvent faible.11 C’est pourquoi la prescription de fortes doses administrées de manière intermittente est souvent préférée aujourd’hui en France, avec l’idée de favoriser l’observance. Deux principes importants sont à respecter toutefois :
– ne prescrire que de la vitamine D3 en cas de prises « espacées » car celle-ci permet de maintenir un statut vitaminique D satisfaisant beaucoup plus longtemps que la vitamine D2 ;12
– en cas de prescription de doses « espacées », exclure les doses très fortes et très espacées, en particulier chez les femmes les plus âgées car une étude chez des femmes australiennes de plus de 80 ans a montré qu’une dose annuelle de 500 000 UI de vitamine D3 administrée pendant 4 ans avait augmenté le risque de fractures et de chutes par rapport à un placebo.13 En France, l’intervalle entre les prises espacées de vitamine D est généralement de 2 à 3 mois pour les doses de 80 000 et 100 000 UI selon les recommandations déjà anciennes du Groupe de recherche et d’information sur les ostéoporoses.14
Une étude récente a comparé trois groupes de femmes ménopausées finlandaises qui ont reçu soit un placebo tous les 3 mois, soit 100 000 UI de vitamine D3 tous les 3 mois, soit 200 000 UI de vitamine D3 tous les 3 mois.15 La 25OHD était dosée avant et 7 jours après chacune de ces prises trimestrielles. Le groupe qui recevait 200 000 UI tous les 3 mois avait logiquement, 7 jours après chacune des prises, une concentration sérique de 25OHD plus élevée que le groupe qui recevait 100 000 UI tous les 3 mois ; en revanche, juste avant la prise suivante, la concentration sérique de 25OHD était exactement la même dans les deux groupes. Les principaux messages de ce travail étaient que : plus on élève la concentration sérique de 25OHD rapidement, plus celle-ci baisse rapidement ; un intervalle de 3 mois entre des prises de 100 000 ou 200 000 UI de vitamine D3 est caractérisé par des fluctuations importantes de la concentration de 25OHD et est probablement trop espacé. En effet, il existe aujourd’hui des études montrant que les fluctuations de la concentration de 25OHD s’accompagnent de variations dans le sens inverse des concentrations sériques de PTH et du CTX, un marqueur de la résorption osseuse (la PTH et le CTX s’élèvent lorsque la 25OHD baisse), ce qui témoigne d’un effet indésirable, tout au moins pour l’os.16
Des études déjà anciennes avaient conclu qu’en termes de stabilité de la concentration de 25OHD, un espacement de 1 mois entre les prises était équivalent aux doses journalières (par exemple 1 500 UI/j équivalait à 45 000 UI/mois).17 Cet intervalle de 1 mois a été testé dans une étude randomisée plus récente où des sujets âgés (67 % de femmes) ayant fait au moins une chute dans l’année précédente ont reçu pendant 1 an une dose de 60 000 UI de vitamine D3 par mois, équivalente en théorie à 2 000 UI/j, ou une dose de 24 000 UI par mois, équivalente en théorie à 800 UI/j.18 Des doses de vitamine D de 800 UI/j associées à du calcium ayant démontré leur efficacité à réduire les chutes d’environ 20 % chez les sujets âgés,2 l’objectif de cette étude était d’évaluer si les fortes doses pouvaient diminuer encore plus le risque de chutes. Le résultat fut décevant puisqu’au bout d’un an les chutes ont été plus nombreuses dans le groupe qui avait reçu 60 000 UI/mois que dans celui qui avait reçu 24 000 UI/mois. Une explication possible pour ce résultat pouvait être que les fortes doses et/ou l’obtention de concentrations élevées de 25OHD étaient responsables de cet excès de chutes. Un argument en faveur de cette hypothèse est que le risque de chutes était plus important chez les participantes qui avaient une concentration supérieure à 20 ng/mL à l’inclusion dans cette étude et/ou qui avaient atteint une concentration élevée de 25OHD sous supplémentation (dans le quartile supérieur, soit 45-99 ng/mL).
Les résultats d’une étude contrôlée un peu plus ancienne par les mêmes auteurs étaient toutefois contre cette hypothèse.19 En effet, chez des femmes âgées comparables à celles de leur étude récente18 en termes d’âge et de nombre de patientes incluses et dont le critère d’inclusion dans l’étude était d’avoir eu une fracture de la hanche récemment, le risque de chutes n’était pas différent dans un groupe qui avait reçu 800 UI/j pendant 1 an par rapport à un groupe qui avait reçu 2 000 UI/j pendant la même période. En revanche, le nombre de réhospitalisations, en particulier pour causes infectieuses, et les complications post-chutes étaient significativement moins nombreuses dans le groupe qui avait reçu 2 000 UI/j que dans le groupe qui avait reçu 800 UI/j, en faveur d’un effet bénéfique des doses les plus fortes de cette étude. On peut cependant noter que les concentrations de 25OHD en début d’étude (13,2 ng/mL en moyenne dans le groupe 2 000 UI/j et 12,3 ng/mL en moyenne dans le groupe 800 UI/j) étaient plus basses que dans l’étude récente18 (18,7 ng/mL dans le groupe 24 000 UI/mois et 20,9 ng/mL en moyenne dans le groupe 60 000 UI/mois).
Dans une autre étude, 107 patients résidant en établissement d’hébergement pour personnes âgées dépendantes (EHPAD) ont reçu soit 100 000 UI de vitamine D3 par mois pendant 1 an soit une dose plus faible de l’ordre de 18 000 UI par mois.20 Si l’incidence des infections respiratoires était significativement plus faible dans le groupe recevant 100 000 UI/mois, le nombre de chutes était, en revanche, significativement plus élevé.
Pour terminer cette revue des études récentes pouvant remettre en question les modalités de supplémentation en vitamine D, il faut citer un essai randomisé où des femmes âgées de 57 à 87 ans, déficitaires en vitamine D (25OHD < 20 ng/mL en début d’étude) et non hospitalisées ont reçu soit un placebo, soit différentes doses de vitamine D3 administrées de façon journalière et allant de 400 à 4 800 UI/j.21 Lorsque les auteurs divisaient les patientes en trois groupes en fonction des doses de vitamine D reçues, celles qui avaient reçu les doses moyennes (de 1 600 à 3 200 UI/j) avaient un risque de chutes significativement réduit par rapport à celles qui avaient reçu le placebo ou les faibles doses (400 UI ou 800 UI/j)mais aussi par rapport à celles qui avaient reçu les fortes doses (4 000 ou 4 800 UI/j), mettant une nouvelle fois en évidence une courbe en U entre le risque de chutes et les doses de vitamine D.
Les résultats des études discutées ci-dessus incitent à plusieurs commentaires :– il faut tout d’abord insister sur le fait que les deux études d’intervention réalisées par l’équipe du Pr Bischoff-Ferrari18, 19 ne comportaient pas de groupe placebo, et qu’on ne peut donc pas conclure qu’une dose mensuelle de 60 000 UI/mois de vitamine D3 augmente le risque de chutes chez les sujets âgés, d’autant plus qu’une étude contrôlée récente a trouvé une réduction significative du risque de chutes chez des sujets de 78 ans en moyenne qui avaient reçu 100 000 UI de vitamine D3 par mois pendant 5 mois par rapport à ceux qui avaient reçu un placebo.22 On peut seulement dire qu’avec 60 000 UI/mois on fait moins bien qu’avec 24 000 UI/mois sur le risque de chutes, et que 2 000 UI/j ont fait mieux que 800 UI/j sur les réhospitalisations pour infections et les complications post-chutes, sans toutefois montrer un avantage sur le risque de chutes ;– malgré les incertitudes liées à un manque de données « définitives », les études citées plus haut sont en faveur de l’utilisation de doses journalières modérées de vitamine D plutôt que de fortes doses administrées de manière intermittente. Cela avait déjà été recommandé par certains experts bien avant ces publications récentes,23, 24 et différentes méta-analyses évaluant l’effet d’une supplémentation en vitamine D sur la force musculaire25 ou le risque d’infections respiratoires26 avaient rapporté un effet bénéfique d’une supplémentation en vitamine D administrée quotidiennement mais pas en fortes doses espacées. Comme indiqué plus haut, le problème est qu’en France les formes pharmaceutiques de vitamine D destinées à une administration journalière sont sous forme de gouttes afin de pouvoir être administrées aux nouveau-nés et aux enfants les plus jeunes. Elles sont peu adaptées à la médecine d’adulte et en particulier aux patients hospitalisés et aux résidents des EHPAD pour qui la supplémentation en vitamine D est pourtant importante et recommandée par toutes les sociétés savantes. Il existe bien sûr de nombreuses spécialités pharmaceutiques combinant calcium et vitamine D, mais elles sont en général mal tolérées ou peu appréciées par les patients qui arrêtent souvent très précocement cette forme de supplémentation. Différents éléments comme le goût, la nature des excipients, la taille du comprimé, et donc la facilité à l’avaler, jouent un rôle sur l’observance des patients à ces combinaisons calcium-vitamine D. De plus, la répartition du calcium et de la vitamine D dans ces préparations pharmaceutiques (400 UI de vitamine D3 avec 500 mg de calcium ou 800 UI de vitamine D3 avec 1 000 mg de calcium en général) est déséquilibrée, apportant (souvent) trop de calcium et pas assez de vitamine D. Comme indiqué plus haut, les apports alimentaires journaliers de la majorité des femmes ménopausées françaises sont en moyenne de 600-700 mg de calcium et très peu de vitamine D. Les recommandations dans cette catégorie de la population étant de 1 200 mg de calcium et de 800-1 200 UI de vitamine D par jour, il serait très utile qu’un laboratoire pharmaceutique soit en mesure de proposer des combinaisons calcium-vitamine D apportant 400-600 mg de calcium et environ 1 000 UI de vitamine D par comprimé et que la forme galénique desdits comprimés soit optimisée pour qu’ils soient acceptés par le plus grand nombre ;– l’étude discutée plus haut18 qui montre un excès de chutes dans un groupe qui a reçu 60 000 UI de vitamine D3 par mois pendant 1 an par rapport à un groupe qui a reçu 24 000 UI/mois a suscité de nombreuses interrogations quant aux modalités de supplémentation en vitamine D, en particulier chez les sujets âgés, avec l’idée que les doses mensuelles les plus fortes utilisées dans cette étude devraient être proscrites. Toutefois, les analyses secondaires en sous-groupes ont montré que cet excès de chutes ne concernait que les participants dont la concentration initiale de 25OHD était supérieure à 20 ng/mL. Cela suggère qu’il peut être important d’évaluer le statut vitaminique D avant de supplémenter afin de ne pas traiter à l’aveugle et de cibler la supplémentation sur ceux/celles qui ont une insuffisance en vitamine D. Cependant, en raison des nouvelles règles de remboursement du dosage de la 25OHD restreignant la prise en charge de cet acte à quelques situations cliniques, il paraît pertinent de trouver d’autres moyens d’évaluer si une personne est à risque de déficit en vitamine D. Il existe depuis peu des scores simples fondés sur les facteurs de risque d’hypovitaminose D identifiés dans les études épidémiologiques permettant de détecter les patients statistiquement à risque de déficit ou d’insuffisance en vitamine D. Ces scores sont très faciles à obtenir à partir de l’interrogatoire des patients, et certains ont été établis dans des populations françaises et sont spécifiques soit des sujets âgés,27 soit de la population générale d’âge intermédiaire (jusqu’à 65 ans) [tableau 1].28
L’utilisation de doses journalières modérées de vitamine D plutôt que de fortes doses administrées de manière intermittente semble donc à privilégier (tableau 2). En se fondant sur des études d’intervention ayant comparé les concentrations de 25OHD atteintes dans des groupes de sujets européens recevant des doses journalières variées de vitamine D3, on peut considérer qu’en population générale de 1 000 à 1 200 UI/j sont nécessaires pour que la majorité de ces sujets aient une concentration de 25OHD comprise entre 20 et 50-60 ng/mL (sans dosage préalable).29 La mise à disposition de formes pharmaceutiques de vitamine D proposant des comprimés ou capsules molles contenant 1 000 à 1 200 UI de vitamine D3 est à encourager fortement. En population générale, une supplémentation, en particulier hivernale, par 1 000 ou 1 200 UI/j pourrait être proposée chez les sujets ayant des facteurs de risque d’hypovitaminose D identifiés grâce aux questionnaires cités plus haut.
Pour les patients ostéoporotiques (tableau 2) chez qui on vise plutôt une concentration supérieure à 30 ng/mL en dosant la 25OHD, il serait facile, en fonction de la concentration initiale de 25OHD, de prescrire plusieurs doses par jour pendant quelque temps (par exemple 3 x 1 000 ou 3 x 1 200 UI par jour pendant 3 ou 4 mois chez ceux qui ont une concentration < 20 ng/mL) suivies par un traitement au long cours par 1 000 à 2 000 UI/j avec réajustement de la posologie en fonction d’un dosage de contrôle. C’est ce qui est déjà préconisé par certains groupes d’experts dans le domaine de l’ostéoporose et des pathologies osseuses.30 En attendant la disponibilité de formes pharmaceutiques permettant une administration journalière simple et efficace, on ne peut que conseiller pour une administration intermittente d’utiliser les plus petites des fortes doses disponibles, soit 80 000 UI aujourd’hui et 50 000 UI bientôt.
Références
1. Bischoff-Ferrari HA, Willett WC, Orav EJ, et al. A pooled analysis of vitamin D dose requirements for fracture prevention. N Engl J Med 2012;367:40-9.
2. Bischoff-Ferrari H, Dawson-Hughes B, Staehelin HB, et al. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials. BMJ 2009;339:b3692.
3. Carmel A, Shieh A, Bang H, Blockman R. The 25(OH)D level to maintain a favourable bisphosphonate response is > 33 ng/mL. Osteoporos Int 2012;23:2479-87.
4. Souberbielle JC, Body JJ, Lappe J, et al. Vitamin D and musculoskeletal health, cardiovascular diseases, autoimmunity and cancer: recommendations for clinical practice. Autoimmun Rev 2010;9:709-15.
5. Larsen T, Mose F, Bech J, Hansen AB, Pedersen EB. Effect of cholecalciferol supplementation during winter months in patients with hypertension: a randomized placebo-controlled trial. Am J Hypertens 2012;25:1215-22.
6. Mason C, Xiao L, Imayama, et al. Vitamin D3 supplementation during weight loss: a double-blind randomized controlled trial. Am J Clin Nutr 2014;99:1015-25.
7. Benhamou CL, Souberbielle JC, Cortet B, et al. ; pour le Groupe de recherche et d’information sur les ostéoporoses (GRIO). La vitamine D chez l’adulte : recommandations du GRIO. Press Med 2011;40:673-82.
8. Holick M, Binkley N, Bischoff-Ferrari H, et al.; Endocrine Society. Evaluation, treatment and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011;96:1911-30.
9. Ross C, Manson JE, Abrams S, et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J Clin Endocrinol Metab 2011;96:53-8.
10. Souberbielle JC, Benhamou CL, Cortet B, et al. Ostéopathies fragilisantes, maladie rénale chronique, malabsorptions, anomalies biologiques du métabolisme phospho-calcique : les bonnes indications pour un remboursement raisonné du dosage de vitamine D. Ann Biol Clin (Paris) 2014;72:385-9.
11. Vernay M, Sponga M, Salanave B, et al. Statut en vitamine D de la population adulte en France : l’étude nationale nutrition santé (ENNS, 2006-2007). BEH 2012:16-17:189-94.
12. Tafaro L, Nati G, Leoni E, et al. Adherence to anti-osteoporotic therapies: role and determinants of “spot therapy”. Osteoporos Int 2013;24:2319-23.
13. Armas LAG, Hollis BW, Heaney RP. Vitamin D2 is much less effective than vitamin D3 in humans. J Clin Endocrinol Metab 2004; 89: 5387-91.
14. Sanders KM, Stuart AL, Williamson EJ, et al. Annual high-dose oral vitamin D and falls and fractures in older women: a randomized controlled trial. JAMA 2010;303:1815-22.
15. Välimäki VV, Löyttyniemi E, Pekkarinen T, Välimäki MJ. How well are the optimal serum 25OHD concentrations reached in high-dose intermittent vitamin D therapy? a placebo-controlled study on comparison between 100 000 IU and 200 000 IU of oral D3 every 3 months in elderly women. Clin Endocrinol (Oxf) 2016;84:837-44.
16. Darling AL, Hart KH, Gibbs MA, et al. Greater seasonal cycling of 25-hydroxyvitamin D is associated with increased parathyroid hormone and bone resorption. Osteoporos Int 2014;25:933-41.
17. Ish-Shalom S, Segal E, Salganik T, Raz B, Bromberg IL, Vieth R. Comparison of daily, weekly, and monthly vitamin D3 in ethanol dosing protocols for two months in elderly hip fracture patients. J Clin Endocrinol Metab 2008;93:3430-5.
18. Bischoff-Ferrari H, Dawson-Hughes B, Orav E, et al. Monthly high-dode vitamin D treatment for the prevention of functional decline: a randomized clinical trial. JAMA Int Med 2016;176:175-83.
19. Bischoff-Ferrari H, Dawson-Hughes B, Platz A, et al. Effect of high-dosage cholecalciferol and extended physiotherapy on complications after hip fracture. Arch Int Med 2010;170:813-20.
20. Ginde A, Blatchford P, Breese K, et al. High-dose monthly vitamin D3 for prevention of acute respiratory infection in older long-term care residents: a randomized clinical trial. J Am Geriatr Soc 2017;65:496-503.
21. Smith L, Gallagher JC, Suiter C. medium doses of daily vitamin D decrease falls and high doses of vitamin D3 increase falls: a randomized clinical trial. J Steroid Biochem Mol Biol 2017;173:317-22.
22. Houston D, Tooze J, Demons J, et al. Delivery of a vitamin D intervention in homebound older adults using a meals-on-wheels program: a pilot study. J Am Geriatr Soc 2015;63:1861-7.
23. Hollis B, Wagner C. The role of the parent compound vitamin D with respect to metabolism and function: why clinical dose intervals can affect clinical outcomes. J Clin Endocrinol Meta 2013;98:4619-28.
24. Vieth R. How to optimize vitamin D supplementation to prevent cancer, based on cellular adaptation and hydroxylase enzymology. Anticancer Res 2009;29:3675-784.
25. Muir S, Montero-Odasso M. Effect of vitamin D supplementation on muscle strength, gait and balance in older adults: a systematic review and meta-analysis. J Am Geriatr Soc 2011;59:2291-300.
26. Martineau A, Jolliffe D, Hooper R, et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ 2017; i6583. doi: 10.1136/bmj.6583.
27. Annweiler C, Kabeshova A, Legeay M, Fantino B, Beauchet O. Derivation and validation of a clinical diagnostic tool for the identification of older community-dwellers with hypovitaminosis D. J Am Med Dir Assoc 2015;16:536.e8-19.
28. Deschasaux M, Souberbielle JC, Andreeva VA, et al. Quick and easy screening for vitamin D insufficiency in adults: a scoring system to be implemented in daily practice. Medicine (Baltimore) 2016; 95: e2783.
29. Cashman K, Ritz C, Kiely M, Odin collaborators. Improved dietary guidelines for vitamin D: application of individual participant data (IPD)-level meta-regression analyses. Nutrients 2017;9(5). doi: 10.3390/nu9050469.
30. Choi HS, Min YK, Byun DW, et al. Korean Society for Bone and Mineral research task force report: perspectives on intermittent high-dose vitamin D supplementation. J Bone Metab 2017;24:141-5.
2. Bischoff-Ferrari H, Dawson-Hughes B, Staehelin HB, et al. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials. BMJ 2009;339:b3692.
3. Carmel A, Shieh A, Bang H, Blockman R. The 25(OH)D level to maintain a favourable bisphosphonate response is > 33 ng/mL. Osteoporos Int 2012;23:2479-87.
4. Souberbielle JC, Body JJ, Lappe J, et al. Vitamin D and musculoskeletal health, cardiovascular diseases, autoimmunity and cancer: recommendations for clinical practice. Autoimmun Rev 2010;9:709-15.
5. Larsen T, Mose F, Bech J, Hansen AB, Pedersen EB. Effect of cholecalciferol supplementation during winter months in patients with hypertension: a randomized placebo-controlled trial. Am J Hypertens 2012;25:1215-22.
6. Mason C, Xiao L, Imayama, et al. Vitamin D3 supplementation during weight loss: a double-blind randomized controlled trial. Am J Clin Nutr 2014;99:1015-25.
7. Benhamou CL, Souberbielle JC, Cortet B, et al. ; pour le Groupe de recherche et d’information sur les ostéoporoses (GRIO). La vitamine D chez l’adulte : recommandations du GRIO. Press Med 2011;40:673-82.
8. Holick M, Binkley N, Bischoff-Ferrari H, et al.; Endocrine Society. Evaluation, treatment and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011;96:1911-30.
9. Ross C, Manson JE, Abrams S, et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J Clin Endocrinol Metab 2011;96:53-8.
10. Souberbielle JC, Benhamou CL, Cortet B, et al. Ostéopathies fragilisantes, maladie rénale chronique, malabsorptions, anomalies biologiques du métabolisme phospho-calcique : les bonnes indications pour un remboursement raisonné du dosage de vitamine D. Ann Biol Clin (Paris) 2014;72:385-9.
11. Vernay M, Sponga M, Salanave B, et al. Statut en vitamine D de la population adulte en France : l’étude nationale nutrition santé (ENNS, 2006-2007). BEH 2012:16-17:189-94.
12. Tafaro L, Nati G, Leoni E, et al. Adherence to anti-osteoporotic therapies: role and determinants of “spot therapy”. Osteoporos Int 2013;24:2319-23.
13. Armas LAG, Hollis BW, Heaney RP. Vitamin D2 is much less effective than vitamin D3 in humans. J Clin Endocrinol Metab 2004; 89: 5387-91.
14. Sanders KM, Stuart AL, Williamson EJ, et al. Annual high-dose oral vitamin D and falls and fractures in older women: a randomized controlled trial. JAMA 2010;303:1815-22.
15. Välimäki VV, Löyttyniemi E, Pekkarinen T, Välimäki MJ. How well are the optimal serum 25OHD concentrations reached in high-dose intermittent vitamin D therapy? a placebo-controlled study on comparison between 100 000 IU and 200 000 IU of oral D3 every 3 months in elderly women. Clin Endocrinol (Oxf) 2016;84:837-44.
16. Darling AL, Hart KH, Gibbs MA, et al. Greater seasonal cycling of 25-hydroxyvitamin D is associated with increased parathyroid hormone and bone resorption. Osteoporos Int 2014;25:933-41.
17. Ish-Shalom S, Segal E, Salganik T, Raz B, Bromberg IL, Vieth R. Comparison of daily, weekly, and monthly vitamin D3 in ethanol dosing protocols for two months in elderly hip fracture patients. J Clin Endocrinol Metab 2008;93:3430-5.
18. Bischoff-Ferrari H, Dawson-Hughes B, Orav E, et al. Monthly high-dode vitamin D treatment for the prevention of functional decline: a randomized clinical trial. JAMA Int Med 2016;176:175-83.
19. Bischoff-Ferrari H, Dawson-Hughes B, Platz A, et al. Effect of high-dosage cholecalciferol and extended physiotherapy on complications after hip fracture. Arch Int Med 2010;170:813-20.
20. Ginde A, Blatchford P, Breese K, et al. High-dose monthly vitamin D3 for prevention of acute respiratory infection in older long-term care residents: a randomized clinical trial. J Am Geriatr Soc 2017;65:496-503.
21. Smith L, Gallagher JC, Suiter C. medium doses of daily vitamin D decrease falls and high doses of vitamin D3 increase falls: a randomized clinical trial. J Steroid Biochem Mol Biol 2017;173:317-22.
22. Houston D, Tooze J, Demons J, et al. Delivery of a vitamin D intervention in homebound older adults using a meals-on-wheels program: a pilot study. J Am Geriatr Soc 2015;63:1861-7.
23. Hollis B, Wagner C. The role of the parent compound vitamin D with respect to metabolism and function: why clinical dose intervals can affect clinical outcomes. J Clin Endocrinol Meta 2013;98:4619-28.
24. Vieth R. How to optimize vitamin D supplementation to prevent cancer, based on cellular adaptation and hydroxylase enzymology. Anticancer Res 2009;29:3675-784.
25. Muir S, Montero-Odasso M. Effect of vitamin D supplementation on muscle strength, gait and balance in older adults: a systematic review and meta-analysis. J Am Geriatr Soc 2011;59:2291-300.
26. Martineau A, Jolliffe D, Hooper R, et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ 2017; i6583. doi: 10.1136/bmj.6583.
27. Annweiler C, Kabeshova A, Legeay M, Fantino B, Beauchet O. Derivation and validation of a clinical diagnostic tool for the identification of older community-dwellers with hypovitaminosis D. J Am Med Dir Assoc 2015;16:536.e8-19.
28. Deschasaux M, Souberbielle JC, Andreeva VA, et al. Quick and easy screening for vitamin D insufficiency in adults: a scoring system to be implemented in daily practice. Medicine (Baltimore) 2016; 95: e2783.
29. Cashman K, Ritz C, Kiely M, Odin collaborators. Improved dietary guidelines for vitamin D: application of individual participant data (IPD)-level meta-regression analyses. Nutrients 2017;9(5). doi: 10.3390/nu9050469.
30. Choi HS, Min YK, Byun DW, et al. Korean Society for Bone and Mineral research task force report: perspectives on intermittent high-dose vitamin D supplementation. J Bone Metab 2017;24:141-5.